La enfermedad de Alzheimer (EA) reporta heterogeneidad de síntomas neuropsicológicos. Esto conduce a errores diagnósticos con otras formas de demencia, como la demencia por cuerpos de Lewy (DPCL). De hecho, alrededor del 50% de los pacientes con DPCL son confundidos como casos de EA. Si bien el diagnóstico de ambos cuadros se basa principalmente en aspectos clínicos, continúa siendo un desafío su diferenciación en base a los síntomas neuropsicológicos y los patrones de atrofia cortical.
ObjetivoEstablecer las principales similitudes y diferencias neuropsicológicas y de atrofia cortical en pacientes con EA y DPCL.
MetodologíaLa presente revisión sistemática siguió los lineamientos establecidos en la declaración PRISMA, utilizando las bases de datos PubMed, Scopus y Web of Science. La búsqueda estuvo limitada a estudios observacionales analíticos de pruebas diagnósticas, publicados en idioma inglés entre enero de 2000 y julio de 2022.
ResultadosLa búsqueda dio como resultado 41 artículos finales. Del total de los artículos identificados se sugiere que los elementos neuropsicológicos clave para el diagnóstico diferencial entre EA y DPCL son la memoria, la función ejecutiva, la atención, las habilidades visuoespaciales/visuoconstructivas y la fluidez verbal (semántica y fonológica), siendo el estadio y el grado de severidad de cada cuadro críticos en el proceso diagnóstico. Los resultados además sugieren un patrón de cambios anatomofuncionales similar entre EA y DPCL en las áreas frontal, parietal, temporal, hipocampal y precuneus.
ConclusiónEl diagnóstico diferencial entre EA y DPCL es un desafío en la práctica clínica, por lo que esta revisión se propone explorar marcadores cognitivos con énfasis en los indicadores lingüísticos además de los cambios anatómicos y funcionales de las áreas cerebrales.
Alzheimer's disease (AD) reports heterogeneity of neuropsychological symptoms misleading the differential diagnosis with other forms of dementia, such as dementia with Lewy bodies (DLB). About 50% of DLB patients are misdiagnosed as AD cases. Likewise, the diagnosis of both diseases is mainly based on clinical characteristics. However, differentiating AD of those with DLB based on neuropsychological symptoms and anatomical and functional brain changes remains challenging.
AimTo establish the main neuropsychological, anatomical, and functional similarities and differences in patients with AD and DLB.
MethodsThe present study followed the PRISMA guidelines and included studies from the PubMed, Scopus, and Web of Sciences databases, published between January 2000 and July 2022.
ResultsForty-one articles were included in this systematic review for critical analysis. Our results suggest that the cognitive key domains to consider in the differential diagnosis are memory, executive function, attention, visuospatial/visuoconstructive skills, and verbal fluency (both semantic and phonological). The stage and severity of both diseases would be essential for differential diagnosis. On the other hand, the anatomical and functional changes suggest a similar atrophy pattern between AD and DLB in the frontal, parietal, temporal, hippocampal, and precuneus regions.
ConclusionThe differential diagnosis between AD and DLB is challenging in clinical practice. Therefore, our results suggest exploring cognitive linguistic markers along with correlating these markers with anatomical and functional brain changes.
La enfermedad de Alzheimer (EA) es la causa más frecuente de demencia neurodegenerativa, ya que representa alrededor del 60-70% de los casos1–3. Gracias a los avances de la técnicas de neuroimagen se han podido descubrir alteraciones moleculares en el cerebro de personas con EA con alta sensibilidad y especificidad, específicamente con la técnica de emisión de positrones (PET en inglés)4, observando la presencia de placas extracelulares de agregados de β-amiloide (Aβ) y ovillos neurofibrilares intracelulares formados de proteína tau hiperfosforilada5, observadas en áreas temporales, frontales y parietales6,7. Dentro de los métodos más comunes para la detección temprana de la EA, está Aβ-PET, tau-PET y [18F]fluoro-2-deoxi-D-glucosa (FDG-PET) y análisis volumétrico de imágenes cerebrales estructurales obtenidas con resonancia magnética (RM). Además de estas técnicas de neuroimagen, biomarcadores de Aβ (relación Aβ42/Aβ40, Aβ42) y tau fosforilada (P-tau) del líquido cefalorraquídeo (LCR) se han establecido en la práctica clínica habitual para ayudar en el diagnóstico de la EA8.
Si bien la EA ha protagonizado el interés en la práctica investigativa, también se imponen otras, como la demencia frontotemporal (DFT) y la demencia por cuerpos de Lewy (DPCL)9–11. Entre la EA y la DFT variante conductual, Toloza-Ramírez et al.12 destacan similitudes sintomatológicas en memoria, función ejecutiva y presencia de indicadores lingüísticos.
Por su parte, la DPCL se caracteriza por fluctuaciones en atención13, y tiene una prevalencia del 0,3-24,4% del total de casos de demencia14. Dentro del diagnóstico neuropatológico diferencial se considera el depósito de α-sinucleína13,15,16, además de observar con FDG-PET un hipometabolismo del lóbulo occipital, sin afectar el cíngulo posterior5.
Neuropsicológicamente, la DPCL manifiesta severos declives en memoria, atención, función ejecutiva y habilidades visuoconstructivas, en contraste con la EA, en donde su principal afección es en la memoria episódica17–19. Además, en ambos cuadros se describen síntomas lingüísticos (p.ej., fluidez verbal), lo cual impacta negativamente en el lenguaje expresivo20–23.
La heterogeneidad de síntomas y patrones de atrofia evidenciados en la EA es un foco de interés actual en neurociencia cognitiva. Estudios sugieren que patológicamente la DPCL con frecuencia es mal diagnosticada, siendo confundida con la EA24–26. Asimismo, estudios post mortem reportan que alrededor del 50% de los pacientes con DPCL presentan carga patológica considerable de EA, lo cual conlleva, recíprocamente, a establecerla un cuadro como diagnóstico secundario del otro13,27. Por otra parte, tal como ocurre en la EA, Oda et al.28 sugieren que la pérdida neuronal colinérgica en la DPCL justifica el declive cognitivo y emocional.
Líneas de investigación29,30 se han enfocado en el diagnóstico diferencial entre EA y DPCL, no solo limitándose a los patrones de atrofia como un factor diferenciador, sino también en identificar los declives neuropsicológicos. Por medio de neuroimagen se ha observado hipometabolismo temporoparietal y occipital en ambos cuadros; no obstante, se destaca que este tiende a ser leve en la EA31. Además, se ha evidenciado una mayor conectividad en la corteza cingulada derecha en la DPCL, en contraste con la EA, que muestra mayor conectividad hipocampal izquierda32.
Adicionalmente, se ha reportado sintomatología neuropsiquiátrica clave para el diagnóstico diferencial. Diversos estudios sugieren que las alucinaciones, la agitación y las alteraciones del sueño son síntomas mayormente reportados en la DPCL versus la EA, lo cual se correlaciona con altas puntuaciones en el Inventario Neuropsiquiátrico (NPI, en inglés) en pacientes con DPCL33–36. Por otra parte, los síntomas motores tienden a estar presentes en hasta el 85% de casos de DPCL13; no obstante, si bien en la EA típica no son característicos, estos se manifiestan en casos de EA atípica como el síndrome corticobasal37. De hecho, la evidencia destaca que dicha sintomatología neuropsiquiátrica promueve un mayor deterioro no solo funcional sino también cognitivo en estos pacientes, favoreciendo incluso la degeneración axonal y el patrón de atrofia en áreas cerebrales relevantes para el funcionamiento cognitivo (p.ej., áreas frontal y límbica)38–41.
Si bien se están realizando esfuerzos en determinar un consenso de las características clínicas y neuropatológicas para establecer el diagnóstico diferencial de la EA y la DPCL5,13, no existe claridad en la distinción de los déficit neuropsicológicos, en especial de la índole cognitiva-lingüística, que apoyen el diagnóstico diferencial. Por ello, el objetivo de la presente revisión es establecer las principales similitudes y diferencias neuropsicológicas (con énfasis en el dominio del lenguaje) y de patrones de cambios anatomofuncionales en pacientes con EA y DPCL. Así, mejorar el proceso de evaluación de los dominios cognitivos favorecerá el diseño de intervenciones tempranas y oportunas en personas con demencia, especialmente en la funcionalidad de las actividades de la vida diaria.
MetodologíaLa presente revisión sistemática consideró los criterios y el diagrama de flujo establecidos en la declaración PRISMA42. Esta ha sido registrada en el repositorio PROSPERO bajo el código CRD42021261164. La lista de chequeo PRISMA puede encontrarse en el material suplementario (Apéndice 1).
Estrategia de búsqueda para la identificación de estudiosLa búsqueda de referencias bibliográficas se realizó utilizando las siguientes bases de datos electrónicas, en el orden indicado: PubMed, Scopus y Web of Science. La búsqueda estuvo limitada a artículos publicados entre enero de 2000 y julio de 2022. Este intervalo de tiempo se debe a que la investigación en los últimos 10 años ha reportado perfiles atípicos de EA, por lo cual resulta necesario extender al año 2000 la búsqueda para obtener una visión general de la EA tanto típica como de sus perfiles atípicos. La sintaxis general de la búsqueda consideró los términos: (Alzheimer disease AND Lewy body dementia) AND (cognitive function OR memory OR executive function OR attention OR visuoconstructive skills OR visuospatial skills OR processing speed OR language) AND (neuropsychological assessment OR cognitive tests OR neuroimaging OR differential diagnosis), siendo todos los términos adaptados a cada base de datos. La estrategia completa de búsqueda en todas las bases de datos se presenta en el material suplementario (Apéndice 2).
Selección de estudios y criterios de inclusión/exclusiónLos artículos seleccionados para efecto de filtrado por título y resumen debían cumplir con los siguientes criterios de inclusión: a)ser estudios observacionales analíticos de pruebas diagnósticas, con reporte de evaluación neuropsicológica y/o de neuroimagen; b)estudios exclusivamente en idioma inglés, y c)reportar participantes con diagnóstico clínico de EA y DPCL, desde los 60años de edad cronológica. Como criterios de exclusión, no fueron considerados: a)documentos editoriales, estudios experimentales, revisiones sistemáticas con o sin metaanálisis, protocolos o tesis; b)pacientes con demencias mixtas o pseudodemencias, y c)pacientes con antecedentes de patologías psiquiátricas (p.ej., psicosis, esquizofrenia).
Extracción de datosPara eliminar artículos duplicados, se procedió a importar los estudios a software Rayyan43. Posteriormente, dos revisores (V.M-C. y D.T.-R.) aplicaron los criterios de inclusión y exclusión a todos los títulos y resúmenes. Ante dudas, se recuperaron los textos completos de los artículos cuando las decisiones no pudieron ser tomadas a partir del título y resumen. Un tercer revisor (T.J.-R.) participó en el consenso de selección final de los artículos a incluir, actuando como juez en la resolución de discrepancias de selección, mediante discusión en los casos necesarios.
Herramientas de evaluación de riesgo de sesgo y calidad metodológicaCon el objetivo de evaluar la calidad metodológica y el riesgo de sesgo en los artículos seleccionados, se utilizó la herramienta QUADAS-244, un instrumento diseñado y validado para evaluar de manera independiente el riesgo de sesgo y calidad metodológica de los estudios de precisión diagnóstica. Para el riesgo de sesgo se evaluaron cuatro dominios clave: la selección de pacientes, la prueba índice, la prueba de referencia y el flujo de los pacientes en el tiempo del estudio (estas dos últimas agrupadas en el dominio de flujo y tiempos). Cada uno de los estudios incluidos se evaluó considerando tres criterios de riesgo: alto, bajo e incierto. Por su parte, la calidad metodológica se evaluó en base a los dominios de selección de pacientes, prueba índice, y prueba de referencia, considerando como criterios de medida de calidad alta, baja e incierta.
Estrategia para la síntesis de datosSe proporcionó una síntesis narrativa de los hallazgos en la tabla 1. La síntesis presentada en la tabla 1 resume las características generales de los estudios como población analizada, edad promedio e instrumentos/medidas utilizadas. Asimismo, en ella se reportan los principales hallazgos referentes a las similitudes y diferencias neuropsicológicas en EA y DPCL, junto a los perfiles neurales reportados.
Cuadro resumen de los estudios analizados
| Población | Edad | Rango edad | Sexo | |||||
|---|---|---|---|---|---|---|---|---|
| X (DE) | (años) | ♀ ♂ | Instrumentos Medidas | Principales hallazgos | ||||
| Primer autor (año) | 60-70 | 71-80 | 81 o + | n (%) | ||||
| Buciuc et al. (2021)45 | Muestra total de 20 participantes: 6 con afasia progresiva primaria variante logopénica y DPCL, 7 con afasia progresiva primaria variante logopénica y EA típica, 5 con afasia progresiva primaria variante logopénica y EA variante hipocampal, y 5 con afasia progresiva primaria variante logopénica y degeneración lobar frontotemporal | 61,3 (–) | ✓ | ✓ | ✓ | 4(20)/16(80) | MMSEMoCAMDS-UPDRS-IIIFBINPI-QWABBNTPPTTTWMS-IIIVOSPTMT-AD-KEFS STROCFFDG-PETPiB-PET | Pacientes con afasia progresiva primaria variante logopénica y DPCL, manifiestan deterioro cognitivo global afectando a nivel de memoria, atención, función ejecutiva y fluidez verbal tanto semántica como fonológica, lo cual es similar a los déficits reportados en pacientes con el mismo tipo de afasia y EA típica. Sin embargo, la severidad es mayor en el primer grupo. Asimismo, desde una perspectiva lingüística, se evidencia severa anomia y severos déficits en fluidez fonológica, lo cual sería un aspecto diferenciador con el grupo de EA típica.Desde una perspectiva anatomofuncional, los pacientes con DPCL presentan pérdida neuronal en sustancia nigra de moderada a severa, en contraste con el grupo de EA típica que impresiona con pérdida leve. Adicionalmente, se evidencia mayor hipometabolismo a nivel parietal en DC; en cambio, en EA el patrón de atrofia es heterogéneo afectando a nivel temporal, parietal y occipital. |
| Tak et al. (2020)46 | Muestra total de 76 participantes: 38 con DPCL y 38 controles | 74,9 (6,2) | ✓ | ✓ | – | 38(50)/38(50) | MMSECDRDSTMT-ATMT-BeTIVMRI | Neuropsicológicamente los pacientes con DPCL impresionan con severo compromiso a nivel de memoria de trabajo y de corto plazo, sumado a declives significativos en el funcionamiento ejecutivo y habilidades atencionales.El núcleo pulvinar muestra un marcado patrón de atrofia, especialmente su porción medial izquierda, siendo esta alteración en etapas tempranas, lo cual promueve el déficit a nivel ejecutivo en la DPCL. |
| Schumacher et al. (2018)47 | Muestra total de 91 participantes: 31 con DPCL, 29 con EA y 31 controles | 76,6 (7,5) | ✓ | ✓ | – | 30(33)/61(67) | MMSECAMCOGUPDRS-IIICAFNPIfMRI | La evaluación neuropsicológica sugiere leves diferencias cognitivas entre sujetos con DPCL y EA, siendo estos últimos los que manifiestan mayor compromiso en los dominios de orientación temporal y espacial, lenguaje expresivo (fluidez verbal), memoria remota y reciente, aprendizaje, atención, funcionamiento ejecutivo y habilidades perceptivas.Los pacientes con DPCL presentan declives en términos de conectividad funcional en redes sensoriomotoras, temporales, de ganglios basales, talámicas, insulares y de cingulado anterior. Asimismo, en la EA se evidencia disminución en conectividad de áreas frontales y temporales. Sin embargo, la comparación entre ambos sugiere leves diferencias para atrofias frontales y temporales, siendo estas claves en diagnósticos iniciales de ambos cuadros. |
| Donaghy et al. (2018)48 | Muestra total de 77 participantes: 37 con DPCL, 20 con EA y 20 controles | 75,9 (6,9) | ✓ | ✓ | – | 14(18)/63(82) | MRIPETCTCSFACE-RRAVLTTMT-ATMT-BFASGNTIADLBADLNPIDCFSCAFGDSMDS-UPDRS motorBP | Pacientes con DPCL con beta amiloide positivo manifiestan declives en orientación espacial y temporal, atención, memoria, fluidez verbal (semántica y fonológica), habilidades visuoespaciales, recuerdo diferido y función ejecutiva. Sin embargo, estos declives tienden a ser menores en sujetos sin carga positiva para beta amiloide, sugiriendo así aspectos claves para el diagnóstico diferencial entre DPCL y EA.Desde una perspectiva anatomofuncional, sujetos con EA presentan mayor atrofia frontal, temporal y parietal. Por su parte, la comparación entre EA y DPCL muestra que en la DPCL existe mayor volumen en hipocampo y lóbulo temporal medial, sumado a mayor perfusión orbitofrontal, lo cual no se evidencia en la EA. |
| Elder et al. (2017)49 | Muestra total de 204 participantes: 65 con DPCL, 76 con EA y 63 controles | 77,8 (6,8) | ✓ | ✓ | – | 75(37)/129(63) | MMSECAMCOGUPDRS-IIINPICAFMRI | En términos de funcionamiento cognitivo general no se evidencian diferencias significativas entre EA y DPCL; sin embargo, en dominio de memoria los pacientes con EA presentan mejor rendimiento. Por su parte, los pacientes con DPCL impresionan con atrofia temporal, hipocampal, parahipocampal y en corteza entorrinal moderada comparada con la severa atrofia en la EA. |
| Kemp et al. (2017)50 | Muestra total de 66 participantes: 37 con DPCL y 29 controles | 68 (8,3) | ✓ | ✓ | – | 33(50)/33(50) | CSFMRIIADLADLMMSEFCSRTDMS-48DSFABTMT-ATMT-BDSBDMS-48DO80FLEDSymSGFSEROCFVOSPMini-SEAFPRTFERRME | Pacientes con DPCL evidencian funcionamiento cognitivo general deficiente. Asimismo, los dominios de memoria se evidencian en recuerdo libre y recuerdo diferido. Por otra parte, las funciones ejecutivas, el lenguaje (denominación y fluidez semántica) y las habilidades visuoconstructivas experimentan severos declives en este grupo.Desde una perspectiva anatomofuncional, los sujetos con DPCL manifiestan atrofia hipocampal bilateral y marcadores positivos para beta amiloide y Tau. |
| Peraza et al. (2016)51 | Muestra total de 53 participantes: 19 con DPCL, 18 con EA y 16 controles | 76,2 (6,9) | ✓ | ✓ | ✓ | 12(23)/41(77) | MRIfMRIMMSEUPDRSCAMCOGCAFNPI | Los pacientes con DPCL y EA manifiestan declives en los dominios cognitivos de memoria remota, memoria reciente, memoria episódica y de corto plazo, orientación, lenguaje (fluidez verbal semántica y fonológica), atención, pensamiento abstracto, funciones ejecutivas y habilidades visuoconstructivas. Si bien los declives no presentan diferencias significativas, los puntajes en los test neuropsicológicos son menores en la EA.El patrón de afectación en DPCL y en EA muestra áreas comunes como el precuneus, el cingulado posterior y el lóbulo frontal. Asimismo, se evidencia mayor patrón de atrofia en el cerebelo, precuneus derecho, língula izquierda, tálamo izquierdo y giro postcentral izquierdo en DPCL comparado con EA. |
| Kobeleva et al. (2017)52 | Muestra total de 71 participantes: 30 con DPCL, 20 con EA y 21 controles | 75,4 (6,8) | ✓ | ✓ | – | 13(18)/58(82) | MMSECAMCOGFASUPDRSCornellCAFNPIfMRI | Pacientes con EA comparados con DPCL muestran mayor compromiso en dominios de memoria, orientación, lenguaje, atención, percepción y pensamiento abstracto. Sin embargo, el funcionamiento ejecutivo se evidencia severamente comprometido en DPCL. Asimismo, la fluidez verbal fonológica experimenta mayores declives en la DPCL comparado con la EA.El correlato anatomofuncional evidencia un aumento en el patrón de conectividad funcional a nivel de corteza cingulada posterior en la EA, y una disminución de dicha conectividad en la corteza prefrontal medial izquierda en la DPCL. |
| Schumacher et al. (2019)53 | Muestra total de 89 participantes: 39 con DPCL, 28 con EA y 22 controles | 76 (6,3) | ✓ | ✓ | – | 18(20)/71(80) | MMSECAMCOGUPDRSCAFNPIANTVBMMRI | Pacientes con DPCL impresionan menos deteriorados en términos cognitivos que aquellos con EA. Asimismo, los declives cognitivos son más evidentes en la EA, abarcando los dominios de orientación, memoria reciente, memoria remota, aprendizaje, lenguaje comprensivo y expresivo, fluidez verbal, atención, percepción y pensamiento abstracto. Por otra parte, los pacientes con DPCL impresionan con mayor nivel de fluctuaciones cognitivas comparados con EA.Adicionalmente, el patrón de atrofia en EA evidencia menor volumen de sustancia gris en corteza temporal, lingual y frontal izquierda, así como el precuneus. En contraste, en la DPCL se evidencia mayor patrón de atrofia en corteza frontal, principalmente en el hemisferio derecho |
| Heitz et al. (2016)54 | Muestra total de 64 participantes: 33 con DPCL, 15 con EA y 16 controles | 69,1 (10,0) | ✓ | ✓ | – | 33(52)/31(48) | MMSEIADLCAFFCSRTDMS-48DO80FABDSTMT-ATMT-BDSSTFLEROCFTVOSPMRIVBMMini-SEARTMEPFSF | Pacientes con EA muestran mayor deterioro en memoria a nivel de recuerdo inmediato y diferido, atención, función ejecutiva y fluidez verbal semántica. En contraste, pacientes con DPCL evidencian déficits en fluidez verbal fonológica, praxias y pensamiento abstracto.Por otra parte, pacientes con EA evidencia mayor patrón de atrofia en giro frontal medial izquierdo, lóbulo parietal bilateral (incluyendo precuneus), cuneus derecho, giro lingual izquierdo y lóbulo temporal medial bilateral. Asimismo, pacientes con DPCL evidencian mayor atrofia en giro cingulado izquierdo y giro frontal medial derecho. |
| Chabran et al. (2020)55 | Muestra total de 159 participantes: 79 con DPCL, 58 con EA y 22 controles | 70,2 (8,5) | ✓ | ✓ | – | 83(52)/76(48) | MMSEMCFSMRIfMRIVBMDMNFPNDAN | Pacientes con DPCL y EA tienen un declive significativo en términos de cognición global; sin embargo, en la EA las afecciones de memoria, atención, habilidades visuoconstructivas y funciones ejecutivas tienden a ser más evidentes.Desde una perspectiva anatomofuncional, en la EA se evidencia mayor patrón de atrofia en lóbulo temporal medial, abarcando el giro hipocampal, el hipocampo y la amígdala. Por su parte, en la DPCL el patrón de atrofia se evidencia igualmente en lóbulo temporal, pero también en la ínsula y los lóbulos frontales. |
| Yamamoto et al. (2017)56 | Muestra total de 130 participantes: 57 con EA y 73 con DPCL | 72,6 (8,7) | ✓ | ✓ | – | 99(76)/31(24) | MoCAMMSE | Pacientes con EA evidencian mayor deterioro en habilidades visuoconstructivas y fluidez verbal (semántica y fonológica). Por su parte, en la DPCL el declive cognitivo es significativo en memoria, especialmente en recuerdo diferido. Asimismo, las habilidades de denominación muestran mayor compromiso en DPCL comparado con EA. |
| Azar et al. (2020)30 | Muestra total de 51 participantes: 34 con EA y 17 con EA-DPCL | 74,7 (8,4) | ✓ | ✓ | ✓ | 29(59)/22(41) | CDRmMMSEHVLTBNTCFLVFTMT-ATMT-BPCCSFCTMRI | Los pacientes con EA evidencian mejor rendimiento en habilidades visuoconstructivas y velocidad del procesamiento de la información. Asimismo, en términos lingüísticos el grupo de EA presenta mejor rendimiento en fluidez verbal de tipo fonológica. Por tanto, estos tres dominios cognitivos se proponen como claves para el diagnóstico diferencial entre EA y DPCL. |
| Firbank et al. (2016)57 | Muestra total de 78 participantes: 23 con EA, 32 con DPCL y 23 controles | 75,7 (6,7) | ✓ | ✓ | – | 16(20)/62(80) | MMSEUPDRSCAMCOGMCFSCAFNPIFASANTDMNfMRI | No se evidencian diferencias significativas en el deterioro cognitivo global entre EA y DPCL. Sin embargo, se evidencia mayor compromiso de funciones ejecutivas en la DPCL, al igual que peor rendimiento en tareas de fluidez verbal fonológica en este grupo.Desde una perspectiva anatomofuncional, se evidencia compromiso similar en DPCL y EA a nivel frontal, parietal y occipital, lo cual repercute en la conectividad de dichas áreas. |
| Peraza et al. (2015)58 | Muestra total de 54 participantes: 18 con DPCL, 19 con EA y 17 controles | 76,2 (6,8) | ✓ | ✓ | – | 11(20)/43(80) | MMSEUPDRSCAMCOGCAFNPIfMRI | En EA comparada con DPCL se evidencian mayores declives en dominios cognitivos de orientación, memoria reciente, memoria remota, aprendizaje, concentración, percepción, habilidades de abstracción y en lenguaje (tanto comprensivo como expresivo).Desde una perspectiva anatomofuncional, los pacientes con DPCL evidencian mayor compromiso en áreas parietales y occipitales posteriores. En contraste, las áreas con mayor compromiso en EA serían las cortezas temporales, el lóbulo occipital derecho y el lóbulo frontal derecho. |
| Brenowitz et al. (2017)59 | Muestra total de 1.603 participantes: 193 con neuropatología, 195 con ictus vascular, 110 con DPCL, 51 con DPCL +ictus vascular, 450 con EA, 292 con EA-DPCL, 217 con EA +ictus vascular y 95 agrupados en EA, DPCL e ictus vascular | 83 (9,9) | ✓ | ✓ | ✓ | 706(44)/897(56) | CDRLMS-ADSSFPFBNTDSymTMT-ATMT-BMRI | Pacientes con EA presentan mayor deterioro en memoria episódica y memoria de trabajo comparados con DPCL. Por otra parte, los dominios de atención, función ejecutiva y lenguaje (fluidez verbal semántica y habilidades de denominación) no muestran diferencias significativas en ambos grupos; sin embargo, se evidencia declive más rápido de estos en pacientes con EA. |
| Pizzi et al. (2015)60 | Muestra total de 45 participantes: 16 con EA, 16 con DPCL y 13 controles | 75,6 (4,8) | ✓ | ✓ | – | 23(51)/22(49) | CDRMMSEDRSFABCAFUPDRS-IIINPIMRISPECTEEG | En términos de rendimiento cognitivo global, pacientes con EA evidencian mayor déficit en dominios de memoria, orientación espacial y temporal, recuerdo diferido, habilidades visuoconstructivas y funcionamiento ejecutivo comparados con pacientes con DPCL.El patrón de atrofia en EA evidencia mayor compromiso bilateral tanto en el tálamo como en la corteza temporal. En contraste, en DPCL el patrón de atrofia comprende tálamo bilateral y proyecciones a corteza prefrontal, parietal y occipital de manera bilateral. |
| Jiménez-Huete et al. (2014)61 | Muestra total de 301 participantes: 199 con EA, 65 con degeneración lobar frontotemporal y 37 con DPCL | 75 (8,0) | ✓ | ✓ | ✓ | 160(53)/141(47) | MECCFLPFTMT-ATMT-BCDTSS-IQCODEFAQGDS-15SRT | Pacientes con EA impresionan con dificultades en nominación, recuerdo libre, recuerdo facilitado y atención. Por su parte, en DPCL se evidencia declive en fluidez verbal fonológica, función ejecutiva y habilidades visuoconstructivas. Asimismo, se destaca compromiso similar en DPCL y EA en dominios de fluidez verbal semántica y memoria de corto plazo y de trabajo. |
| Nervi et al. (2008)62 | Muestra total de 591 participantes: 157 con EA, 70 con DPCL y 364 controles | 80 (7,6) | ✓ | ✓ | ✓ | 396(67)/195(33) | CDRSRTBVRTRDTMMSESFPFBNTBDAEWAIS-RUPDRSAPOE-ɛ4 genotype | En EA se evidencia compromiso de memoria diferida, habilidades visuoconstructivas, orientación, habilidades de denominación, y fluidez verbal semántica y fonológica en comparación a pacientes con DPCL.Desde una perspectiva diagnóstica, no se evidencian diferencias significativas en ambos grupos para la presencia de APOE-ɛ4. |
| Bradshaw et al. (2004)63 | Muestra total de 25 participantes: 13 con DPCL y 12 con EA | 78,3 (4,5) | ✓ | ✓ | ✓ | 12(48)/13(52) | MMSECDRNARTUPDRSHADSBPRSFSIQVIQPIQCAFWASIBI | Desde una perspectiva neuropsicológica, se evidencian diferencias significativas en pacientes con EA y DPCL. Pacientes con EA impresionan con mayor compromiso a nivel de memoria; en cambio, pacientes con DPCL manifiestan mayor compromiso en dominio cognitivo de atención. Asimismo, se destaca que estos declives son claves en las repercusiones funcionales que evidencian estos pacientes. |
| Colloby et al. (2017)64 | Muestra total de 127 participantes: 41 con DPCL, 47 con EA y 39 controles | 78.3 (7,1) | ✓ | ✓ | – | 43(34)/84(66) | MMSECAMCOGUPDRS-IIINPICAFTIVMRICSFVBM | No se evidencian diferencias significativas entre pacientes con EA y DPCL en los dominios de orientación, memoria de corto y largo plazo, memoria reciente, lenguaje, atención, pensamiento abstracto, percepción y habilidades visuoconstructivas.Por otra parte, se evidencia similar patrón de atrofia en hipocampo bilateral tanto para EA como para DPCL |
| Colloby et al. (2014)65 | Muestra total de 127 participantes: 41 con DPCL, 47 con EA y 39 controles | 78,3 (7,1) | ✓ | ✓ | ✓ | 43(34)/84(66) | MMSECAMCOGNPIRBDUPDRS-IIICAFTIVVBMMRI | No se evidencian diferencias significativas entre EA y DPCL para el declive en dominios cognitivos de memoria, orientación, lenguaje, habilidades visuoconstructivas y atención.Desde una perspectiva anatomofuncional, pacientes con EA evidencian mayor pérdida de sustancia gris en cerebelo y lóbulo temporal bilateral. Asimismo, la EA evidencia pérdida de sustancia blanca en pedúnculo cerebelar medial bilateral. Por su parte, la DPCL muestra pérdida de sustancia gris a nivel de cerebelo, pero esta pérdida no es significativa comparada con EA. |
| Kraybill et al. (2005)66 | Muestra total de 135 participantes: 48 con EA, 22 con DPCL y 65 con EA-DPCL | 76 (6,8) | ✓ | ✓ | – | 77(57)/58(43) | MMSEDRSTMT-AWAIS-RDSCERAD-NFOMWMSWAIS-RTMT-ATMT-BASN | Pacientes con EA impresionan con mayor declive en dominios de memoria (recuerdo retardado) y habilidades de denominación. En contraste, DPCL evidencia mayores declives en funcionamiento cognitivo y atención. En cuanto a las habilidades visuoconstructivas, no se evidencian diferencias significativas en ambos grupos. |
| Gomperts et al. (2008)67 | Muestra total de 78 participantes: 8 con DPCL, 7 con demencia por enfermedad de Parkinson, 11 con enfermedad de Parkinson, 15 con EA y 37 controles | 71.3 (2,1) | ✓ | ✓ | – | 39(50)/39(50) | CDRUPDRSMMSEBDSDSTMT-ATMT-BCFPFBNTLMFRSRTFCSRTBVDTMCFSWAIS-RNPIGDSAMNART-VIQPETPiB-PET | En DPCL se evidencia mayor compromiso en atención, funciones ejecutivas, recuerdo diferido, memoria episódica, habilidades de denominación y fluidez verbal semántica y fonológica comparados con EA.Pacientes con EA impresionan con mayor atrofia temporal y bajo compromiso de lóbulo occipital. Por su parte, en DPCL se evidencia compromiso parietal tanto a nivel lateral como de precuneus, y de corteza cingulada posterior. |
| Taylor et al. (2013)68 | Muestra total de 42 participantes: 23 con EA y 19 con DPCL | 77,5 (10,0) | ✓ | ✓ | ✓ | 19(45)/23(55) | MMSECAMCOGUPDRS-IIICAFCRTSPECT | En EA los dominios más afectados son la memoria, lenguaje, orientación y pensamiento abstracto. Por su parte, en DPCL se evidencia mayor compromiso atencional.Desde una perspectiva anatomofuncional, ambos grupos muestran patrón de atrofia bilateral en tálamo, putamen y precuneus, además de lóbulo occipital izquierdo. Asimismo, en EA se evidencia atrofia bilateral en giro pre y poscentral y cerebelo, además de lóbulo temporal izquierdo. Por su parte, en DPCL se evidencia atrofia bilateral en corteza cingulada anterior y caudado. |
| Hamilton et al. (2008)69 | Muestra total de 66 participantes: 22 con DPCL y 44 con EA | 72,7 (5,9) | ✓ | ✓ | – | 32(48)/34(52) | MMSEM-DRSWISC-R BDBNTADLBI | Pacientes con DPCL presentan severo déficit en habilidades visuoconstructivas; en cambio, en EA se evidencia mayor compromiso en habilidades de lenguaje. Para ambos grupos, estos declives predicen el progreso a estadios de compromiso cognitivo global severo. |
| Fong et al. (2011)70 | Muestra total de 46 participantes: 14 con DPCL, 16 con EA y 16 controles | 70,7 (9,5) | ✓ | ✓ | – | 21(46)/25(54) | MMSECTMRICERADCOWATBNTRAVLTSFFASDS | En DPCL se evidencia mejor rendimiento en memoria diferida, habilidades de reconocimiento y fluidez verbal fonológica que en EA. Por su parte, en EA se evidencia mayor compromiso en tareas de denominación y fluidez verbal semántica.El correlato anatomofuncional evidencia hipoperfusión bilateral en lóbulo frontal, precuneus, lóbulo parietal y occipital para DPCL. Asimismo, en EA se evidencia hipoperfusión frontal, parietal y occipital; no obstante, esta es mayor en DPCL. |
| Ballard et al. (2001)71 | Muestra total de 190 participantes: 85 con DPCL, 80 con EA y 35 controles | 77 (6,8) | ✓ | ✓ | – | 103(54)/87(46) | MMSECDSM-UPDRSCOGDRAS-DCRTCogRTDSWAIS-RVIG | Si bien tanto la DPCL como la EA evidencian un compromiso cognitivo general significativo, el aspecto diferenciador entre ambos sería el declive en el dominio cognitivo de atención y sus fluctuaciones, puesto que en DPCL se evidencian déficits severos. |
| Kawai et al. (2013)72 | Muestra total de 440 participantes: 402 con EA y 38 con DPCL | 78,8 (6,3) | ✓ | ✓ | – | 313(71)/127(29) | MMSEADAS-JcogFABRCPMDSLMWMS-RMRICT | Pacientes con EA presentan mayores declives en orientación espacial y temporal, y recuerdo diferido. Por su parte, sujetos con DPCL impresionan con mayor compromiso en dominios de atención, función ejecutiva, habilidades visuoconstructivas y fluidez verbal fonológica. Asimismo, se proponen estos dominios como claves para el diagnóstico diferencial de ambos cuadros. |
| Ryman et al. (2021)73 | Muestra total de 2.433 participantes: 111 con DPCL, 741 con EA-DPCL, 1.357 con EA y 224 controles | 80,1 (9,5) | ✓ | ✓ | ✓ | 1.086(45)/1.347(55) | MMSECERADTMT-ATMT-BDSymVFSFBNTDSBI | Se evidencian severos declives en DPCL para los dominios de función ejecutiva y habilidades visuoespaciales. Por su parte, el grupo de EA muestra significativos declives a nivel de memoria y lenguaje. No obstante, en términos de atención, ambos grupos evidencian el mismo nivel de deterioro. |
| Watson et al. (2015)74 | Muestra total de 94 participantes: 31 con DPCL, 30 con EA y 33 controles | 77,5 (6,0) | ✓ | ✓ | – | 33(35)/61(65) | MMSECAMCOGUPDRS-IIINPIB-ADLMRICSF | Los pacientes con EA muestran un mayor deterioro en términos de cognición global que pacientes con DPCL. Asimismo, en EA se evidencian severos declives en atención, memoria, orientación espacial y temporal, lenguaje, función ejecutiva y habilidades visuoconstructivas.Desde una perspectiva anatomofuncional, en EA el patrón de atrofia comprende áreas temporales y parietales, con extensión a áreas frontales. Asimismo, destacan la severa atrofia en hipocampo, precuneus y corteza entorrinal en EA. Por su parte, en DPCL se evidencia patrón de atrofia a nivel parietal inferior, cingulado posterior y giro fusiforme. |
| Prats-Sedano et al. (2021)75 | Muestra total de 182 participantes: 76 con DPCL, 40 con EA y 66 controles | 73,8 (7,1) | ✓ | ✓ | – | 48(26)/134(74) | MMSEACE-RBI | En pacientes con EA se evidencia mayor compromiso a nivel de memoria. En contraste, sujetos con DPCL muestran mayores declives en habilidades visuoespaciales. Asimismo, no se evidencian diferencias significativas en los dominios de atención, orientación y lenguaje; no obstante, cabe destacar que en términos de fluidez verbal los sujetos con DPCL muestran un declive levemente mayor que los pacientes con EA. |
| Mitolo et al. (2016)76 | Muestra total de 228 participantes: 28 con DPCL, 115 con EA y 85 controles | 73,1 (8,6) | ✓ | ✓ | – | –/– | MMSEM-DRSVOTCDTWISC-R BDBNTSFCVLTWMS-RLM | Neuropsicológicamente, se evidencia que pacientes con DPCL impresionan con mayores déficits en habilidades visuoespaciales y visuoconstructivas, fluidez verbal semántica y lenguaje. En contraste, si bien el lenguaje se ve comprometido en EA, los déficits en memoria episódica son característicos en este grupo. |
| Kenny et al. (2012)32 | Muestra total de 47 participantes: 15 con DPCL, 16 con EA y 16 controles | 78,1 (7,7) | ✓ | ✓ | – | –/– | MMSEUPDRS-IIIGDSNPICCECAFfMRI | El rendimiento cognitivo global en pacientes con DPCL y EA, si bien presenta leves diferencias en puntuaciones, estas no son significativas. Por tanto, los resultados evidencian igual nivel de deterioro en ambos grupos. No obstante, la memoria se evidencia severamente afectada en pacientes con EA.Desde una perspectiva anatomofuncional, se evidencia mayor conectividad en hipocampo izquierdo, ínsula derecha y lóbulo parietal inferior en EA. En contraste, en DPCL se evidencia mayor conectividad en corteza cingulada posterior derecha y área límbica (cingulado anterior izquierdo), globo pálido derecho, culmen derecho y tonsila cerebelosa derecha. Asimismo, ambos grupos muestran conectividad común a nivel de ínsula, tálamo y caudado. |
| Stavitsky et al. (2006)77 | Muestra total de 83 participantes: 55 con EA y 28 con DPCL | 73,3 (7,9) | ✓ | ✓ | ✓ | 43(52)/40(48) | mMMSEDSHVLT-RIADLADLDSS | Pacientes con EA evidencian mayor compromiso a nivel de memoria, mientras que en DPCL se evidencia mayor compromiso en habilidades visuoconstructivas. Asimismo, pacientes con EA manifiestan mayores alteraciones conductuales e incremento de alucinaciones visuales, lo cual en DPCL tiende a mantenerse estable en el progreso del cuadro. Por otra parte, en términos de declives lingüísticos, no se evidencian diferencias significativas entre ambos grupos. |
| Mak et al. (2016)78 | Muestra total de 104 participantes: 35 con DPCL, 34 con EA y 35 controles | 77,7 (6,0) | ✓ | ✓ | – | 38(36)/66(64) | MMSECAMCOGCAFUPDRS-IIINPIHVLTBVMTMRI | Los pacientes con EA muestran mayor compromiso en los dominios cognitivos de recuerdo diferido y capacidad de retención de información, además de compromiso en memoria verbal y aprendizaje en comparación a DPCL. Por su parte, DPCL muestra mayor compromiso en memoria reciente, al igual que mayores fluctuaciones cognitivas en comparación a EA.Desde una perspectiva anatomofuncional, se evidencia mayor patrón de atrofia hipocampal medial en DPCL. Si bien la atrofia hipocampal tiende a ser característica en EA, los resultados sugieren que la atrofia a nivel de CA1 sería un aspecto clave para diferenciar entre EA y DPCL. |
| Park et al. (2011)79 | Muestra total de 103 participantes: 10 con DPCL, 76 con EA y 17 con demencia por enfermedad de Parkinson | 70,2 (7,2) | ✓ | ✓ | – | 68(66)/35(34) | K-MMSECDRGDSB-ADLDSK-BNTRCFTCOWATSTSVLTMRI | Se evidencia en pacientes con DPCL mayor compromiso en funciones ejecutivas y atención que en EA. Asimismo, tanto DPCL como EA impresionan con compromiso en memoria episódica. Por otra parte, el lenguaje y las habilidades de denominación, si bien se encuentran deteriorados en ambos grupos, los pacientes con DPCL obtienen menores puntuaciones en la evaluación. |
| Breitve et al. (2018)80 | Muestra total de 186 participantes: 119 con EA y 67 con DPCL | 75,6 (7,5) | ✓ | ✓ | ✓ | 116(62)/70(38) | MMSECDRCVLT-IITMT-ATMT-BCOWATBNTVOSPSTI-FP-CIT SPECT | Pacientes con EA obtienen un rendimiento más bajo que DPCL en dominios de atención, lenguaje (fluidez verbal semántica), función ejecutiva y memoria (recuerdo diferido). No obstante, en el seguimiento se evidencia que el severo compromiso en atención en DPCL logra predecir la progresión y el deterioro en este grupo de pacientes, lo cual no se evidencia en EA. |
| Mak et al. (2015)81 | Muestra total de 69 participantes: 13 con DPCL, 23 con EA y 33 controles | 76,7 (6,3) | ✓ | ✓ | ✓ | 24(35)/45(65) | MMSEBADLUPDRS-IIINPICogFluctCAMCOGMRI | No se evidencian diferencias significativas en medidas basales y seguimiento para DPCL y EA en dominios de memoria, atención, función ejecutiva, habilidades visuoconstructivas, percepción, pensamiento abstracto y fluidez verbal. No obstante, las fluctuaciones cognitivas son mayores en DPCL que en EA.El correlato anatomofuncional evidencia que en EA el patrón de atrofia comprende el giro temporal superior y medio izquierdo, el cual se extiende al giro lingual izquierdo. En contraste, en DPCL se evidencia patrón de atrofia a nivel frontal y parietal. |
| Firbank et al. (2007)82 | Muestra total de 46 participantes: 16 con DPCL, 15 con EA y 15 controles | 75,6 (7,3) | ✓ | ✓ | – | 18(39)/28(61) | MMSECAMCOGUPDRSNPICDSUPDRS-IIICTMRI | El rendimiento cognitivo global se evidencia mayormente comprometido en DPCL, afectando los dominios de atención, orientación, memoria, lenguaje a nivel de fluidez verbal, habilidades visuoconstructivas, percepción, pensamiento abstracto y función ejecutiva.Desde una perspectiva anatomofuncional, los pacientes con DPCL impresionan con atrofia a nivel de giro poscentral derecho. En contraste, el patrón de atrofia en EA incluye el lóbulo temporal inferior y medial anterior, además del fascículo longitudinal inferior y uncinado. |
| Watson et al. (2012)83 | Muestra total de 106 participantes: 35 con DPCL, 36 con EA y 35 controles | 77,8 (6,0) | ✓ | ✓ | ✓ | 38(36)/68(64) | MMSECAMCOGVFBADLNPIUPDRS-IIIMRI | Tanto en DPCL como en EA se evidencian declives en memoria episódica. Asimismo, la fluidez verbal fonológica se evidencia mayormente comprometida en DPCL en comparación con EA.El correlato anatomofuncional muestra que en DPCL existe mayor atrofia parietal, occipital y temporal, con extensión al lóbulo frontal. Por su parte, en EA el patrón de atrofia tiende a ser más generalizado, incluyendo las mismas áreas que en DPCL, pero con mayor compromiso temporal. |
✓: pertenece; –: no reportado.
ACE-R: Addenbrooke's Cognitive Examination-revised; ADAS-Jcog: Alzheimer's disease assessment scale-cognitive component-Japanese version; ADL: Activities of Daily Living; AMNART-VIQ: American version of the National Adult Reading Test, verbal IQ; ANT: Attention network test; ASN: α-synuclein; BADL: Bristol Activities of Daily Living Scale; B-ADL: Bristol Activities of Daily Living Scale; BDAE: Boston diagnostic aphasia examination; BDS: Blessed dementia scale; BI: Brain imaging; BNT: Boston naming test; BP: blood pressure; BPRS: Brief Psychiatric Rating Scale; BVDT: Benton visual form discrimination test; BVMT: Brief Visuospatial Memory Test; BVRT: Benton Visual Retention Test; CAF: Clinical Assessment of Fluctuations; CAF: Clinician Assessment of Fluctuation; CASI: Cognitive Abilities Screening Instrument; CCE: Cambridge Cognitive Examination; CDR: Clinical Dementia Rating; CDS: Cornell Depression Scale; CDT: Clock drawing test; CERAD: Consortium to establish a registry of Alzheimer's Disease neuropsychological battery; CERAD-N: Consortium to establish a registry of Alzheimer's Disease, test battery naming subtest; CFL: Category fluency; COGDRAS-D: Cognitive Drug Research Computerized Assessment System for Dementia Patients; CogFluct: Cognitive Fluctuation Scale; CogRT: Cognitive reaction time; COWAT: Controlled oral word association test; CRT: Choice reaction time; CSF: Cerebrospinal fluid; CT: Computerized tomography; CVLT: California Verbal Learning Test; CVLT-II: The second edition of California Verbal Learning Test; DAN: Dorsal attention network; DCFS: Dementia Cognitive Fluctuations Scale; DDS: Dependence Scale sum; DE: desviación estándar; DMN: Default mode network; DMS-48: Delayed Matching to Sample-48 items; DO80: Oral denomination-80 items; DRS: Dementia rating scale; DS: Digit Span; DSB; digit span backward; DSST: Digit symbol substitution test; DSym: digit symbol; EEG: Electroencephalography; eTIV: estimated total intracranial volume; FAB: Frontal Assessment Battery; FAQ: Functional Assessment Questionnaire; FAS: FAS Verbal fluency; FCSRT: Free cued selective reminding test; FER: Facial Emotion Recognition; FLE: Formal Lexical Evocation; fMRI: functional Magnetic Resonance Imaging; FOM: Fuld object memory; FPN: Frontoparietal network; FPRT: Faux Pas Recognition Test; FRSRT: Free selective reminding test; FSE: Formal semantic evocation; FSIQ: Full Scale IQ; GDS: Geriatric Depression Scale; GDS-15: Geriatric depression scale with 15 items; GNT: Graded naming test; HADS: Hospital Anxiety and Depression Scale; HDRS: Hamilton Depression Rating Scale; HVLT: Hopkins Verbal Learning Test; HVLT-R: Hopkins Verbal Learning Test-Revised; IADL: Instrumental Activities of Daily Living Scale; I-FP-CIT SPECT: Ioflupane single-photon emission computed tomography; K-BNT: Korean version of the Boston Naming Test; K-MMSE: Korean version of the Mini-Mental State Examination; LM: Logical memory; LMS-A: Logical Memory Story A immediate and delayed recall; MCFS: Mayo Clinic fluctuation scale; M-DRS: Mattis dementia rating scale; MDS-UPDRS: Unified Parkinson's Disease Rating Scale motor sub-scale; MEC: Miniexamen Cognoscitivo; MFCS: Mayo Fluctuation Composite Score; Mini-SEA: Mini-Social Cognition & Emotional Assessment; mMMSE: modified Mini-Mental State Exam; M-UPDRS: Modified Unified Parkinson's Disease Rating Scale; NA: Neuropsychological assessment; NART: National Adult Reading Test; NPI: Neuropsychiatric Inventory; PC: Pentagon copy; PET: Positron Emission Tomography; PF: phonological fluency; PiB-PET: Pittsburgh Compound B, Positron Emission Tomography; PIQ: Performance IQ; RAVLT: Rey Auditory Verbal Learning Test; RBD: REM sleep behaviour disorder; RCFT: Rey Complex Figure Test; RCPM: Raven's Coloured Progressive Matrices; RDT: Rosen drawing test; RME: Reading the Mind in the Eyes; RTME: Reading the mind in the eyes; SF: semantic fluency; SG: symbol gesture; SPECT: Single photon emission computed tomography; SRT: Selective reminding test; SS-IQCODE: Shortened Spanish-Informant Questionnaire on Cognitive Decline in the elderly; ST: Stroop Test; SVLT: Seoul Verbal Learning Test; TIV: Total intracranial volume; UPDRS: Unified Parkinson's Disease Rating Scale; UPDRS-III: Unified Parkinson's Disease Rating Scale Part III; VBM: Voxel-based morphometry; VF: Verbal fluency; VH: Visual hallucinations; VIG: Tasks and digit vigilance; VIQ: Verbal IQ; VOSP: Visual Object and Space Perception battery; VOT: Visual organization test; WAIS-R: Wechsler Adult Intelligence Scale, revised; WASI: Wechsler Abbreviated Scale of Intelligence; WCST: Wisconsin Card Sorting Test; WISC-R BD: Wechsler Intelligence Test for Children-Revised, block design subtest; WMS: Wechsler Memory Scale; WMS-R: Wechsler Memory Scale-Revised.
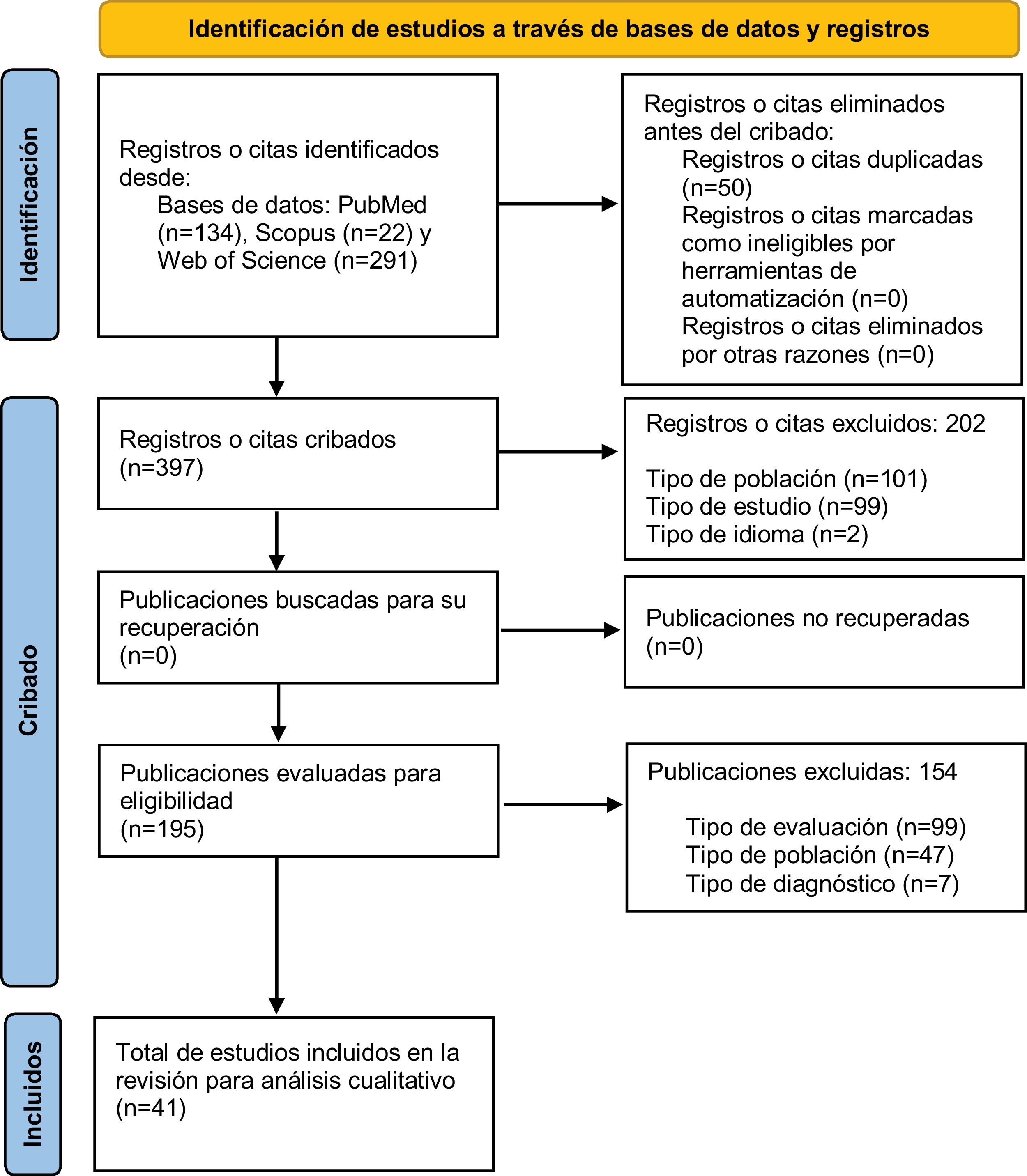
El proceso de selección de artículos se ilustra en el diagrama PRISMA42 (fig. 1). Se identificaron títulos y resúmenes de 447 artículos, de los cuales 50 eran duplicados. Tras aplicar los criterios de inclusión y exclusión, 202 artículos fueron descartados. De los 195 artículos seleccionados a texto completo para su elegibilidad, 154 fueron excluidos. Finalmente, 41 estudios fueron incluidos en la presente revisión sistemática para análisis cualitativo.
Características de los estudios y principales hallazgosLa tabla 1 muestra las características generales de los 41 estudios incluidos en esta revisión. En relación a los años de publicación, el mayor número de estudios se concentra en el año 2017 (6 artículos), mientras que los años 2019, 2007, 2006, 2005, 2004 y 2001 presentan el menor número de publicaciones (un artículo cada uno). La muestra total estuvo constituida por 8.780 personas, con edad promedio de 75,2años (rango entre 60 a 80años, DE: 7,0). Adicionalmente, en cuanto a la variable de sexo, 4.498 corresponden a hombres (57%).
En cuanto a los principales hallazgos neuropsicológicos, los resultados sugieren que los dominios cognitivos de memoria, atención, función ejecutiva, habilidades visuoespaciales/visuoconstructivas y fluidez verbal (tanto semántica como fonológica) serían aspectos clave para el diagnóstico diferencial entre EA y DPCL. Asimismo, desde una perspectiva anatomofuncional, el patrón de atrofia a nivel frontal, parietal y temporal, además de hipocampo y precuneus, permiten establecer diagnósticos diferenciales entre ambos cuadros. No obstante, los hallazgos destacan que el nivel de conectividad funcional en DPCL comprende una disminución en redes sensoriomotoras, temporales, de ganglios basales, talámicas, insulares y de cingulado anterior en DPCL, mientras que en EA la disminución en conectividad funcional afectaría las áreas frontales y temporales, con aumento de conectividad en el cíngulo posterior y el hipocampo. Esto cobra relevancia, puesto que se propone como un indicador interesante de incorporar para el diagnóstico precoz y certero.
Finalmente, en cuanto a los instrumentos y medidas neuropsicológicas más utilizadas para el diagnóstico de EA y DPCL, destacan el uso de MMSE, MoCA Test, BNT, TMT parteA yB, FAB, FAS y CAMCOG. Adicionalmente, las técnicas de neuroimagen mayormente utilizadas en los estudios incluidos corresponden a MRI, fMRI y PET, que en su conjunto elaboran un correlato anatomofuncional (tabla 1).
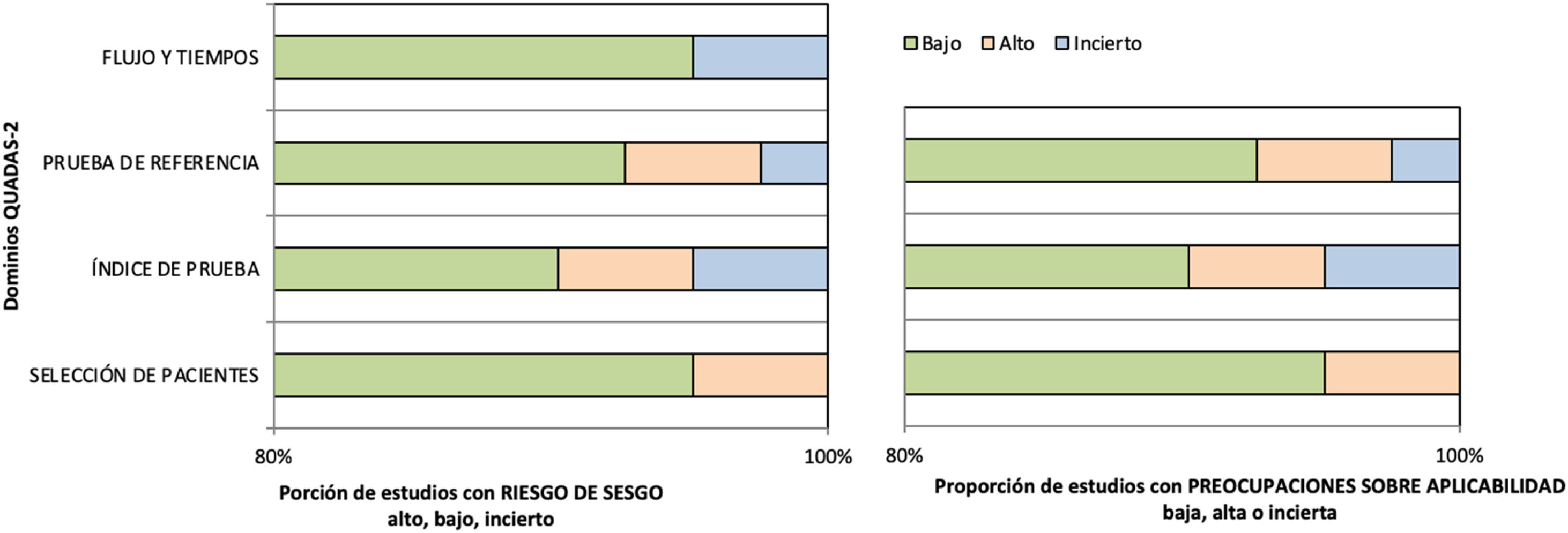
Evaluación de riesgo de sesgo y calidad metodológicaSe realizó el análisis de los 41 artículos seleccionados según QUADAS-244 (fig. 2). Del análisis de sesgo, en los dominios de selección de pacientes, flujo y tiempos, el 95% de los estudios fueron clasificados como bajo riesgo de sesgo, y el 5% como riesgo incierto. En el dominio índice de prueba el 90% se clasificaron con bajo riesgo, el 5% con alto riesgo, y el otro 5% como riesgo incierto. Asimismo, en el dominio de prueba de referencia el 93% se categorizaron como bajo riesgo, el 5% como alto riesgo, y solo el 2% como riesgo de sesgo incierto. Por su parte, la evaluación de calidad metodológica de los artículos dio como resultado que para la selección de pacientes el 95% se consideraron con alta calidad metodológica, mientras que los dominios de índice de prueba y prueba de referencia mostraron un 90% y un 93% de artículos con alta calidad, respectivamente.
DiscusiónEl objetivo de la presente revisión fue establecer las principales similitudes y diferencias neuropsicológicas y de cambios anatomofuncionales en la EA y la DPCL. Nuestros resultados sugieren que la memoria, la atención, la función ejecutiva, las habilidades visuoespaciales/visuoconstructivas y la fluidez verbal semántica y fonológica se postulan como indicadores adicionales que pueden favorecer el diagnóstico diferencial. Líneas de investigación84–87 reportan diferencias en el progreso del deterioro cognitivo global en la EA y la DPCL. En ellos se sugiere que en la DPCL el deterioro cognitivo es acelerado en comparación con la EA. De hecho, Giil y Aarsland88 destacan que en un seguimiento de 5años la DPCL evoluciona a deterioro cognitivo avanzado. Por otra parte, destacan que en la EA la principal característica es la heterogeneidad de dominios cognitivos afectados. Respecto a los cambios anatomofuncionales, las áreas frontales, parietales, temporales, hipocampales y precuneus muestran patrones de atrofia específicos que permitirían diferenciar ambos cuadros.
Memoria episódicaNuestros hallazgos relativos a memoria episódica sugieren que esta se afecta en ambos grupos. No obstante, la severidad del declive es mayor en la EA, lo cual está en línea con investigaciones previas13,89. En contraste, Calderon et al.20 reportan que el déficit en memoria episódica no presenta diferencias en ambos cuadros; de hecho, sugieren mayor compromiso en memoria de trabajo en la DPCL. Asimismo, la capacidad para consolidar información presenta diferencias significativas, destacando la EA por el déficit severo principalmente en memoria diferida y verbal45.
Por otra parte, un estudio reciente90 destaca que el estadio predemencia sería clave para diferenciar entre pacientes que progresan a EA y a DPCL. Los resultados sugieren que los sujetos en etapa de deterioro cognitivo leve que manifiestan sutiles déficits en memoria evolucionan a DPCL; en contraste, la progresión a EA estaría determinada por compromiso severo de memoria. Estudios previos91–93 destacan que este desempeño también se manifiesta en casos de deterioro cognitivo subjetivo. Asimismo, Lemstra et al.94 destacan la importancia de los casos de DPCL que concomitan con EA, ya que en estos sujetos el declive de memoria, incluso en etapas iniciales, tiende a ser severo. No obstante, la literatura reporta resultados contradictorios, ya que otros estudios previos sugieren que en pacientes con EA +DPCL el rendimiento en memoria es mejor que en EA pura19,95, mientras que Azar et al.30 destacan que no existirían diferencias en deterioro de memoria en pacientes con EA que concomita con DPCL. Dichas discrepancias pueden deberse a las diferencias en el número de participantes incluidos. Por otra parte, cabe destacar que en EA y EA +DPCL se evidencia superposición de síntomas tanto cognitivos como de áreas cerebrales afectadas, lo cual conduce a un diagnóstico diferencial relativamente impreciso77,96.
Atención y función ejecutivaLos declives en atención y funcionamiento ejecutivo destacan como marcadores cognitivos para el diagnóstico diferencial entre EA y DPCL. En línea con nuestros hallazgos, Xu et al.97 reportan que el declive en ambos dominios es severo en la DPCL comparado con la EA. Por otra parte, diversos autores98–100 sugieren que la atención selectiva sería el marcador cognitivo diferencial en etapas iniciales. Si bien el déficit atencional en la EA se experimenta precozmente, estos son más evidentes en etapas moderadas y severas71. No obstante, existen discrepancias con otros estudios101–103, los cuales sugieren que la atención dividida sería clave para diferenciar estos cuadros, ya que en la DPCL el declive es severo.
En cuanto al funcionamiento ejecutivo, se postulan subdominios específicos para el diagnóstico diferencial. Por ejemplo, la evidencia destaca que el control inhibitorio97,104,105 y la flexibilidad cognitiva50,106–109 se ven afectados en la DPCL. En contraste, Bailon et al.110 y Bussè et al.103 sugieren que la flexibilidad cognitiva no experimenta declives significativos en la DPCL. Asimismo, el rendimiento en tareas de pensamiento abstracto y habilidades conceptuales también muestra discrepancias. Algunos autores enfatizan que no existe afectación105,108, mientras que Perri et al.111 reportan un severo compromiso en pacientes con DPCL en comparación con la EA.
Habilidades visuocognitivasEl déficit visuoconstructivo y visuoespacial destacan en la EA y la DPCL. Ferman et al.107 señalan que los declives visuoconstructivos permiten diferenciar de manera correcta no solo la DPCL de la EA, sino que también de personas mayores sanas (sensibilidad del 80%, especificidad del 90%). En línea, otros estudios112–114 indican que en la DPCL las habilidades visuoconstructivas están severamente comprometidas, mientras que en la EA destaca el declive severo en memoria episódica, lo cual favorece el diagnóstico diferencial. Adicionalmente, dichos estudios señalan que las etapas iniciales son esenciales para identificar el déficit, ya que la sintomatología motora de la DPCL en etapas avanzadas contribuye a errores diagnósticos.
Por su parte, las habilidades visuoespaciales también se postulan como claves en el diagnóstico diferencial. Clásicamente, en la DPCL se ha asociado como diferenciador el severo déficit visuoespacial66,77,95,98; sin embargo, se reportan hallazgos interesantes en la EA. Se postula que los declives en estas habilidades serían las primeras manifestaciones cognitivas en la EA, siendo su etapa inicial fundamental para distinguirla de la DPCL115–118.
Adicionalmente, las habilidades visuoperceptivas han sido asociadas a estos cuadros, destacando por su alta complejidad entre los distintos tipos de habilidades visuocognitivas. Se ha reportado que estas se deterioran significativamente en la DPCL, permitiendo en etapas tempranas diferenciarla de la EA22,54,62,76,119,120. No obstante, existen discrepancias, ya que estos déficits se han identificado igualmente en la EA preclínica y en la EA leve121,122.
Fluidez verbal semántica y fonológicaDiversos estudios62,105,106,123 reportan que sujetos con DPCL experimentan severos declives en fluidez semántica y fonológica, destacando además el compromiso en denominación. Ralph et al.22 concuerdan con este postulado, pero destacan que la EA típica evidencia mejor rendimiento fonológico. Otras investigaciones124–126 destacan que el declive en fluidez verbal semántica en la EA se debe a la pérdida del conocimiento semántico. Asimismo, los sujetos con DPCL manifiestan igualmente sintomatología lingüística, pero se diferencian de la EA por presentar preservación de habilidades léxicas y semánticas127. Adicionalmente, cabe destacar que las tareas de fluidez verbal que involucran verbos también se postulan como marcadores cognitivo-lingüísticos. De hecho, Delbeuck et al.128 evidenciaron que pacientes con DPCL logran producir mayor cantidad de verbos en comparación con la EA.
Herramientas de evaluación neuropsicológicaLos estudios analizados en esta revisión reportan el uso frecuente de MMSE y MoCA test para evaluación del desempeño cognitivo. El MMSE es un cribado cognitivo rápido y simple, pero no permite evaluar de manera exhaustiva los diferentes dominios cognitivos. Sin embargo, en la práctica clínica se potencia su uso, ya que permite establecer la progresión del declive cognitivo y diferenciar la EA de la DPCL. De hecho, en la DPCL se evidencian significativas disminuciones en puntajes en seguimiento anual comparados con la EA84,88,129. En línea, estudios longitudinales80,130,131 destacan el rápido deterioro evidenciado en la DPCL por medio de este cribado. Si bien se recomienda que el MMSE es una herramienta más útil que MoCA para la identificación de deterioro cognitivo en la DPCL132, no se recomienda su uso con fines de pronóstico en cuanto al diagnóstico y el declive cognitivo en estudios longitudinales133. Usar el MMSE para monitorizar el curso de la enfermedad tiene utilidad solo en estadios avanzados de la DPCL (GDS>4), ya que en etapas tempranas es normal con frecuencia, y en caso de verse alterado, lo hace cuando hay un perfil amnésico que indica copatología EA. Adicionalmente se reporta variación en las puntuaciones obtenidas en el MMSE, las cuales difieren significativamente en la DPCL (menores puntuaciones en MoCA test y mayores en MMSE)134.
En nuestros hallazgos el FCSRT no evidencia una alta frecuencia de uso, pese a que ha mostrado eficacia en identificar a sujetos con EA135. De hecho, Bussè et al.136 estudiaron su efectividad para distinguir la DPCL de la EA, destacando que si bien los sujetos con DPCL presentan mejor rendimiento general, las puntuaciones en memoria total y recuerdo libre retardado serían claves para diferenciarlos de la EA.
Por otra parte, la evaluación lingüística se basa principalmente en pruebas como el BNT, FAS, fluidez verbal semántica y los subdominios del CAMCOG. Si bien estas herramientas otorgan una visión generalizada del desempeño lingüístico, no evalúan de manera detallada sus subdominios. Así, el Mini-Linguistic State Examination (MLSE)137, recientemente validado en hispanohablantes138 para clasificar la afasia progresiva primaria, podría ser una herramienta de utilidad para caracterizar de mejor manera los declives lingüísticos en la EA y la DPCL en base a fonología, semántica y sintaxis (incluso memoria de trabajo). No obstante, la evaluación lingüística debería considerar en forma complementaria el análisis del lenguaje espontáneo, ya que se propone como clave para diferenciar estos cuadros139.
Técnicas de neuroimagen y patrón de atrofiaLa resonancia estructural es comúnmente utilizada en el diagnóstico de EA y DPCL, permitiendo identificar daño estructural y pérdida de sustancia gris. Investigaciones previas140–142 confirman nuestros hallazgos, destacando que el patrón de atrofia en la DPCL se superpone con la EA. Sin embargo, este es menos difuso en la DPCL, impresionando con moderada preservación temporal medial. En concordancia, diversos estudios143–145 reportan que la EA no solo presenta atrofia temporal, sino también en cingulado, regiones parahipocampales y precuneus. Asimismo, señalan que en la DPCL el adelgazamiento cortical afecta regiones temporooccipitales superiores, orbitofrontales laterales y corteza cingulada posterior y medial143–145.
Por otra parte, estudios con resonancia funcional (fMRI, en inglés) muestran mayor conectividad a nivel de corteza parietal inferior y putamen en la DPCL, mientras que en la EA destacan las áreas frontoparietales, la corteza prefrontal medial, la corteza visual primaria y el hipocampo izquierdo146,147. En contraste, Schumacher et al.47 sugieren cautela en la interpretación de la fMRI, puesto que el incremento de conectividad frontotemporal en la DPCL se superpone con lo reportado en la EA.
El creciente interés por establecer un diagnóstico diferencial certero entre la EA y la DPCL ha promovido el uso de la PET. Esta técnica ha mostrado utilidad para identificar la EA y distinguirla de la DPCL, siendo el hipocampo la región de interés. Mediante PET-TAU es posible identificar la presencia de TAU con mayor concentración hipocampal en la EA y moderada en la DPCL148–150. Asimismo, el uso de PET-FDG sugiere que en la DPCL el hipometabolismo es en el área occipital, preservando el cíngulo posterior, mientras que en la EA el hipometabolismo consideraría áreas temporooccipitales5. Finalmente, Marquié et al.151 sugieren que el uso del radiotrazador 18F-AV-1451 en PET-TAU sería un potencial biomarcador para el diagnóstico diferencial, ya que presenta alta afinidad a la patología neurofibrilar de TAU en la EA.
Limitaciones de la revisiónNuestro estudio presenta cuatro importantes limitaciones a destacar. En primer lugar, la presente revisión no cuenta con un metaanálisis que contribuya de mejor manera a la interpretación de los hallazgos neuropsicológicos y neurales en la EA y la DPCL. En segundo lugar, el número de bases de datos incluidas fue reducido, contando solo con 3 (PubMed, Scopus y Web of Science). Por tanto, futuras investigaciones deberían ampliar el número de bases de datos para obtener una visión global acerca del diagnóstico diferencial en estos cuadros. En tercer lugar, nuestra estrategia de búsqueda fue limitada, enfocándose solo en estudios observaciones de pruebas diagnósticas, descartando así otros diseños de estudio e incluso el diagnóstico neuropatológico. Asimismo, dado nuestro rango de años de estudios incluidos, consideramos necesario tener presente las actualizaciones de los criterios diagnósticos en futuras investigaciones sobre esta temática. Finalmente, cabe destacar que no fue considerada la inclusión de perfiles atípicos de la EA como la afasia progresiva primaria y la atrofia cortical posterior, ya que diversas investigaciones sugieren sintomatología común con la DPCL152–155.
Aportes clínicosDe nuestro conocimiento, esta es la primera revisión sistemática que comprende el diagnóstico diferencial entre la EA y la DPCL considerando tanto el perfil neuropsicológico como el perfil del correlato anatomofuncional. Estos hallazgos no solo son de utilidad para la práctica investigativa, ya que contribuyen de manera directa a mejorar la pesquisa y el diagnóstico diferencial certero en etapas iniciales de ambos cuadros.
Futuras líneas de investigaciónFuturas investigaciones deberían considerar el estudio del procesamiento semántico y fonológico de manera exhaustiva mediante fMRI, caracterizando en forma complementaria el patrón de conectividad de las áreas cerebrales responsables del procesamiento lingüístico en la EA y la DPCL. Finalmente, cabe destacar que el desafío futuro es promover estudios donde el diagnóstico clínico no se limite exclusivamente a la sintomatología neuropsicológica y el patrón de atrofia, sino también a la diferenciación en conjunto con la sintomatología neuropsiquiátrica de ambos cuadros. Respecto a las características de interacción psicoemocional y cognición social, es necesario profundizar en habilidades que conciernen la teoría de la mente, pues pocas investigaciones han examinado la relación de estos procesos y los síntomas neuropsiquiátricos en etapas tempranas del desarrollo de cuadros de demencia156,157.
ConclusiónLa presente revisión identificó las principales similitudes y diferencias tanto neuropsicológicas como de atrofia cortical en pacientes con EA y DPCL. Si bien se proponen como marcadores cognitivos de importancia los dominios de memoria, atención, función ejecutiva, habilidades visuoespaciales/visuoconstructivas y fluidez verbal semántica y fonológica, el nivel de severidad en etapas tempranas sería clave para el diagnóstico diferencial de estos cuadros. Por su parte, el patrón de atrofia fronto-parieto-temporal hipocampal y de precuneus tiende a sobreponerse en ambos en la EA y la DPCL. En este sentido, la identificación de alteraciones funcionales mediante resonancia magnética funcional jugaría un rol de importancia no solo en etapas iniciales, sino también en estadios preclínicos de ambos cuadros neurodegenerativos.
Finalmente, cabe mencionar que el lenguaje se destaca una vez más como un indicador adicional que puede favorecer el diagnóstico diferencial en la EA. No obstante, resulta necesario promover la evaluación del lenguaje espontáneo como recurso complementario para diferenciar de manera temprana y certera entre casos de EA y de DPCL.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesNinguno.
David Toloza-Ramirez agradece a ANID-Subdirección de Capital Humano/Doctorado Nacional/2021-21212181, y Teresa Julio-Ramos a ANID-Subdirección de Capital Humano/Doctorado Nacional/2023-21230591. Asimismo, los autores agradecen a Daniela Aguirre, adscrita al programa de Magíster en Neurociencias de la Universidad Autónoma de Chile, Sede Temuco, por su apoyo en la construcción teórica preliminar de este estudio.