La distonía que responde a dopa (DRD) engloba un grupo clínica y genéticamente heterogéneo de trastornos, que se suele manifestar como una distonía apendicular, típicamente de miembros inferiores, fluctuante a lo largo del día, y que puede progresar a otras partes del cuerpo e incluso cursar con signos parkinsonianos. Como su nombre indica, mejora con tratamiento con levodopa1,2.
Suele deberse a defectos genéticos en enzimas que participan en la biosíntesis de dopamina, y pueden heredarse de forma autosómica dominante (como la asociada al gen GCH1) o recesiva (por mutaciones en los genes TH, SPR o PTP). En algunos casos puede ocurrir por otros trastornos genéticos no relacionados con la síntesis de dopamina, como en la paraplejía espástica hereditaria tipo 11, la ataxia espinocerebelosa tipo 3 o la ataxia telangiectasia1.
Presentamos el caso de una paciente con esta enfermedad, en la que se hallaron dos mutaciones diferentes, una en el gen de la parkina (PRKN) y otra en el de la reductasa de sepiapterina (SPR).
La paciente es una mujer que actualmente tiene 22 años. No tiene antecedentes familiares de enfermedades neurológicas. Los síntomas empezaron cuando tenía 14 años, con movimientos involuntarios de inversión del pie derecho que le dificultaban la marcha. En la exploración neurológica se objetivaba postura distónica en inversión de dicho pie, aumento de tono en miembro inferior derecho, así como temblor en la maniobra de Mingazzini, sin otras alteraciones. El tratamiento con levodopa indujo una mejoría significativa, por lo que se diagnosticó de DRD y se solicitó un estudio genético de GCH1 que resultó negativo.
En los meses siguientes notó torpeza en la mano derecha. En la exploración se constató bradicinesia y rigidez en dicha extremidad, así como disminución del braceo. Caminaba arrastrando el pie derecho. Se extendió el estudio genético que fue negativo para el gen HTT, pero mostró una mutación en el gen PRKN (c.1204 C>T) que codifica la parkina y en el gen SPR (C.308 C>G) que codifica la reductasa de sepiapterina, ambas en heterocigosis y de significado incierto. En sus progenitores, ambos asintomáticos, se hallaron dichas mutaciones: la del gen PRKN en el padre y la del gen SPR en la madre.
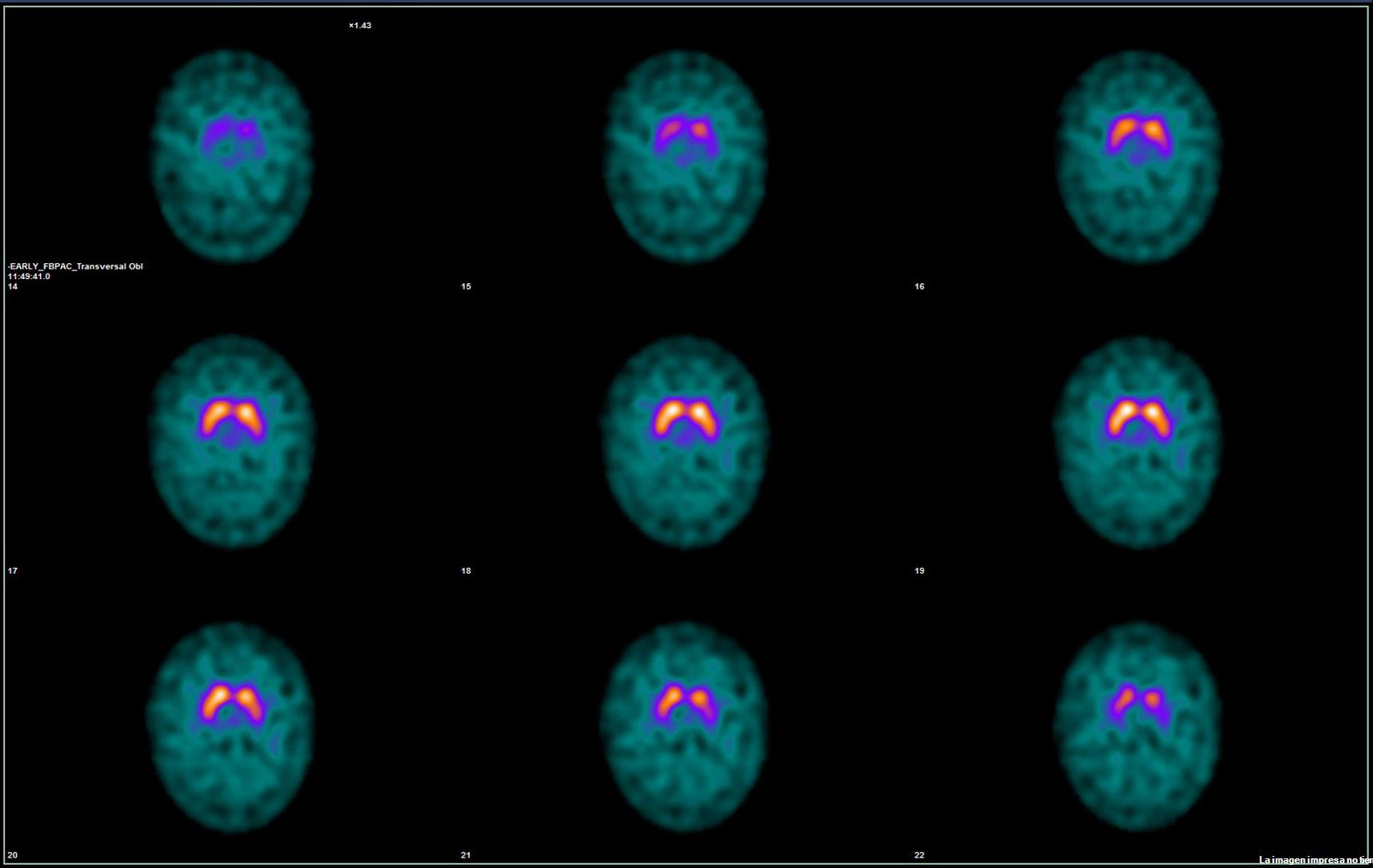
Posteriormente progresó la clínica, con aumento de rigidez del lado derecho y bradicinesia bilateral de predominio derecho, por lo que se aumentó la dosis de levodopa. También notó hiposmia y disgeusia. Además, se diagnosticó de vejiga neurógena. Se solicitó un DaTSCAN (fig. 1) y una gammagrafía de inervación miocárdica con 123I-MIBG que fueron normales.
La paciente no toleró el aumento de medicación, por lo que se derivó a la unidad de trastornos del movimiento. Tampoco mejoró tras infiltración de toxina botulínica en músculo tibial posterior derecho. Se planteó tratamiento con estimulación cerebral profunda (ECP), que la paciente aceptó, y se colocaron electrodos en ambos globos pálidos internos. Previamente a la intervención, tenía una puntuación en la escala UPDRS motora de 45 sin medicación y de 35 tras administración de levodopa. La paciente mejoró significativamente tras la ECP, con parámetros iniciales de 1,5mA, 60μs y 130Hz bilaterales, escalando de forma progresiva durante 8 meses hasta 3,8mA, consiguiéndose así una puntuación en la escala UPDRS motora de 0, pudiéndose suspender la medicación. Persiste una leve distonía ocasional en el pie.
La DRD puede ocurrir por deficiencia de reductasa de sepiapterina, que típicamente sigue un patrón de herencia autosómico recesivo, y condiciona un defecto en la producción de BH4, un cofactor clave en la síntesis de dopamina1–4. Generalmente provoca trastornos del movimiento, crisis oculógiras y discapacidad intelectual en los primeros años de vida cuando se heredan dos alelos patológicos1,3,4.
Por otro lado, las mutaciones en PRKN son la causa más frecuente de parkinsonismo juvenil5, también de herencia autosómica recesiva. Condicionan un defecto de parkina, una ligasa de ubiquitina que participa en la mitofagia y en la biosíntesis de mitocondrias5.
Existe un caso descrito de DRD sin signos parkinsonianos en una paciente portadora de una mutación en heterocigosis en PRKN6, así como otro caso publicado de DRD en una paciente con una mutación en heterocigosis en SPR7.
Sin embargo, dado que ninguno de los progenitores de nuestra paciente mostró sintomatología, creemos que su clínica se debe a la presencia simultánea de estas dos mutaciones en heterocigosis. No hemos encontrado ningún otro caso en la literatura con esta presentación.
La ECP es un tratamiento efectivo para el control de los síntomas de la enfermedad de Parkinson idiopática8, y, aunque con menor evidencia, también parece serlo en los parkinsonismos hereditarios9. La ECP palidal ha demostrado utilidad en el tratamiento de las distonías10, incluyendo aquellas que responden a dopa11. En nuestro caso también ha sido así, por lo que es una alternativa a considerar en pacientes que no responden al tratamiento farmacológico o que no lo toleran.
AutoríaTodos los autores de este trabajo cumplen los criterios de autoría del ICMJE y contribuyeron sustancialmente al trabajo tanto en concepto y diseño, adquisición, análisis e interpretación de los datos, así como en la realización y revisión del manuscrito.
Consentimiento informadoSe ha solicitado el consentimiento informado al paciente participante en este estudio.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.