La neurosonología es una disciplina médica que utiliza las técnicas de ultrasonografía para estudiar el sistema nervioso, y sus aplicaciones van progresivamente en aumento. Las indicaciones y la metodología de aplicación de estas técnicas en pacientes con cefalea no están bien definidas, por lo que existe la necesidad de una guía de consenso, basada en la opinión de expertos, que permita estandarizar su aplicación en la práctica clínica.
DesarrolloExpertos en cefaleas y neurosonología, designados por el Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología y la Sociedad Española de Neurosonología, identificaron las cefaleas primarias y secundarias en las que la neurosonología tiene mayor aplicación clínica. Se realizó una revisión sistemática cualitativa de la bibliografía, en base a la evidencia científica disponible.
ConclusionesEl dúplex-color cervical se consideran una técnica de cribado en pacientes con alta sospecha clínica de disección arterial y podría estar indicada también para el seguimiento. El Doppler transcraneal es una técnica útil para evaluar la presencia de vasoespasmo basándose en los cambios la velocidad media de flujo y el los índices de resistencia y pulsatilidad. La identificación del «signo del halo» es altamente específica de arteritis temporal. La medición de la vaina del nervio óptico permite evaluar la presencia de hipertensión intracraneal. Finalmente, la neurosonología puede ser de ayuda en procedimientos de infiltración occipital o para la realización de una punción lumbar y permite identificar cambios en las estructuras involucradas en la fisiopatología de la migraña, como la sustancia gris periacueductal y los núcleos del rafe.
Neurosonology is a medical discipline that utilizes ultrasound techniques to study the nervous system, with its applications progressively increasing. The indications and methodology for applying these techniques in patients with headaches are not well defined, thus there is a need for a consensus guideline, based on expert opinion, to standardize their application in clinical practice.
DevelopmentExperts in headaches and neurosonology, appointed by the Headache Study Group of the Spanish Society of Neurology and the Spanish Society of Neurosonology, identified primary and secondary headaches where neurosonology has the greatest clinical application. A qualitative systematic review of the literature was conducted, based on available scientific evidence.
ConclusionsCervical color duplex is considered a screening technique in patients with a high clinical suspicion of arterial dissection and may also be indicated for follow-up. Transcranial Doppler is a useful technique for evaluating the presence of vasospasm based on changes in mean flow velocity, and resistance and pulsatility indexes. Identification of the «halo sign» is highly specific for temporal arteritis. Measurement of the optic nerve sheath allows evaluation of the presence of intracranial hypertension. Finally, neurosonology may assist in occipital infiltration procedures or lumbar puncture and enables identification of changes in structures involved in the pathophysiology of migraine such as the periaqueductal gray matter and the raphe nuclei.
La neurosonología es una disciplina médica que utiliza las técnicas de ultrasonografía para estudiar el sistema nervioso. En la actualidad, las indicaciones y la metodología de aplicación de estas técnicas en pacientes con cefalea no están bien definidas, por lo que existe la necesidad de una guía de consenso, basada en la opinión de expertos, que permita estandarizar su aplicación en la práctica clínica.
El Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología y la Sociedad Española de Neurosonología identificó a un grupo de expertos que definieron de manera consensuada cuales eran las cefaleas primarias y secundarias en las que la neurosonología tiene un papel más relevante.
Se realizó una revisión sistemática cualitativa de la bibliografía, en base a la evidencia científica disponible en bases de datos como Pubmed y Cochrane Library, desde enero de 1990 hasta enero de 2024, así como las guías de práctica clínica y documentos de consenso, incorporando la experiencia de los autores.
Disección arterial cervical espontáneaLa disección arterial cervical se define por la presencia de un hematoma en la pared de la arteria carótida o vertebral, representando una de las principales causas del ictus en paciente joven1-2. El síntoma de inicio más frecuente es cefalea y dolor de cuello1,2. El diagnóstico de disección arterial extracraneal requiere la identificación por imagen de alguno de los siguientes hallazgos específicos3: hematoma intramural, aneurisma disecante, estenosis-oclusión larga con morfología característica (apariencia de llama o terminación en punta de lápiz), flap intimal, doble luz arterial u oclusión >2cm por encima de la bifurcación con un aneurisma disecante.
Las técnicas de elección para confirmar la presencia de una disección arterial son la resonancia magnética (RM) y la tomografía computarizada (TC), quedando la angiografía por sustracción digital reservada para pacientes jóvenes con alta sospecha clínica y con negatividad en las pruebas de imagen no invasivas1,4.
Diferentes estudios han demostrado que la sensibilidad (S) de las técnicas neurosonológicas (dúplex-color) es superior al 90% en disecciones graves evaluadas por expertos en neurosonología, comparado con la RM o la TC5-6. Sin embargo, el estudio ecográfico de troncos supraaórticos tiene importantes limitaciones1-2 para valorar determinados segmentos arteriales (carótida supramandibular y segmento V2 vertebral), disecciones cortas y disecciones con bajo porcentaje de estenosis, o que solo han causado síntomas locales, como síndrome de Horner7. Por ello, ante la sospecha de disección arterial extracraneal por técnicas neurosonológicas, es imprescindible confirmar el diagnóstico con RM o TC1,8,9.
La estenosis o la oclusión arterial son los hallazgos más frecuentemente descritos en la disección arterial cervical5, si bien son inespecíficos y solo en ocasiones es posible visualizar la morfología característica en llama o punta de lápiz9. A diferencia de las estenosis típicas, en la disección arterial es habitual que las velocidades pico-sistólicas intraestenóticas no estén excesivamente elevadas y que presenten un patrón post-estenótico de muy alta resistencia y escaso flujo diastólico9.
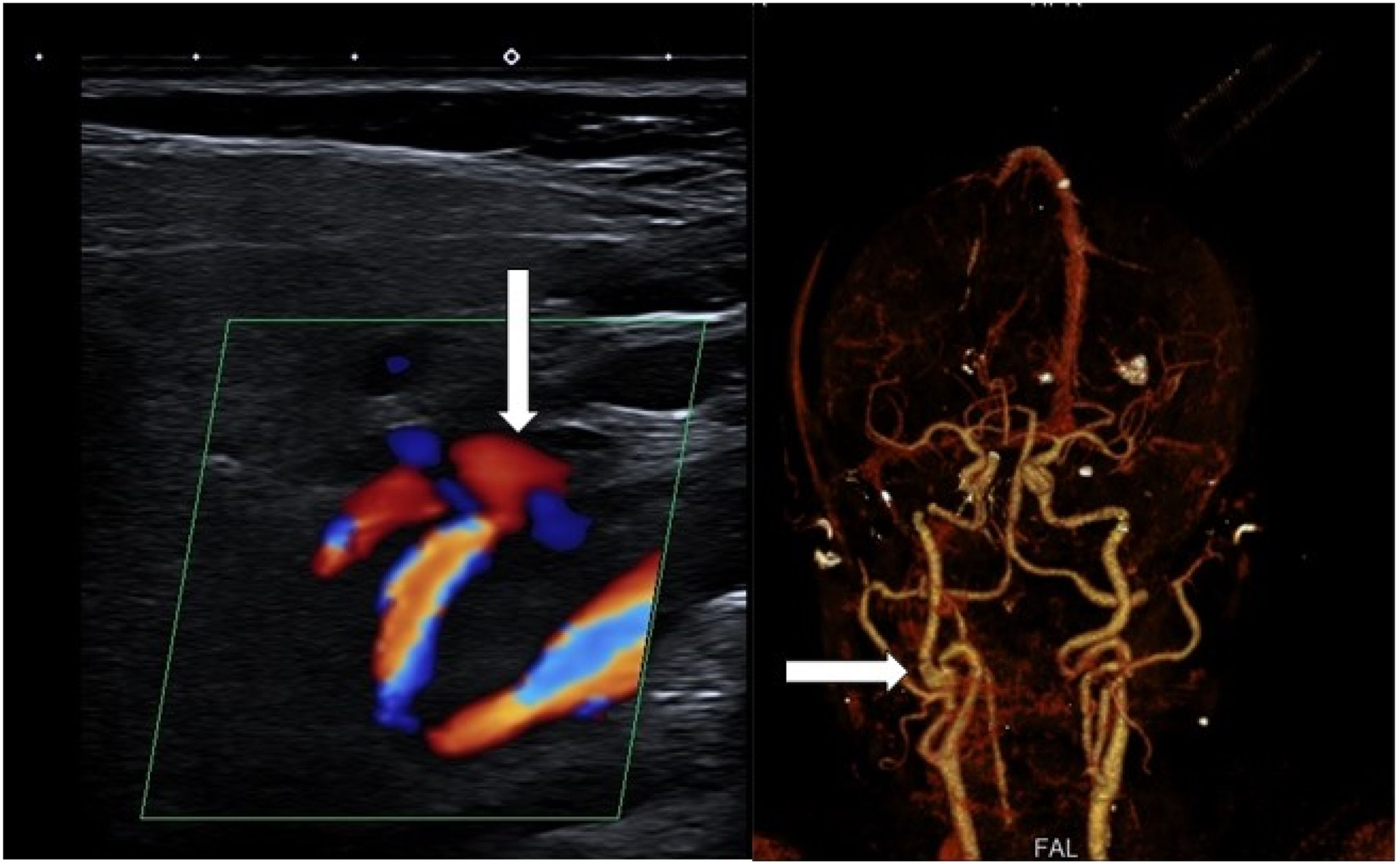
Con frecuencia, la ultrasonografía no permite visualizar los hallazgos específicos de disección arterial. En concreto, la detección de la doble luz o la presencia de una imagen hipoecogénica, de localización excéntrica, sugestiva de trombo mural, se detecta en menos del 25% de pacientes5, siendo la visualización del flap intimal aún menos frecuente5,7, aunque sí que se puede visualizar el aneurisma disecante cuando ocurre (fig. 1).
Por todo lo expuesto, el dúplex color cervical se considera en la actualidad una técnica de cribado para el diagnóstico de pacientes con alta sospecha clínica de disección arterial y podría estar indicada también para el seguimiento1,8,9.
Vasoespasmo de las arterias intracraneales. Hemorragia subaracnoidea. Síndrome de vasoconstricción cerebral reversibleLa cefalea en trueno es la manifestación más frecuente de la hemorragia subaracnoidea (HSA). El vasoespasmo es una de las complicaciones más frecuentes tras una HSA, afecta al 30-70% de los pacientes y puede ser evaluado mediante Doppler transcraneal (DTC). En un tercio de pacientes el vasoespasmo puede conllevar una isquemia diferida o puede suponer un hallazgo angiográfico sin correlato clínico10. Consiste en un estrechamiento patológico de las arterias cerebrales, apareciendo típicamente entre el tercer y el séptimo día tras la HSA. El DTC puede ser muy útil por su carácter no invasivo11. La velocidad media (Vm), que es la medida más relevante para evaluar la presencia de vasoespasmo, estará elevada. Además, deben analizarse los índices de resistencia y pulsatilidad, que capturan cambios en la resistencia vascular, y que también se encuentran incrementados12.
Para mitigar factores de confusión como la edad o patologías que puedan influir en el flujo sanguíneo cerebral se usan índices corregidos, como el índice de Lindergaard (IL), que es el cociente resultante de la división de la Vm de la arteria cerebral media (ACM) entre la Vm de la carótida interna extracraneal13. En la tabla 1 se muestran los valores estandarizados de la Vm, el IL y el índice de Sloan (IS) para el diagnóstico de vasoespasmo en las diferentes arterias del polígono de Willis14.
Valores estandarizados de velocidades de flujo e índices corregidos para el diagnóstico de vasoespasmo en las diferentes arterias del polígono de Willis
| Arteria | VPS (cm/s) | Vm (cm/s) | IL/IS |
|---|---|---|---|
| ACM | 108 | 35-90 | <3 |
| Vasoespasmo leve | 200-250 | 120-150 | 3-4 |
| Vasoespasmo moderado | 250-300 | 150-200 | 4-6 |
| Vasoespasmo severo | > 300 | > 200 | > 6 |
| ACA | |||
| Vasoespasmo leve-moderado | > 120 | > 80 | > 4 |
| Vasoespasmo severo | > 155 | ||
| ACI | |||
| Vasoespasmo leve-moderado | > 120 | > 130 | |
| Vasoespasmo severo | > 155 | ||
| ACP | |||
| Vasoespasmo leve-moderado | > 100 | > 110 | |
| Vasoespasmo severo | > 120 |
ACA: arteria cerebral anterior; ACI: arteria carótida interna; ACM: arteria cerebral media; ACP: arteria cerebral posterior; IL: índice de Lindergaard; IS: índice de Sloan (utilizado en ACA); Vm: velocidad media; VPS: velocidad pico-sistólica.
El síndrome de vasoconstricción cerebral reversible (SVCR) es un síndrome clínico-radiológico debido, probablemente, a una disfunción endotelial y de la autorregulación del tono vascular. Cursa con una vasoconstricción arterial difusa, multifocal y segmentaria que se resuelve habitualmente en menos de 3meses. En ocasiones el SVCR puede acompañarse de HSA y/o áreas de isquemia15. La etiología puede ser idiopática o secundaria, reconociéndose como desencadenantes más comunes el posparto precoz, la preeclampsia y el uso de fármacos, fundamentalmente serotoninérgicos, simpaticomiméticos o inmunomoduladores. El síntoma clave de este síndrome es la cefalea en trueno recurrente16, acompañada a veces de sintomatología neurológica focal y/o crisis epilépticas17.
En la actualidad, la arteriografía continúa siendo el gold standard diagnóstico del fenómeno de SVCR18. El DTC tendría una S cercana al 90% en comparación con la arteriografía19,20. El hallazgo principal es el incremento en las velocidades de flujo en al menos uno de los principales vasos sanguíneos cerebrales (promedio de 120cm/s), alcanzando su punto máximo entre la 3.ª y la 4.ª semanas a partir del inicio de los síntomas.
Los parámetros habitualmente utilizados para establecer la gravedad de la vasoconstricción son los mismos a los detallados en el vasoespasmo tras HSA.
El síndrome de encefalopatía posterior reversible (PRES) es un síndrome clínico radiológico que se solapa con el SVCR, y su diagnóstico se basa en la combinación de los hallazgos clínicos característicos, la presencia de factores de riesgo y los cambios en la RM craneal. Las etiologías son variadas, e incluyen el uso de fármacos citotóxicos e inmunosupresores, enfermedades autoinmunes y otros procesos sistémicos, como crisis hipertensiva, sepsis, trasplante, eclampsia o insuficiencia renal.
En el PRES pueden aparecer datos de vasoconstricción análogos al SVCR, por lo que el DTC sería de utilidad21. Algunos autores defienden el uso, además de la DTC, de la ecografía transorbitaria para medir de forma no invasiva los signos de aumento de presión intracraneal22.
Arteritis de células gigantesLa arteritis de células gigantes (ACG) es una vasculitis que afecta a los vasos craneales, la arteria temporal (AT) y las arterias extracraneales (aorta y sus ramas)23,24, y es más común en personas mayores de 50años25. Tiene una incidencia anual de 10/100.000 y una prevalencia de 50 casos por cada 100.000 individuos.
La edad, principal factor de riesgo, puede influir a través de procesos degenerativos, estrés oxidativo, mutaciones y disfunciones mitocondriales26-27. Adicionalmente, se ha sugerido que ciertos agentes infecciosos podrían activar células dendríticas vasculares28.
El síntoma inicial más común es una cefalea de novo persistente (60% de los casos)29. Aunque típicamente se localiza en las sienes, debido a la inflamación de la AT, también puede ser frontal, occipital o generalizada30. Adicionalmente se puede observar claudicación mandibular y neuropatía óptica isquémica anterior, entre otros31-33. La exploración puede evidenciar sensibilidad, induración y ausencia de pulso de la AT y/u otras arterias craneales31. Si bien dichos hallazgos son típicos de la ACG, su ausencia no la descarta; por otra parte, algunas personas mayores pueden tener una AT prominente sin significado patológico34.
Aunque la biopsia de la AT ha sido la prueba de referencia en el pasado, la experiencia del cirujano, el fenotipo, la longitud y la calidad de la muestra pueden afectar la S35. Se estima que la mitad de las biopsias resultan negativas por su afectación parcheada36. En el análisis sanguíneo se puede encontrar una velocidad de sedimentación globular mayor a 50mm/h y la proteínaC reactiva mayor a 20mg/l. Otros hallazgos incluyen anemia, leucocitosis y trombocitosis, entre otros. La angiografía mediante RM de alta resolución con contraste permite visualizar la inflamación de la AT y el edema mural37. Sin embargo, la necesidad de contraste y los costos que conlleva limitan el uso generalizado de esta prueba.
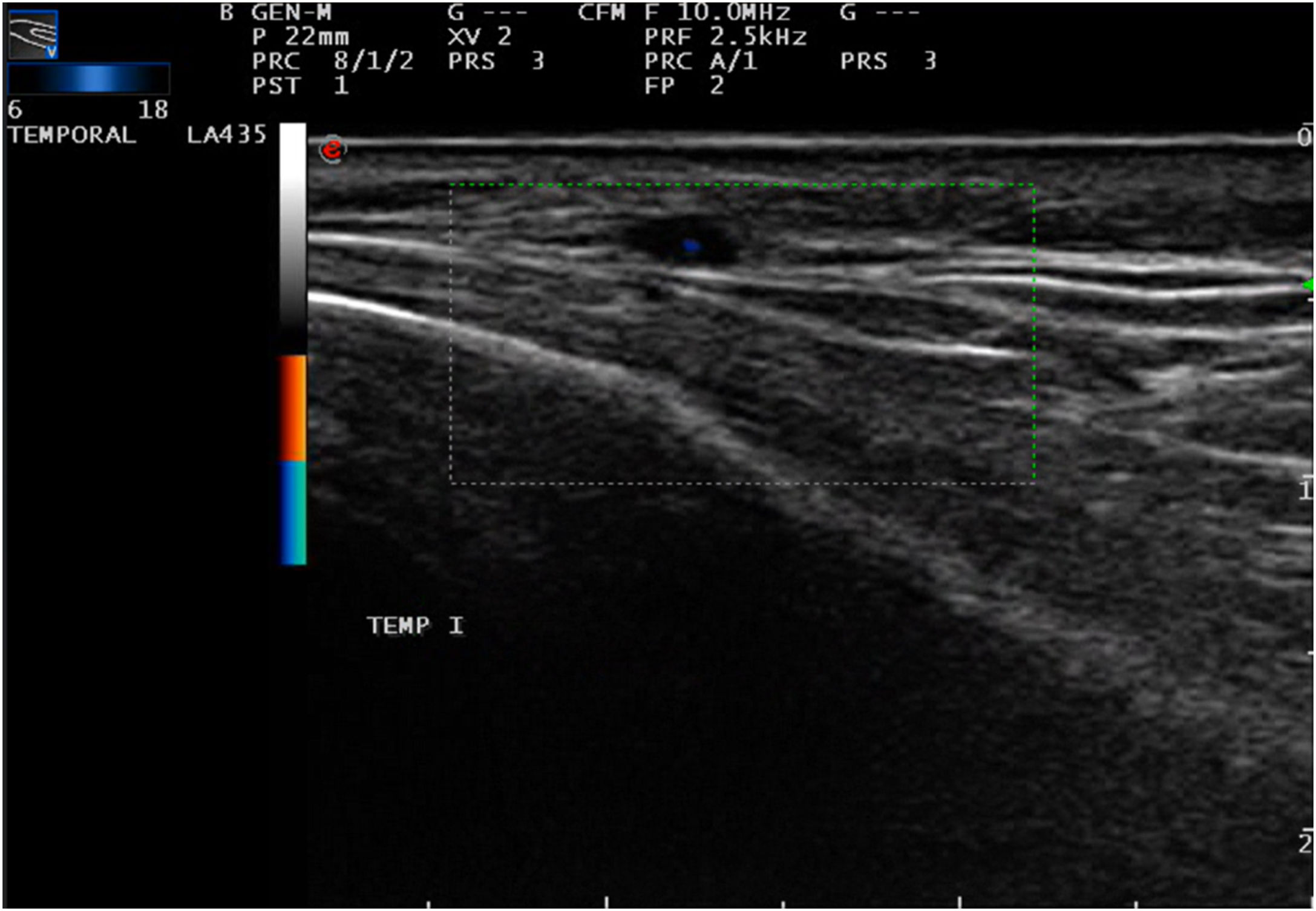
Para evitar los inconvenientes asociados a la biopsia, el dúplex-color de la cabeza, el cuello y las extremidades superiores se ha convertido en una herramienta diagnóstica muy útil. Con una resolución de 0,1mm, permite visualizar la AT y otras arterias craneales pequeñas, como las faciales, las occipitales y las vertebrales. La S oscila entre el 55 y el 100%, y la especificidad (E), entre el 78 y el 100%38. Preferiblemente se debe realizar antes de iniciar el tratamiento o dentro de la primera semana, ya que la terapia con glucocorticoides disminuye la S. Es recomendable evaluar también las arterias axilares y subclavias, dado que es posible identificar señales de vasculitis en arterias más grandes, hallazgos que podrían pasar desapercibidos en estudios diagnósticos que solo se enfocan en las arterias craneales39. El hallazgo típico es el «signo del halo» (fig. 2), que se caracteriza por una imagen hipoecogénica de 0,3 a 2,0mm alrededor de la luz vascular que indica la presencia de edema en la pared40 (fig. 2). La presencia de halo en ambas AT es altamente específico de arteritis temporal41. El «signo de compresión» también tiene alta E, y hace referencia a la persistencia del halo tras comprimir la luz del vaso con la sonda de ultrasonido42. Además, pueden observarse estenosis (con marcada elevación de la velocidad de flujo) y oclusión de la arteria, pero su E es considerablemente menor.
La ecografía Doppler (ED) tiene como desventaja que se trata de una prueba «operador-dependiente». Adicionalmente, la variabilidad en los equipos, las configuraciones de la sonda, la técnica y el contexto clínico pueden influir en los resultados. La estandarización de estos factores facilita su uso generalizado en la arteritis temporal.
El estudio mínimo engloba las temporales, aunque se recomienda estudiar el máximo número de arterias potencialmente afectadas (troncos supraaórticos, occipitales, mandibulares, órbita, axilar y polígono de Willis), especialmente si la clínica orienta a la afectación de ese territorio. En la evaluación de las arterias cervicales, extracraneales, orbitarias y axilares se emplea una sonda lineal (3-12MHz). En la arteria temporal es recomendable el uso de sondas de alta frecuencia (≥15MHz), aunque la de 3-12Hz resulta suficiente. Para las arterias intracraneales del polígono de Willis y el arco aórtico se debe utilizar una sonda sectorial de baja frecuencia (1-4MHz).
Estudio del nervio óptico en la hipertensión y la hipotensión intracranealLa hipertensión intracraneal idiopática (HII) produce cefalea diaria de características variables que empeora con la tos, el esfuerzo o el decúbito43,44. Asocia oscurecimientos transitorios, diplopía, pérdida de agudeza visual y tinnitus pulsátil. Es frecuente a la exploración el papiledema, aunque puede no estar presente. Se desconoce la causa, aunque se postula alteración de la absorción del líquido cefalorraquídeo (LCR) o estenosis del seno transverso uni o bilateral45. La obesidad y los factores hormonales y metabólicos juegan un papel crucial.
La RM craneal y la punción lumbar son diagnósticas. Se trata de técnicas muy precisas y sensibles, pero costosa y de larga duración la primera, y no ausente de efectos secundarios la segunda46. La ED color es una técnica sencilla, rápida, económica, inocua, que se puede hacer a pie de cama con rapidez, con escasa variabilidad intra e interobservador, y es ideal para la consulta de neurología.
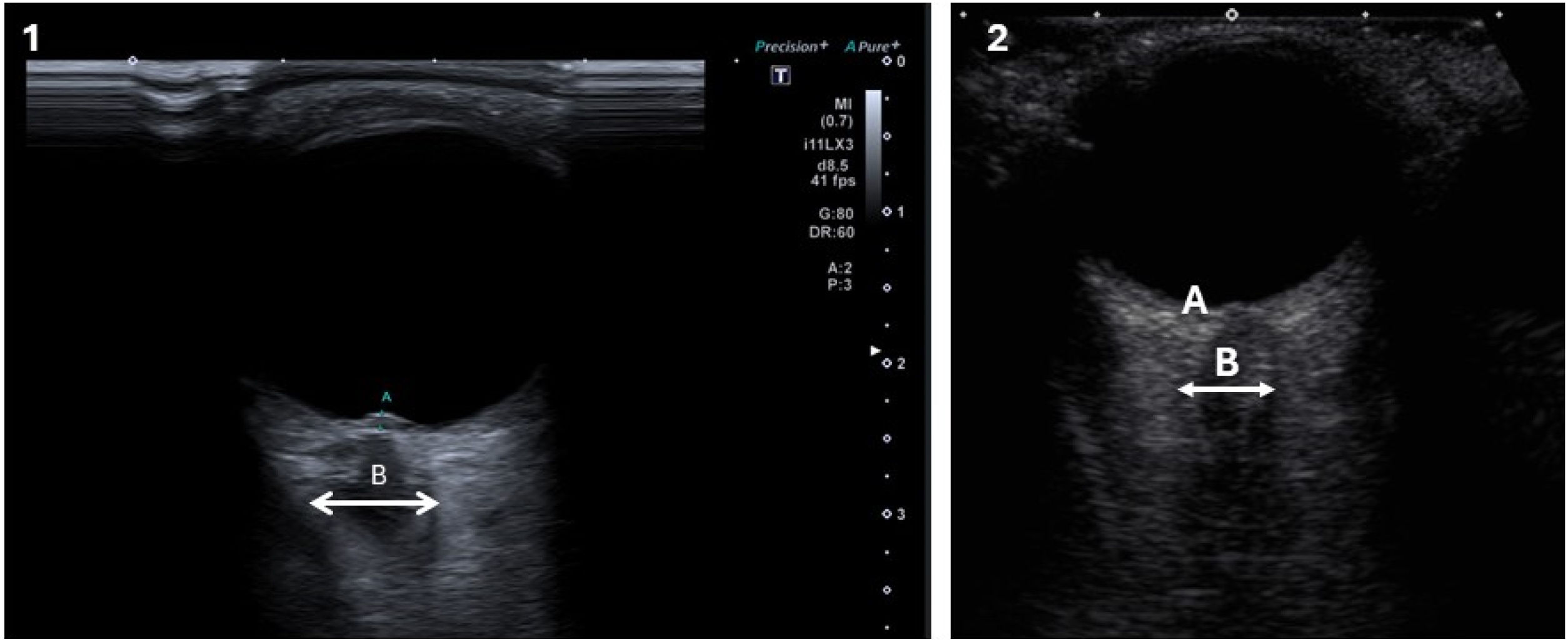
El nervio óptico (NO) es una estructura tubular de unos 5cm de largo, cubierta por las tres capas meníngeas y un pequeño espacio subaracnoideo. Diversos estudios han mostrado la utilidad de la medición de la vaina del NO (ONSD) para la detección de la HII, encontrándose aumentado su valor respecto a pacientes sanos47-50 (fig. 3). También podemos encontrar una protrusión de la cabeza del NO por presencia de papiledema47. Es útil tanto para el diagnóstico como en el seguimiento, normalizándose los valores una vez realizado el tratamiento pertinente47,49,51. Varios estudios han mostrado buena correlación entre esta técnica y la RM craneal, siendo la ultrasonografía más económica y fácilmente accesible al neurólogo de consulta46,50,51.
Ecografía orbitaria, modo B. En 1 se muestra papiledema que sobresale en el globo ocular (A), nervio óptico (B) y vaina del nervio óptico (flecha). En 2 se ilustra la ecografía orbitaria normal: papila(A), nervio óptico (B) y vaina del nervio óptico (flecha).
Imagen cortesía del Dr. Rodríguez Pardo de Donlebún.
La cefalea atribuida a la hipotensión intracraneal espontánea se produce por una fuga de LCR de localización habitualmente espinal. Es más frecuente en mujeres de mediana edad y se relaciona con enfermedades del tejido conectivo o patología degenerativa discal. En los casos secundarios a traumatismos leves suele existir un defecto basal de las vainas de las raíces nerviosas por divertículos meníngeos, una rotura por una hernia discal u osteófitos, o una fístula de LCR-venosa. La cefalea es ortostática (aunque puede desaparecer en casos crónicos), bilateral, occipital y de intensidad variable, que puede empeorar con maniobras de Valsalva o con la tos. Asocia rigidez de cuello, náuseas, vómitos, tinnitus, hipoacusia, inestabilidad o vértigos. La RM craneal es de gran ayuda para el diagnóstico.
En ultrasonografía existe una reducción significativa del ONSD al cambiar el paciente de posición supina a la bipedestación, respecto a controles sanos y pacientes con hipotensión intracraneal sin cefalea52. También se ha observado una reducción del ONSD al diagnóstico, llegando a alcanzar valores normales tras meses de tratamiento con cafeína y el uso de parches de sangre autóloga53.
Bloqueo anestésico del nervio occipital mayor43,54-58El nervio occipital mayor (NOM) es la rama sensitiva que emerge de la división posterior del nervio espinal C2. Junto con el nervio occipital menor, el NOM recoge la información sensitiva táctil y algésica desde la región occipital hasta el vértex.
Actualmente, el bloqueo anestésico del NOM tiene beneficio demostrado en ensayos clínicos aleatorizados en migraña, cefalea en racimos, cefalea cervicógena y neuralgia occipital. Sus contraindicaciones son la alergia a los anestésicos locales y la presencia de defectos óseos craneales. El efecto adverso más frecuente es la reacción vagal.
La realización de ecografía en el NOM tiene la ventaja de localizar con seguridad el nervio y de poder infiltrar la zona intermedia, que parece ser más eficaz.
El NOM puede localizarse usando un transductor lineal de alta frecuencia (10-12MHz) situado en la región cervical con el borde medial de la sonda sobre la apófisis espinosa de C2 y el borde lateral hacia la apófisis transversa de C1. De esta manera, la sonda se sitúa en posición oblicua sobre la localización del obliquus capitis inferior. En este punto debe localizarse el semispinalis capitis, superficial con respecto al músculo anterior. La sección transversal del NOM se visualizará entre ambos músculos. Usando Doppler color no visualizaríamos la arteria occipital en este caso (se encuentra más cefálica), pero podríamos localizar la arteria vertebral si seguimos el trayecto del obliquus capitis inferior hacia lateral. Esta arteria, por lo tanto, no está directamente relacionada con el NOM, pero su localización es aconsejable para evitar puncionarla durante la infiltración.
Para la infiltración se puede usar cualquier anestésico local en una jeringa de 2-5ml con una aguja de 25G y de 4-5cm de longitud. Para una mejor visualización de la aguja se puede realizar una infiltración en el plano del transductor una vez localizados el nervio y la arteria vertebral, progresando la aguja desde el borde lateral de la sonda hacia medial. Suelen infiltrarse entre 2 y 5ml de anestésico local.
Punción lumbar59-62La punción lumbar (PL) asistida por ultrasonidos fue descrita por los rusos Bogin y Stulin en 1971, y siempre es recomendable realizarla si hay disponibilidad de ecógrafo. Ante la falta de disponibilidad, se puede programar la PL eco-asistida en ciertos casos de potenciales obstáculos en el trayecto de la aguja o de riesgo de sangrado (tabla 2). También se podría contemplar en pacientes en los que se intuye una mala cooperación: pacientes muy ansiosos, niños… Otra posible indicación podría ser que el médico que debe realizar la PL no tenga experiencia, aunque para realizar la ecografía se requiere experiencia también. Finalmente, se debe realizar la PL eco-asistida ante una PL que no es fructífera tras varios intentos.
Entidades que más frecuentemente dificultan la PL
| Entidades que dificultan punción lumbar basada en marcadores anatómicos |
|---|
| Obesidad (IMC > 35) |
| Lesiones subcutáneas a la inspección/palpación (mayor riesgo de sangrado) |
| Deformaciones de la columna vertebral |
| Cirugía vertebrodiscal (escoliosis, hiperlordosis, hipercifosis) |
| Traumatismo vertebral previo |
| Riesgo de sangrado |
| Mala cooperación |
Las tres aplicaciones más habituales de la PL ecoguiada son la escoliosis en pacientes jóvenes, la artrosis en mayores y la obesidad.
Otras aplicaciones posibles son: lesiones subcutáneas a la inspección/palpación (lipomas, quistes sebáceos…), trastornos de la curvatura fisiológica de la columna vertebral (escoliosis, hiperlordosis, hipercifosis…), deformaciones de la columna vertebral congénitas o adquiridas (artrosis, enfermedades reumáticas…), cirugía vertebro-discal o traumatismo vertebral grave previos en el área lumbar de la punción. Otra posible indicación es el riesgo de sangrado en pacientes con una malformación vascular subcutánea en el área lumbar de la punción. Otras potenciales indicaciones incluyen pacientes sometidos a mielografía o inyección intratecal de fármacos, antecedente de complicaciones en PL previa o procedimientos anestésicos espinales: síndrome de hipotensión intracraneal, hematoma paraespinal, radiculopatía aguda, meningitis/absceso…
Otras aplicaciones futurasEn la fase aguda de la trombosis de senos venosos (TSVC) la oclusión de los senos durales puede diagnosticarse mediante ecografía dúplex transcraneal codificada en color (TCCS) tras la aplicación de un agente de contraste eco que demuestre un defecto de llenado. El flujo venoso colateral puede evaluarse tanto por DTC como por ED color transcraneal (TCCS). El dúplex es especialmente rentable si la TSVC se extiende a las venas yugulares. Sin embargo, las técnicas ultrasonográficas no son lo suficientemente sensibles para excluir la trombosis venosa cerebral, pero pueden complementar otras técnicas de imagen63-64. La ultrasonografía intracraneal con contraste es probablemente una herramienta útil para el diagnóstico de TSVC si no se pueden utilizar otras modalidades de neuroimagen o si la única opción posible es un examen a pie de cama65.
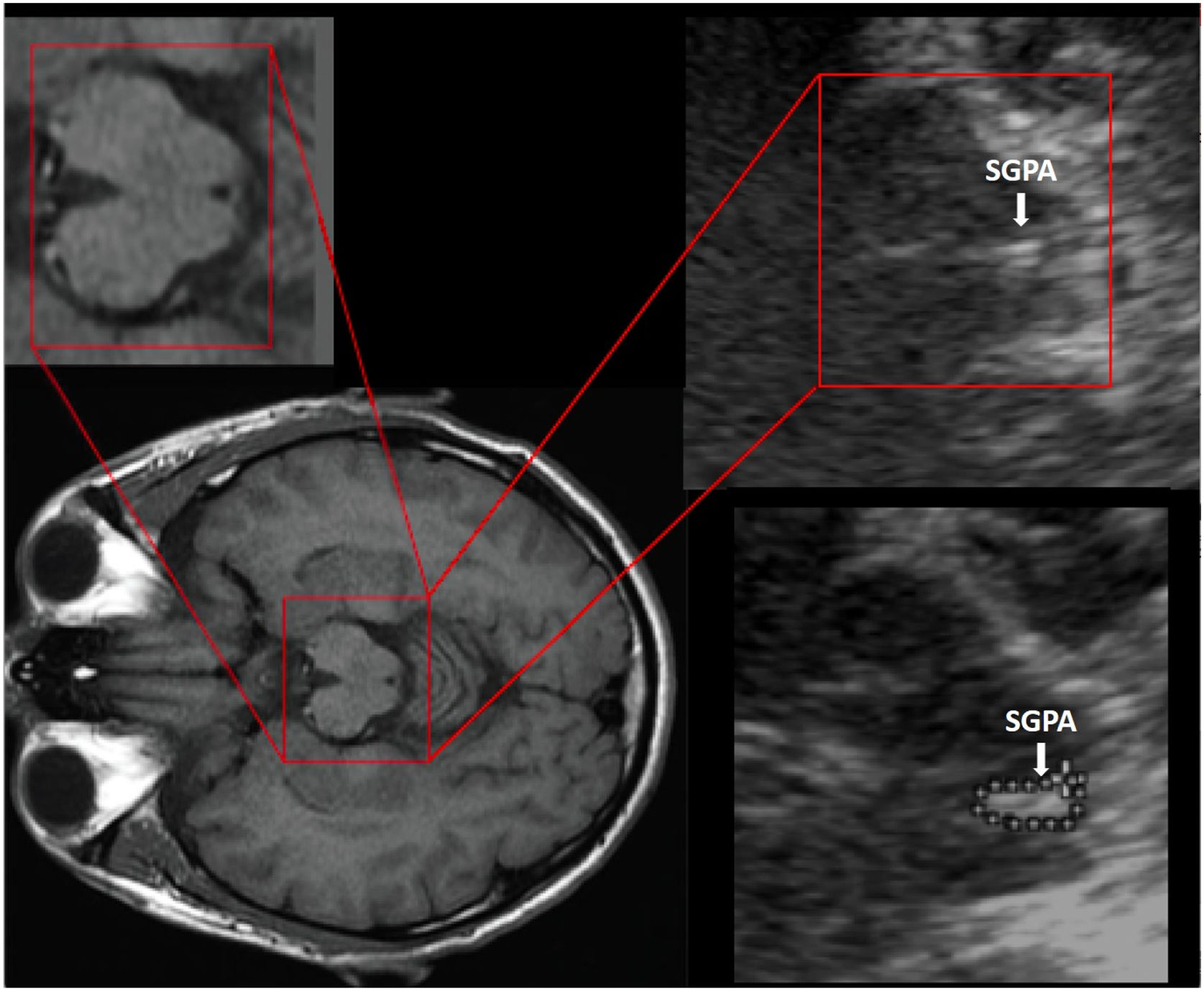
Se ha explorado la utilidad de la ecografía transcraneal en el estudio de estructuras cerebrales profundas, como la sustancia gris periacueductal (SGPA), que juega un papel fundamental en la migraña. La SGPA controla la respuesta nociceptiva, permite la inhibición de estímulos dolorosos y conecta con estructuras encefálicas, fibras medulares ascendentes y núcleos del rafe. En un estudio de casos y controles se observó que los pacientes con migraña crónica presentaban cambios estructurales en la SGPA en comparación con los pacientes con migraña episódica y los controles. Dichos cambios consistían en una mayor área de esta estructura, así como una menor intensidad de la ecogenicidad y mayor heterogeneidad de la misma66.
La hipoecogenicidad de los núcleos del Rafe (hR) es más prevalente en pacientes con depresión unipolar67 en comparación con los controles. La comorbilidad entre migraña y depresión es bidireccional, lo que sugiere un mecanismo común de disfunción serotoninérgica68-70. Hasta la fecha, cinco estudios y un metaanálisis han explorado la asociación entre hR y migraña. Tres de los cinco estudios, así como el metaanálisis, han mostrado una mayor prevalencia de hR en pacientes con migraña en comparación con los controles71-73. En los pacientes con migraña, la presencia de hR se ha asociado con puntuaciones más altas en las escalas de depresión72,74, mayor frecuencia de ataques75 y mayor uso de analgésicos71.
Como técnica, se utiliza un transductor de ultrasonidos de 2MHz con una profundidad de penetración de 14cm y un rango dinámico de 45-55db. El examen se realiza a través de la ventana ósea transtemporal para evaluar los planos mesencefálico y talámico. La SGPA se define ecográficamente como una estructura que rodea el acueducto de Silvio, con una ecogenicidad mayor que la señal del LCR observada en el acueducto y en el tejido circundante (fig. 4). La hipoecogenicidad de los núcleos del rafe del tronco encefálico se considera cuando esta estructura de la línea media del mesencéfalo esté interrumpida o no es visible67.
Conflictos de interesesNinguno.