OnabotulinumtoxinA ha demostrado ser eficaz como tratamiento preventivo en pacientes con migraña crónica (MC). El Grupo de Estudio de Cefalea de la Sociedad Española de Neurología ha considerado que sería de interés, a los 5 años de la aprobación en España de la onabotulinumtoxinA, reunir a un grupo de expertos en el tratamiento de pacientes con MC para elaborar con la evidencia actual y nuestra experiencia unas recomendaciones dirigidas a facilitar su uso en la práctica clínica diaria. Con este fin planteamos 12 preguntas que nos hacemos como médicos y que también nos realizan nuestros pacientes. Cada autor ha contestado una pregunta y luego el documento ha sido revisado por todos. Esperamos que esta revisión constituya una herramienta práctica para ayudar a los neurólogos que tratan a pacientes con MC.
OnabotulinumtoxinA has been demonstrated to be effective as a preventive treatment in patients with chronic migraine (CM). Five years after the approval of onabotulinumtoxinA in Spain, the Headache Study Group of the Spanish Society of Neurology considered it worthwhile to gather a group of experts in treating patients with CM in order to draw up, based on current evidence and our own experience, a series of guidelines aimed at facilitating the use of the drug in daily clinical practice. For this purpose, we posed 12 questions that we ask ourselves as doctors, and which we are also asked by our patients. Each author responded to one question, and the document was then reviewed by everyone. We hope that this review will constitute a practical tool to help neurologists treating patients with CM.
Uno de los objetivos del Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología (GECSEN) es elaborar documentos de consenso para establecer unas «guías de buena práctica clínica» a partir de la experiencia y la evidencia contrastada. El consenso sobre técnicas de infiltración anestésica en nervios pericraneales1 fue nuestro primer trabajo y este documento tiene la intención de seguir en la misma línea. La elección de estos temas se ha basado, principalmente, en la falta de un claro «consenso» sobre cómo se debe aplicar y evaluar un tratamiento en la práctica clínica diaria.
Además, se ha tenido en cuenta la experiencia de aquellos neurólogos que, por trabajar en unidades de cefalea de referencia y haber demostrado a través de sus publicaciones interés en el tema que se trata, aportaran una información de lo que ocurre en la vida real una vez un tratamiento se pone en práctica tras ser aprobado después de la realización de ensayos clínicos.
El objetivo de este manuscrito es dar respuesta a las preguntas que los neurólogos se plantean a la hora de afrontar el manejo terapéutico con onabotulinumtoxin A (OnabotA) en los pacientes con migraña crónica (MC) con el objetivo final de poder ofrecerles el mejor tratamiento posible y así minimizar el impacto y la discapacidad que genera.
MetodologíaUn grupo de neurólogos expertos en el manejo y tratamiento de pacientes con MC han trabajado en colaboración para contestar a partir de su experiencia y de la evidencia publicada a las 12 preguntas que consideraron que son las que más influyen en el manejo terapéutico de los pacientes con MC tratados con OnabotA.
Los temas que se han tratado responden a 6 áreas de interés:
1) mecanismo de acción de OnabotA, 2) factores relacionados con la respuesta al tratamiento con OnabotA, 3) dosificación de OnabotA y tratamiento coadyuvante, 4) coste-efectividad del tratamiento con OnabotA, 5) seguridad del tratamiento con OnabotA e 6) información dirigida al paciente.
Se realizó una revisión de la literatura en la base de datos MEDLINE mediante el proveedor Pubmed, que incluyó los diferentes artículos publicados hasta abril de 2017. Esta búsqueda bibliográfica se complementó con las listas de referencias obtenidas de los artículos seleccionados, bases de datos de organizaciones y de las sociedades de Neurología y de las guías de práctica clínica de referencia.
Cada neurólogo ha contestado una pregunta. Esta contestación ha sido revisada críticamente y de forma ciega por otro experto y después todos revisaron de forma conjunta el documento final.
1. ¿Cuál es el mecanismo de acción de onabotulinumtoxinA?OnabotA (Botox®) es una de las formas de toxina botulínica de tipo A (BoNTA), perteneciente a la gran familia de neurotoxinas sintetizadas por la bacteria Clostridium botulinum. Se trata de una proteína compuesta por 2cadenas polipeptídicas, una pesada y una ligera, que permanecen unidas por un puente disulfuro2,3. Al entrar en contacto con las terminaciones nerviosas presinápticas, la cadena pesada se une a receptores de membrana y el complejo toxina-receptor se integra en la neurona mediante un proceso de endocitosis. A continuación, se produce un cambio de conformación de la proteína, se rompe el enlace disulfuro y la cadena ligera se libera hacia el citoplasma neuronal3,4. Tras pasar al citoplasma, la cadena ligera interacciona con el complejo SNARE (del inglés, Soluble N-ethylmaleimide-sentive factor Attachment protein REceptor). Este complejo está formado por un grupo de proteínas vesiculares y de membrana, y permite la fusión de las vesículas sinápticas con la membrana sináptica. Concretamente la BoNTA escinde la proteína SyNaptosomal Associated Protein-25 (SNAP-25), una proteína esencial del complejo SNARE que está anclada en la cara interna de la membrana plasmática5. Al dañar el complejo SNARE, la toxina impide la exocitosis de neurotransmisores y neuropéptidos desde las terminaciones nerviosas hacia la hendidura sináptica3.
El efecto más conocido de OnabotA es su capacidad de inhibir la liberación de acetilcolina en la placa motora. Este efecto se ha aprovechado extensamente para tratar procesos neurológicos caracterizados por hiperactividad muscular. OnabotA también bloquea la liberación de acetilcolina desde las terminaciones nerviosas del sistema nervioso vegetativo, lo que justifica su aplicación en determinados cuadros de disfunción autonómica4,6. En los últimos años las indicaciones terapéuticas de OnabotA se han extendido al campo del dolor, al haber demostrado eficacia clínica en la MC y en otros síndromes dolorosos. También en el ámbito experimental se ha podido demostrar que la BoNTA interfiere en la transmisión de los estímulos de dolor7-9.
El mecanismo exacto por el cual OnabotA tiene un efecto antinociceptivo no se ha aclarado por completo. En cultivos celulares y en el animal de laboratorio se ha comprobado que la BoNTA bloquea la liberación periférica de neuropéptidos implicados en la inflamación neurogénica, como la sustancia P10,11 y el péptido relacionado con el gen de la calcitonina (CGRP)11,12, y de neurotransmisores excitadores como el glutamato13,14. También es capaz de bloquear la translocación de receptores de membrana hacia la superficie de las neuronas sensitivas, como el receptor vaniloide transient receptor potential vanilloid 1 (TRPV1)15-17 o el receptor purinérgico P2X316. Por todos estos mecanismos, la BoNTA podría disminuir la sensibilización de las terminaciones nerviosas periféricas e, indirectamente, la sensibilización central18. Este parece ser el fundamento de la aplicación de infiltraciones pericraneales de OnabotA en el tratamiento de la MC. De hecho, en el protocolo Phase III Research Evaluating Migraine Prophylaxis Therapy (PREEMPT III) los puntos de infiltración se sitúan próximos a los nervios peritracraneales que dirigen sus aferencias hacia el núcleo espinal del trigémino19. Además, algunos trabajos experimentales señalan que la BoNTA podría modular directamente las señales de los nociceptores meníngeos a través de ramas nerviosas colaterales que atraviesan las suturas del cráneo20,21. Independientemente de sus efectos periféricos, en condiciones experimentales con dosis altas, BoNTA podría llegar a alcanzar el sistema nervioso central por transporte axónico retrógrado y por transferencia interneuronal22. Sin embargo, en el animal de experimentación solo se han detectado fragmentos de escisión de la proteína SNAP-25 en las neuronas más periféricas, por lo que resulta poco probable que las infiltraciones de BoNTA tengan efectos relevantes a nivel central23.
2. ¿Cuáles son los factores predictores de la respuesta a onabotulinumtoxinA?Desde el inicio de la investigación de OnabotA como posible tratamiento en MC, múltiples grupos de investigación han buscado factores predictores de respuesta a dicho tratamiento. Para su análisis se propone la siguiente clasificación:
Clínico/demográficosDiferentes variables clínicas se han propuesto como posibles predictores de la respuesta a OnabotA; entre ellos, la cefalea con una marcada unilateralidad o alodinia24, la cefalea ocular o implosiva25 o la presencia en la exploración de sensibilidad pericraneal26, que no han sido confirmados en estudios posteriores27. Se ha indicado que un menor tiempo de evolución de la migraña28 o de la situación de cronicidad29 se relacionarían con una mejor respuesta.
AnalíticosSe ha publicado que los niveles de CGRP y, en menor medida, del VIP, podían predecir la respuesta a OnabotA en pacientes con MC30.
NeurorradiológicosEn el campo de la neurosonología, se ha encontrado que la ratio entre la velocidad —medida en un doppler transcraneal interictal— de la arteria cerebral media y la carótida interna ipsolateral, era significativamente mayor en los respondedores31.
Un trabajo publicado por el grupo de Borsook identifica cambios estructurales y funcionales en estudios en estado de reposo (resting-state), que se presentan de forma diferente entre respondedores y no respondedores32. El número de pacientes evaluados en este trabajo es reducido y habrá que esperar confirmación de sus resultados por otros grupos.
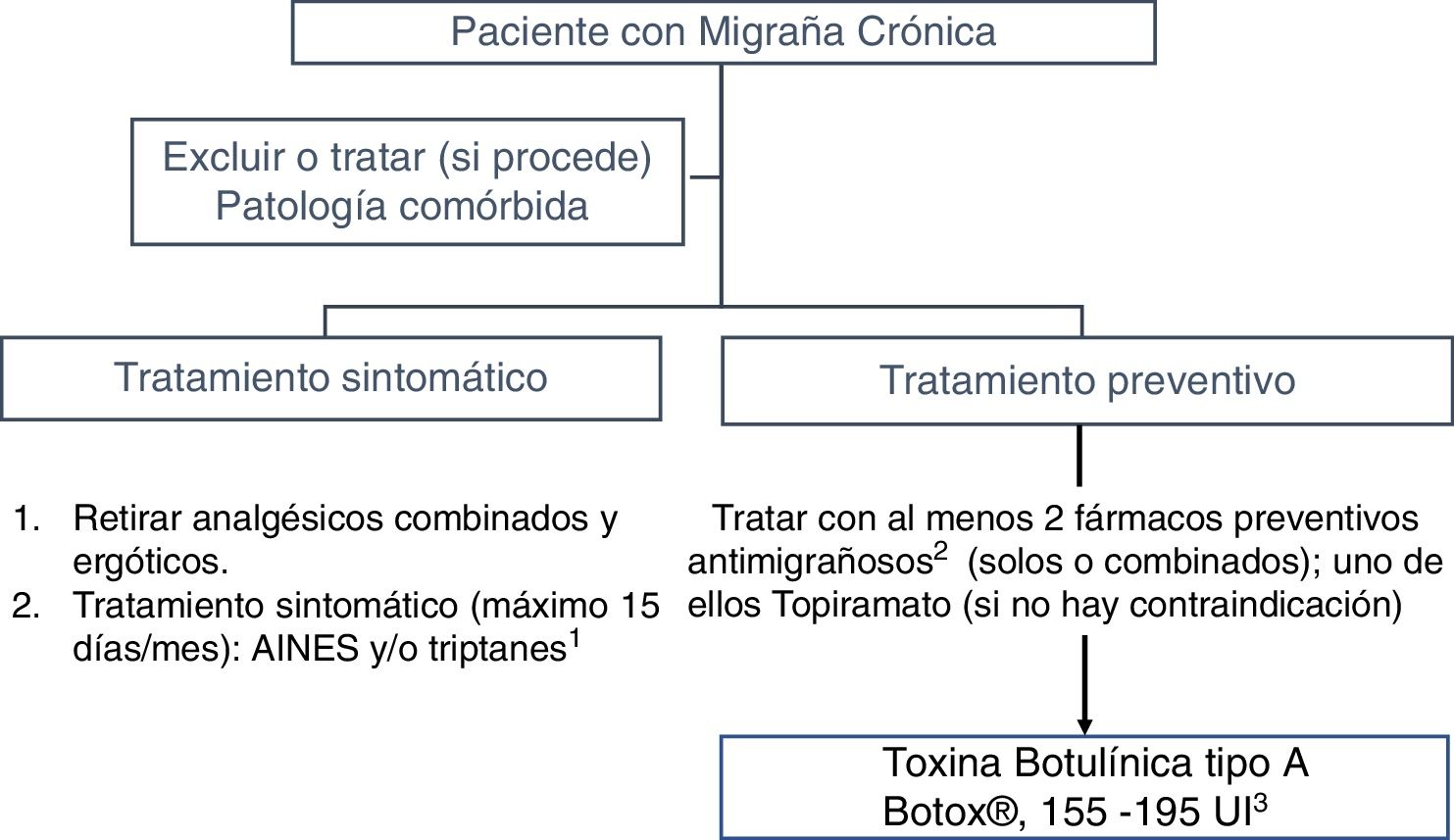
3. ¿Cuándo es el momento idóneo para iniciar tratamiento con onabotulinumtoxinA?En España, OnabotA está aprobada desde el año 2012 como tratamiento preventivo de la MC «en pacientes que no han respondido adecuadamente o son intolerantes a los medicamentos preventivos de la migraña». En la Guía oficial de práctica clínica en cefaleas del GECSEN del año 201533 se propone, tras la publicación de los estudios PREEMPT34,35, iniciar dicho tratamiento en pacientes con intolerancia, contraindicación o falta de respuesta a al menos 2fármacos preventivos (un ß-bloqueante y topiramato) que se habrán utilizado a las dosis mínimas recomendadas y durante al menos 3 meses36 (nivel de evidencia IV, grado de recomendación GECSEN) (fig. 1).
Cada vez existen más pruebas que señalan que un menor tiempo de evolución de la migraña, en general28,31, y de la MC, en particular37, se asocian con una evolución favorable y mejor respuesta al tratamiento con OnabotA, por lo que se recomienda iniciar el tratamiento preventivo de manera precoz38.
4. ¿Cómo evaluar la respuesta a onabotulinumtoxinA?Evaluar la respuesta de un paciente al tratamiento con OnabotA requiere tener en consideración no solo variables objetivas, funcionales y operativas sino también variables subjetivas. Las primeras se cuantifican mediante un calendario en el que se marcan los días con dolor y los días de incapacidad, y ayudan al neurólogo a decidir, conjuntamente con el paciente, la respuesta al tratamiento39.
Las variables subjetivas serían la intensidad de la cefalea, la tolerabilidad y la valoración global de continuar o no con el tratamiento40. En la tabla 1 se muestra una relación de las principales variables objetivas y subjetivas.
Criterios de respuesta en el tratamiento con OnabotA en migraña crónica
| Variables objetivas | |
|---|---|
| Primarias | Reducción del n.° de días de cefalea y del n.° de días de migraña al mes |
| Reducción en intensidad de dolor | |
| Reducción en el número de días de uso y número de dosis de analgésicos | |
| Mejoría en las escalas de discapacidad (MIDAS) e impacto (HIT-6) de la cefalea | |
| Presencia/ausencia de efectos secundarios | |
| Secundarias | Reducción del coste fármaco-económico:directo (por enfermedad) e indirecto (pérdida de productividad) |
| Variable subjetiva | Decisión del paciente de seguir o no con el tratamiento |
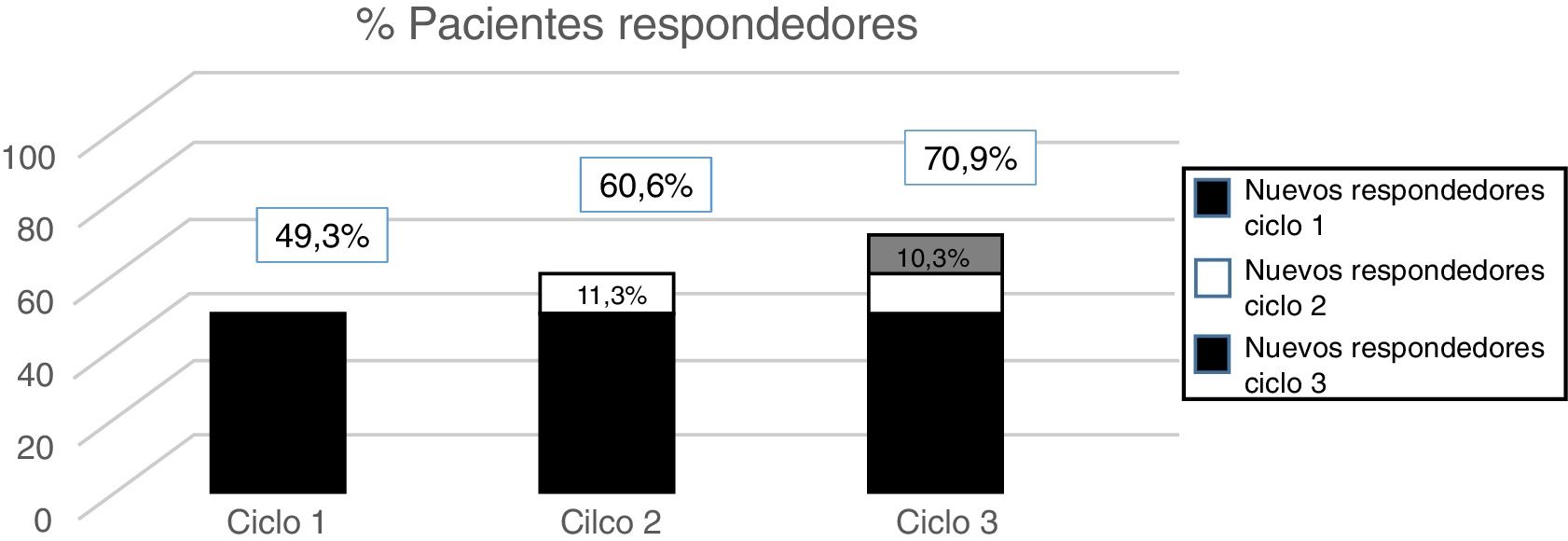
A partir de los datos del programa PREEMPT40, sabemos que aproximadamente un 15% de los pacientes (dependiendo de la medida de eficacia que usemos) inicia su respuesta clínica en el segundo ciclo de tratamiento. De esta forma, en ausencia de una aparente respuesta al ciclo inicial, se deberá, obligatoriamente, administrar un segundo ciclo, considerando la posibilidad de incrementar la dosis a 195 U. Estos resultados, por un lado, son esperables teniendo en cuenta la intrínseca variabilidad de la MC —que puede hacer que una aparente falta de respuesta a un ciclo no sea tal— y, por otro, indican que el efecto de OnabotA, al menos en los primeros ciclos de tratamiento, es acumulativo.
El análisis post hoc de los pacientes incluidos en el estudio PREEMPT aclara que un tercer ciclo del tratamiento consigue rescatar hasta un 10% de los pacientes aparentemente refractarios41 (fig. 2). Por tanto, según los datos de este trabajo, que son congruentes con la práctica clínica habitual, aun cuando no se objetive una respuesta satisfactoria a las 24 semanas, es recomendable infiltrar OnabotA al menos una tercera vez, incrementando la dosis a 195 U42, antes de establecer la ausencia de respuesta a este tratamiento (nivel de evidencia IV, grado de recomendación GECSEN)33.
6. ¿Cuándo administrar más de 155 U de onabotulinumtoxinA?La recomendación de la dosis actual de 155-195 U procede de los datos que se han ido acumulando en los diferentes ensayos clínicos realizados con OnabotA en el tratamiento de la migraña43,44. Estudios con dosis más elevadas (225-260 U) que no seguían el paradigma de inyección PREEMPT —si bien no consiguieron el objetivo primario de eficacia— permitieron demostrar la seguridad de dosis más altas45,46.
En los estudios PREEMPT34,35 se utilizó una dosis inicial de 155 U administrada en puntos fijos. Se contemplaba la posibilidad de utilizar, a elección del investigador y en función de la localización del dolor, una dosis adicional de 40 U en la zona temporal, occipital o del trapecio hasta una dosis máxima de 195 U. En la práctica clínica no se han realizado estudios comparativos entre las diferentes dosis, si bien la mayoría de los autores proponen utilizar dosis más altas en los pacientes que son refractarios a dosis iniciales bajas47.
Un reciente estudio ha demostrado la eficacia mantenida durante los 2años de seguimiento de la dosis de 195 U en 143 pacientes con MC y uso excesivo de fármacos42. Comparada con una cohorte histórica tratada con 155 U, la respuesta a 195 U fue superior, desde el primer ciclo, en el número de días con cefalea, número de días con migraña y puntuación en el HIT-6. La diferencia en el consumo de medicación sintomática para la migraña no fue significativa hasta el cuarto ciclo42.
Fruto de los datos publicados y de la experiencia clínica, hay 2razones para recomendar subir la dosis tras una primera sesión: la ausencia de respuesta o una respuesta insuficiente ante una primera infiltración, o bien una duración insuficiente de dicha respuesta, con un empeoramiento a las 8-10 semanas tras una buena respuesta inicial.
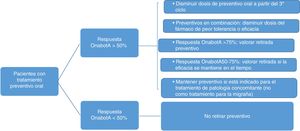
7. ¿Cómo manejar el tratamiento preventivo oral en pacientes con onabotulinumtoxinA?En la práctica clínica es relativamente habitual mantener la prevención oral, aunque la respuesta no sea óptima, cuando iniciamos el tratamiento con OnabotA48,49. La respuesta tras un primer o segundo ciclo puede permitir la retirada o bajada de dosis de esos otros fármacos preventivos orales. Según la evidencia disponible, ello se logra en más de la mitad de los pacientes (en el 45,2% de forma completa y en el 13,9% de forma parcial)49.
Dos son las situaciones de partida al iniciar tratamiento con OnabotA:
- •
Paciente sin tratamiento preventivo oral por intolerancia, contraindicación o ausencia de respuesta tras, al menos, 6 semanas de tratamiento.
- •
Paciente en tratamiento preventivo oral en monoterapia o terapia combinada, con respuesta parcial.
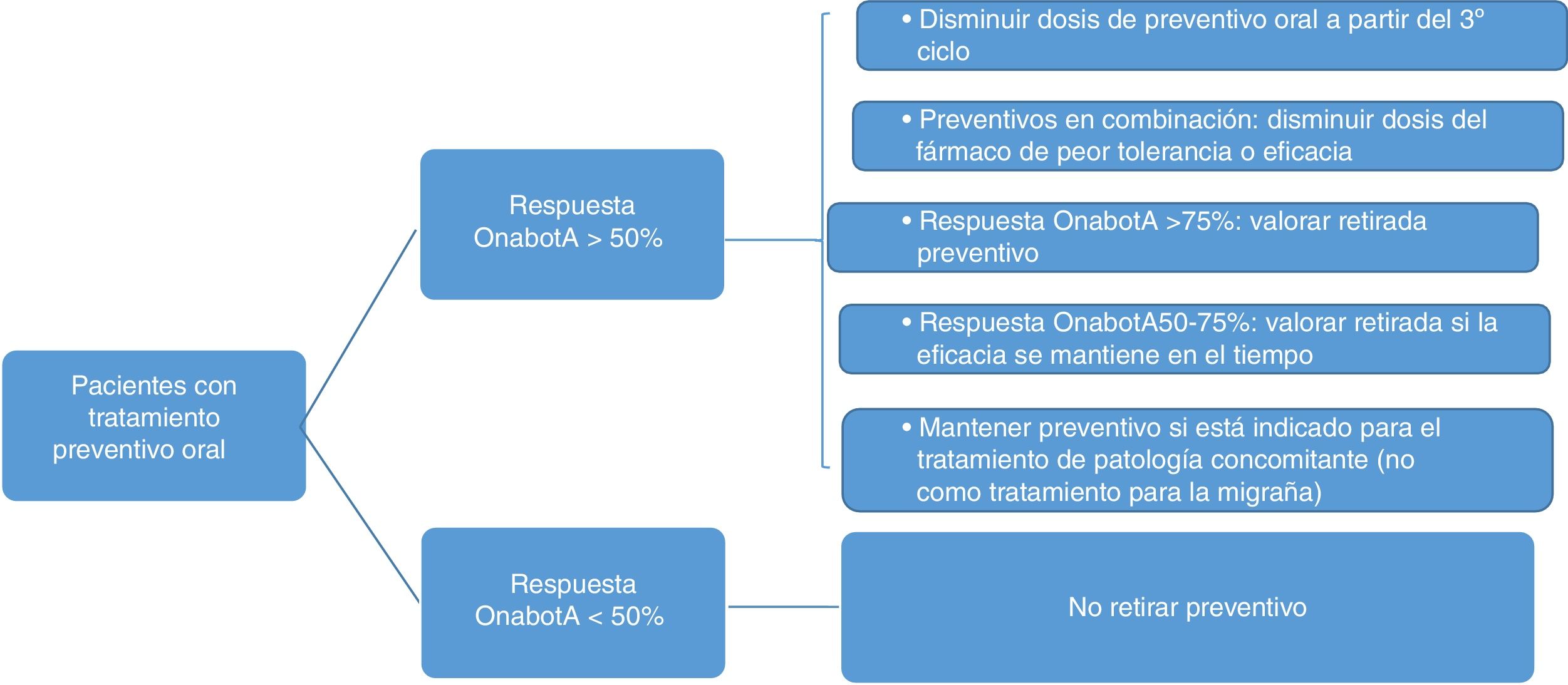
El protocolo de retirada de tratamiento preventivo oral queda reflejado en la figura 3. Se ha de tener en cuenta, además:
- •
La opinión y consentimiento del paciente.
- •
Si existe un empeoramiento, se recomienda volver a la dosis previa.
- •
En el supuesto de terapia combinada, ante igualdad de eficacia y tolerabilidad, se mantendrá topiramato.
- •
El tratamiento preventivo puede estar indicado para el tratamiento de enfermedades concomitantes.
De acuerdo con la evidencia publicada, todavía es difícil predecir cuándo un paciente alcanzará un máximo de respuesta con el tratamiento con OnabotA. Los resultados del estudio PREEMPT y de las series de práctica clínica50-53 indican que la reducción en el número de días de cefalea, intensidad y consumo de analgésicos podría ser progresiva hasta el cuarto ciclo.
Sin embargo, dichos estudios no son directamente comparables, ya que la medición de la respuesta varía. Los resultados del estudio PREEMPT54 muestran que los pacientes continuaban mejorando desde el inicio con el tratamiento con OnabotA, al menos durante el tiempo de seguimiento del estudio. El estudio REPOSE52, con un diseño observacional, multicéntrico y prospectivo, registró datos de 783 pacientes con MC tratados con OnabotA durante un año. Se concluyó que la eficacia, en términos de reducción del número de días de cefalea y de mejora de la calidad de vida, se mantenía a lo largo del año de seguimiento. Si bien las diferencias se calcularon desde el valor inicial, parecían incrementarse de forma progresiva en las primeras 4visitas.
Guerzoni et al.50 publicaron un estudio prospectivo que siguió durante 18 meses a 57 pacientes con MC tratados con OnabotA. El número de días de cefalea o migraña al mes se redujo de forma significativa y progresiva, comparados con el valor inicial. A los 6meses del comienzo del tratamiento, la disminución en el número de días de dolor fue del 22% y, de manera consistente, se redujo un 18% adicional tras cada tratamiento. El consumo de analgésicos disminuyó un 26% a los 6meses y un 67% a los 18 meses.
El estudio COMPEL es un estudio observacional, prospectivo, multicéntrico y abierto que incluyó a 715 pacientes tratados con OnabotA51. El seguimiento fue de 108 semanas y 9ciclos de tratamiento. Los autores concluyeron que la eficacia observada fue secuencial y que alcanzó su valor máximo tras el noveno ciclo con respecto al inicio.
Negro et al.53, en un estudio observacional y prospectivo, siguieron a 132 pacientes con MC durante 2 años. Observaron reducciones significativas, en comparación con los valores iniciales, desde el primer ciclo en todas las variables estudiadas (número de días de cefalea y de migraña al mes, HIT-6), si bien este incremento en el beneficio fue menos llamativo después del primer año.
9. En el largo plazo ¿cómo se maneja a los respondedores?Dado que la MC es una enfermedad de larga evolución, es lícito plantearse qué hacer con estos pacientes tras finalizar el primer año de tratamiento. No existe un consenso establecido en este punto, al no disponer de estudios controlados frente a placebo de más de un año de duración55. Sin embargo, existen datos de práctica clínica de hasta 5años de tratamiento que permiten aconsejar en este sentido.
Diversos trabajos no controlados han demostrado que, durante el primer año, alrededor del 70% de los pacientes responden objetiva (reducción de al menos un 50% en sus días de migraña en al menos 3 de 4 tratamientos) y subjetivamente a la OnabotA47,56-59.
¿Puede suspenderse el tratamiento al final del primer año?Los datos disponibles muestran que la mitad de los pacientes necesitan continuar con OnabotA trimestralmente, ya que a partir de las 12 semanas experimentan un empeoramiento sistemático. De la mitad restante, hasta un 40% puede posponer las inyecciones un mes (necesitarían OnabotA 3veces al año) y el 10% restante no necesitaría continuar con las inyecciones48.
¿Qué ocurre con la respuesta a partir del año?En la práctica clínica se ha demostrado que tan solo uno de cada 10pacientes que responden durante el primer año no lo hace durante el segundo48. En el seguimiento a 5años, la evidencia disponible indica que, a partir del segundo año, la pérdida de respuesta es excepcional. En esta misma serie ningún paciente dejó de responder a OnabotA entre el tercer y el quinto año de tratamiento. Los beneficios del tratamiento a largo plazo no se limitan al número de días sin dolor, sino que incluyen una reducción en el consumo de analgésicos y de visitas a Urgencias por cefalea grave de, al menos, un 50%48,60.
La excelente tolerabilidad de OnabotA se mantiene a partir del año. La tasa de efectos adversos se sitúa por debajo del 20%, los abandonos por este motivo son excepcionales y el perfil no varía sobre el ya conocido en esta indicación a corto plazo, salvo por la posible presencia de atrofia muscular local, que nos debería llevar a disminuir la dosis en ese músculo en particular48.
¿Qué hacer si en un momento determinado un paciente no responde a un ciclo?La ausencia de respuesta puede ser aparente. Dado que la MC es una enfermedad que puede fluctuar y empeorar de forma cíclica, se ha propuesto como medida de respuesta la reducción>50% en al menos 3 de 4 tratamientos48. Si hubiera una falta de respuesta o respuesta insuficiente, debería incrementarse la dosis de OnabotA a 195 U (ver pregunta 6)42.
10. OnabotulinumtoxinA en migraña crónica: ¿es realmente un tratamiento coste-efectivo?Estudios recientes muestran que el coste de la MC oscila entre 1.500 y 3.700 € al año, y triplica al de la migraña episódica61. El coste directo de la MC es mayor porque los pacientes requieren más atención médica (en consulta externa, urgencias o en régimen de hospitalización) y más estudios complementarios para confirmar el diagnóstico. Además, en los pacientes con MC el coste indirecto derivado del absentismo laboral y de la pérdida de productividad, que representa más del 70% del coste global de la migraña, también se incrementa de forma significativa62. El control del gasto es uno de los ejes fundamentales de la política sanitaria, puesto que los recursos de los sistemas de salud son limitados63. Por este motivo, los tratamientos que se van introduciendo en la práctica clínica deben ser eficaces, pero también coste-efectivos, sobre todo en enfermedades prevalentes, discapacitantes, con mucha comorbilidad asociada y de larga duración, como la MC63,64.
Los primeros estudios económicos, basados en estimaciones, muestran que el tratamiento con OnabotA es coste-efectivo, al reducir tanto los costes directos como los indirectos65,66, dato que se confirma en estudios posteriores de práctica clínica67,68. Cuando se compara OnabotA con otros tratamientos preventivos orales, se observa que solo en los sujetos tratados con OnabotA disminuyen las visitas a urgencias o la necesidad de hospitalización69. En España, diferentes publicaciones48,69 muestran que este tratamiento reduce el coste directo fundamentalmente por la disminución en el consumo de triptanes y de las visitas a urgencias.
En relación con el coste indirecto, el tratamiento con OnabotA se asocia a una marcada reducción de la discapacidad asociada a la migraña y mejora la calidad de vida de los pacientes40. Por tanto, parece razonable concluir que el impacto del tratamiento va más allá de la disminución de los gastos directos y que, al mejorar la discapacidad, se reduce de forma paralela el coste indirecto asociado al absentismo y a la pérdida de productividad causado por la MC.
11. ¿Es onabotulinumtoxinA un tratamiento seguro?En el análisis de la seguridad y tolerabilidad de OnabotA en los 5ensayos que dieron lugar al desarrollo de su indicación en MC70, la tasa de abandono del fármaco debido a efectos adversos fue de un 3,4%. Los problemas más frecuentes fueron dolor cervical (12,6%), debilidad muscular (8%) sensación de rigidez muscular (6,1%) y ptosis palpebral (4,6%). Aunque un 72,9% de los pacientes tratados con OnabotA describieron al menos un efecto adverso, en solo un 5,4% se consideró como importante, frente a un 3% en el grupo placebo.
En el programa PREEMPT solo un 34,8% de los pacientes experimentó algún efecto adverso relacionado con la medicación. En sesiones sucesivas, el porcentaje de pacientes con efectos adversos relacionados con la medicación disminuyó del 48,3% en la primera al 19,1% en la quinta sesión54.
En el estudio de práctica clínica con mayor número de pacientes publicado hasta la fecha, los porcentajes de rigidez (14,5%) y ptosis palpebral (11%) fueron algo mayores que en los ensayos clínicos. Los autores de este trabajo observaron ocasionalmente exacerbación de la cefalea durante los primeros días posteriores a la inyección (4,3%) y disfagia (1,96%)59.
El grupo de trabajo de Pascual et al.48 describió en 2pacientes tratados durante más de 5años atrofia muscular frontotemporal. En ambos casos se trató de una observación de los investigadores, sin repercusión funcional ni estética y sin necesidad de interrumpir el tratamiento. Finalmente, con relación a la dosis de 195 U, en el estudio de Negro et al.42 la tasa de efectos adversos fue similar en ambas cohortes (155 y 195 U).
12. ¿Cómo manejar las expectativas del paciente? ¿Cómo informar al paciente?Para manejar correctamente las expectativas de estos pacientes ante el tratamiento con OnabotA deberemos responder a las siguientes cuestiones con la información que conocemos y que está resumida en este documento:
¿Cuánto y cuándo voy a mejorar?El tratamiento con OnabotA, tanto en los ensayos clínicos como en la práctica real28,42,48,58,59,71-74, ha demostrado una reducción del 50% en el número de días con cefalea y días de migraña al mes, así como una mejoría en la intensidad del dolor (días con consumo de medicación analgésica y número de dosis).
Alrededor del 80% de los pacientes responden a la infiltración de OnabotA durante y después del primer año de tratamiento38,42,48,58,71-75. Esto permite, en algunos casos, ir retirando medicación preventiva a partir del tercer ciclo y suspenderla finalmente en casi la mitad de los pacientes42. Esta mejoría se observa también en escalas tanto de calidad de vida como de impacto de la cefalea, y se mantiene en el tiempo49,71.
Compromiso terapéuticoLos estudios actuales señalan que un menor tiempo de evolución de la migraña en general28,76 y de la MC en particular, así como un tratamiento más precoz, se asocian con una mejor respuesta al tratamiento38. Tras un primer ciclo con 155 U, deberemos plantear subir la dosis a 195 U cuando no hay respuesta, esta es subóptima o no se mantiene hasta el siguiente ciclo (empeoramiento a las 8-10 semanas tras una buena respuesta inicial)42,47.
¿Es un tratamiento seguro?Sí. En los ensayos clínicos34,35 y en estudios de práctica clínica real52,59, los efectos secundarios son leves y transitorios: dolor cervical, debilidad muscular, sensación de rigidez muscular y ptosis palpebral. Así mismo, cuando se valoran los datos de seguridad a largo plazo48 y con dosis más altas42 los efectos adversos no difieren, lo que demuestra que el uso de OnabotA en MC es seguro y que la retirada del tratamiento como consecuencia de estos es anecdótica.
¿Durante cuánto tiempo y cada cuánto?No existe un consenso sobre cuándo finalizar el tratamiento con OnabotA en el paciente respondedor. Sí sabemos que, en aproximadamente un 20% de los casos, el intervalo entre ciclos puede extenderse a 4o 5meses75. De ello se deduce que el efecto de OnabotA es acumulativo en ciclos sucesivos, si bien es difícil hoy en día establecer un momento a partir del cual los pacientes alcanzan un beneficio máximo. La pérdida de respuesta tras el primer año de tratamiento es rara y si ocurre debemos considerar un incremento de dosis a 195 U. Una vez restablecida la respuesta, se podría reajustar la dosis atendiendo a las necesidades del paciente. Los datos de seguimiento a 5años indican que la excelente tolerabilidad de OnabotA se mantiene en el tiempo48.
ConclusionesLas conclusiones de este consenso, derivadas de las preguntas inicialmente planteadas y basadas en nuestra experiencia clínica y la evidencia publicada, aparecen reflejadas en la tabla 2.
Conclusiones
| Mecanismo de acción en migraña crónica |
| BoNTA bloquea la exocitosis de neuropéptidos y neurotransmisores implicados en la génesis y propagación de los impulsos de dolor (sustancia P, CGRP, glutamato), así como en la translocación de receptores de membrana hacia la superficie de las neuronas sensitivas (TRPV1, P2X3) |
| Predictores de respuesta |
| Los factores predictores de respuesta a OnabotA se relacionan con su mecanismo de acción de OnabotA (niveles en plasma de CGRP) y con parámetros que pueden implicar una pérdida de la capacidad de «de-cronificación» de la migraña (edad, tiempo de evolución y cambios estructurales o funcionales en neuroimagen) |
| Cuándo iniciar el tratamiento con OnabotA |
| Se debe iniciar de forma precoz el tratamiento con OnabotA en todos aquellos pacientes con MC que presenten ausencia de respuesta, intolerancia o contraindicación de 2tratamientos preventivos orales |
| Variables de respuesta |
| Además de las variables objetivas y cuantitativas (disminución en el número de días de cefalea al mes, número de días de migraña al mes y número de días libres de dolor) es importante considerar variables subjetivas (decisión del paciente de continuar con el tratamiento) |
| Cuántos ciclos se deben intentar ante la ausencia inicial de respuesta |
| Aun cuando no se objetive una respuesta satisfactoria a las 24 semanas, es razonable completar 3ciclos de tratamiento con OnabotA, incrementando la dosis a 195 U, antes de establecer su ineficacia. Se deberá, así mismo, valorar la existencia de factores de cronificación, refractariedad, comorbilidades o coexistencia de otra fuente de dolor o cefalea primaria |
| Cuándo administrar más de 155 U de OnabotA |
| Es recomendable utilizar dosis de 195 U tras una primera infiltración en ausencia de respuesta, cuando esta es subóptima o insuficiente en el tiempo, con empeoramiento a las 8-10 semanas tras una buena respuesta inicial. Es importante valorar la existencia de escaso desarrollo de la musculatura cervical, por el mayor riesgo de efectos adversos |
| Cómo manejar el tratamiento preventivo oral en pacientes con OnabotA |
| Ante una mejoría mantenida>75%, se recomienda la retirada completa del tratamiento preventivo oral. Si la mejoría es del 50-75%, se intentará reducir la dosis en el caso de monoterapia o retirar uno de los 2fármacos en caso de terapia combinada. En este último supuesto, en igualdad de eficacia y tolerabilidad, se mantendrá topiramato. Ante una mejoría <50% se aconseja mantener la profilaxis oral |
| ¿Existe un efecto acumulativo de OnabotA? |
| El efecto de OnabotA como tratamiento preventivo de la MC es acumulativo en los ciclos sucesivos, si bien todavía es difícil establecer un momento a partir del cual los pacientes alcanzan un beneficio máximo |
| A largo plazo ¿cómo manejar a los respondedores? |
| Tras un primer año de tratamiento, el 10% de los pacientes lo suspenderán por buena respuesta; en el 40% se podrá diferir un mes cada ciclo y aproximadamente la mitad continuará con ciclos trimestrales. La pérdida de respuesta tras el primer año es excepcional y, si ocurriera, se deberá incrementar la dosis a 195 U |
| OnabotA en migraña crónica: ¿es realmente un tratamiento coste-efectivo? |
| Sí. El tratamiento con OnabotA, confirmado en estudios de práctica clínica, reduce tanto los costes directos como los indirectos. Al ser un fármaco muy bien tolerado, no genera un consumo de recursos derivado de posibles efectos adversos, ya que son infrecuentes y leves |
| ¿Es OnabotA un tratamiento seguro? |
| Sí. La retirada del tratamiento con OnabotA en MC por efectos adversos es infrecuente, si bien no disponemos de datos de seguimiento superior a 5años |
Los autores declaran no tener ningún conflicto de intereses.
Los autores desean agradecer a los Laboratorios Allergan su colaboración con la asistencia en la redacción médica y la logística de las reuniones.
Cabe señalar que Allergan S. A. no participó en la preparación del documento ni influyó de ninguna manera en las conclusiones alcanzadas.
La asistencia editorial en la preparación de este manuscrito fue proporcionada por el Dr. Antonio Martínez de Ciencia y Deporte S. L. El apoyo para esta asistencia fue financiado por Allergan S. A.