El síndrome del túnel carpiano (STC) es la neuropatía periférica más común. Consiste en la compresión del nervio mediano a nivel de túnel carpiano. Tiene una alta prevalencia y genera una situación muy discapacitante desde las primeras fases. En los casos graves el tratamiento suele ser quirúrgico, mientras que en los leves y moderados el tratamiento es conservador. El objetivo de esta revisión es conocer los tratamientos conservadores, así como su efectividad, en pacientes con STC leve y moderado, en los 15 últimos años.
DesarrolloSe realizó una revisión sistemática según los criterios de PRISMA. Se emplearon las bases de datos Medline, PEDro y Cochrane. Se seleccionaron aquellos ensayos clínicos controlados y aleatorizados que analizasen los efectos del tratamiento conservador sobre los síntomas y la función en pacientes con STC leve o moderado. Se incluyeron 32 ensayos clínicos. Existe evidencia sobre la efectividad de los fármacos orales aunque las infiltraciones parecen ser más efectivas. El uso de férulas ha mostrado ser efectivo y asociado a otras técnicas no farmacológicas también. Las técnicas de electroterapia no han mostrado resultados concluyentes sobre la efectividad de forma aislada. Otras técnicas de tejido blando también han mostrado buenos resultados pero es escasa la evidencia en este campo. También se han propuesto varias combinaciones de tratamiento farmacológico con no farmacológico sin resultados concluyentes.
ConclusionesExisten varios tratamientos conservadores capaces de mejorar los síntomas y la función de los pacientes con STC leve y moderado. Estos incluyen el uso de férulas, fármacos orales, infiltraciones, técnicas de electroterapia, técnicas manuales específicas y ejercicios de deslizamiento neural, así como la combinación de varias de ellas. No ha sido posible describir la mejor técnica o combinación de técnicas debido a las limitaciones de los estudios, por lo que es necesario realizar más estudios con una calidad metodológica adecuada.
Carpal tunnel syndrome (CTS) is the most common peripheral neuropathy. It is characterised by the compression of the median nerve in the carpal tunnel. CTS presents a high prevalence and it is a disabling condition from the earliest stages. Severe cases are usually treated surgically, while conservative treatment is recommended in mild to moderate cases. The aim of this systematic review is to present the conservative treatments and determine their effectiveness in mild-to-moderate cases of CTS over the last 15 years.
MethodsA systematic review was performed according to PRISMA criteria. We used the Medline, PEDro, and Cochrane databases to find and select randomised controlled clinical trials evaluating the effects of conservative treatment on the symptoms and functional ability of patients with mild to moderate CTS; 32 clinical trials were included. There is evidence supporting the effectiveness of oral drugs, although injections appear to be more effective. Splinting has been shown to be effective, and it is also associated with use of other non-pharmacological techniques. Assessments of the use of electrotherapy techniques alone have shown no conclusive results about their effectiveness. Other soft tissue techniques have also shown good results but evidence on this topic is limited. Various treatment combinations (drug and non–pharmacological treatments) have been proposed without conclusive results.
ConclusionsSeveral conservative treatments are able to relieve symptoms and improve functional ability of patients with mild-to-moderate CTS. These include splinting, oral drugs, injections, electrotherapy, specific manual techniques, and neural gliding exercises as well as different combinations of the above. We have been unable to describe the best technique or combination of techniques due to the limitations of the studies; therefore, further studies of better methodological quality are needed.
El síndrome del túnel carpiano (STC) se define como el conjunto de signos y síntomas que se producen por la lesión del nervio mediano a nivel de la muñeca. El STC consiste en la compresión del nervio mediano a su paso por el túnel carpiano y es la neuropatía periférica más común1.
De forma general se considera que entre el 3,8 y el 4,9% de la población lo presenta1, siendo más frecuente en mujeres que en varones2 y el pico más alto de prevalencia se encuentra entre los 50 y los 59 años1.
La sintomatología del STC es variada y es frecuente que su presentación sea bilateral3,4. Se caracteriza por dolor, hormigueo y/o sensación de entumecimiento en la mano, muñeca y 3 primeros dedos, extendiéndose a veces a otras regiones y tendiendo a empeorar durante la noche3,4. En estados más avanzados existe una disminución de fuerza y función de la mano. Un aspecto destacable es que, en ocasiones, no existe una relación directa entre la afectación en la conducción neural y la sintomatología y algunos pacientes en fases leves o moderadas presentan ya una gran sintomatología y una capacidad funcional disminuida5.
Con relación al tratamiento, los autores coinciden en que cuando la etiología se relaciona con una enfermedad sistémica, el abordaje debe basarse en el control de estos factores6. Otro factor a tener en cuenta a la hora de establecer el mejor tratamiento es la gravedad de la dolencia. Si el STC es grave, el tratamiento de elección es el quirúrgico7 mientras que si el STC es leve o moderado, se optará por un tratamiento conservador. Existen numerosos tratamientos conservadores para el STC7, sin embargo, no hay consenso sobre las mejores técnicas no quirúrgicas disponibles para los pacientes con afectación leve o moderada8.
Considerando los valores de prevalencia e incidencia de esta dolencia la situación tan incapacitante que genera, así como los elevados costes socioeconómicos que conlleva, ya que está considerada como enfermedad profesional9, el objetivo de este estudio fue revisar y valorar la eficacia del tratamiento conservador para los pacientes con STC leve o moderado mediante una revisión de la bibliografía en los últimos 15 años.
DesarrolloSe realizó una revisión sistemática siguiendo los criterios establecidos en la declaración PRISMA. Se realizaron búsquedas bibliográficas de ensayos clínicos en las bases de datos Medline, PEDro, Cochrane y Scopus. Para ello se utilizaron los siguiente términos MESH: «carpal tunnel syndrome», «treatment outcome», «therapy» y «physical therapy».
Estos términos se combinaron para obtener el máximo número de artículos disponibles.
Criterios de inclusiónSe incluyeron ensayos clínicos desde el año 2000 hasta la actualidad y que cumplieran los siguientes criterios:
- -
Que incluyesen a pacientes diagnosticados de STC que no presentaran alguna enfermedad sistémica (como osteoartritis, artritis reumatoide, diabetes mellitus, embarazo u otras enfermedades sistémicas) o algún traumatismo agudo en la región cervical o del miembro superior a la que pudiera atribuirse el STC.
- -
Que incluyesen a pacientes con STC que no hubieran recibido previamente tratamiento quirúrgico.
- -
Se seleccionaron los estudios que aplicaban tratamiento conservador a pacientes con STC leve o moderado comparándolo con un grupo control, placebo u otro tratamiento diferente, en base a los resultados obtenidos en el ENG. Se aceptaron los criterios de clasificación de la gravedad del STC establecidos por los diferentes autores con el objetivo de poder utilizar los datos aportados en los distintos estudios.
- -
Que valorasen los efectos sobre las variables dolor, función o alguna que mostrase algún cambio en cuanto a la recuperación en el estado de salud de los pacientes.
- -
Que estuviesen escritos en inglés, francés o castellano.
Dos revisores independientes aplicaron los criterios de inclusión para seleccionar estudios potencialmente relevantes en base al título y al resumen de los resultados encontrados tras la búsqueda bibliográfica. Se estableció un consenso para la inclusión de los artículos. Un tercer revisor resolvía las dudas o desacuerdos que podían surgir a la hora de seleccionar los estudios.
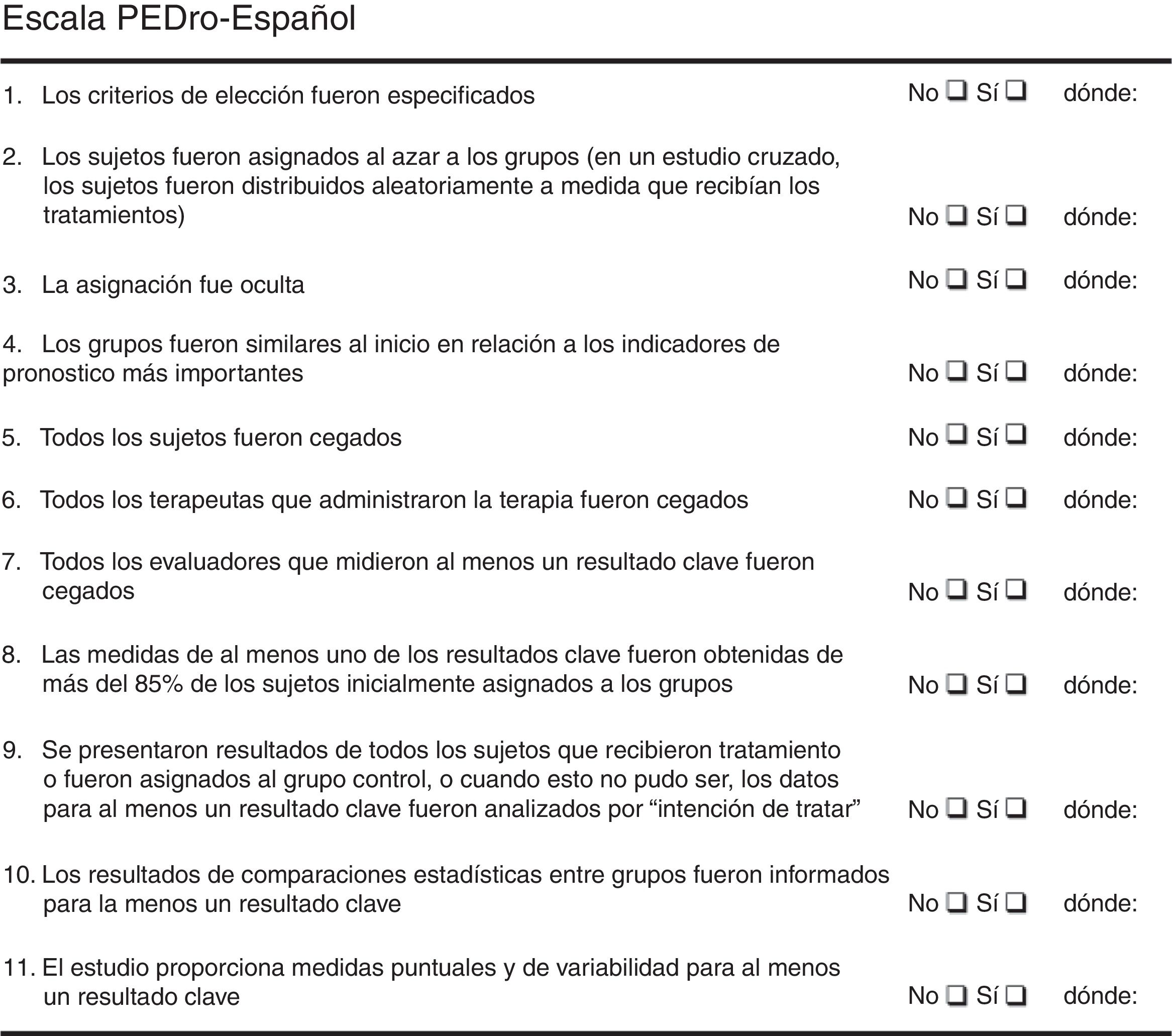
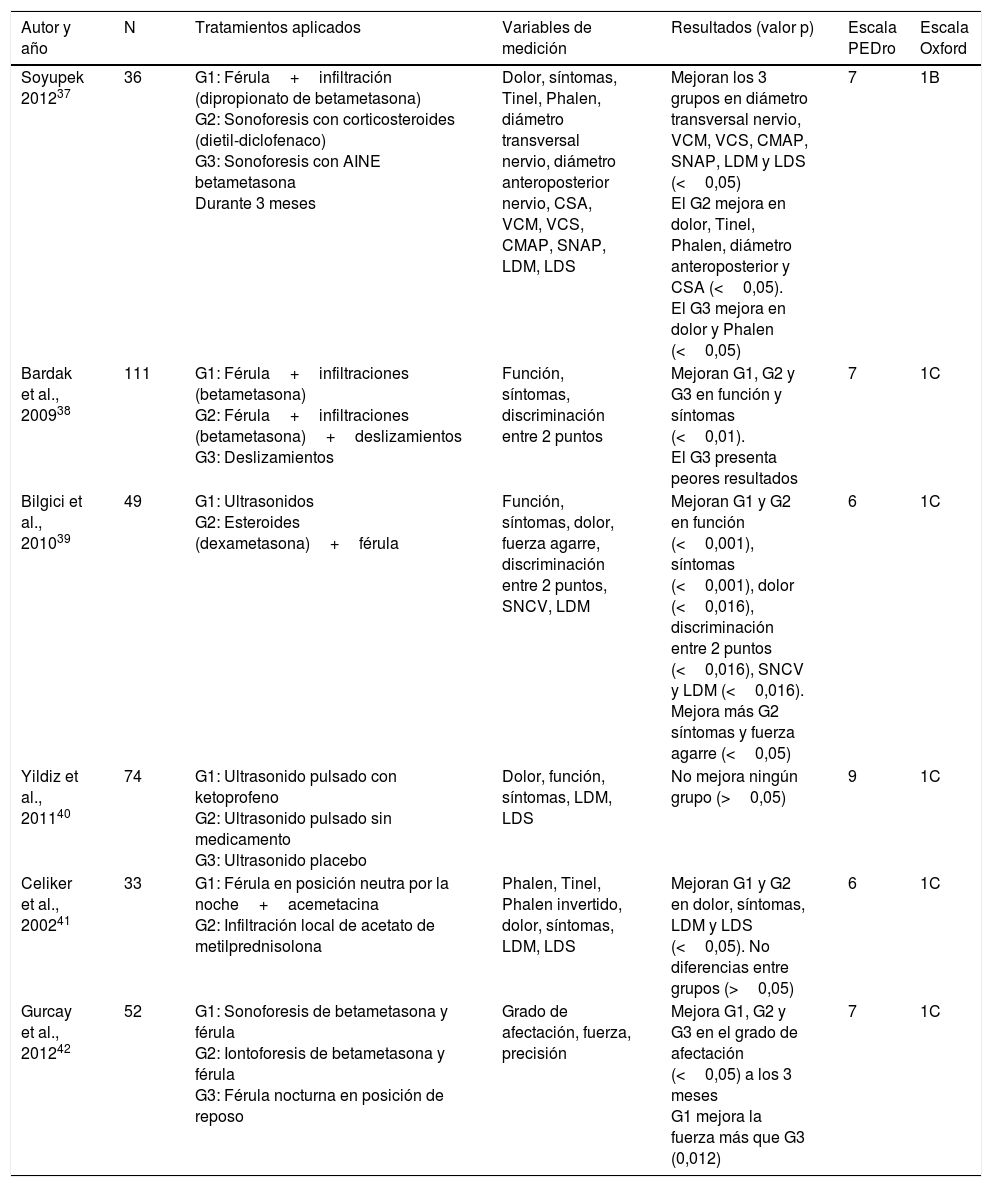
Valoración de la calidad metodológica de los estudiosPara valorar la calidad metodológica de los estudios se utilizó la escala PEDro (fig. 1) que está basada en la lista Delphi desarrollada por Verhagen y sus colaboradores en el Departamento de Epidemiología de la Universidad de Maastricht y que ayuda a identificar con rapidez los ensayos con suficiente validez. Los criterios que se tuvieron en cuenta para esta categorización se detallan en la figura 1; cada ítem puntuaba 1 punto si la respuesta era «sí» o 0 puntos si la respuesta era «no». Los puntos se otorgaban únicamente cuando se cumplía el criterio claramente, pudiéndose obtener un máximo de 10 puntos.
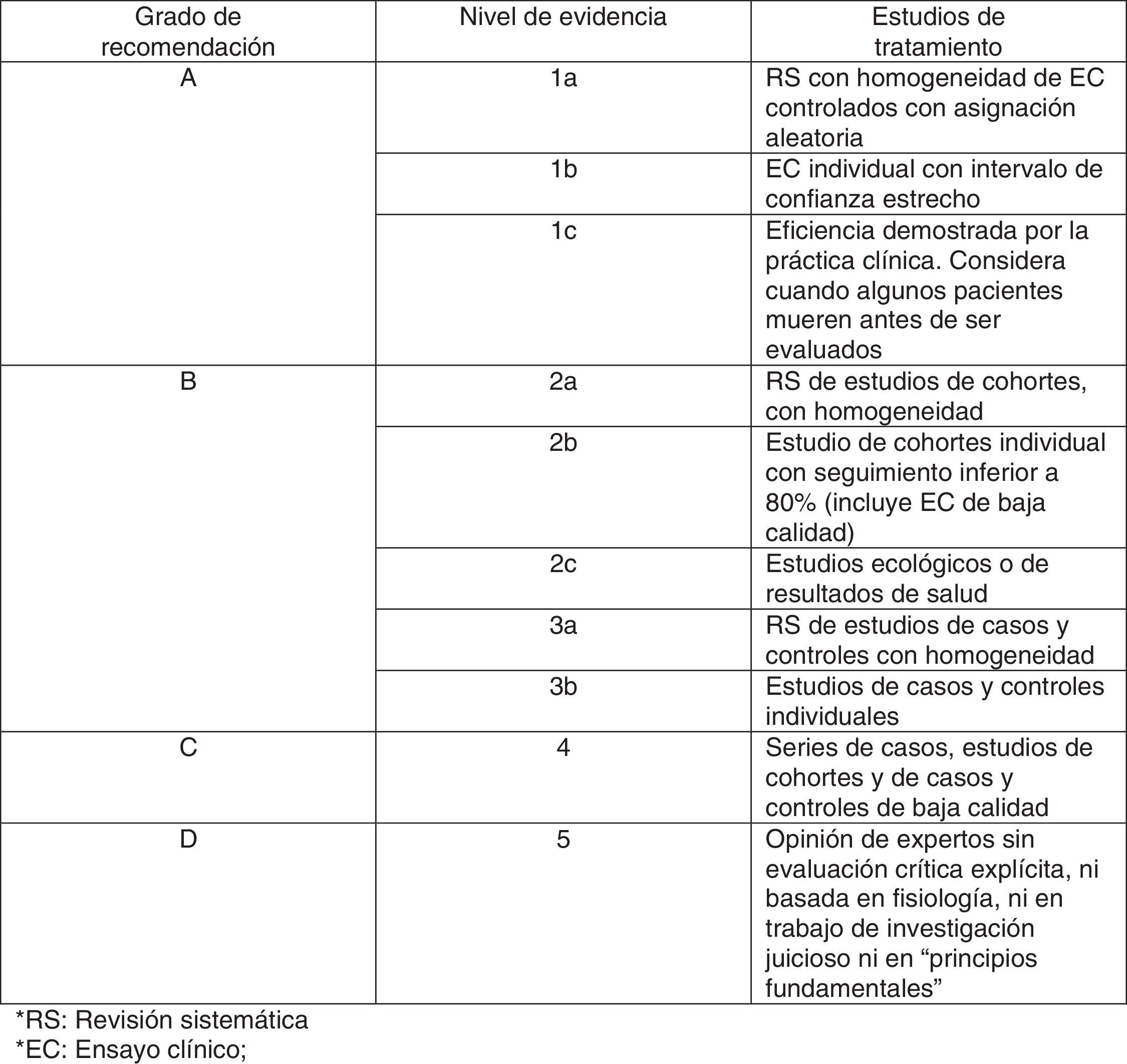
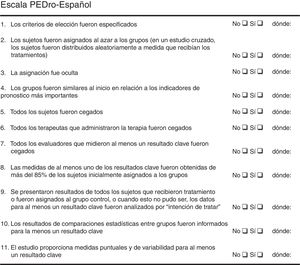
Además, para calificar el nivel de evidencia de los estudios incluidos también se aplicó la escala de Oxford10 (fig. 2), que valora la evidencia según el área temática o el escenario clínico y el tipo de estudio. Esta clasificación gradúa la evidencia de acuerdo al mejor diseño para cada escenario clínico, valorando en el caso de los estudios de tratamiento la mejor evidencia a partir de revisiones sistemáticas de ensayos clínicos o en su defecto ensayos clínicos individuales con intervalos de confianza estrechos.
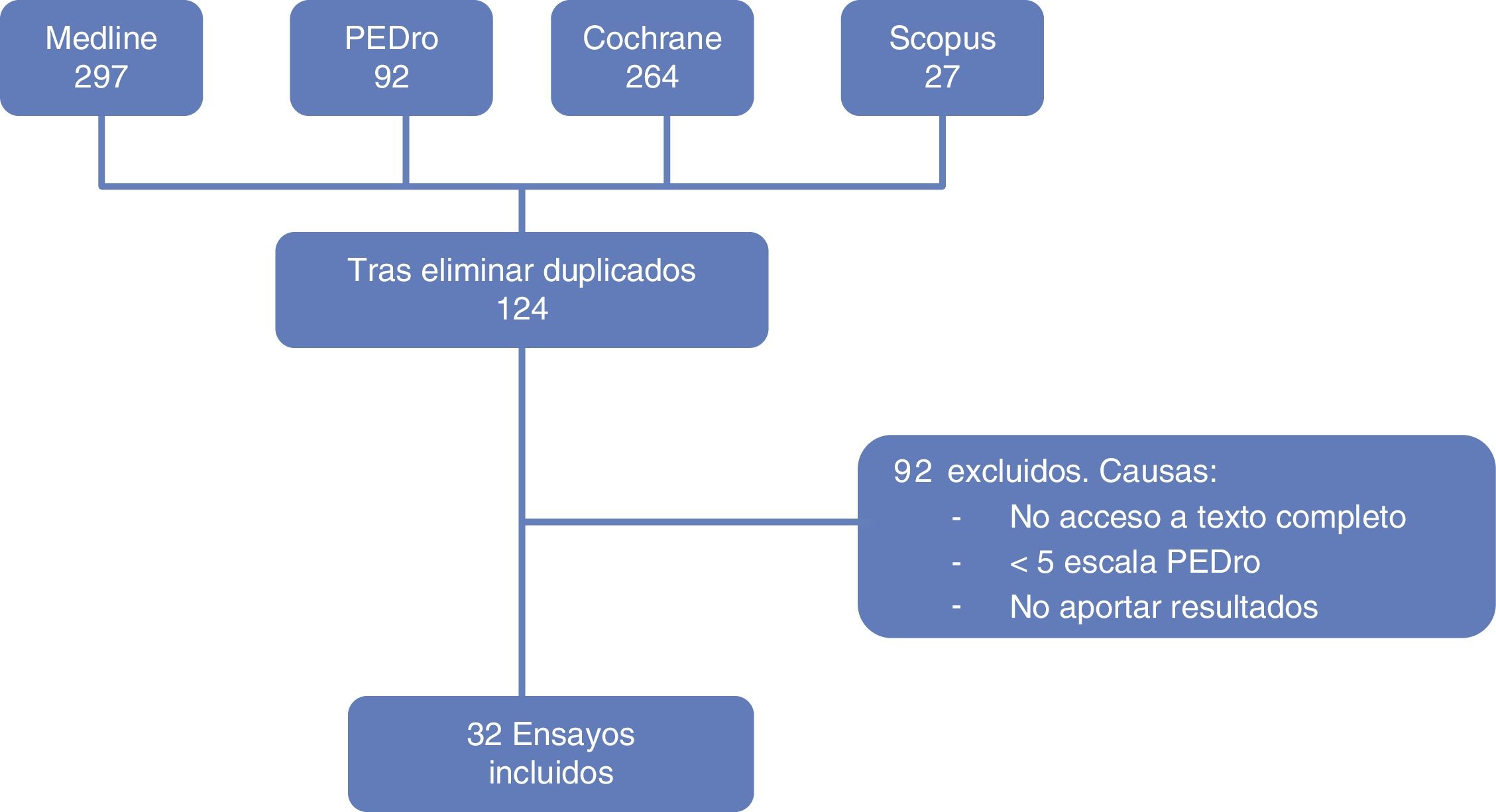
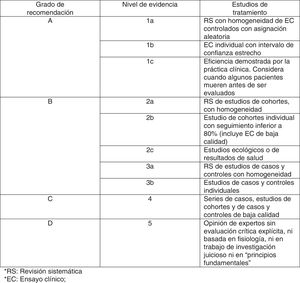
ResultadosSelección de los estudiosSe obtuvieron un total de 676 ensayos clínicos entre las diferentes bases de datos analizadas. Después de excluir los duplicados quedaron 124 artículos (83 de Medline, 34 de Cochrane y 7 de PEDro). Tras la revisión del título y el resumen se descartaron aquellos que no eran relevantes para este estudio y, de los seleccionados, se excluyeron aquellos a los que no se tuvo acceso al texto completo.
Finalmente, se procedió al análisis del texto completo para confirmar que cumplían los criterios de inclusión descritos, quedando un total de 32 ensayos clínicos. El proceso de selección de los artículos se refleja en el diagrama de flujo (fig. 3).
Calidad metodológica de los ensayos incluidosNueve estudios presentaron una puntuación mayor de 8 sobre 10 en la escala PEDro. El resto de los artículos puntuaron por encima del 5, presentando aspectos mejorables, tales como la falta de grupo control en algún estudio, la falta de homogeneidad de los grupos al inicio del tratamiento o la falta de datos en relación con los resultados obtenidos.
Según la escala de Oxford ningún artículo obtuvo un nivel de recomendación A, asignándose a 17 artículos la categoría 1B, a 14 artículos la categoría 1C y a un artículo la categoría 3B.
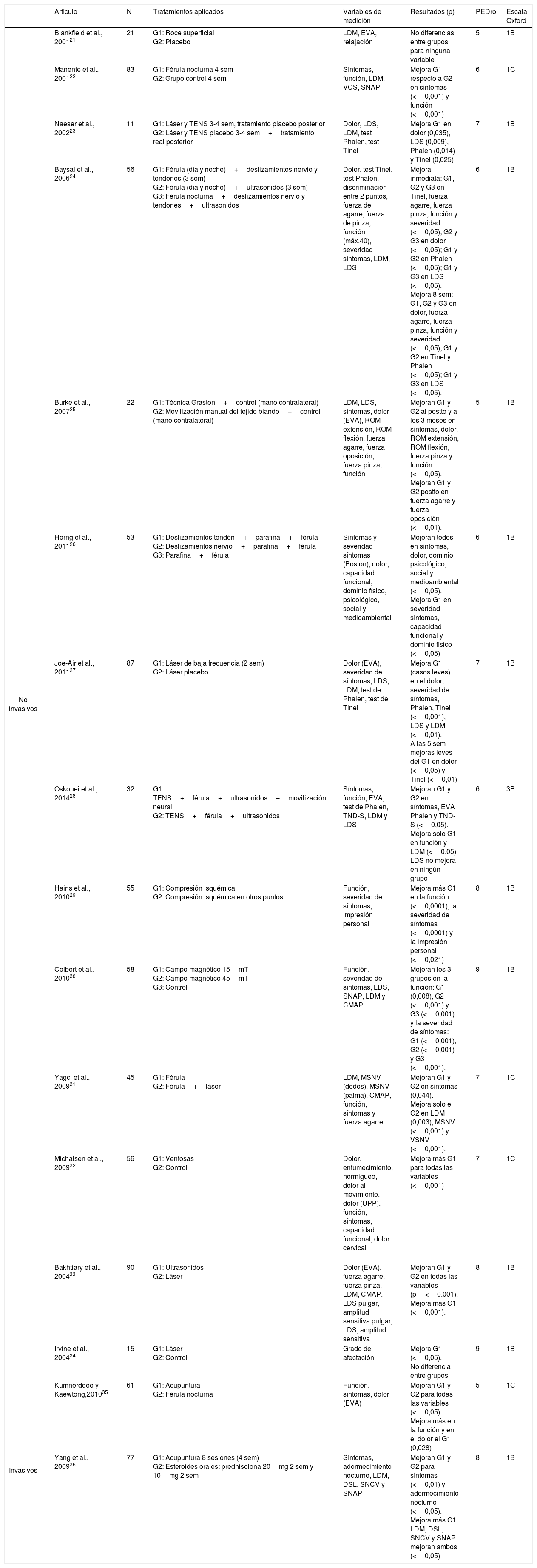
Características de los estudiosDe los 32 ensayos clínicos analizados, 10 utilizaron tratamientos farmacológicos11–20 (tabla 1), 16 emplearon tratamientos no farmacológicos21–36 (tabla 2) y 6 utilizaron tratamientos combinados37–42 (farmacológicos y no farmacológicos) (tabla 3). Las tablas 1-3 muestran los detalles de cada uno de los ensayos clínicos analizados.
Síntesis de resultados. Tratamientos farmacológicos
| Artículo | N | Tratamientos aplicados | Variables de medición | Resultados (valor de p) | PEDro | Escala Oxford | |
|---|---|---|---|---|---|---|---|
| No invasivos | Hui et al., 200111 | 36 | G1: Esteroides orales (prednisolona), 10 días G2: Placebo (suero salino) | Síntomas | Mejora G1 postto (0,027) y a las 8 sem (0,034) | 9 | 1C |
| Chang et al., 200212 | 109 | G1: Esteroides orales (prednisolona) (4 sem) G2: Esteroides orales (prednisolona) (2 sem) | Síntomas, LDM, CMAP, VCS, tiempo conducción muñeca-palma, SNAP | Mejoran G1 y G2 postto y al año se mantienen (<0,001) | 6 | 1C | |
| Nalamachu et al., 200613 | 100 | G1: Lidocaína 5% G2: Lidocaína (metilprednisolona) 1% y naproxeno | Dolor, calidad de vida, impresión global | Mejoran G1 y G2 (<0,0001) | 7 | 1C | |
| Wong et al., 200120 | 60 | G1: Acetato metilprednisolona, 10 días G2: Prednisolona, 10 días | Síntomas (GSS) | Mejoran G1 y G2 postto (<0,001). No diferencia G1-G2 (0,07) A las 10 sem mejora G1 (<0,001) | 9 | 1B | |
| Amirjani et al., 200914 | 17 | G1: Iontoforesis corticosteroides (dexametasona fosfato sódico) G2: Control | BOSTON, sensibilidad, CMAP, SNAP | No mejoras ningún grupo para ninguna variable | 6 | 1B | |
| Invasivos | Karadas et al., 201115 | 90 | G1: Infiltración acetónido de triamcinolona G2: Infiltración procaina HCl G3: Ambas infiltraciones | LDM, VCS, dolor (EVA) | Mejoran todos postto (<0,001) y a los 4 meses (<0,01) Mejora más G3 en dolor (<0,002) y VCS (0,019) | 8 | 1B |
| Peters-Veluthamaningal et al., 201016 | 69 | G1: Infiltración corticosteroides (acetónido de triamcinolona) G2: Placebo | Función, síntomas, impresión personal | Mejora G1 respecto a G2 en función (<0,001), síntomas (0,002) e impresión personal (<0,001) | 9 | 1B | |
| Gökoğlu et al., 200517 | 27 | G1: Infiltración de corticoides (acetato de metilprednisolona) G2: Iontoforesis (dexametasona fosfato sódico) | Función, síntomas, dolor (EVA), LDM y LDS | G1 mejoran función (<0,005), síntomas (<0,05) y dolor (<0,001) postto y 2 y 8 semanas | 7 | 1B | |
| Armstrong et al., 200418 | 43 | G1: Infiltración esteroides (betametasona y lidocaína) G2: Placebo | Satisfacción, LDM, LDS, función, síntomas | G1 mejora satisfacción más que G2 (<0,01) | 8 | 1C | |
| Sevim et al., 200419 | 90 | G1: Férula/G2: Infiltración esteroides distal (betametasona) G3. Infiltración esteroides proximal (betametasona) G4: Control | VCS, LDS, LDM Síntomas neurales | G1 mejora todo excepto LDM (<0,001) No compara entre grupos | 6 | 1C |
CMAP: potencial de acción muscular compuesto; EVA: escala visual analógica; G: grupo; LDM: latencia distal motora; LDS: latencia distal sensitiva; Postto: resultados postratamiento; Sem: semanas; SNAP: potencial de acción neural sensitivo; VCS: velocidad de conducción sensitiva.
Síntesis de resultados. Tratamientos no farmacológicos
| Artículo | N | Tratamientos aplicados | Variables de medición | Resultados (p) | PEDro | Escala Oxford | |
|---|---|---|---|---|---|---|---|
| No invasivos | Blankfield et al., 200121 | 21 | G1: Roce superficial G2: Placebo | LDM, EVA, relajación | No diferencias entre grupos para ninguna variable | 5 | 1B |
| Manente et al., 200122 | 83 | G1: Férula nocturna 4 sem G2: Grupo control 4 sem | Síntomas, función, LDM, VCS, SNAP | Mejora G1 respecto a G2 en síntomas (<0,001) y función (<0,001) | 6 | 1C | |
| Naeser et al., 200223 | 11 | G1: Láser y TENS 3-4 sem, tratamiento placebo posterior G2: Láser y TENS placebo 3-4 sem+tratamiento real posterior | Dolor, LDS, LDM, test Phalen, test Tinel | Mejora G1 en dolor (0,035), LDS (0,009), Phalen (0,014) y Tinel (0,025) | 7 | 1B | |
| Baysal et al., 200624 | 56 | G1: Férula (día y noche)+deslizamientos nervio y tendones (3 sem) G2: Férula (día y noche)+ultrasonidos (3 sem) G3: Férula nocturna+deslizamientos nervio y tendones+ultrasonidos | Dolor, test Tinel, test Phalen, discriminación entre 2 puntos, fuerza de agarre, fuerza de pinza, función (máx.40), severidad síntomas, LDM, LDS | Mejora inmediata: G1, G2 y G3 en Tinel, fuerza agarre, fuerza pinza, función y severidad (<0,05); G2 y G3 en dolor (<0,05); G1 y G2 en Phalen (<0,05); G1 y G3 en LDS (<0,05). Mejora 8 sem: G1, G2 y G3 en dolor, fuerza agarre, fuerza pinza, función y severidad (<0,05); G1 y G2 en Tinel y Phalen (<0,05); G1 y G3 en LDS (<0,05). | 6 | 1B | |
| Burke et al., 200725 | 22 | G1: Técnica Graston+control (mano contralateral) G2: Movilización manual del tejido blando+control (mano contralateral) | LDM, LDS, síntomas, dolor (EVA), ROM extensión, ROM flexión, fuerza agarre, fuerza oposición, fuerza pinza, función | Mejoran G1 y G2 al postto y a los 3 meses en síntomas, dolor, ROM extensión, ROM flexión, fuerza pinza y función (<0,05). Mejoran G1 y G2 postto en fuerza agarre y fuerza oposición (<0,01). | 5 | 1B | |
| Horng et al., 201126 | 53 | G1: Deslizamientos tendón+parafina+férula G2: Deslizamientos nervio+parafina+férula G3: Parafina+férula | Síntomas y severidad síntomas (Boston), dolor, capacidad funcional, dominio físico, psicológico, social y medioambiental | Mejoran todos en síntomas, dolor, dominio psicológico, social y medioambiental (<0,05). Mejora G1 en severidad síntomas, capacidad funcional y dominio físico (<0,05) | 6 | 1B | |
| Joe-Air et al., 201127 | 87 | G1: Láser de baja frecuencia (2 sem) G2: Láser placebo | Dolor (EVA), severidad de síntomas, LDS, LDM, test de Phalen, test de Tinel | Mejora G1 (casos leves) en el dolor, severidad de síntomas, Phalen, Tinel (<0,001), LDS y LDM (<0,01). A las 5 sem mejoras leves del G1 en dolor (<0,05) y Tinel (<0,01) | 7 | 1B | |
| Oskouei et al., 201428 | 32 | G1: TENS+férula+ultrasonidos+movilización neural G2: TENS+férula+ultrasonidos | Síntomas, función, EVA, test de Phalen, TND-S, LDM y LDS | Mejoran G1 y G2 en síntomas, EVA Phalen y TND-S (<0,05). Mejora solo G1 en función y LDM (<0,05) LDS no mejora en ningún grupo | 6 | 3B | |
| Hains et al., 201029 | 55 | G1: Compresión isquémica G2: Compresión isquémica en otros puntos | Función, severidad de síntomas, impresión personal | Mejora más G1 en la función (<0,0001), la severidad de síntomas (<0,0001) y la impresión personal (<0,021) | 8 | 1B | |
| Colbert et al., 201030 | 58 | G1: Campo magnético 15mT G2: Campo magnético 45mT G3: Control | Función, severidad de síntomas, LDS, SNAP, LDM y CMAP | Mejoran los 3 grupos en la función: G1 (0,008), G2 (<0,001) y G3 (<0,001) y la severidad de síntomas: G1 (<0,001), G2 (<0,001) y G3 (<0,001). | 9 | 1B | |
| Yagci et al., 200931 | 45 | G1: Férula G2: Férula+láser | LDM, MSNV (dedos), MSNV (palma), CMAP, función, síntomas y fuerza agarre | Mejoran G1 y G2 en síntomas (0,044). Mejora solo el G2 en LDM (0,003), MSNV (<0,001) y VSNV (<0,001). | 7 | 1C | |
| Michalsen et al., 200932 | 56 | G1: Ventosas G2: Control | Dolor, entumecimiento, hormigueo, dolor al movimiento, dolor (UPP), función, síntomas, capacidad funcional, dolor cervical | Mejora más G1 para todas las variables (<0,001) | 7 | 1C | |
| Bakhtiary et al., 200433 | 90 | G1: Ultrasonidos G2: Láser | Dolor (EVA), fuerza agarre, fuerza pinza, LDM, CMAP, LDS pulgar, amplitud sensitiva pulgar, LDS, amplitud sensitiva | Mejoran G1 y G2 en todas las variables (p<0,001). Mejora más G1 (<0,001). | 8 | 1B | |
| Irvine et al., 200434 | 15 | G1: Láser G2: Control | Grado de afectación | Mejora G1 (<0,05). No diferencia entre grupos | 9 | 1B | |
| Invasivos | Kumnerddee y Kaewtong,201035 | 61 | G1: Acupuntura G2: Férula nocturna | Función, síntomas, dolor (EVA) | Mejoran G1 y G2 para todas las variables (<0,05). Mejora más en la función y en el dolor el G1 (0,028) | 5 | 1C |
| Yang et al., 200936 | 77 | G1: Acupuntura 8 sesiones (4 sem) G2: Esteroides orales: prednisolona 20mg 2 sem y 10mg 2 sem | Síntomas, adormecimiento nocturno, LDM, DSL, SNCV y SNAP | Mejoran G1 y G2 para síntomas (<0,01) y adormecimiento nocturno (<0,05). Mejora más G1 LDM, DSL, SNCV y SNAP mejoran ambos (<0,05) | 8 | 1B |
/ CMAP: potencial de acción muscular compuesto; EVA: escala visual analógica; G: grupo; LDM: latencia distal motora; LDS: latencia distal sensitiva; Postto: resultados postratamiento; ROM: rango de movimiento; Sem: semanas; SNAP: potencial de acción neural sensitivo; TENS: transcutaneous electrical nerve stimulation; TND-S: test neurodinámico estándar; UPP: umbral de dolor a la presión; VCS: velocidad de conducción sensitiva.
Síntesis de resultados. Tratamientos combinados
| Autor y año | N | Tratamientos aplicados | Variables de medición | Resultados (valor p) | Escala PEDro | Escala Oxford |
|---|---|---|---|---|---|---|
| Soyupek 201237 | 36 | G1: Férula+infiltración (dipropionato de betametasona) G2: Sonoforesis con corticosteroides (dietil-diclofenaco) G3: Sonoforesis con AINE betametasona Durante 3 meses | Dolor, síntomas, Tinel, Phalen, diámetro transversal nervio, diámetro anteroposterior nervio, CSA, VCM, VCS, CMAP, SNAP, LDM, LDS | Mejoran los 3 grupos en diámetro transversal nervio, VCM, VCS, CMAP, SNAP, LDM y LDS (<0,05) El G2 mejora en dolor, Tinel, Phalen, diámetro anteroposterior y CSA (<0,05). El G3 mejora en dolor y Phalen (<0,05) | 7 | 1B |
| Bardak et al., 200938 | 111 | G1: Férula+infiltraciones (betametasona) G2: Férula+infiltraciones (betametasona)+deslizamientos G3: Deslizamientos | Función, síntomas, discriminación entre 2 puntos | Mejoran G1, G2 y G3 en función y síntomas (<0,01). El G3 presenta peores resultados | 7 | 1C |
| Bilgici et al., 201039 | 49 | G1: Ultrasonidos G2: Esteroides (dexametasona)+férula | Función, síntomas, dolor, fuerza agarre, discriminación entre 2 puntos, SNCV, LDM | Mejoran G1 y G2 en función (<0,001), síntomas (<0,001), dolor (<0,016), discriminación entre 2 puntos (<0,016), SNCV y LDM (<0,016). Mejora más G2 síntomas y fuerza agarre (<0,05) | 6 | 1C |
| Yildiz et al., 201140 | 74 | G1: Ultrasonido pulsado con ketoprofeno G2: Ultrasonido pulsado sin medicamento G3: Ultrasonido placebo | Dolor, función, síntomas, LDM, LDS | No mejora ningún grupo (>0,05) | 9 | 1C |
| Celiker et al., 200241 | 33 | G1: Férula en posición neutra por la noche+acemetacina G2: Infiltración local de acetato de metilprednisolona | Phalen, Tinel, Phalen invertido, dolor, síntomas, LDM, LDS | Mejoran G1 y G2 en dolor, síntomas, LDM y LDS (<0,05). No diferencias entre grupos (>0,05) | 6 | 1C |
| Gurcay et al., 201242 | 52 | G1: Sonoforesis de betametasona y férula G2: Iontoforesis de betametasona y férula G3: Férula nocturna en posición de reposo | Grado de afectación, fuerza, precisión | Mejora G1, G2 y G3 en el grado de afectación (<0,05) a los 3 meses G1 mejora la fuerza más que G3 (0,012) | 7 | 1C |
/ AINE: antiinflamatorios no esteroideos; CMAP: potencial de acción muscular compuesto; CSA: área de sección transversal; G: grupo; LDM: latencia distal motora; LDS: latencia distal sensitiva; SNAP: potencial de acción neural sensitivo; VCM: velocidad de conducción motora; VCS: velocidad de conducción sensitiva
Dentro de los tratamientos farmacológicos parece que hay una buena evidencia de que los esteroides orales son efectivos a corto y medio plazo11, pero no se conocen las dosis óptimas ni los mejores fármacos. Las infiltraciones han mostrado mejoras en los síntomas, función e impresión personal de los pacientes15–20. Los fármacos más utilizados son prednisolona, metilprednisolona, dexametasona fosfato sódico, acetónido de triamcinolona, acetato de metilprednisolona, lidocaína y dietil-diclofenaco pero no se conoce la dosis más adecuada ni el fármaco a corto plazo13,20.
En relación con los tratamientos no farmacológicos, el uso de la férula22,24,26,28,31,35, la electroterapia23,24,27,28,30,31,33,34 y las técnicas de terapia manual25,29,32 han sido los abordajes más estudiados. El uso de la férula de forma aislada ha mostrado ser efectivo en la disminución de los síntomas y la mejora de la función pero no en las variables electroneurográficas22. Sin embargo la combinación de la férula con otras técnicas muestra mejores resultados como el láser31, transcutaneous electrical nerve stimulation (TENS), deslizamientos neurales28 o ultrasonidos24 o parafina26, obteniéndose en algunos casos mejoras en las variables electroneurográficas: latencia distal motora, potencial de acción neural sensitivo o la latencia distal sensitiva pero sin obtener un consenso claro en la mejora de estas variables.
Las técnicas de electroterapia de forma aislada no han mostrado tampoco resultados concluyentes. No hay evidencia suficiente para afirmar la efectividad del láser frente a un control o un placebo27,31,34, sin embargo asociado al TENS mejora el dolor, el pico de latencia sensitiva, test de Phalen y Tinel23. Por otro lado, los ultrasonidos parecen ser más efectivos en la mejora del dolor, fuerza y variables electroneurográficas33.
Dentro de las técnicas manuales tanto la compresión isquémica29 como la técnica de «ventosas»32 mejoran los síntomas y la función de forma significativa.
La técnica Graston ha mostrado ser efectiva para el aumento del rango de movimiento pero no para mejorar el dolor, sensibilidad y las variables del ENG: latencia distal motora y velocidad de conducción sensitiva25. La acupuntura es efectiva para disminuir el dolor y mejorar la función, mostrando mejores resultados que el uso de la férula35. Y además se han evidenciado mejoras en la latencia distal motora36.
Finalmente la mayoría de combinaciones entre el tratamiento farmacológico y no farmacológico no son concluyentes en la mejor asociación de técnicas37–42.
Hay estudios que no encuentran mejoras al asociar técnicas no farmacológicas como el uso de la férula al tratamiento farmacológico41. Por otro lado, no hay evidencia de que sea mejor asociar el tratamiento farmacológico al no farmacológico como el ultrasonido o la férula39,42. Aunque de forma general en la bibliografía encontramos que la combinación del tratamiento no farmacológico asociado al farmacológico es más efectivo que uno solo37,38.
DiscusiónEl objetivo de esta revisión fue conocer la efectividad de las técnicas de intervención no quirúrgicas empleadas en el tratamiento de pacientes con STC leve o moderado.
Entre los tratamientos conservadores que se aplican en estos pacientes encontramos la toma de fármacos orales. El mecanismo de acción de este tipo de tratamiento se basa en actuar de manera sistémica en el organismo y llegar a reducir la presión del fluido intersticial dentro del túnel carpiano. La evidencia ha mostrado mejoras a corto y largo plazo en los síntomas y en algunas variables electroneurográficas11,12.
De forma más local se propone la aplicación de infiltraciones con el principio de generar un efecto anestésico mediante el aumento del umbral de excitabilidad eléctrico para estabilizar el canal de sodio. Esta técnica invasiva presenta una serie de riesgos previamente descritos43,44 como lesiones iatrogénicas. Por otro lado, no se conoce el mejor fármaco para realizar la infiltración ni la dosis óptima de la aplicación13,15 únicamente se ha demostrado que son efectivas las infiltraciones en comparación con un grupo placebo o con un grupo control16,18.
No existen diferencias entre el abordaje mediante fármacos de forma sistémica y de forma local a corto plazo, pero a largo plazo parece ser mejor la infiltración20. Sin embargo, es escasa la evidencia disponible para afirmarlo con rotundidad. Otra técnica que ofrece posibilidades de introducir el fármaco de manera más local es la iontoforesis, pero aplicado como único tratamiento en el STC no ha mostrado ser efectivo frente a un control14. Por otro lado, el límite de 5 años de la revisión ha hecho que no hayamos encontrado ningún estudio en el que aplicaran gabapentina, un fármaco antiepiléptico bastante frecuente en la práctica clínica habitual y que ha mostrado ser un fármaco analgésico efectivo en el STC, siendo mejor tolerado que otros fármacos como opioides o antidepresivos.
Dentro de los tratamientos no farmacológicos encontramos que las férulas son una de las aplicaciones más frecuentemente estudiadas. El objetivo de estos dispositivos es mantener la muñeca en una posición que disminuya la presión dentro del túnel carpiano. Se han estudiado diferentes posiciones y tipos de férulas pero no se ha llegado a un acuerdo ni sobre la mejor férula, ni sobre la posición en la que deben mantenerse los dedos45. Posiblemente, las características antropométricas y funcionales individuales de cada paciente son un factor influyente, y hace difícil establecer la mejor posición y material de estabilización. El uso de la férula ha mostrado mejorar las variables clínicas, pero no las variables electroneurográficas22, sin embargo, la calidad metodológica de los estudios realizados según las escalas utilizadas no es muy alta22.
En lo que respecta a la combinación de la férula con otras modalidades terapéuticas, los deslizamientos neurales24 parafina y deslizamientos del tendón26, no han mostrado superioridad con ninguno de ellos frente a la férula de forma aislada. Sin embargo, las asociaciones de férula a los ultrasonidos24 y combinar la férula con TENS y movilización neural28 han mostrado un efecto mayor.
Otro grupo de tratamientos no farmacológicos ampliamente utilizados son los de electroterapia, pero los resultados realizados hasta la fecha muestran resultados poco concordantes en relación con su efectividad. Por un lado el láser ha mostrado mejoras en la velocidad de conducción neural y en el resto de variables clínicas estudiadas en los casos leves27. Sin embargo, otro ensayo refleja que no hay diferencias respecto a un grupo control34. Las diferencias en los resultados entre ambos artículos pueden deberse a diferencias metodológicas, ya que en el primer estudio utilizaban un grupo placebo y en el segundo un grupo control. También las variables de medición de cada uno de los estudios fueron distintas. Al comparar unas técnicas de electroterapia con otras, el ultrasonido parece ser más efectivo que el láser, y aunque solo hay un estudio que lo avala, la calidad metodológica del mismo es buena33. Y respecto a otras técnicas de electroterapia, en la magnetoterapia no se ha evidenciado su efectividad frente a un control30.
La terapia manual es otra de las modalidades terapéuticas no farmacológicas utilizadas en el tratamiento del STC. Dentro de ella encontramos las técnicas de compresión isquémica, el masaje, la técnica de Graston o las ventosas. Su objetivo es la disminución de la tensión de los músculos y tejidos blandos adyacentes a la región de compresión neural para mejorar el deslizamiento neural. Las técnicas compresión isquémica sobre el bíceps, pronador redondo y subescapular han mostrado cierta efectividad en la mejora de la función y de los síntomas29, sin embargo, hay que tener en cuenta las deficiencias en la calidad metodológica como que el grupo de pacientes era diferente en cada grupo. También la técnica de Graston y la de «ventosas» aplicada en la musculatura del antebrazo ha mostrando mejoras en los síntomas respecto a un grupo control25,32, aunque estos estudios presentaban deficiencias en cuanto a la calidad metodológica, como el número de pacientes. Sin embargo, debido a la escasez de estudios y a la variabilidad de sus intervenciones, resulta difícil establecer la mejor técnica e, incluso, conocer los mecanismos de actuación. La acupuntura ha mostrado cierta eficacia, produciendo mejores resultados que el tratamiento farmacológico y que la férula en los síntomas, en la función y en algunas variables electroneurográficas35,36.
En la práctica clínica habitual se suelen combinar los tratamientos farmacológicos con los no farmacológicos. En este sentido se han estudiado varias combinaciones de tratamientos, y varios estudios concuerdan en la efectividad de la asociación de férulas con tratamiento farmacológico37 y mostrando ser más efectivo que otro tratamiento no farmacológico38,41,42.
Otra combinación estudiada es la de ultrasonidos con fármacos orales o con infiltración de esteroides sin mostrar mejores resultados que el ultrasonido aplicado de forma aislada39,40.
Debido a la falta de estudios y de homogeneidad en los mismos para comparar las técnicas de tratamiento y las diferentes combinaciones no podemos afirmar que la combinación de tratamientos farmacológicos y no farmacológicos sea más eficaz que la aplicación aislada del tratamiento conservador.
LimitacionesLa revisión realizada presenta algunas limitaciones derivadas de los ensayos clínicos incluidos para la misma, como la variabilidad en cuanto a las variables de medición que han tenido en cuenta en los distintos ensayos, lo que hace difícil la comparación entre los mismos. Por otro lado las diferentes combinaciones de tratamiento propuestas por los autores y las diferentes agrupaciones de técnicas de tratamiento ha dificultado la posibilidad de realizar comparaciones entre los mismos.
Respecto a la metodología de algunos artículos, no se detallaba de forma concreta, lo que dificultó la tarea de responder a las preguntas para valorar la calidad metodológica. Y en cuanto a los resultados, en varios artículos no se realizaba comparaciones entre grupos lo que no ha permitido que extrajésemos conclusiones acerca de qué técnica es mejor.
Tras esta revisión se ve necesaria la realización de más estudios que valoren de forma específica una técnica o combinación de técnicas de tratamiento en las que se midan variables tanto clínicas y funcionales como neurofisiológicas, y que la calidad de los mismos sea la más adecuada para poder considerar los resultados con seguridad.
ConclusionesExiste evidencia científica que avala la efectividad en el tratamiento del STC leve y moderado con la toma de esteroides orales a medio plazo. Las infiltraciones locales parecen ser efectivas aunque son necesarios más estudios en este campo en cuanto al riesgo y efectividad. Hay evidencia de la efectividad del uso de férulas a corto plazo. La efectividad de la férula es mayor si se asocia con otras técnicas de tratamiento como TENS, ultrasonidos o deslizamientos neurales, aunque no se ha determinado qué combinación es la mejor. Las técnicas de electroterapia muestran cierta controversia en cuanto a la efectividad, aunque parece que el ultrasonido es más efectivo que el láser. La evidencia sobre el abordaje del tejido blando mediante técnicas manuales o instrumentales no está muy clara. La acupuntura parece ser una técnica efectiva aunque no hay mucha evidencia al respecto.
No ha sido posible describir la mejor técnica o combinación de técnicas de tratamiento ya que en muchos de los casos se asociaban diferentes técnicas y la falta de homogeneidad en las variables estudiadas dificulta la comparativa. Por tanto se ve necesaria la realización de más estudios y con mejor calidad metodológica para poder obtener resultados concluyentes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se ha recibido ningún tipo de financiación para este trabajo.
Conflicto de interesesNo existe conflicto de intereses.