En los últimos años se han incorporado un importante número de fármacos para el tratamiento de los pacientes con epilepsia, sobre todo para aquellos que no responden a los medicamentos existentes.
El objetivo de este trabajo fue realizar una actualización de las guías terapéuticas publicadas en el año 2005, que serán de ayuda a los médicos que se ocupan de tratar enfermos adultos con epilepsia.
Material y métodosSe seleccionaron, a partir de un sistema de búsqueda bibliográfica, aquellos artículos de relevancia clínica referidos al tratamiento farmacológico, que analizaran la eficacia, tolerabilidad y seguridad de los fármacos antiepilépticos.
ResultadosDe acuerdo con el momento evolutivo de la enfermedad los pacientes fueron agrupados en aquellos con crisis de reciente diagnóstico y aquellos con epilepsia resistente. Se analizaron los fármacos aprobados para su comercialización y la evidencia existente para el tratamiento en función del tipo de crisis: focal o generalizada de inicio.
ConclusiónComo resultado del análisis de la evidencia existente fue posible realizar una actualización de las guías de tratamiento previas para establecer una aproximación terapéutica de acuerdo al tipo de epilepsia. Aún no se cuenta en la literatura con evidencia que soporte el tratamiento de los pacientes de acuerdo a algún síndrome epiléptico particular.
In the last few years the number of antiepileptic drugs available has increased considerably, in particular for those patients who do not respond to the existing drugs.
The aim of this study was to perform an update of treatment guidelines published in 2005, that will be helpful to physicians who take care of adult epileptic patients.
Material and methodsA bibliographical search was done for those relevant articles referred to the pharmacological treatment of the epilepsy, analyzing the efficacy, tolerability and safety of the antiepileptic drugs.
ResultsAccording to the evolutive stage of the disease, epilepsy patients were grouped into those with recent diagnosis and drug-resistant patients. We analyzed antiepileptic drugs approved for marketing and the evidence for the treatment according to the seizure type: focal or generalized at onset.
ConclusionAs a result of analyzing the available evidence was possible to perform an update of the previous treatment guidelines establishing a therapeutic approach based on the type of epilepsy. Although, there is no evidence in the literature, that support the treatment of patients according to a particular epileptic syndrome.
La constante incorporación de nuevas medicaciones como alternativas al tratamiento farmacológico de los pacientes con epilepsia obliga a una revisión permanente de este tema. Es por ello que el Grupo de Epilepsia de la Sociedad Neurológica Argentina (SNA) ha decidido realizar una actualización de las guías de tratamiento publicadas previamente1,2.
En las guías previas los pacientes fueron clasificados, con la finalidad de definir el tratamiento, de acuerdo al momento evolutivo de su enfermedad. Para ello se habían considerado 4 grupos: pacientes con crisis única, pacientes de reciente diagnóstico, pacientes no respondedores a fármacos de primera línea y pacientes refractarios1,2.
Teniendo en cuenta la definición de la Liga Internacional Contra la Epilepsia (ILAE) de 20053, que para realizar el diagnóstico de epilepsia se requiere al menos la ocurrencia de una crisis epiléptica, se ha decidido considerar a los 2 primeros ítems de forma conjunta y realizar una discusión acerca de la decisión terapéutica. También se cambia la denominación de epilepsia refractaria por resistente a fármacos4 y se elimina del análisis el grupo de pacientes no respondedores a fármacos de primera línea, considerando que esta discusión se realizará en los pacientes resistentes. Por lo tanto, los grupos a considerar serán solo 2:
- 1)
Pacientes que inician el tratamiento.
- 2)
Pacientes con epilepsia resistente a fármacos.
Cuando un paciente se presenta en la consulta por una primera crisis no provocada debemos, en primer lugar, confirmar la naturaleza epiléptica del episodio realizando un interrogatorio detallado del evento y apoyándonos en los exámenes complementarios, tales como el EEG y las IRM.
Una vez confirmado este diagnóstico debemos tener en claro si este episodio constituye una primera crisis aislada o si el paciente ya había tenido previamente otros episodios sugestivos de crisis, los cuales no habían sido jerarquizados. En esta segunda opción la decisión es sin duda la de comenzar el tratamiento antiepiléptico. En la primera opción deberán tenerse en cuenta algunas cuestiones que serán analizadas a continuación.
Como se comentara en la guía previa, la recomendación de iniciar tratamiento en los pacientes con una primera crisis debe hacerse cuando exista alguna posibilidad razonable de recurrencia1,2. Esta posibilidad oscila, según la literatura, entre un 17 a un 80% entre los 2 y 5 años después de haber presentado el primer evento5–9.
Muchos estudios epidemiológicos han analizado los parámetros de recurrencia en los pacientes tras el primer evento. Un examen físico neurológico anormal y/o una IRM anormal, mostrando una lesión epileptogénica; la presencia de un EEG anormal con actividad epileptiforme: espigas, poliespigas, espiga-onda y ondas agudas, especialmente si el patrón en el EEG es de espiga-onda; una historia —en un familiar de primer grado— de epilepsia; la presencia de crisis durante el sueño y crisis focales han sido tomadas como variables que estando presentes nos indicarían un mayor riesgo de recurrencia de crisis10–14.
Analizando también la evidencia que existe con relación al tratamiento de una primera crisis se encuentran 2 estudios abiertos: el First Seizure Trial Group (FIRST) y el Multicentre Study of Early Epilepsy and Single Seizures (MESS). En dichos estudios los pacientes fueron divididos en 2 grupos, aquellos que fueron asignados a recibir tratamiento farmacológico de forma inmediata y aquellos que fueron asignados a recibirlo de forma diferida15,16. Ambos estudios demostraron que diferir el tratamiento no modifica el pronóstico a largo plazo de la enfermedad. A pesar de haber diferencias en cuanto a los resultados, siendo más favorable el beneficio del tratamiento precoz en el FIRST con respecto al MESS, no sería de mala práctica diferir el tratamiento hasta que ocurra una segunda crisis, excepto que el paciente tenga alguna de las variables que se asocian con un pronóstico desfavorable, o que diferir el tratamiento sea, desde el punto de vista del médico y del paciente, razonablemente inaceptado. Con esta idea fue que la ILAE entonces consideró que para realizar el diagnóstico de epilepsia el paciente debería tener al menos una crisis y con un solo episodio podría iniciarse un tratamiento farmacológico3.
Los enfermos que no deberían tratarse ante una primera crisis serían aquellos cuyas crisis ocurren ante situaciones especiales (crisis provocadas) tales como17–19:
- •
Abstinencia de alcohol.
- •
Abuso de sustancias.
- •
Crisis vinculadas a enfermedad aguda (crisis sintomáticas agudas).
- •
Traumatismo de cráneo cerrado sin evidencia de daño cerebral.
- •
Privación excesiva de sueño.
Una vez tomada la decisión de iniciar el tratamiento el siguiente paso consiste en decidir qué fármaco utilizar. El objetivo principal del tratamiento de la epilepsia es lograr el cese de las crisis sin eventos adversos. Se recomienda iniciar el tratamiento siempre en monoterapia, con el fin de disminuir la toxicidad potencial y con ello reducir la posibilidad de desarrollar eventos adversos, mejorar la adherencia, reducir los costes y la potencialidad de interacciones farmacológicas20,21. La dosis se incrementa de forma progresiva hasta lograr el control de las crisis o la aparición de eventos adversos no tolerables1.
La elección de un fármaco para un paciente en particular debe basarse en las evidencias aportadas por la literatura sobre la eficacia, evaluada a través de los estudios clínicos controlados, aleatorizados y bien diseñados, teniendo en cuenta además el perfil de tolerabilidad22. Resulta indispensable intentar definir al menos el tipo de crisis, para lo cual un interrogatorio detallado del evento, apoyado por los exámenes complementarios tales como el EEG y las IRM, permitirán una aproximación acabada a la forma de epilepsia del paciente, ya sea focal o generalizada de inicio. Idealmente esta decisión debería ser adecuada al síndrome epiléptico; sin embargo, esta situación no ha podido ser definida en la literatura, ya que tampoco se cuenta con diseños de ensayos clínicos particulares al respecto1.
Existen limitaciones en la calidad de la evidencia disponible para determinar estas decisiones terapéuticas. Una revisión sistemática, recientemente actualizada por la ILAE, concluyó que de 39 ensayos elegibles en adultos con crisis focales solo 4 fueron calificados como clase i, uno fue calificado como de clase ii y 34 recibieron la calificación más baja (clase iii)23. Para la confección de la presente guía se tomaron como referencia para calificar los estudios clínicos los niveles de evidencia y grados de recomendación de las guías de la Scottish Intercollegiate Guidelines Network (SIGN) (tabla 1)2,24. Esta forma de analizar los estudios permite, solamente, clasificar la evidencia de los ensayos clínicos, aunque con ciertas limitaciones. Por ejemplo, no todos los llamados «fármacos clásicos», cuyo uso se remonta a varios años atrás, cuentan con el tipo de diseño de estudio del cual se dispone en la literatura actual.
Determinación de niveles de evidencia y grados de recomendación de acuerdo con el tipo de estudios clínicos
| Niveles de evidencia | |
| 1++ | Metaanálisis de alta calidad, revisiones sistemáticas de ECA, o ECA con muy bajo riesgo de sesgo |
| 1+ | Metaanálisis bien realizados, revisiones sistemáticas o ECA con bajo riesgo de sesgo |
| 1− | Metaanálisis, revisiones sistemáticas o ECA con alto riesgo de sesgo |
| 2++ | Revisiones sistemáticas de alta calidad de estudios de caso-control o de cohorteEstudios de caso-control o de cohorte de alta calidad, con muy bajo riesgo de confusión o sesgo y una alta probabilidad de que la relación sea causal |
| 2+ | Estudios de caso-control o de cohortes bien realizados, con bajo riesgo de confusión o sesgo y una moderada probabilidad de que la relación sea causal |
| 2- | Estudios de caso-control o de cohorte con alto riesgo de confusión o sesgo y un significativo riesgo de que la relación no sea causal |
| 3 | Estudios no analíticos, como reporte de caso y serie de casos |
| 4 | Opinión de expertos |
| Grados de recomendación | |
| A | Al menos un metaanálisis, revisión sistemática o ECR calificado como 1++ y directamente aplicable a la población objeto; o un cuerpo de evidencia consistente principalmente de estudios calificados como 1+, directamente aplicable a la población objeto y demostrando total consistencia de los resultados |
| B | Un cuerpo de evidencia que incluya estudios calificados como 2++, directamente aplicables a la población objeto y demostrando total consistencia de los resultados; o evidencia extrapolada de estudios calificados como 1++ o 1+ |
| C | Un cuerpo de evidencia que incluya estudios calificados como 2+, directamente aplicables a la población objeto y demostrando total consistencia de los resultados, o evidencia extrapolada de estudios calificados como 2++ |
| D | Niveles de evidencia 3 o 4, o evidencia extrapolada desde estudios calificados como 2+ |
ECA: ensayos clínicos aleatorizados.
Por otra parte, el escenario de los ensayos clínicos es muy lejano a la práctica clínica diaria. Por todo esto no resulta sorprendente que las guías de tratamiento más reconocidas, como las de la Academia Americana de Neurología (AAN), de la National Institute for Health and Clinical Excellence (NICE), la SIGN y la ILAE difieran en sus recomendaciones en cuanto a la elección de los antiepilépticos para el inicio en monoterapia de primera línea23,25–29.
En la actualización de la guía NICE se recomiendan como tratamientos de primera línea, tanto para niños como para adultos con epilepsia focal recientemente diagnosticada, la CBZ y a la LTG. Como otras opciones recomienda LEV, OXC o VPA, si las anteriores no son adecuadas o no son toleradas30.
En la actualización de la evidencia que realizó la ILAE, acerca de la eficacia y efectividad de los fármacos antiepilépticos como monoterapia en pacientes de reciente comienzo con epilepsia focal, se han incorporado como opciones LEV y ZNS23.
También en epilepsia generalizada existe una limitación importante de estudios clínicos con buena calidad metodológica. Tanto en la revisión de la ILAE como en la guía de la AAN ambas concluyeron, aunque con un bajo nivel de evidencia, que CBZ, LTG, OXC, PB, PHT, TPM y VPA resultaron eficaces para el tratamiento de crisis epilépticas generalizadas en el adulto25,26. Sin embargo, en la última guía de la ILAE se agregaron como opción, aunque con un nivel de evidencia muy bajo, GBP, LEV y VGB en el tratamiento de adultos con crisis generalizadas y TPM y VPA, también con un muy bajo nivel de evidencia, para el síndrome de epilepsia mioclónica juvenil23.
En el estudio pragmático SANAD, donde se incluyeron todas las formas clínicas de epilepsia generalizada como un único grupo, el VPA resultó ser más eficaz que LTG y mejor tolerado que TPM. Si bien se sugiere que el fármaco de elección para este tipo de crisis y para los que posean crisis que no puedan ser clasificadas como focales o generalizadas es el VPA, advierte acerca de la potencialidad de efectos teratogénicos que pueden aparecer con este fármaco31.
Posteriormente se publicaron 2 ensayos de no inferioridad que demostraron que tanto el LEV como la ZNS tienen resultados similares en eficacia y tolerabilidad comparados con la CBZ de liberación sostenida, en pacientes adultos con crisis focales o tónico-clónicas generalizadas32,33.
Sobre la base de estudios de cohortes y recientes revisiones se considera que el VPA es el tratamiento de elección de la epilepsia mioclónica juvenil26,34–40.
Varios estudios han mostrado eficacia de CZP, LEV, LTG, TPM y ZNS en el tratamiento de las crisis mioclónicas en la epilepsia generalizada idiopática34,41–50. Sin embargo, deberá tenerse precaución con el uso de LTG, ya que en algunos casos puede agravar las mioclonías40,51.
Dos recientes guías publicadas en el año 2012 consideran el VPA como de elección en todas las crisis generalizadas, excepto en mujeres en edad fértil30,52–54.
También el VPA es considerado como fármaco de elección de acuerdo con la opinión de expertos en pacientes con síndrome de Lennox-Gastaut55.
Como ya se mencionó, la elección definitiva de un fármaco para un paciente con epilepsia recientemente diagnosticada o no tratada no solo debe analizar la eficacia, sino también otras variables tales como:
- •
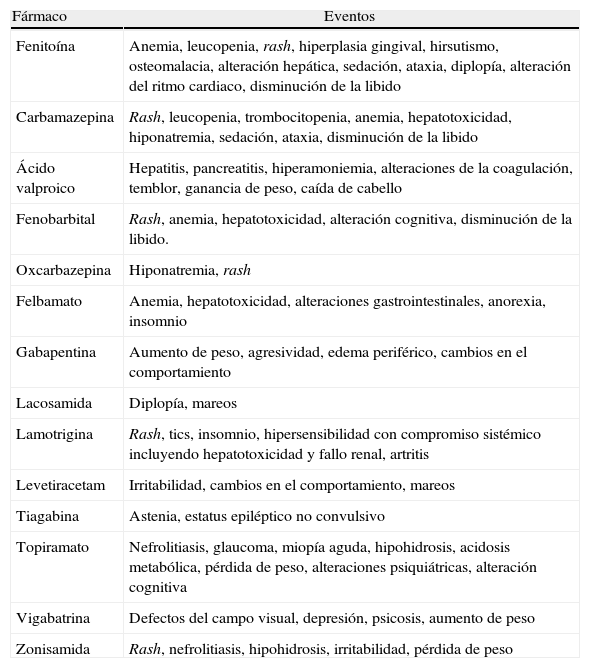
Específicas del fármaco: perfil de seguridad (potencial de generar efectos adversos como reacciones de idiosincrasia, efectos teratogénicos y efectos crónicos secundarios [tabla 2]), las propiedades farmacocinéticas (potencial de inducción enzimática, interacciones con otros medicamentos), el tipo de formulaciones existentes (por ejemplo disponibilidad de formulaciones endovenosas u orales, tiempo en alcanzar la dosis objetivo eficaz), el coste y la disponibilidad.
Tabla 2.Eventos adversos serios y no serios asociados más frecuentes
Fármaco Eventos Fenitoína Anemia, leucopenia, rash, hiperplasia gingival, hirsutismo, osteomalacia, alteración hepática, sedación, ataxia, diplopía, alteración del ritmo cardiaco, disminución de la libido Carbamazepina Rash, leucopenia, trombocitopenia, anemia, hepatotoxicidad, hiponatremia, sedación, ataxia, disminución de la libido Ácido valproico Hepatitis, pancreatitis, hiperamoniemia, alteraciones de la coagulación, temblor, ganancia de peso, caída de cabello Fenobarbital Rash, anemia, hepatotoxicidad, alteración cognitiva, disminución de la libido. Oxcarbazepina Hiponatremia, rash Felbamato Anemia, hepatotoxicidad, alteraciones gastrointestinales, anorexia, insomnio Gabapentina Aumento de peso, agresividad, edema periférico, cambios en el comportamiento Lacosamida Diplopía, mareos Lamotrigina Rash, tics, insomnio, hipersensibilidad con compromiso sistémico incluyendo hepatotoxicidad y fallo renal, artritis Levetiracetam Irritabilidad, cambios en el comportamiento, mareos Tiagabina Astenia, estatus epiléptico no convulsivo Topiramato Nefrolitiasis, glaucoma, miopía aguda, hipohidrosis, acidosis metabólica, pérdida de peso, alteraciones psiquiátricas, alteración cognitiva Vigabatrina Defectos del campo visual, depresión, psicosis, aumento de peso Zonisamida Rash, nefrolitiasis, hipohidrosis, irritabilidad, pérdida de peso - •
Específicas del paciente: el potencial de maternidad, si se trata de un individuo añoso y las enfermedades coexistentes o comorbilidades que presenta. Estas últimas deben tenerse en cuenta no solo debido a las interacciones con los otros fármacos utilizados para tratarlas, sino también porque algunos antiepilépticos pueden afectar positiva o negativamente a los trastornos comórbidos22.
Una vez que se revisaron los estudios clínicos se procedió a clasificarlos en función de los niveles de evidencia y grados de recomendación, tomando como referencia las guías de la SIGN, tal cual fuera explicado previamente2,24.
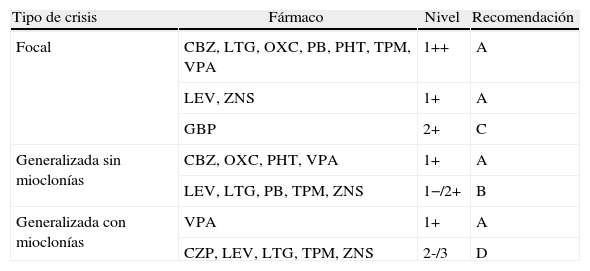
En resumen, las posibilidades de tratamiento en epilepsia focal como terapia inicial son las siguientes (tabla 3):
Resumen de los niveles de evidencia de tratamiento de acuerdo al tipo de crisis en epilepsia de reciente comienzo
| Tipo de crisis | Fármaco | Nivel | Recomendación |
| Focal | CBZ, LTG, OXC, PB, PHT, TPM, VPA | 1++ | A |
| LEV, ZNS | 1+ | A | |
| GBP | 2+ | C | |
| Generalizada sin mioclonías | CBZ, OXC, PHT, VPA | 1+ | A |
| LEV, LTG, PB, TPM, ZNS | 1−/2+ | B | |
| Generalizada con mioclonías | VPA | 1+ | A |
| CZP, LEV, LTG, TPM, ZNS | 2-/3 | D |
CBZ: carbamazepina; CZP: clonazepam; GBP: gabapentina; LEV: levetiracetam; LTG: lamotrigina; OXC: oxcarbazepina; PB: fenobarbital; PHT: fenitoína; TPM: topiramato; VPA: ácido valproico; ZNS: zonisamida.
- •
Ácido valproico26,30,56–61.
- •
Carbamazepina56–58,60–71.
- •
Difenilhidantoína o fenitoína56,62,68,72–75.
- •
Fenobarbital56,62,69.
- •
Lamotrigina63–65,70,73,76.
- •
Oxcarbazepina66,67,71,72,74,75,77,78.
- •
Topiramato58,79–81.
- •
Gabapentina en mayores de 60 años82.
Si bien el FBM también está aprobado por las autoridades regulatorias con esta indicación, de acuerdo a estudios con buen nivel de evidencia, los eventos adversos observados en la etapa de comercialización del fármaco desaconsejan su uso como terapia inicial83–87.
Sugerencias en pacientes con epilepsia focal- •
Fármaco de elección: carbamazepina (pacientes sin comorbilidad).
- •
Otras opciones posibles con buen nivel de evidencia: ácido valproico (no recomendado para mujeres en edad fértil), fenitoína, fenobarbital, lamotrigina, levetiracetam, oxcarbazepina, topiramato y zonisamida.
- •
Otras opciones posibles con menor nivel de evidencia: gabapentina, aunque esta última solo representa una opción en individuos mayores de 60 años.
En resumen, las posibilidades de tratamiento en epilepsia generalizada no mioclónica como terapia inicial son las siguientes (tabla 3):
Nivel de evidencia 1+, grado de recomendación A- •
Ácido valproico30,31,54,70,71,88–92.
- •
Carbamazepina66,67,70,71.
- •
Fenitoína o difenilhidantoína66,72.
- •
Oxcarbazepina72.
- •
Fenobarbital23,25,26.
- •
Lamotrigina23–26,31.
- •
Levetiracetam31.
- •
Topiramato23,25,26,31.
- •
Zonisamida33.
- •
Fármaco de elección: ácido valproico (no recomendado para mujeres en edad fértil).
- •
Otras opciones posibles con buen nivel de evidencia: carbamazepina, fenitoína, oxcarbazepina.
- •
Otras opciones posibles con menor nivel de evidencia: fenobarbital, lamotrigina, levetiracetam, topiramato y zonisamida.
Las posibilidades de tratamiento en epilepsia generalizada con crisis mioclónicas son las expuestas en la tabla 3:
Nivel de evidencia 1+, grado de recomendación A- •
Ácido valproico26,34-40.
- •
Fármaco de elección: ácido valproico (no recomendado para mujeres en edad fértil).
- •
Otras opciones posibles: no hay otros fármacos con buena evidencia para este síndrome epiléptico específico.
La ILAE ha establecido recientemente que debe considerarse farmacorresistente a aquel paciente en el cual no se haya logrado la desaparición de las crisis epilépticas después del uso de al menos 2 fármacos anticomiciales apropiados, ya sea que hayan sido utilizados en monoterapia o en combinación4. Esto se fundamenta en que las posibilidades de responder al tratamiento farmacológico con la sucesiva incorporación de otros fármacos se reducen de forma significativa. Según estudios prospectivos controlados y aleatorizados, la posibilidad de remisión en pacientes que no respondieron al uso de varios fármacos previos es menor al 10%22,93,94.
Sin embargo, el diagnóstico de farmacorresistencia no es sinónimo de imposibilidad de tratamiento. Generalmente en este grupo de pacientes se utilizan combinaciones de al menos 2 fármacos, en donde el fármaco utilizado como terapia inicial es tomado como patrón, y a este se le adiciona una segundo medicamento1,2.
No se encuentran en la literatura análisis de combinaciones farmacológicas que puedan utilizarse como guía en pacientes resistentes. Los aspectos que deberían ponerse en consideración al intentar un nuevo fármaco en este grupo de pacientes son: espectro y mecanismos de acción, eficacia, perfil de eventos adversos, el efecto esperado en función de las características del paciente y la posibilidad de interacciones, ya sean farmacocinéticas o farmacodinámicas22.
Es por ello que ante pacientes farmacorresistentes es imprescindible realizar una detallada anamnesis de la historia farmacológica, conociendo qué fármacos tomó, a qué dosis, cuáles fueron las causas por las cuales debió suspenderse cada uno, qué grado de respuesta presentó con cada fármaco, cómo fueron los esquemas en combinación, cómo fueron incorporados y titulados los fármacos, cómo se suspendieron y cuál fue la adherencia del paciente al tratamiento indicado.
Tampoco es conveniente que esta situación se convierta en inercial y perdure a lo largo del tiempo, evitando así el beneficio potencial de otros tratamientos, como puede ser la posibilidad de una cirugía, tal como se plantea en la guía de definición de epilepsia resistente de la ILAE4.
El manejo de los pacientes que no responden a los fármacos en monoterapia debe establecerse utilizando una cuidadosa politerapia individualizada. De acuerdo con las recomendaciones de las guías previas se remarca que debe tomarse un fármaco como patrón, y a este se le adiciona otro, que es más conveniente que sea uno nuevo, considerando el perfil de interacciones de menor cuantía con estas medicaciones1,2. La mayor amenaza en este grupo de pacientes es el uso excesivo de fármacos en politerapia, ya que el sobretratamiento también puede afectar la calidad de vida.
En resumen, los fármacos que pueden adicionarse en epilepsia focal son los siguientes (tabla 4)
Resumen de los niveles de evidencia de tratamiento en epilepsia focal como terapia aditiva
| Fármaco | Nivel | Recomendación |
| ESL, GBP, LCM, LEV, LTG, OXC, PER, PGB, RTG o EZG, TGB, TPM, ZNS. | 1++ | A |
ESL: eslicarbazepina; GBP: gabapentin; LCM: lacosamida; LEV: levetiracetam; LTG: lamotrigina; OXC: oxcarbazepina; PER: perampanel; PGB: pregabalina; RTG o EZG: retigabina o ezogabina; TPM: topiramato; ZNS: zonisamida.
- •
- •
Gabapentin98–105.
- •
Lacosamida106–108.
- •
Lamotrigina109–117.
- •
Levetiracetam118–123.
- •
Oxcarbazepina124,125.
- •
- •
Pregabalina130–133.
- •
Retigabina o ezogabinaf134–136.
- •
Tiagabinaf137–140.
- •
Topiramato141–148.
- •
Zonisamida149–155.
Si bien FBM también está aprobada con esta indicación156,157, los eventos adversos observados en el posmarketing hacen que este fármaco deba ser utilizado con precaución85–87. Esta misma situación ocurre con la VGB, cuyos efectos en el campo visual, atribuidos en algunos casos a daño retiniano irreversible, desaconsejan su uso158–169.
Sugerencias en pacientes con epilepsia focal resistenteCualquiera de los fármacos mencionados previamente puede ser utilizado como terapia adicional.
En resumen, los fármacos que pueden adicionarse en epilepsia generalizada son los siguientes:
Nivel de evidencia 1++, grado de recomendación A- •
Felbamato para Lennox-Gastaut170–173.
- •
Lamotrigina para Lennox-Gastaut y nivel de evidencia 2+, grado de recomendación C para el resto de las crisis30,174–178.
- •
Rufinamidaf para Lennox-Gastaut170,179,180.
- •
Topiramato para Lennox-Gastaut y nivel de evidencia 2+, grado de recomendación C para el resto de las crisis30,170,181,182.
- •
Levetiracetam183–186.
- •
Zonisamida187,188.
- •
Fármaco de elección: levetiracetam.
- •
Otras opciones posibles: lamotrigina, topiramato y zonisamida.
- •
Fármacos de elección: lamotrigina, topiramato.
- •
Otras opciones posibles: felbamato, rufinamida.
En general las benzodiacepinas (diazepam, clonazepam, clobazam y lorazepam) deberían ser utilizadas principalmente como terapia de rescate y no como fármacos a largo plazo, excepto en situaciones particulares1.
ConclusionesLa finalidad del tratamiento de la epilepsia es tener al paciente libre de crisis o con una significativa reducción en su frecuencia y con mejoría en su calidad de vida. Es indudable que esto no debe ser logrado a cualquier precio, en especial si hablamos tanto de cuestiones económicas como de eventos adversos vinculados a la toma de la medicación.
En los últimos años se han incrementado las opciones terapéuticas en el tratamiento de la epilepsia. Esto nos ha llevado a realizar este trabajo de actualización. A pesar de todo esto, aún no se ha podido encontrar drógale fármaco antiepiléptico ideal.
Si bien es cierto que hay muchos estudios que demuestran evidencia para el uso de los fármacos nuevos en epilepsia focal en pacientes resistentes, muchos de ellos aún no han sido testados en pacientes de reciente diagnóstico.
En epilepsia generalizada el número de trabajos es limitado, y se necesita más evidencia para realizar recomendaciones específicas en esta población.
Los estudios clínicos han demostrado que los nuevos fármacos tienen igual eficacia, mayor tolerabilidad, mayor espectro de acción y menos interacciones en relación con los fármacos clásicos. Sin embargo, estos estudios analizan poblaciones seleccionadas de enfermos, y muchos de ellos resultan complejos al intentar correlacionarlos con la práctica clínica diaria.
En países como el nuestro el coste económico de los medicamentos, particularmente de los nuevos, es aún extremadamente alto. Es por ello que la valoración de un fármaco no solo debe sustentarse en la eficacia, demostrada en los ensayos clínicos, sino en la tolerabilidad, que mide la incidencia, severidad e impacto de los eventos adversos causados por el medicamento en el paciente. La combinación de ambos conceptos es la efectividad23, que es lo que determina que el paciente continúe tomando la medicación a lo largo del tiempo. Por lo tanto, para evaluar el verdadero impacto de los fármacos en el tratamiento deberían realizarse análisis de coste-efectividad.
Estas guías de tratamiento están orientadas hacia los neurólogos generales para que puedan aproximar sus decisiones terapéuticas con mayor precisión.
Conflicto de interesesDamián E. Consalvo ha recibido honorarios por investigación clínica de: AstraZeneca, Bial, Eisai, GlaxoSmithKline, Janssen-Cilag, Johnson & Johnson y Valeant; y honorarios por conferencias de: Janssen-Cilag, Novartis y UCB.
María E. Fontela declara no tener conflicto de intereses.
Cristina E. Papayannis declara no tener conflicto de intereses.
Lucas M. Romano ha recibido apoyo para asistir a jornadas y congresos de: Bagó, GlaxoSmithKline, Novartis y Raffo.
Patricia C. Saidón declara no tener conflicto de intereses.
Ricardo D. Bernater ha recibido apoyo para asistir a jornadas y congresos de: Abbott, GlaxoSmithKline y Janssen-Cilag.