Realizar un metaanálisis de estudios observacionales y de intervención, que analizan la proporción de pacientes con epilepsia mioclónica juvenil farmacorresistente y evaluar el impacto del ácido valproico versus los antiepilépticos lamotrigina y levetiracetam en el control de crisis epilépticas.
Pacientes y métodosSe realizó una búsqueda sistemática de los estudios publicados en PubMed, The Cochrane Library, ClinicalTrials.gov, LILACS, Plataforma de Registro Internacional de Ensayos Clínicos (ICTRP) y Google Scholar hasta agosto 2020, para identificar todos los estudios observacionales o de intervención que evalúen los tratamientos en epilepsia mioclónica juvenil.
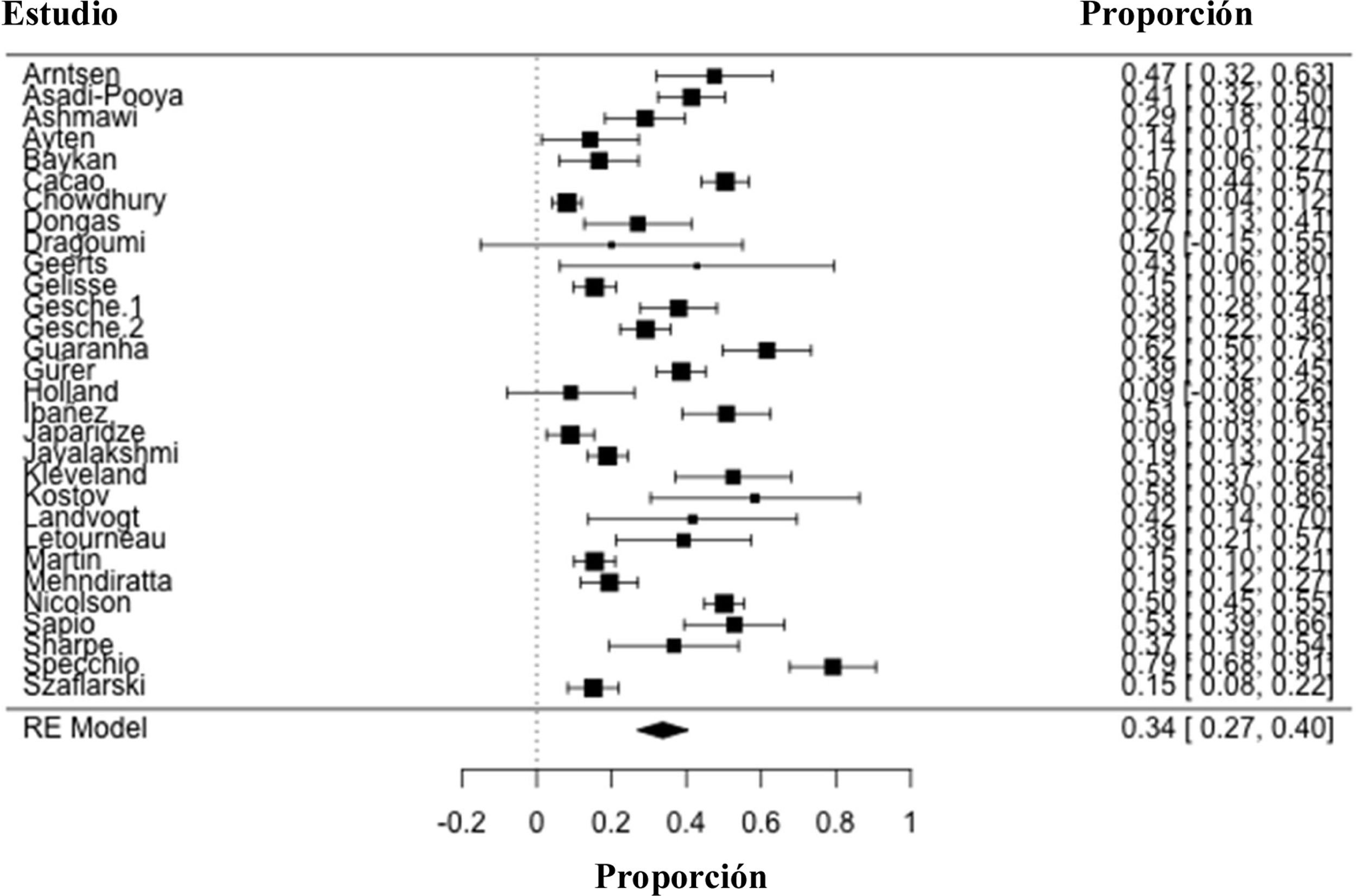
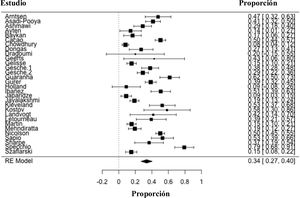
ResultadosSe identificaron un total de 30 estudios, publicados entre 1995 y 2020, con un número total de 2770 participantes, de los cuales 914 presentan epilepsia mioclónica juvenil farmacorresistente y 1856 se encontraban libres de crisis con el tratamiento antiepiléptico. El metaanálisis de proporción evidencia cómo el 34% (IC95%: 27-40%) de los participantes incluidos son farmacorresistentes (I2=94,1%; IC95% 27-40%; p<0,001).
ConclusiónA pesar de los significativos avances, la evidencia actual ha mostrado hallazgos inconsistentes en cuanto al estudio de la epilepsia mioclónica juvenil farmacorresistente, en donde al parecer lo que está claro es que se trata de un síndrome de epilepsia heterogénea, con un patrón complejo, y con una respuesta al tratamiento igualmente variable.
Carry out a meta-analysis of observational and intervention studies that analyze the proportion of patients with drug-resistant juvenile myoclonic epilepsy and evaluate the impact of valproic acid versus the antiepileptic drugs lamotrigine and levetiracetam in the control of epileptic seizures.
Patients and methodsA systematic search of studies published in PubMed, The Cochrane Library, ClinicalTrials.gov, LILACS, the International Clinical Trials Registry Platform (ICTRP) and Google Scholar up to August 2020 was carried out to identify all observational or intervention studies that evaluate treatments in patients with juvenile myoclonic epilepsy.
ResultsA total of 30 studies were identified, published between 1995 and 2020, with a total number of 2770 participants, of which 914 had drug-resistant juvenile myoclonic epilepsy and 1856 were seizure-free with antiepileptic treatment. The proportion meta-analysis shows that 34% (95% CI: 27-40%) of the included participants are drug resistant (I2=94.1%; 95% CI 27-40%; P<.001).
ConclusionDespite significant advances, current evidence has shown inconsistent findings regarding the study of drug-resistant juvenile myoclonic epilepsy, where apparently what is clear is that it is a heterogeneous epilepsy syndrome, with a complex pattern, and with an equally variable response to treatment
La epilepsia mioclónica juvenil (EMJ) es la forma más común de epilepsia generalizada genética, y afecta al 5-10% de todas las personas con epilepsia, con una prevalencia de 0,1-0,2 / 100.0001; no obtuvo su reconocimiento oficial como un síndrome por la ILAE hasta 19892, más de 30 años después de sus descripciones iniciales3. Su reconocimiento mundial y el aumento de los estudios realizados en diferentes países han creado confusión en cuanto a su diagnóstico, el tratamiento en los diferentes grupos de edad y las recomendaciones de estilo de vida, características que aún no son claras.
Según su definición, «la respuesta a los medicamentos apropiados es buena»; lo que podría llevar a un asesoramiento optimista4 o a un manejo subóptimo5 teniendo en cuenta que, aproximadamente, un tercio de los pacientes con EMJ no responden por completo al tratamiento, a pesar del uso de múltiples fármacos antiepilépticos (FAE)6.La farmacorresistencia, por lo tanto, puede encontrarse en el 15-30% de los pacientes con diagnóstico de EMJ7,8, e incluso algunos reportes de centros de referencia alcanzan cifras de hasta el 50%9. Si bien se han analizado algunas cohortes de pacientes en donde se ha encontrado que la ocurrencia combinada de los 3 tipos de crisis y los trastornos psiquiátricos coexistentes son factores de riesgo asociados con la resistencia a los medicamentos10, hoy en día aún existe poca literatura que confirme en qué medida estos factores aumentan el riesgo de farmacorresistencia, tanto como factores únicos o en combinación con otras características clínicas, y todavía hay poca evidencia de un tratamiento diferencial en este tipo de pacientes.
Es por ello por lo que la EMJ farmacorresistente cuenta con múltiples interrogantes en cuanto a su heterogeneidad, tanto genética, como en su presentación clínica, o en el tratamiento actualmente empleado. Es por ello importante establecer la frecuencia con la que los individuos son farmacorresistentes para brindar un tratamiento y pronóstico adecuados. Varios estudios han explorado los factores clínicos y de riesgo de la EMJ farmacorresistente4,11, pero los estudios individuales están limitados por tamaños de muestra relativamente pequeños y con inconsistencias entre las definiciones empleadas o en cuanto al tratamiento empleado.
Nuestro objetivo es estimar la proporción de pacientes con EMJ farmacorresistente y evaluar el impacto del ácido valproico versus los FAE lamotrigina y levetiracetam en el control de crisis epilépticas en pacientes con EMJ. Mediante esta revisión sistemática y metaanálisis se pretende por tanto establecer esas diferencias entre un manejo de primera línea con ácido valproico y el tratamiento de segunda línea con lamotrigina y levetiracetam.
MétodosEste metaanálisis siguió las directrices PRISMA12 y MOOSE para realizar y reportar revisiones sistemáticas y metaanálisis.
Estrategia de búsquedaSe llevó a cabo una búsqueda bibliográfica en las bases de datos electrónicas PubMed, The Cochrane Library, ClinicalTrials.gov, LILACS, Plataforma de Registro Internacional de Ensayos Clínicos (ICTRP) y Google Scholar. Las búsquedas de esta revisión se realizaron por primera vez el 26 de agosto de 2020, se restringió a estudios en humanos y artículos publicados inicialmente, sin restricciones de idioma, la fecha de la última revisión fue el 2 de septiembre de 2020. La búsqueda en PubMed incluyó la combinación de los siguientes descriptores MeSH:
Search: (Myoclonic Epilepsy, Juvenile) AND (Drug Resistant Epilepsy)
((((«myoclonic epilepsy, juvenile»[MeSH Terms] OR ((«myoclonic»[All Fields] AND «epilepsy»[All Fields]) AND «juvenile»[All Fields])) OR «juvenile myoclonic epilepsy»[All Fields]) OR ((«myoclonic»[All Fields] AND «epilepsy»[All Fields]) AND «juvenile»[All Fields])) OR «myoclonic epilepsy juvenile»[All Fields]) AND ((«drug resistant epilepsy»[MeSH Terms] OR ((«drug»[All Fields] AND «resistant»[All Fields]) AND «epilepsy»[All Fields])) OR «drug resistant epilepsy»[All Fields])
Translations
Myoclonic Epilepsy, Juvenile: «myoclonic epilepsy, juvenile»[MeSH Terms] OR («myoclonic»[All Fields] AND «epilepsy»[All Fields] AND «juvenile»[All Fields]) OR «juvenile myoclonic epilepsy»[All Fields] OR («myoclonic»[All Fields] AND «epilepsy»[All Fields] AND «juvenile»[All Fields]) OR «myoclonic epilepsy, juvenile»[All Fields]
Drug Resistant Epilepsy: «drug resistant epilepsy»[MeSH Terms] OR («drug»[All Fields] AND «resistant»[All Fields] AND «epilepsy»[All Fields]) OR «drug resistant epilepsy»[All Fields].
Criterios para la inclusión y selección de los estudiosSe identificaron artículos que describen el tratamiento con FAE y el control de crisis epilépticas en pacientes con EMJ, según los criterios definidos por la ILAE13. Se incluyeron todos los estudios observacionales retrospectivos y prospectivos, los ensayos clínicos controlados aleatorizados y las revisiones sistemáticas. Los estudios debían informar el resultado de las crisis después del inicio de tratamiento con FAE, independientemente de los criterios de diagnóstico usados por el estudio para EMJ. Se incluyeron artículos publicados en inglés y español. Se excluyeron los protocolos de ensayos clínicos, estudios de farmacogenómica, reportes o series de casos, guías de práctica clínica y revisiones temáticas o narrativas. Los estudios con información limitada sobre el diseño, información limitada en los datos o no disponibilidad de texto completo fueron igualmente excluidos.
Debido a que las definiciones pueden presentar una variación entre los estudios, consideramos EMJ farmacorresistente como la persistencia de cualquier tipo de crisis (es decir, crisis mioclónicas, ausencia o crisis tónico-clónicas generalizadas) a pesar del tratamiento con FAE, independientemente de la duración del periodo de seguimiento definido por los autores para considerarlos libres de crisis. Se excluyen los casos de pacientes seudofarmacorresistentes, reportados por los autores de los estudios individuales, es decir, aquellos que presentan crisis debido al incumplimiento con el tratamiento, tratamiento inadecuado u otros factores no relacionados con el tratamiento.
Selección de estudiosEl proceso de selección de estudios para su inclusión en la revisión implicó diligenciar una base de datos en el programa Excel y eliminar títulos duplicados. Dos autores de la revisión (PS y JZ) examinaron todos los títulos, resúmenes y palabras clave de las publicaciones identificadas por las búsquedas, para evaluar la elegibilidad de los estudios. Se excluyeron las publicaciones que describían estudios que claramente no cumplían con los criterios de inclusión en esta etapa. Se recuperaron todos los artículos potencialmente relevantes y 2 revisores (PS y JZ) evaluaron de forma independiente el texto completo de cada artículo, según los criterios de selección preespecificados. Resolvimos los desacuerdos mediante discusión. Si persistían los desacuerdos, el tercer autor de la revisión (RP) arbitraba.
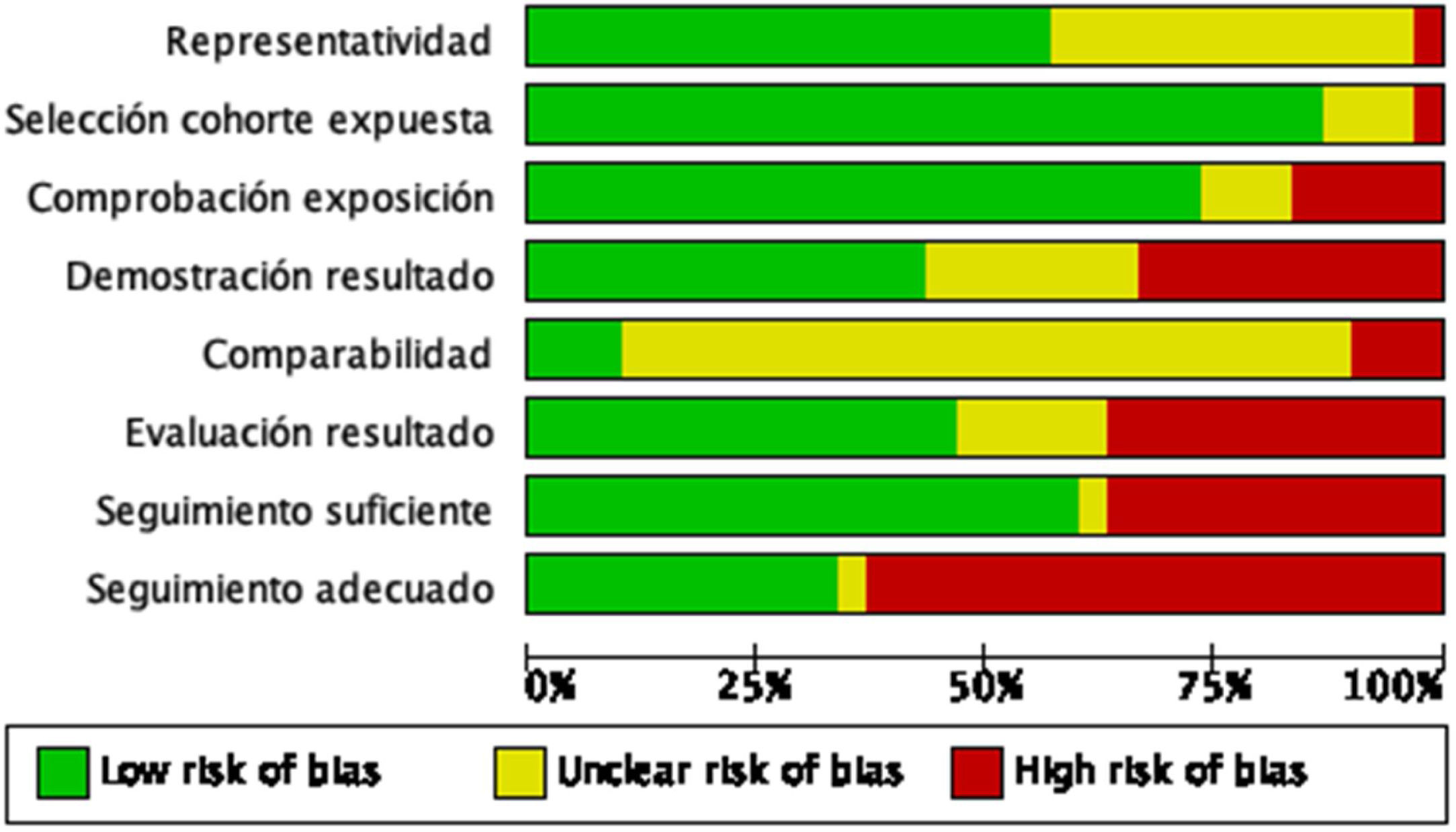
Evaluación de la calidad de los estudiosDos autores de la revisión (PS y JZ) evaluaron de forma independiente la calidad de los estudios incluidos mediante la escala de evaluación de la calidad de Newcastle-Ottawa. Esta escala se utiliza para evaluar 3 componentes principales: selección (Representatividad de la cohorte expuesta, Selección de la cohorte no expuesta, Comprobación de la exposición, Demostración de que el resultado de interés no estaba presente al inicio del estudio), comparabilidad (Comparabilidad de las cohortes sobre la base del diseño o análisis) y desenlaces (Evaluación del desenlace, seguimiento fue lo suficientemente largo para que ocurrieran los resultados y adecuado seguimiento de las cohortes). Se obtienen valores que van entre 0 a 9, donde se considera que los estudios tienen una alta calidad son aquellos con una puntuación≥5 estrellas y baja calidad cuando obtienen una puntuación<5 estrellas. Resolvimos cualquier desacuerdo mediante discusión.
Extracción y gestión de datosUn autor de la revisión (PS) extrajo de forma independiente en un formulario de Excel la siguiente información de los estudios incluidos, si estaban disponibles.
- 1.
Métodos: Diseño del estudio, país en donde se realizó y definición de estado libre de crisis.
- 2.
Participantes: Número total de participantes con EMJ, número total de participantes farmacorresistentes, número total de participantes con control de crisis, número total de pacientes con acido valproico, número total de pacientes con levetiracetam, número total de pacientes con lamotrigina, duración media del seguimiento.
Se utilizó Review Manager 5.4 (RevMan) para sintetizar los datos disponibles. El uso de un modelo de efectos fijos o de efectos aleatorios se definió principalmente de los resultados de la prueba estadística I2 para la heterogeneidad, donde se considera que los valores entre el 50% y el 75% representan una heterogeneidad moderada y aquellos>75% representan una alta heterogeneidad. Se considero que, si se presentaba una heterogeneidad baja, se utilizaría un modelo de efectos fijos, pero si se encontraba una heterogeneidad alta o moderada, se adoptaría un modelo de efectos aleatorios. Para la evaluación de la prevalencia de farmacorresistencia se utilizó el paquete MAJOR de JAMOVI versión 1.2.27.0. Como medida común de asociación inicialmente se presentan proporciones con sus respectivos intervalos de confianza del 95% (IC95%) para la prevalencia de farmacorresistencia entre los estudios y mediante RevMan, para cada estudio individual se evalúan las frecuencias absolutas de los eventos y al tratarse de datos dicotómicos se usa como medida de asociación común el OR como medida de resultado, con sus IC95%. El valor de significación fue p<0,05 para todos los análisis.
Análisis de subgruposSe realizaron análisis de subgrupos según los diferentes FAE empleados. Se consideró realizar análisis de subgrupos para ácido valproico vs. levetiracetam o lamotrigina con respecto al control de crisis, pero en los estudios no se encontraron datos estratificados, por lo que se realizaron los análisis independientes para cada uno de los FAE empleados.
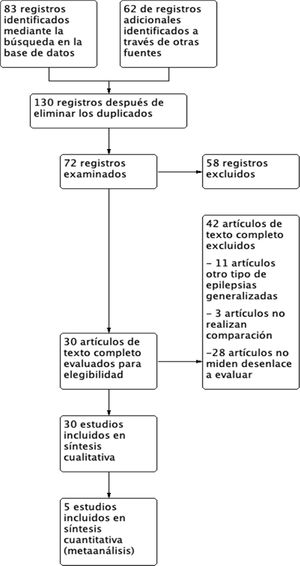
ResultadosSelección de los estudiosLa figura 1 muestra los resultados del proceso de búsqueda bibliográfica y selección de los estudios, que se realizó por última vez el 2 de septiembre de 2020. La búsqueda principal arrojó 145 artículos potenciales. Tras el proceso de selección, y posterior a la exclusión de los artículos duplicados y la aplicación de los criterios de inclusión y exclusión, se incluyó un total de 30 artículos para el metaanálisis de prevalencia, en donde se describen los resultados del tratamiento. Finalmente se seleccionan 5 artículos que contaban con la medida de asociación común para ser incluidos en el metaanálisis de FAE empleados y relación con el control de crisis.
Características de los estudios incluidos en el metaanálisisSe identificaron un total de 30 estudios, publicados entre 1995 y 2020, con un número total de 2770 participantes con EMJ, de los cuales 914 presentan EMJ farmacorresistente y 1856 se encontraban libres de crisis con el tratamiento antiepiléptico. Las características de los estudios incluidos en el metaanálisis se encuentran en la tabla 1. Los estudios se realizaron en su mayoría en Europa, pero podemos encontrar estudios en Latinoamérica, Asia y Norteamérica. El periodo de seguimiento varió entre uno y 35,5 años con una mediana de seguimiento de 11,4 años (rango intercuartílico: 2-16 años). La forma de definir a los pacientes libres de crisis no se presenta de forma regular en todos los estudios, con variación en la definición de libertad de crisis que van desde los 3 meses hasta los 15 años, con una mediana de un año (rango intercuartílico: 1-2 años).
Características de los estudios incluidos en el metaanálisis de prevalencia
| Estudio (referencia) | Año | País | Total, muestra | Pacientes evento | Pacientes control | Seguimiento (años) | Definición libertad crisis |
|---|---|---|---|---|---|---|---|
| Arntsen et al.30 | 2017 | Noruega | 40 | 19 | 21 | 31 | 5 años libre de crisis |
| Asadi-Pooya et al.31 | 2014 | Irán | 116 | 48 | 68 | 35,5 | 1 año libre de crisis |
| Ashmawi et al.32 | 2017 | Egipto | 69 | 20 | 49 | No reportada | 5 años libre de crisis |
| Ceyhan Dirican et al.33 | 2016 | Turquía | 28 | 4 | 24 | 2 | No reportada |
| Baykan et al.23 | 2008 | Turquía | 48 | 8 | 40 | 19,6 | Libre de todas las crisis al menos durante 5 años |
| Cação et al.9 | 2018 | Portugal | 240 | 121 | 119 | No reportada | Libre de crisis el año anterior |
| Chowdhury y Brodie26 | 2016 | Reino Unido | 186 | 15 | 171 | 14 | No presentar crisis durante 12 meses con un régimen de FAE sin cambios |
| Fernando-Dongas et al.7 | 2000 | Estados Unidos | 37 | 10 | 27 | No reportada | Libre de crisis con monoterapia con ácido o mioclonías ocasionales |
| Dragoumi et al.34 | 2013 | Grecia | 5 | 1 | 4 | 8,3 | 1 año libre de crisis |
| Geerts et al.35 | 2010 | Países Bajos | 7 | 3 | 4 | No reportada | 1 año libre de crisis |
| Gelisse et al.18 | 2000 | Francia | 155 | 24 | 131 | 17 | No reportada |
| Gesche et al.25 | 2017 | Dinamarca | 87 | 33 | 54 | No reportada | Ausencia de crisis de más de un año con la terapia actual |
| Gesche et al.36 | 2020 | Dinamarca | 172 | 50 | 122 | 15 | no reportada |
| Guaranha et al.37 | 2011 | Brasil | 65 | 40 | 25 | 5,7 | 2 años libre de crisis |
| Gürer et al.38 | 2019 | Turquía | 215 | 83 | 132 | 2 | Periodos libre de todas las crisis de al menos 2 años |
| Holland et al.39 | 2010 | Estados Unidos | 11 | 1 | 10 | No reportada | 3 meses libre de crisis |
| Gomez-Ibañez40 | 2017 | Londres | 69 | 35 | 34 | 2 | Sin crisis por 12 meses o 3 veces el periodo más largo sin crisis antes del inicio del tratamiento |
| Japaridze et al.41 | 2016 | Georgia | 78 | 7 | 71 | 1 | 1 año libre de crisis |
| Jayalakshmi et al.10 | 2014 | India | 201 | 38 | 163 | 7,2 | 2 años libre de crisis |
| Kleveland y Engelsen42 | 1998 | Noruega | 40 | 21 | 19 | No reportada | 1 año libre de crisis |
| Kostov et al.43 | 2007 | Noruega | 12 | 7 | 5 | No reportada | No reportada |
| Landvogt et al.44 | 2010 | Alemania | 12 | 5 | 7 | No reportada | No reportada |
| Létourneau et al.45 | 2010 | Canadá | 28 | 11 | 17 | No reportada | Libertad de crisis con el primer FAE |
| Martin et al.27 | 2019 | Alemania | 168 | 26 | 142 | 9 | Libre de tener crisis en régimen FAE un año independiente de la dosis |
| Mehndiratta y Aggarwal46 | 2002 | India | 103 | 20 | 83 | No reportada | 15 años libre de crisis |
| Nicolson et al.47 | 2004 | Reino Unido | 341 | 171 | 170 | No reportada | 1 año libre de crisis |
| Sapio et al.48 | 2015 | Francia | 53 | 28 | 25 | No reportada | No reportada |
| Sharpe y Buchanan49 | 1995 | Australia | 30 | 11 | 19 | No reportada | No reportada |
| Specchio et al.28 | 2006 | Múltiples países | 48 | 38 | 10 | 1,6 | Ausencia de todas las crisis durante 12 meses |
| Szaflarski et al.50 | 2010 | Estados Unidos | 106 | 16 | 90 | No reportada | 3 meses sin crisis |
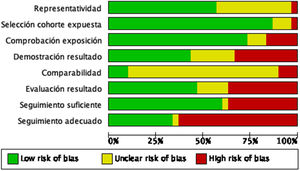
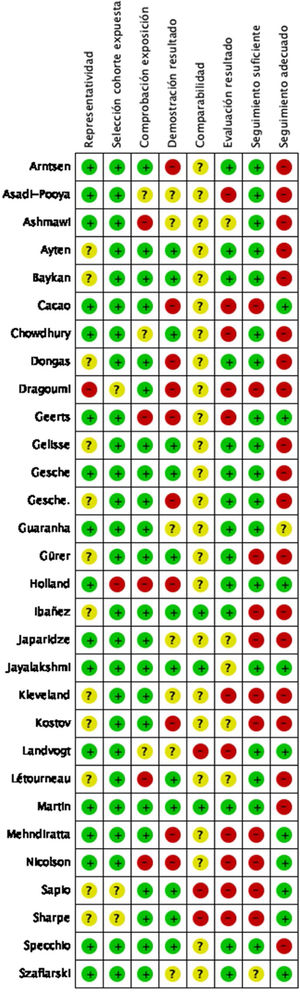
La mayoría de los estudios tuvieron un riesgo de sesgo bajo (19 estudios), obteniendo una puntuación≥5 puntos en la escala de evaluación de la calidad de Newcastle-Ottawa. En la figura 2 se puede observar el juicio de los autores de la revisión sobre cada riesgo de sesgo, expresados como porcentajes en todos los estudios incluidos y en la figura 3 se resume el riesgo de sesgo según el juicio de los autores sobre cada elemento de sesgo para cada estudio.
Las estimaciones individuales de los estudios y la estimación global de la prevalencia de EJM farmacorresistente se observa en la figura 4. El metaanálisis evidencia cómo el 34% (IC95%: 27-40%) de los participantes incluidos con EJM son farmacorresistentes. Esta proporción de participantes varía entre el 8% y el 79%, y la heterogeneidad entre los estudios es alta (I2=94,1%; IC95%: 27-40%; p<0,001).
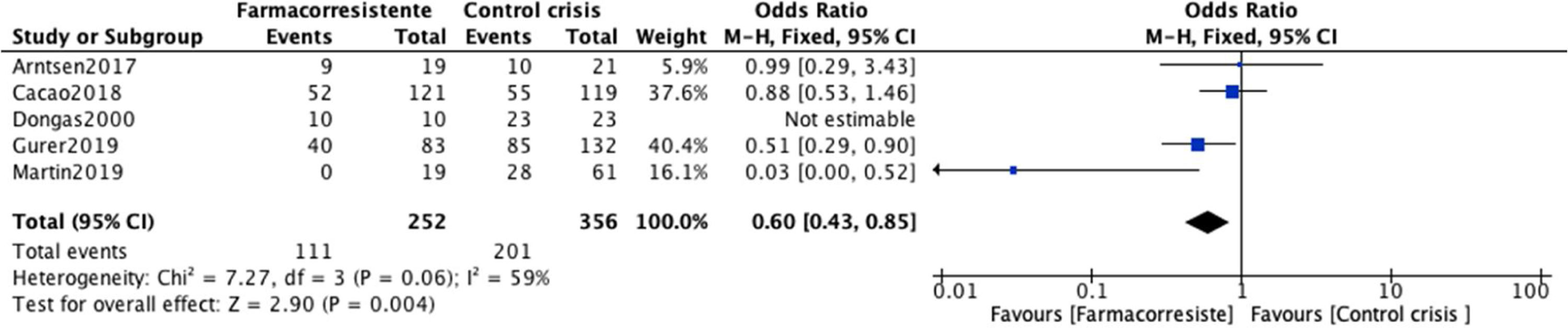
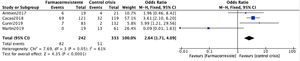
Metaanálisis del control de crisis según el antiepiléptico utilizadoPor la distribución de los datos en los estudios individuales, no es posible realizar una estimación general que compare el uso de ácido valproico vs. levetiracetam o lamotrigina. Es por esto por lo que se presenta la estimación global para control de crisis de cada uno de los FAE. Las estimaciones individuales de los estudios y la estimación general para el control de crisis con el uso de ácido valproico se muestra en la figura 5. Cinco estudios, que incluyeron en total 2085 participantes con EMJ, se incluyeron en el análisis de ácido valproico7,9,27,30,38. Todas las estimaciones del OR para el control de crisis con ácido valproico estaban por debajo de la unidad, lo que causa un OR combinado de 0,60 (IC95%: 0,43-0,85). Por lo tanto, la medida se encuentra a favor del grupo de farmacorresistencia. Es decir, los participantes que recibieron ácido valproico tienen un riesgo mayor de presentar farmacorresistencia que los que no recibían ácido valproico; sin embargo, este incremento no fue estadísticamente significativo (p=0,06). Los OR para los estudios individuales se encuentran entre OR=0,03 hasta OR=0,99; y la heterogeneidad entre los estudios para el control de crisis fue moderada (Chi2=7,27; p=0,06; I2=59%).
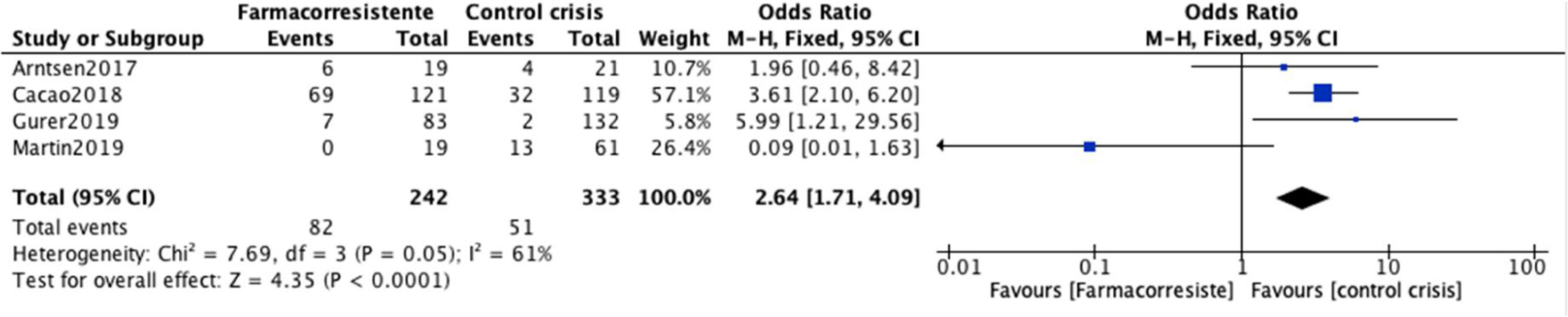
Las estimaciones individuales de los estudios y la estimación general para el control de crisis con el uso de levetiracetam se muestran en la figura 6. Cuatro estudios, que incluyeron en total 2048 participantes con EMJ, se incluyeron en el análisis de levetiracetam9,27,30,38. Tres de los 4 estudios presentan OR para el control de crisis con levetiracetam por encima de la unidad, lo que causa un OR combinado de 2,64 (IC95%: 1,71-4,09). Por lo tanto, las medidas se encuentran a favor del grupo control. Es decir, los participantes que recibieron levetiracetam tienen un riesgo mayor de presentar control de crisis que los que no recibían levetiracetam, siendo este incremento estadísticamente significativo (p=0,05). Los OR para los estudios individuales se encuentran entre OR=0,09 hasta OR=5,99; y la heterogeneidad entre los estudios para el control de crisis fue moderada (Chi2=7,69; p=,05; I2=61%).
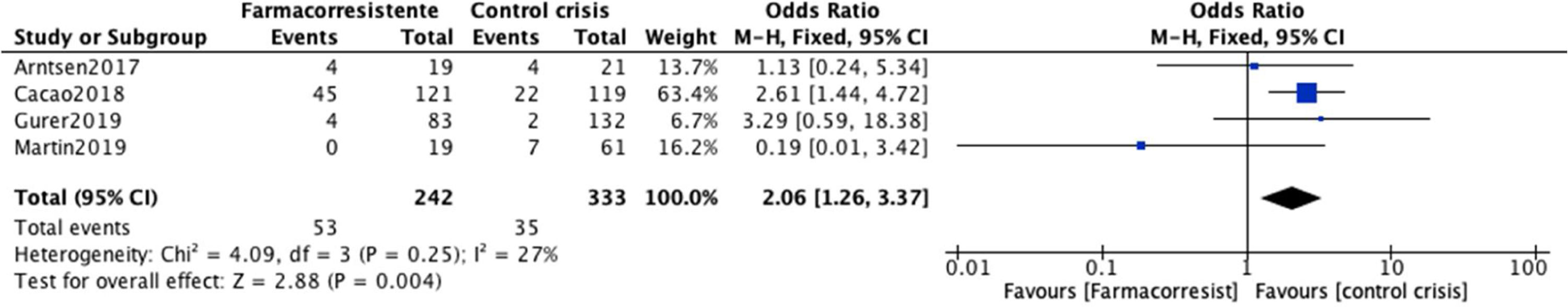
Por último, las estimaciones individuales de los estudios y la estimación general para el control de crisis con el uso de lamotrigina se muestran en la figura 7 Cuatro estudios, que incluyeron en total 2048 participantes con EMJ, se incluyeron en el análisis de lamotrigina9,27,30,38. Tres de los 4 estudios presentan OR para el control de crisis con lamotrigina por encima de la unidad, lo que causa un OR combinado de 2,06 (IC95%: 1,26-3,37). Por lo tanto, las medidas se encuentran a favor del grupo control. Es decir, los participantes que recibieron lamotrigina tienen un riesgo mayor de presentar control de crisis que los que no recibían lamotrigina; sin embargo, este incremento no fue estadísticamente significativo (p=0,25). Los OR para los estudios individuales se encuentran entre OR=0,19 hasta OR=3,29; y la heterogeneidad entre los estudios para el control de crisis fue baja (Chi2=4,09; p=0,25; I2=27%).
DiscusiónLa EMJ afecta a aproximadamente 8,5 millones de personas en todo el mundo14; es considerada la causa más común de crisis epilépticas hereditarias en personas con epilepsia en la población en general15. Los datos epidemiológicos reportados podrían estar subestimados puesto que a menudo este síndrome no se ha considerado una entidad fácil de diagnosticar1. Para EMJ farmacorresistente aún se tienen múltiples interrogantes en cuanto a su heterogeneidad genética, su presentación clínica y su tratamiento, con pocos estudios al respecto. Poco se conoce de las características del síndrome farmacorresistente y es allí en dónde obtener resultados podría brindar posibles respuestas e hipótesis para nuevos estudios y tratamientos más adecuados.
Hoy en día se ha puesto en duda el concepto que indica que la respuesta al tratamiento con FAE apropiados es buena16, y cómo los pacientes necesitan tratamiento de forma indefinida debido a una alta tasa de recaída17, ya que se ha evidenciado que algunos pacientes, incluso con el tratamiento antiepiléptico adecuado y estilos de vida óptimos, no logran el control de crisis18 y se les cataloga como farmacorresistentes; mientras que por otro lado, grupos de pacientes se encuentran libres de crisis sin tratamiento6,19–23. Se conoce que aproximadamente un tercio de los pacientes con EMJ no responden por completo y se vuelven refractarios al tratamiento farmacológico a pesar del uso de múltiples fármacos6 y aún no se ha encontrado una explicación neurobiológica para ello.
Una vez que se ha realizado el diagnóstico de EMJ, el médico debe tomar decisiones de manejo junto con el paciente. Se requiere un manejo especial dado que su epilepsia comienza en edades vulnerables, como el periodo de la adolescencia y, en consecuencia, se podrían generar problemas con el estilo de vida, lo cual típicamente puede aumentar la probabilidad de crisis5. La mayoría comienzan el tratamiento en base a una historia clínica clara, especialmente cuando ya ha ocurrido una crisis tónico-clónica generalizada, y generalmente se tiene en cuenta el género y el peso para la elección del tratamiento. Los hombres generalmente serán tratados con ácido valproico mientras que las mujeres podrán ser tratadas con ácido valproico o se planteará el inicio de levetiracetam o lamotrigina5.
La primera línea de tratamiento es el uso de monoterapia con ácido valproico, lo cual conduce al control total de crisis en aproximadamente 80% de los pacientes. La razón principal para tratar a los pacientes con EMJ con otros FAE además del ácido valproico es la frecuencia de efectos secundarios como temblores, aumento de peso y pérdida de cabello18. Se considera de forma tradicional que con el desarrollo de nuevos FAE se esta logrando un mejor control de crisis en algunos síndromes epilépticos. Sin embargo, siguen existiendo pacientes que no responden al tratamiento adecuadamente24, y como lo muestra nuestra investigación, las prevalencias de epilepsia farmacorresistentes siguen siendo muy similares a las reportadas años atrás, con porcentajes que se encuentra alrededor del 34% (IC95%: 27%-40%); por lo tanto, la farmacorresistencia en pacientes con diagnóstico de EMJ sigue encontrándose entre el 15% y podría llegar a ser hasta del 50% en algunos centros de referencia7–9.
Si bien se han analizado algunas cohortes de pacientes en donde se ha encontrado que la ocurrencia combinada de los 3 tipos de crisis y los trastornos psiquiátricos coexistentes son factores de riesgo asociados con la resistencia a los medicamentos10, hoy en día aún existe poca literatura que confirme en qué medida estos factores aumentan el riesgo de farmacorresistencia, tanto como factores únicos o en combinación con otras características clínicas o genéticas, y más aún cuál sería el tratamiento ideal a emplear. En nuestro metaanálisis observamos cómo los pacientes en tratamiento con ácido valproico tienen valores a favor del grupo farmacorresistente con OR=0,60 (IC95%: 0,43-0,85). Es decir, los participantes que recibieron ácido valproico tienen un riesgo mayor de presentar farmacorresistencia que los que no recibían ácido valproico. Sin embargo, este resultado no fue estadísticamente significativo (p=0,06) y vale la pena mencionar que este análisis no permitió identificar a los pacientes en politerapia versus los pacientes en monoterapia con ácido valproico, lo que podría comportarse como un factor de confusión. Hay que tener en cuenta que incluso algunos autores han declarado que hoy en día, a pesar de los múltiples FAE disponibles, no se debería declarar a los pacientes con EMJ como resistentes a los medicamentos a menos que estos hayan sido tratados adecuadamente con ácido valproico25; por otro lado, algunos autores muestran cómo las características clínicas del grupo de pacientes que responde al ácido valproico son similares a las reportadas por Janz en sus primeras descripciones, mientras que el grupo resistente podría presentar una mayor incidencia de características atípicas que incluyen anormalidades asimétricas en el electroencefalograma, semiología atípica de crisis y anormalidades en la neuroimagen7.
Algunos estudios han indicado alternativas diferentes al ácido valproico para el tratamiento de EMJ, como el levetiracetam26, con datos que reportan hasta un 42% de control durante más de un año de seguimiento27. Es por ello que se ha considerado que este fármaco está elegido correctamente para estos pacientes25. Nuestros hallazgos indican respaldar estas afirmaciones, donde encontramos que los pacientes que se encuentran en tratamiento con levetiracetam presentan OR a favor del grupo control de crisis 2,64 (IC95%: 1,71-4,09; p=0,05), datos que fueron estadísticamente significativos, pero que deben ser interpretados con precaución debido a la heterogeneidad moderada encontrada en los estudios individuales (I2=61%); lo que también podría estar de acuerdo con informes que han demostrado un efecto positivo del levetiracetam en pacientes con EMJ que no responden a los FAE convencionales como el ácido valproico28. El levetiracetam, por tanto, es un FAE prometedor para este tipo de epilepsia, y que ya ha sido aprobado en ensayos clínicos aleatorizados como tratamiento en epilepsias generalizadas28. Adicionalmente consideramos que dada su eficacia anticonvulsiva demostrada, puede ser una opción adecuada a considerar especialmente en mujeres en edad fértil, en las que el ácido valproico podría considerarse potencialmente peligroso a menos que se cumplan con las condiciones estrictas de prevención del embarazo. Se propone, por tanto, el levetiracetam como una opción favorable para el tratamiento de la EMJ farmacorresistente.
Por otro lado, la lamotrigina si bien se ha mostrado como una buena opción terapéutica en pacientes con EMJ26, ha evidenciado datos contradictorios, al compararse con el ácido valproico o con el levetiracetam, con datos que reportan un control de hasta 15% en un seguimiento mayor de un año27, en comparación con otros autores que indican que ninguno de los pacientes resistentes al ácido valproico respondió a la lamotrigrina25. Nuestros resultados evidencian cómo los pacientes con uso de lamotrigina podrían estar a favor del control de crisis, sin embargo, estos hallazgos no fueron estadísticamente significativos.
La falta de respuesta debe ser analizada teniendo en cuenta los aspectos farmacocinéticos y farmacodinámicos. Entendiéndose la resistencia farmacocinética como aquella que se produce cuando no se alcanzan concentraciones del FAE necesarias para lograr la eficacia clínica, y resistencia farmacodinámica cuando se producen alteraciones en los blancos terapéuticos en los que deben actuar los FAE. Esta variabilidad en la respuesta se puede atribuir a múltiples aspectos entre los que se encuentran: los diferentes polimorfismos de las enzimas metabolizadoras y sus inductores, la sobreexpresión de las sustancias transportadoras como la glucoproteína P y las proteínas asociadas a la resistencia a múltiples medicamentos, los polimorfismos de las enzimas que intervienen en la fase ii del metabolismo y en la conjugación de los FAE, y los polimorfismos en los lugares de acción, como los canales iónicos y los receptores GABA y glutamato, entre otras posibles alteraciones24. Por esto, es importante indicar que nuestra revisión no analizaba la farmacorresistencia desde sus posibles causas fisiopatológicas y que tiene las limitaciones propias de los estudios individuales incluidos, al ser en su mayoría estudios observacionales, aspectos que podrían evaluarse en próximos estudios.
Es por ello que, a pesar de los significativos avances, la evidencia actual sigue mostrando hallazgos inconsistentes en cuanto al estudio de la EMJ, específicamente de la farmacorresistente, en donde al parecer lo que está claro es que se trata de un síndrome de epilepsia heterogénea, con un patrón complejo, y con una respuesta al tratamiento igualmente variable29. Es por esto importante seguir estudiando este subtipo del síndrome para brindar un adecuado tratamiento y enfoque pronóstico igualmente apropiado.
FinanciaciónProyecto de mínima cuantía modalidad. Investigación Universidad CES. Código del proyecto: INV.022021.001 Medellín. Colombia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.