El kindling es un modelo que consiste en la repetición de estímulos para producir crisis epilépticas espontáneas (CEE).
ObjetivoDistinguir efecto convulsivo y subconvulsivo en ratones viejos y jóvenes, para evaluar las diferencias entre la ictogénesis y epileptogénesis.
Materiales y métodosSe realizó kindling rápido utilizando pentilentetrazol (PTZ) en ratones C57BL/6. Utilizando dosis convulsivas (C) (75 mg/kg en una inyección) y subconvulsiva (SC) (10 mg/kg cada cinco minutos por 30 minutos, siendo un total de cinco inyecciones). Se conformaron cuatro grupos, sujetos de experimentación (SE) jóvenes (<32 semanas; C = 8; SC = 9) y 16 SE viejos (>32 semanas; C = 8; SC = 8). Utilizando Score de Racine (SR). Estadística descriptiva.
ResultadosRealizamos 16 protocolos C y 17 protocolos SC. El tiempo de latencia a fase 1 en segundo es menor en C viejos (50,5 seg) que en C jóvenes (170,3). En SC, fue mayor en el grupo de viejos 170,3 vs. jóvenes 105,5 (p = 0,001). El grupo C jóvenes presentaron mayor tiempo durante fase 1 a 3, y C viejos durante fase 4 y 5. Los SC jóvenes presentan mayor duración en fase 2, a diferencia de SC viejos con duración lineal en diferentes fases SR (p = 0,001). No hubo diferencias en muerte espontánea.
ConclusiónEl tiempo de latencia a fase 1 fue menor en SE viejos convulsivos y mayor que los SE jóvenes SC, sugiriendo mayor ictogénesis y menos epileptogénesis en la población vieja. La tendencia en SE viejos a permanecer más tiempo en fases 4 y 5 en dosis convulsivas sugiere mayor tendencia a ictogénesis y mayor severidad de las CE.
Kindling Model consist sequential injections of a dose Pentylenetetrazole causing spontaneous seizures. (ES)
ObjectivesCompare convulsive and subconvulsive effect in old and young mice, to evaluate the differences between ichthyogenesis and epileptogenesis.
MethodsRapid kindling model was performed using pentylenetetrazole in C57BL/6 mice. Using convulsive doses (C) (75 mg/kg in one injection) and sub-convulsive (SC) (10 mg/kg every 5 minutes for 30 minutes, for a total of 5 injections). Four groups were formed, young mouse (<32 weeks; C = 8; SC = 9) and 16 Old mouse (>32 weeks; C = 8; SC = 8). Using Racine Score. Descriptive statistics.
ResultsHas been made 16 C protocols and 17 SC protocols. The latency time to phase 1 in sec. it is lower in old C (50.5 sec) than in young C (170.3). In SC, it was higher in the old group 170.3 vs young 105.5 (P = 0.001). Young C group presented longer time during Phase 1 to 3, and old C group during phase 4 and 5. Young SC presented longer duration in phase 2, unlike old SC with linear duration in different SR phases (P = 0.001). There were no differences in spontaneous death in all groups.
ConclusionLatency time to Phase 1 was shorter in old convulsives and longer than young SC, indicative greater ichthyogenesis and less epileptogenesis in the old population. Tendency in the elderly to stay longer in phases 4 and 5 in convulsive doses suggests a greater tendency to ichthyogenesis and greater severity of spontaneous seizures.
La epilepsia es un trastorno del cerebro caracterizado por una predisposición para generar crisis epilépticas (CE) y por las consecuencias neurobiológicas, cognitivas, psicológicas y sociales de esta condición1. Es una patología de alta frecuencia, con una incidencia en el mundo de 20-70/100.000 año, y puede variar según la región geográfica2.
Existen varios modelos experimentales para el estudio de la epilepsia, uno de los más ampliamente utilizados es el llamado kindling3,4, que consiste en la administración repetida de estímulos químicos o eléctricos5-7 dando lugar a una progresiva sensibilización, generando crisis que eventualmente desencadenan crisis epilépticas recurrentes (CRE) espontáneas8.
El modelo de kindling químico se fundamenta en la administración repetida de fármacos hasta alcanzar CE. Ejemplos de sustancias químicas que se utilizan en kindling en sujetos de experimentación (SE) incluyen pentilentetrazol (PTZ), FG-7142 y picrotoxina, entre otros9-11.
La herramienta más ampliamente difundida para evaluar clínicamente este modelo, se denomina Score de Racine (SR)12, es una escala comportamental, validada en SE para analizar CE en modelos de kindling. El SR posee distintas etapas que progresan en la etapa 0 a la etapa V, están basadas en el comportamiento del animal luego del estímulo (tabla 1).
Score de Racine
| Etapa | Comportamiento |
|---|---|
| 0 | Moverse, explorar, arreglarse. |
| I | Mirada en blanco y permanece quieto; batidos de perro mojado. |
| II | Cabeza asintiendo; movimientos clónicos de boca/mandíbula; posición de lordosis. |
| III | Clonus de las extremidades anteriores o sin clonus de las extremidades anteriores; cola recta, todas las extremidades estiradas con pequeños rebotes (movimiento de palomitas de maíz). |
| IV | Alzamiento y clonus de la extremidad anterior; el animal puede caerse, pero debería poder volver rápidamente a su posición vertical. |
| V | Convulsión tónica/clónica generalizada; progresión rápida del clonus de la extremidad anterior a caerse sin recuperación de la posición vertical. |
La epileptogénesis es un proceso continuo mediante el cual una red neuronal, previamente normal, se ve alterada funcionalmente con un aumento de la susceptibilidad a las CE, por lo que presenta una mayor probabilidad de generar CRE13. La epileptogénesis se refiere al desarrollo y extensión de tejido capaz de generar CRE, iniciando una condición epiléptica y/o progresión de la epilepsia después de que se establece. No solamente se refiere al periodo de tiempo entre la noxa epileptogénica y el diagnóstico de epilepsia14,15–17. Fisiopatológicamente esta reorganización cerebral puede incluir pérdidas neuronales, cambios en la expresión de canales activados por voltaje, receptores, alteraciones metabólicas, procesos inmunológicos y gliosis.
La ictogénesis se define como los procesos de transición del estado interictal a una crisis epiléptica. En ella se incluye un estado preictal, con signos clínicos específicos y una electrofisiología distinta que puede brindar oportunidades para anticipar, o incluso prevenir, las CE. Los mecanismos biológicos de la ictogénesis siguen siendo poco conocidos y variables18.
Ambos fenómenos pueden ser estudiados a través de modelos de kindling. La inyección de una única dosis destinada a producir CE nos permite observar el proceso de ictogénesis, mientras que las inyecciones repetidas de dosis menores hasta generar CRE permiten evaluar el proceso de epileptogénesis.
Los procesos de epileptogénesis e ictogénesis aún no se han terminado de comprender debido a la gran cantidad de variables que pueden influir sobre los mismos. Los modelos de kindling son modelos que permiten estudiar clínica, eléctrica y patológicamente estos procesos. Nuestra experiencia intenta evaluar dichos procesos a través de dos protocolos diferentes. Valorando dos grupos de SE de distintas edades con un protocolo de kindling químico rápido con dosis convulsivas y dosis subconvulsivas repetidas y comparar ambos procesos (epileptogénesis vs. ictogénesis)18.
Materiales y métodosEl estudio se llevó a cabo en la provincia de San Luis, Argentina, en el campus de la Universidad Católica de Cuyo con sede San Luis (UCC-SL).
Se realizó kindling rápido utilizando PTZ en ratones C57BL/6, con dosis convulsivas (C) (75 mg/kg en una inyección) y subconvulsiva (SC) (10 mg/kg cada cinco minutos por 30 minutos, siendo un total de cinco inyecciones). Se conformaron cuatro grupos, 17 SE jóvenes (< 32 semanas; C = 8; SC = 9) y 16 SE viejos (> 32 semanas; C = 8; SC = 8). Todo el procedimiento fue grabado en video para la discusión y evaluación luego mediante el SR.
El agua y los alimentos estaban disponibles para el consumo ad libitum. Se busca el mínimo dolor y sufrimiento, y una cantidad reducida de animales. Para la eutanasia, los animales se anestesiaron profundamente con clorhidrato de ketamina y xilazina (200 mg/kg + 10 mg/kg; intraperitoneal) antes de la muerte por decapitación.
Criterios de inclusiónRatones cepa C57BL/6 > 32 Semanas y < 32 Semanas. Sin patología de base y cuidado extremo de bioterio.
Manejo de animalesLa investigación tiene la aprobación del comité de bioética de la Universidad Católica de Cuyo (sede en San Juan) y todos los investigadores conocen y cumplen con los requisitos éticos, legales y jurídicos, establecidos en las normas bioéticas nacionales -Disposición ANMAT 5330/97- e internacionales - Código de Nüremberg, Declaración de Helsinki y sus modificaciones, Declaración Universal sobre Genoma Humano y Derechos Humanos aprobada por la Conferencia General de la UNESCO, del 11 de noviembre de 1997. Se han seguido las directrices del ARRIVED 2.0. Protocolo utilizado adaptado por Musto et al., 201519-21.
Susceptibilidad a las CE:
- 1.
Cada animal se colocó en una cámara de observación acrílica individual durante 30 minutos antes y después de la inyección de PTZ, un antagonista del receptor del subtipo A del ácido γ-aminobutírico A (GABA-A), Sigma, St. Louis, MO, EE. UU.) y clínicamente se evaluó de acuerdo con la puntuación de Racine12.
- 2.
Protocolo sub convulsivo: el PTZ se inyectó cinco veces por vía intraperitoneal cada 5 min (10 mg/kg).
- 3.
Protocolo convulsivo: se inyectó una dosis convulsiva de PTZ (75 mg/kg, IP) una única vez, luego se observó el comportamiento del SE.
- 4.
Se cuantificó el tiempo de latencia en segundos a la fase 1 y la gravedad de las crisis se clasificó de acuerdo con el SR (Musto et al., 2015).21
- 5.
Se observó a los animales antes (30 minutos, línea de base), durante y después de las inyecciones continuas de PTZ (30 minutos estimados) o inyección única según el caso. El ruido ambiental se mantuvo a un nivel mínimo. Se utilizó una cámara de video para grabar cada ratón para monitorear la actividad de las CE después de la inyección de PTZ.
- A
Preparación de PTZ
- 1.
Se disolvió 2 mg/mL PTZ en solución fisiológica NaCl 0,9%.
- 2.
Dosis convulsivas de PTZ (75 mg/kg) vía intraperitoneal (IP).
- 3.
Dosis subconvulsivas (10 mg/kg - IP).
- A
Inyección de PTZ
- 1.
Se realizó la experimentación entre las 9:00 a.m. y las 15:00 p.m. en tres días.
- 2.
Se obtuvo el peso corporal del SE.
- 3.
Cada animal se colocó en una cámara de observación acrílica individual durante 30 minutos previos a la inyección.
- 4.
Durante el periodo de adaptación se calculó el volumen de solución de PTZ para la inyección en función del peso corporal del animal y la dosis de inyección previamente determinada.
- 5.
Se inyectó el PTZ por vía intraperitoneal con una jeringa de 1 mL a una aguja de calibre 26 G en el cuadrante izquierdo o derecho del abdomen del animal. Evitando inyectarse en la línea media y en los casos de repetición de dosis, evitar cambiar el sitio de punción.
- 6.
Se observaron los comportamientos de los animales 30 minutos después de la administración de PTZ y se clasificó el comportamiento de acuerdo con el SR in vivo para luego compararlo con los videos semanas después de la experimentación.
- 7.
Se realizó la eutanasia del SE.
Los datos de cada experimento se promediaron y se expresaron como media ± SD (standard deviation). Se realizó estadística descriptiva, se utilizó X2, prueba de Kruskal-Wallis, prueba T y ANOVA para la comparación de grupos. Se llevó a cabo el cálculo de tamaño muestral con base en comparaciones previas en dos poblaciones de ratones de distintas edades22, para un poder de 80%, con error alfa de 5%, con un mínimo de tres SE por grupo. Se utilizó StatsDirect (v3.2.7).
ResultadosSe realizaron 16 protocolos de kindling convulsivos y 17 subconvulsivos, quedando configurados los siguientes grupos, SE subconvulsivos jóvenes n = 9, SE convulsivos jóvenes n = 8, SE subconvulsivos viejos n = 8 y SE convulsivos viejos n = 8, no existen diferencias estadísticamente significativas en la cantidad de SE de cada grupo (tabla 2).
Comparación de SE en protocolos convulsivo y subconvulsivo
| Convulsivo | Subconvulsivo | Valor de p | |
|---|---|---|---|
| Jóvenes | 8 (45%) | 9 (55%) | p = 0,99 # |
| Viejos | 8 (50%) | 8 (50%) | |
| Peso | 25,37 (SD 4,77) | 24,8 (SD 3,9) | p = 0,8 * |
| Sexo | 9 (52,94%) | 10 (58.8%) | p = 0,94 # |
| Latencia a 1 | 60,31 (SD 34,66) | 136 (SD 94) | p =0,01 * |
| Mayor fase alcanzada | 4,68 (SD 0,47) | 3 (SD 1,2) | p =0,0001 * |
| Muerte espontánea | 4 (25%) | 2 (11,7%) | p = 0,5 # |
| Duración fase 1 | 68,12 (SD 66,46) | 187,5 (SD 197) | p =0,04 * |
| Duración fase 2 | 100,43 (SD 148,46) | 943,8 (SD 618) | p =0,0001 * |
| Duración fase 3 | 260,87 (SD 346,49) | 335 (SD 461) | p = 0,5 * |
| Duración fase 4 | 381,37 (SD 354,24) | 13,7 (SD 43) | p =0,001 * |
| Duración fase 5 | 530,31 (SD 608,43) | 77,5 (SD 234) | p =0,006* |
#: X2; *: T apareado.
Se encontró diferencia significativa entre el peso de los SE jóvenes y los SE viejos (p < 0,005), no encontrando diferencias entre el peso de los SE en ambos protocolos. No se encontraron diferencias significativas en el sexo de los SE en los cuatro grupos.
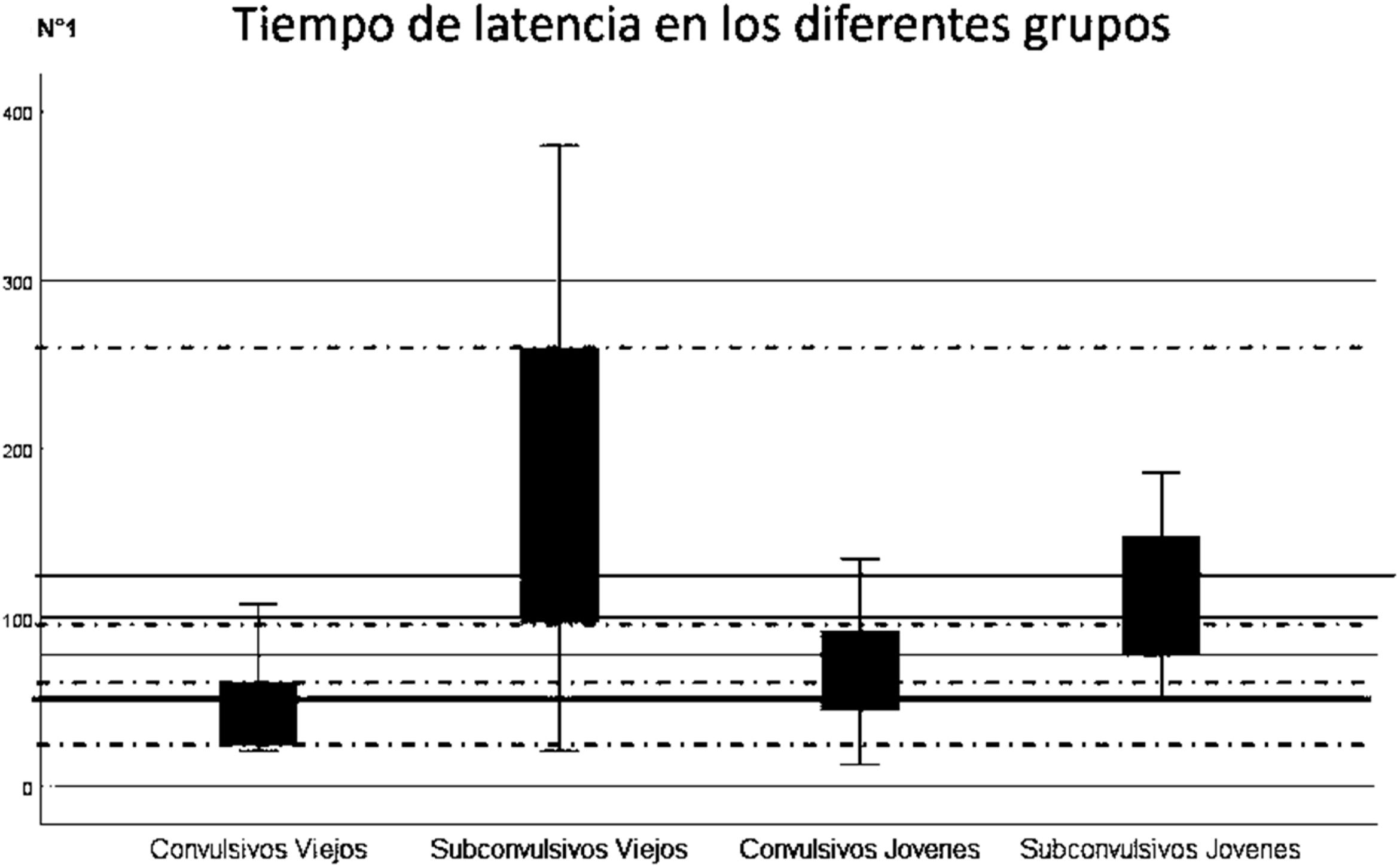
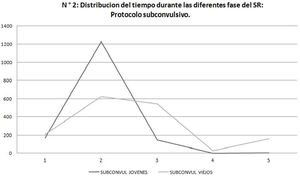
El tiempo medio de latencia a fase 1 (en segundos) fue de 88,8 (SD 45,2) para los SE jóvenes y de 110,4 (SD 107) para los SE viejos. El análisis de latencia a fase 1 en los grupos mostró una media de 170,3 segundos en SE convulsivos jóvenes y de 50,5 segundos en SE convulsivos viejos; y de 105,5 segundos para SE subconvulsivos jóvenes y 170,3 segundos para SE subconvulsivos viejos, encontrándose diferencias significativas entre los grupos (fig. 1 y tabla 3).
Comparación entre SE jóvenes (< 32 semanas) y viejos (> 32 semanas)
| Convulsivos jóvenes | Convulsivos viejos | Subconvulsivos jóvenes | Subconvulsivos viejos | Valor de p | |
|---|---|---|---|---|---|
| Latencia a 1 | 170,37 (SD 125,03) | 50,5 (SD 28) | 105,5 (SD 45) | 170,3 (SD 125) | p =0,01 æ |
| Mayor fase alcanzada | 3,5 (SD 1,30) | 4,87 (SD 0,35) | 2,5 (SD 1) | 3,5 (SD 1) | p =0,0001 æ |
| Muerte espontánea | 1 (12,5%) | 3 (37,5%) | 1 (11%) | 1 (12,5%) | p = 0,1 # |
| Duración fase 1 | 207 (SD 248,76) | 67,62 (SD 67) | 170,3 (SD 153) | 207 (SD 248) | p =0,001 ø |
| Duración fase 2 | 627 (SD 612,20) | 62,25 (SD 80) | 1225,5 (SD 497) | 627 (SD 612) | |
| Duración fase 3 | 544,5 (SD 533,26) | 118 (SD 142) | 148,7 (SD 305) | 544 (SD 533) | |
| Duración fase 4 | 29,12 (SD 62,54) | 247 (SD 354) | 0 (SD 0) | 29 (SD 62) | |
| Duración fase 5 | 160,12 (SD 333,41) | 649 (SD 723) | 4,2 (SD 12) | 160 (SD 333) |
æ: Anova One Way; ø: Kruscas Wallis; #: X2.
El tiempo de latencia resultó mucho mayor en los SE convulsivos jóvenes que en los SE convulsivos viejos, sin embargo, en el protocolo de subconvulsivos es el subgrupo de SE viejos el que demoró mayor tiempo en alcanzar fase 1 entre todos los grupos.
La mayor fase alcanzada fue en promedio 4,1 (SD 0,9) para SE viejos, siendo mayor comparada a la de los SE jóvenes que fue de 3 (SD 0,7), con una diferencia estadísticamente significativa (p = 0,04). En el grupo de convulsivos viejos la mayor fase alcanzada media fue de 4,87 (SD 0,35) y de 3,5 (SE 1,30) para convulsivos jóvenes, mientras que en el protocolo subconvulsivo los SE viejos alcanzaron una media de 3,5 (SD 1) y de 2,5 (SD 1) para SE subconvulsivos jóvenes, siendo los de menor etapa alcanzada, con diferencia significativa entre los grupos (p < 0,001).
Los SE viejos alcanzaron significativamente mayores fases en el SR. No hubo diferencia estadísticamente significativa para la variable de muerte espontánea entre los grupos.
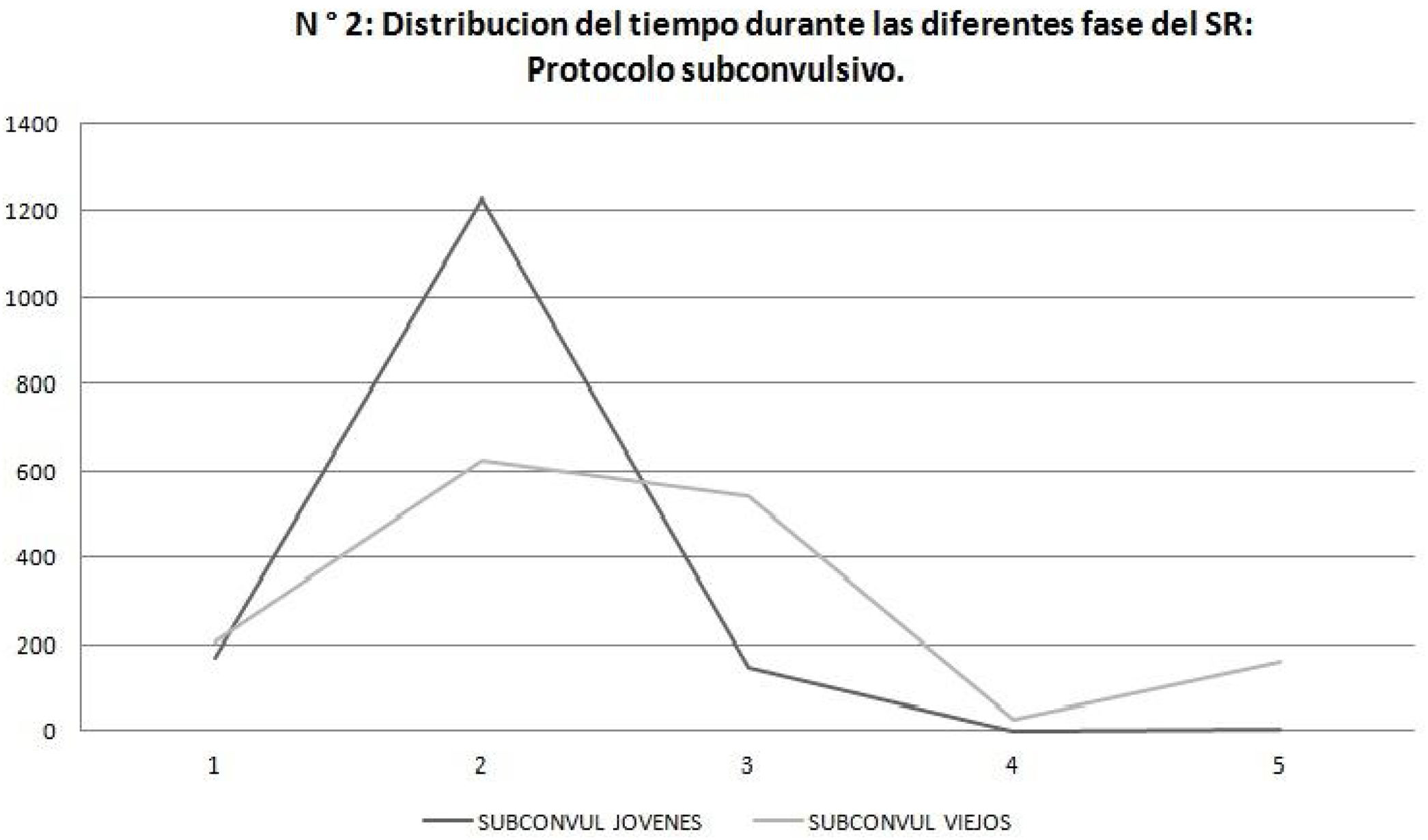
El análisis de duración de las fases evidenció que en el protocolo subconvulsivo los SE jóvenes estuvieron más tiempo en fase 2 del SR comparado con los SE viejos que presentan una duración más uniforme en las diferentes fases (fig. 2). (p = 0,001).
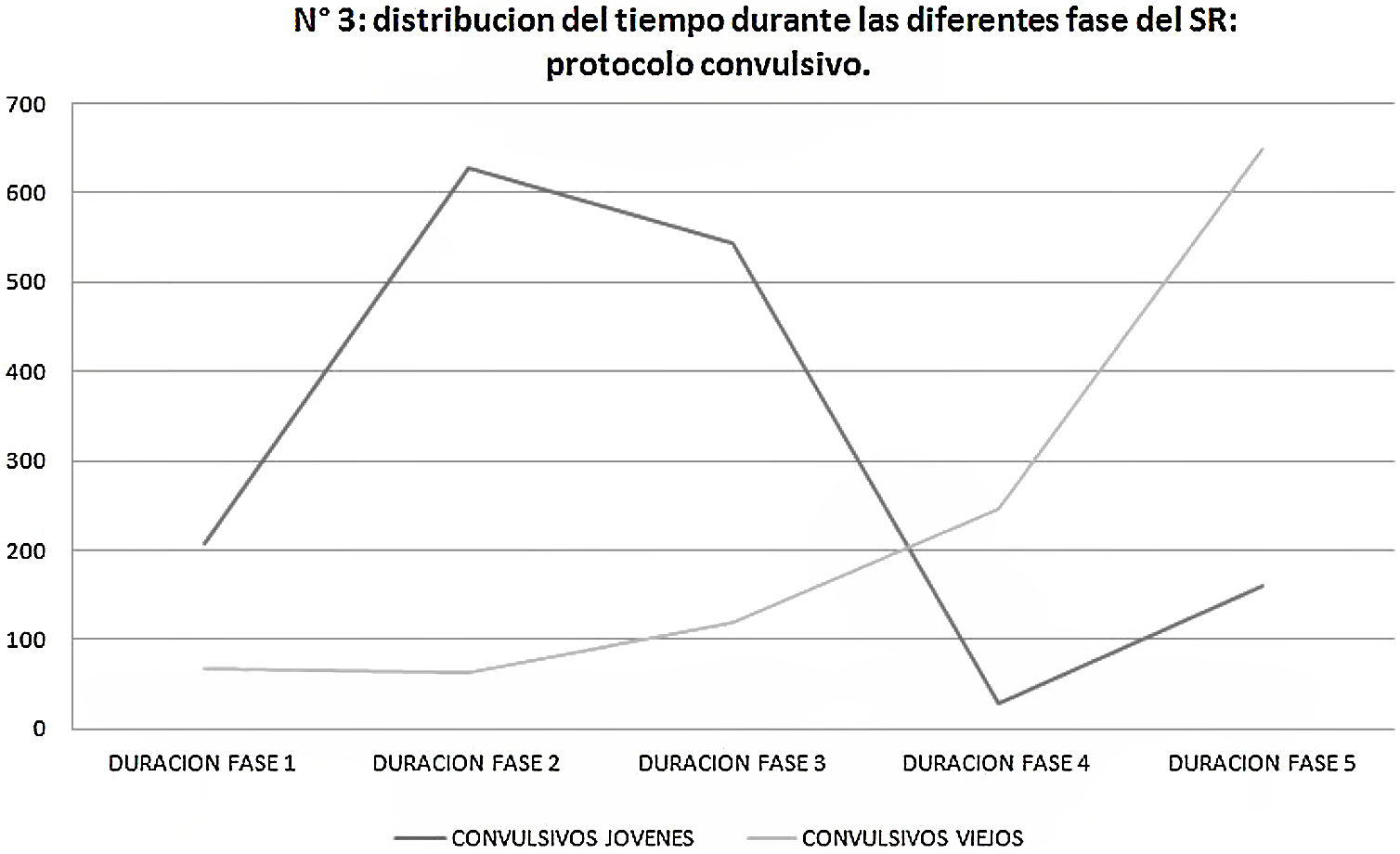
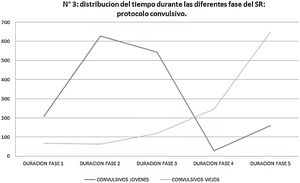
En cuanto al protocolo convulsivo, cabe destacar que los SE jóvenes estuvieron más tiempo durante las fases 1 a 3 del SR, mientras que los SE viejos estuvieron más tiempo durante las fases 4 y 5 (fig. 3).
ConclusiónEl número de SE es adecuado y los grupos no muestran sesgo de peso o sexo. La variable tiempo de latencia a fase 1 evidenció un comportamiento opuesto en ambos protocolos. En el protocolo convulsivo los SE mostraron significativamente menos tiempo que el resto de los grupos, mientras que en grupo viejos subconvulsivos este tiempo se prolonga incluso más que en los SE jóvenes. Esto sugiere que en poblaciones de ratones viejos el proceso de ictogénesis parece estar facilitado, mientras que muestran cierta resistencia a la epileptogénesis.
Este hallazgo podría explicar la menor tasa de refractariedad en esta población y la tendencia a presentar significativamente más crisis sintomáticas provocadas que en población joven. Se ha demostrado que el fenómeno de ictogénesis puede producirse en personas no epilépticas, considerándose que el mecanismo de las crisis sintomáticas involucra redes neuronales primitivas en anfibios22. En pacientes ancianos las crisis sintomáticas agudas son menos frecuentes con relación a las crisis no provocadas, sin embargo, estas siguen siendo más frecuentes que en pacientes jóvenes. En cuanto a la severidad, los ancianos presentan una mayor tasa de mortalidad y en 50% evolucionan a estado epiléptico. En cuanto a farmacorresistencia, la frecuencia se estima en 2 de 1.000 adultos mayores23,24. La epileptogénesis fue estudiada previamente en modelos animales en ratas y ratones utilizando kindling eléctrico, encontrándose mayor necesidad de estímulos eléctricos en SE añosos para el kindling completo y mayor severidad en el SR en esta población en consonancia con nuestros hallazgos. Los posibles mecanismos implicados en esta «resistencia» al kindling es la pérdida de los receptores de glutamato y la mayor capacidad de unión a receptores de benzodiacepinas25.
La distribución del tiempo en las distintas fases también fue diferente, siendo los SE viejos los que pasan mayor tiempo en fases más severas en el SR. En el protocolo subconvulsivo los SE jóvenes permanecieron significativamente más tiempo durante la fase 2, luego de lo cual se observó una rápida progresión hacia el kindling completo (fase 5), mientras que en la población vieja la distribución fue lenta y proporcionada. Estudios en humanos muestran que la población añosa presenta mayor grado de comorbilidades y severidad de las crisis comparadas con población joven. Los ancianos presentan mayor frecuencia de primer episodio epiléptico con etiología estructural y mayor mortalidad por evento ictal de causa cerebrovascular25,26.
En resumen, nuestros hallazgos muestran que los SE viejos llegan al kindling completo de manera más paulatina, compatible con el concepto de «resistencia» a la epileptogénesis y alcanzan mayor severidad de las CE. Mecanismos que pueden explicar estos fenómenos son el crecimiento axonal y la hiperexcitabilidad cortical que se encuentran disminuidos en la población añosa, llevando a una menor epileptogénesis y a un alto umbral de crisis en forma crónica27.
Las debilidades del estudio: sin correlación con electrofisiología, no hay medición de biomarcadores ni anatomía patológica. Nuestros hallazgos fueron alentadores y creemos que deberían en lo sucesivo compararse con pruebas moleculares, genéticas o electrofisiológicas a fin de comprender la dinámica de los procesos de ictogénesis y epileptogénesis.
Este trabajo permite en un modelo animal evaluar la relación entre epilepsia y envejecimiento. Se plantean posibles mecanismos neurofisiológicos detrás de las diferencias observadas entre SE jóvenes y viejos. En humanos se han demostrado características diferentes en epilepsia en población añosa. Este trabajo sugiere que mecanismos similares pueden producirse en el cerebro humano. El proceso de envejecimiento del sistema nervioso está aún en estudio. Conforme la población mundial envejece, aumenta la importancia de continuar investigando con protocolos que evalúen el efecto de la edad en el sistema nervioso.
FinanciaciónEl Honorable Concejo Deliberante de la Ciudad de San Luis financió el estudio.
Conflicto de interesesLos autores no declaran conflicto de intereses.
Al Honorable Concejo Deliberante de la Ciudad de San Luis por la financiación.
A los estudiantes Milagros Aballay, Guillermina Ugo y Alan Ojeda por el cuidado a los animales de experimentación