Distintas vías metabólicas pueden verse alteradas después de una crisis epiléptica, entre ellas los aminoácidos. El objetivo del estudio es analizar la concentración de aminoácidos en suero de pacientes con epilepsia, a través de la evaluación del metaboloma por espectroscopia por resonancia magnética y determinar su utilidad como biomarcador en dicha enfermedad.
MétodosEstudio transversal en pacientes con epilepsia y grupo control sano. Se analizaron niveles séricos de 15 aminoácidos utilizando espectroscopia por resonancia magnética y se obtuvieron variables clinicodemográficas. El análisis estadístico se realizó con SPSS21, considerando significativo un valor de p≤0,05.
ResultadosSe incluyeron 14 pacientes con epilepsia y 13 controles. Se observó que los pacientes con epilepsia tenían niveles más altos de ácido glutámico (3,613 AUC vs. 2,861 AUC, p=0,043) y prolina (4,851 AUC vs. 3,843 AUC, p=0,038), mientras que la fenilalanina (0,706 AUC vs. 0,861 AUC, p=0,016), el triptófano (2,129 AUC vs. 2,512 AUC, p=0,007) y la treonina (4,424 AUC vs. 5,313 AUC, p=0,033) mostraron concentraciones más bajas que el grupo control. Tras crisis epilépticas se observó una disminución de treonina (5,006 AUC vs. 4,424 AUC, p=0,007), isoleucina (3,974 AUC vs. 3,240 AUC, p=0,027), valina (2,783 AUC vs. 2,534 AUC, p=0,044) y leucina (1,790 AUC vs. 1,572 AUC, p=0,025) en el suero.
ConclusiónLa disminución de treonina, valina, isoleucina y leucina después de una crisis epiléptica podría considerarse como biomarcador de la enfermedad, aunque se requieren investigaciones adicionales para confirmar estos hallazgos.
Different metabolic pathways may be altered after a seizure, including amino acids. Our study aims to analyze serum amino acid concentrations in patients with epilepsy through metabolomic evaluation using magnetic resonance spectroscopy and determine their utility as biomarkers of seizures.
MethodsA cross-sectional study involving patients with epilepsy and a healthy control group. Serum levels of fifteen amino acids were analyzed using magnetic resonance spectroscopy, and clinical-demographic variables were collected. Statistical analysis was conducted with SPSS21, considering a significant value of p ≤ 0.05.
ResultsThe study included fourteen patients with epilepsy and thirteen controls. Patients exhibited higher levels of glutamic acid (3.613 AUC vs. 2.861 AUC, p 0.043) and proline (4.851 AUC vs. 3.843 AUC, p 0.038), while phenylalanine (0.706 AUC vs. 0.861 AUC, p 0.016), tryptophan (2.129 AUC vs. 2.512 AUC, p 0.007), and threonine (4.424 AUC vs. 5.313 AUC, p 0.033) showed lower concentrations than the control group. Following seizures, a decrease in threonine (5.006 AUC vs. 4.424 AUC, p 0.007), isoleucine (3.974 AUC vs. 3.240 AUC, p 0.027), valine (2.783 AUC vs. 2.534 AUC, p 0.044), and leucine (1.790 AUC vs. 1.572 AUC, p 0.025) was observed in the serum.
ConclusionThe reduction in threonine, valine, isoleucine, and leucine after a seizure could be considered a biomarker for the disease, although further investigations are required to confirm these findings.
La epilepsia es una enfermedad neurológica que se caracteriza por presentar una predisposición para generar crisis epilépticas, con implicación neurobiológica, cognitiva, psicológica y social1. Por ende, para una óptima aplicación de la definición son necesarias herramientas diagnósticas, entre ellas el electroencefalograma, que puede no estar disponible en un escenario de atención primaria de la salud1. Teniendo en cuenta que cerca del 80% de los pacientes con diagnóstico de epilepsia viven en países de ingresos bajos y medianos2, es de vital importancia contar con pruebas diagnósticas de menor costo y mayor accesibilidad, que nos permitan identificar aquellos pacientes con un alto riesgo de desarrollar epilepsia tras haber padecido una primera crisis3.
En los últimos años ha existido un aumento en la cantidad de trabajos de investigación sobre epileptogénesis y la búsqueda de biomarcadores genéticos, moleculares, celulares, etc. que puedan predecir de forma fiable la presencia, el desarrollo o la progresión de la epilepsia, los efectos del tratamiento antiepiléptico o la respuesta tras una cirugía resectiva3. Idealmente para que un biomarcador sea útil en un contexto clínico no debería ser invasivo y muy probablemente sean necesarios varios biomarcadores juntos para una correcta interpretación de estos3.
Distintas vías metabólicas se ven alteradas después de una crisis epiléptica4, entre ellas la de los aminoácidos, que son los componentes básicos para la síntesis de proteínas que participan en la producción de neurotransmisores, estrés oxidativo y metabolismo energético5. Los aminoácidos y los ácidos orgánicos son los principales metabolitos alterados en pacientes con epilepsia. Al compararlos con controles sanos se observaron diferencias significativas en la concentración de glutamato, lactato y citrato5.
Es importante destacar que los metabolitos, al ser partículas pequeñas, pueden cruzar la barrera hematoencefálica5, y como resultado asegurar un flujo bidireccional entre el compartimento sanguíneo y el cerebral. De esta manera es posible que las anomalías en los niveles séricos de metabolitos reflejen las del cerebro4.
El estudio metabolómico podría ser una herramienta complementaria rápida para el diagnóstico de epilepsia, que no solo contribuye a la comprensión de la fisiopatología subyacente de la misma, sino que también proporcionaría evidencia fiable para el desarrollo de nuevas medicaciones anticrisis5.
En consecuencia, el objetivo de este trabajo es analizar la concentración de aminoácidos en suero de pacientes con epilepsia, a través de la evaluación del metaboloma por espectroscopia por resonancia magnética y evaluar su utilidad como biomarcador en dicha enfermedad.
Sujetos y métodosDiseño del estudio y selección de sujetosEl estudio fue aprobado por el Comité de Ética del Hospital Italiano de Buenos Aires a través de la Plataforma de Registro Informatizado de Investigaciones en Salud de Buenos Aires (PRIISA), con código de registro #4553. Se obtuvo el consentimiento informado de todos los participantes del estudio.
Es un estudio analítico de tipo transversal, realizado en la Sección de Epilepsia del Hospital Italiano de Buenos Aires, entre mayo de 2021 y mayo de 2022. Se incluyeron pacientes con diagnóstico de epilepsia y sujetos control que cumplieron con los siguientes criterios de inclusión: ser>18años, permanecer internados en la unidad de videoelectroencefalografía (VEEG) entre 72 y 96horas, cumplir criterios de epilepsia confirmados a través de VEEG, obtención de la muestra de sangre en condiciones basales (sin crisis epilépticas durante al menos 24horas) y posterior a las crisis epilépticas con una ventana de tiempo menor a 30minutos, ninguno de ellos en tratamiento con dieta cetogénica actual. Los sujetos del grupo control incluidos fueron>18años, sin diagnóstico de epilepsia ni con enfermedad conocida y sin tratamiento farmacológico.
Se obtuvieron en todos los casos variables demográficas y se diferenció según los tipos de crisis epilépticas, tipos de epilepsia y síndromes epilépticos, de acuerdo con la clasificación y terminología de la Liga Internacional contra la Epilepsia6. Se determinó la presencia o no de epilepsia refractaria, los años de evolución de enfermedad y la frecuencia de crisis. Para aquellas epilepsias focales se tuvo en cuenta su localización temporal o extratemporal, la presencia o no de alteraciones en la resonancia magnética cerebral, el tipo y la cantidad de medicación anticrisis actual.
Para su estudio las muestras de sangre fueron agrupadas en 3 grupos:
- A)
Pacientes en los que solo se obtuvo muestras de sangre en condiciones basales.
- B)
Pacientes en los que además de la muestra basal, se obtuvo muestras inmediatamente posteriores a la crisis epiléptica.
- C)
Muestras de sangre de sujetos control.
Todas las muestras de sangre fueron obtenidas por venopunción, inmediatamente procesadas, colocándolas en tubos con gel activador de 4ml, dejándolas reposar durante minutos hasta la visualización de la formación del coágulo, posterior a lo cual se realizó un centrifugado, con una centrifugadora análoga (Arcano modelo 800D) a 3.000rp durante 5minutos para la obtención de suero. El mismo fue alicuotado con el uso de micropipetas, en tubos Eppendorf® de 1ml e inmediatamente congeladas a –40°C (Deep freezer Haier Biomedical).
Todas las muestras de pacientes, tanto en condiciones basales como posteriores a las crisis, fueron obtenidas y procesadas de la misma manera. De igual modo se procedió con las muestras de los controles. Aquellas muestras que sufrieron hemólisis durante su procesamiento fueron descartadas.
Preparación de muestras para espectroscopia por resonancia magnética nuclearLas proteínas plasmáticas fueron precipitadas con metanol 80% (en relación 1:2) como fue descrito previamente7. Todos los experimentos de RMN fueron realizados a 298K en un espectrómetro Bruker Avance III que opera a una frecuencia 1H de 600,2MHz. La asignación de los metabolitos se realizó utilizando las bases de datos electrónicas públicas disponibles Human Metabolome Database y Biological Magnetic Resonance Bank8,9.
Se realizó un análisis metabolómico no dirigido pesquisando los espectros de aminoácidos para su posterior análisis.
Para el análisis de los grupos primero se realizaron pruebas de normalidad de Shapiro-Wilk. Para aquellas con distribución normal se realizó test «t» de Student para muestras relacionadas, y para aquellas con distribución no normal análisis no paramétrico de Wilcoxon. Se fijó como significativo un valor de p≤0,05.
ResultadosCaracterísticas de los pacientes con epilepsia y sujetos controlSe incluyeron en el análisis 14 pacientes con epilepsia y 13 sujetos control. De estos últimos 8 fueron varones y 5 mujeres. Para el grupo de pacientes con epilepsia hubo 8 varones y 6 mujeres. La edad media fue para el grupo control de 36,62±8,6 años y 40,36±14,4 años para el grupo de pacientes con epilepsia. No hubo diferencias significativas en cuanto a sexo y edad.
Todos los sujetos incluidos en el grupo de epilepsia presentaban epilepsia focal, siendo temporales en un 37,5% y extratemporales en un 62,5%. Con relación al tipo de crisis el 64,3% fue de tipo focal, con pérdida de conciencia, mientras que el 35,7% tuvo un inicio focal y progresión a tónico clónica bilateral.
El 87,5% de los pacientes presentaba una epilepsia refractaria a fármacos. El tiempo de evolución de la enfermedad fue de 21,21±14,5 años. La presencia de hallazgos patológicos en la RMN de cerebro se encontró en un 27,4%, siendo la esclerosis del hipocampo el hallazgo más frecuente. El 85,5% de los pacientes estaba en politerapia con medicaciones anticrisis (MAC), siendo el levetiracetam la MAC más utilizada, seguido de la lacosamida.
Se pesquisaron tanto en el grupo control como en el grupo de epilepsia un total de 15 aminoácidos: fenilalanina, triptófano, tirosina, treonina, lisina, isoleucina, valina, alanina, prolina, acido glutámico, glutamina, metionina, serina, glicina y leucina.
Características de los aminoácidos en sujetos con epilepsia en estado basal frente al grupo controlDel análisis de los aminoácidos en suero de ambos grupos se objetivó en el grupo de pacientes con epilepsia en condiciones basales, en comparación con el grupo control, una mayor concentración de ácido glutámico (3,613 AUC vs. 2,861 AUC; p=0,043) y prolina (4,851 AUC vs. 3,843 AUC; p=0,038), mientras que la fenilalanina (0,706 AUC vs. 0,861 AUC; p=0,016), el triptófano (2,129 AUC vs. 2,512 AUC; p=0,007) y la treonina (4,424 AUC vs. 5,313 AUC; p=0,033) mostraron menor concentración (tabla 1 y fig. 1).
Comparación de concentración sérica de aminoácidos en pacientes con epilepsia en estado basal vs. grupo control sano
| Aminoácido | Grupo | N | Media | DE | ES | Coeficiente de variación |
|---|---|---|---|---|---|---|
| Fenilalanina | 0 | 13 | 0,861 | 0,153 | 0,,042 | 0,178 |
| 1 | 14 | 0,706 | 0,159 | 0,042 | 0,225 | |
| Triptófano | 0 | 13 | 2,512 | 0,288 | 0,080 | 0,115 |
| 1 | 14 | 2,129 | 0,373 | 0,100 | 0,175 | |
| Prolina | 0 | 13 | 3,843 | 1,221 | 0,339 | 0,318 |
| 1 | 14 | 4,851 | 1,168 | 0,312 | 0,241 | |
| Ácido glutámico | 0 | 13 | 2,861 | 1,036 | 0,287 | 0,362 |
| 1 | 14 | 3,613 | 0,787 | 0,210 | 0,218 | |
| Treonina | 0 | 13 | 5,313 | 1,082 | 0,300 | 0,204 |
| 1 | 14 | 4,424 | 0,967 | 0,258 | 0,218 |
| t | df | p | Diferencia media | Diferencia ES | D de Cohen | ES D de Cohen | |
|---|---|---|---|---|---|---|---|
| Fenilalanina | 2,584 | 25 | 0,016 | 0,155 | 0,060 | 0,995 | 0,432 |
| Triptófano | 2,968 | 25 | 0,007 | 0,383 | 0,129 | 1,143 | 0,446 |
| Prolina | –2,192 | 25 | 0,038 | –1,008 | 0,460 | –0,844 | 0,419 |
| Ácido glutámico | –2,134 | 25 | 0,043 | –0,752 | 0,352 | –0,822 | 0,418 |
| Treonina | 2,256 | 25 | 0,033 | 0,889 | 0,394 | 0,869 | 0,421 |
Análisis de «t» de Student, donde se observa un aumento significativo de prolina y ácido glutámico y un descenso de fenilalanina, triptófano y treonina en el grupo de pacientes con epilepsia en estado basal.
df: degrees of freedom; ES: error estándar; t: test de «t» de Student.
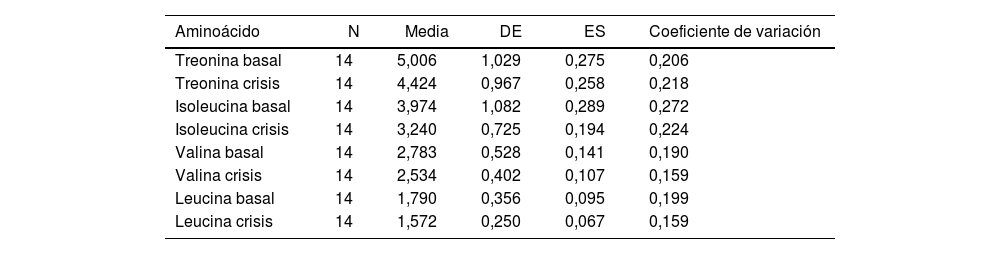
Del análisis de los aminoácidos que mostraron diferencias significativas en suero de pacientes en estado basal y con posterioridad a las crisis epilépticas, se encontró después de las crisis una disminución de treonina (5,006 AUC vs. 4,424 AUC; p=0,007), isoleucina (3,974 AUC vs. 3,240 AUC; p=0,027), valina (2,783 AUC vs. 2,534 AUC; p=0,044) y leucina (1,790 AUC vs. 1,572 AUC; p=0,025) (tabla 2 y fig. 2).
Aminoácidos en pacientes con epilepsia en estado basal vs. poscrisis
| Aminoácido | N | Media | DE | ES | Coeficiente de variación |
|---|---|---|---|---|---|
| Treonina basal | 14 | 5,006 | 1,029 | 0,275 | 0,206 |
| Treonina crisis | 14 | 4,424 | 0,967 | 0,258 | 0,218 |
| Isoleucina basal | 14 | 3,974 | 1,082 | 0,289 | 0,272 |
| Isoleucina crisis | 14 | 3,240 | 0,725 | 0,194 | 0,224 |
| Valina basal | 14 | 2,783 | 0,528 | 0,141 | 0,190 |
| Valina crisis | 14 | 2,534 | 0,402 | 0,107 | 0,159 |
| Leucina basal | 14 | 1,790 | 0,356 | 0,095 | 0,199 |
| Leucina crisis | 14 | 1,572 | 0,250 | 0,067 | 0,159 |
| Medida 1 | Medida 2 | t | df | p | D de Cohen | ES D de Cohen |
|---|---|---|---|---|---|---|
| Treonina basal | Treonina crisis | 3,191 | 13 | 0,007 | 0,853 | 0,213 |
| Isoleucina basal | Isoleucina crisis | 2,490 | 13 | 0,027 | 0,665 | 0,348 |
| Valina basal | Valina crisis | 2,226 | 13 | 0,044 | 0,595 | 0,251 |
| Leucina basal | Leucina crisis | 2,540 | 13 | 0,025 | 0,679 | 0,302 |
Test «t» de Student donde se muestran las diferencias significativas, observándose una disminución de treonina, isoleucina, valina y leucina posterior a las crisis epilépticas en relación con su estado basal.
df: degrees of freedom; ES: error estándar; t: test de «t» de Student.
La epilepsia es una condición neurológica caracterizada por la generación de descargas eléctricas anormales en el cerebro, lo que provoca crisis epilépticas recurrentes. Durante las convulsiones se producen cambios en la actividad eléctrica y metabólica del cerebro, lo que puede aumentar la demanda de varios nutrientes, incluyendo los aminoácidos10, los cuales, a pesar de que su principal función es la síntesis de proteínas, según el contexto clínico pueden ser una fuente alternativa de energía11. En el último tiempo se ha tratado de identificar las distintas vías metabólicas que se ven afectadas en pacientes con epilepsia.
En nuestro estudio se analizaron los aminoácidos presentes en sujetos con epilepsia en estado basal vs. controles, donde se evidenció un aumento de ácido glutámico. El glutamato es el principal neurotransmisor excitatorio del sistema nervioso central y el aminoácido más abundante del cerebro. Toda la actividad del glutamato cerebral se produce en el espacio extracelular, por lo cual una desregulación glutamatérgica puede conducir a una acumulación de glutamato, producir excitotoxicidad y muerte celular12. En el estudio realizado por Wang en 20164 se evidenció un marcado aumento de glutamato sérico en pacientes con epilepsia, e inmediatamente posterior a una crisis, lo que se asimila a los resultados de nuestro estudio.
Otro aminoácido que encontramos con aumento estadísticamente significativo fue la prolina; este aminoácido se encuentra asociado con el aumento de estrés oxidativo e inflamación, que desempeñan un papel importante en la patogénesis de la epilepsia. En un estudio experimental realizado en 2003 se evidenció que el aumento de la prolina en el cerebro de las ratas reduce el potencial antioxidante y causa estrés oxidativo, ocasionando disfunción neurológica en pacientes con hiperprolinemia13. A su vez, la prolina tiene efectos sobre el sistema glutamatérgico, ocasionando menor captación del glutamato, y por ende su acumulación y excitotoxicidad14. Aún no se encuentran estudios en humanos, por lo cual sería interesante que se realizaran algunas investigaciones con dicho aminoácido.
En referencia a los aminoácidos en los cuales se encontró una disminución de su concentración al compararlos con los controles, podemos mencionar un descenso significativo de triptófano. Este aminoácido esencial es un precursor clave en la vía de la síntesis de nicotinamida adenina dinucleótido (NAD+). La NAD es una coenzima que tiene un rol importante en numerosas reacciones metabólicas, especialmente en la producción de energía en forma de adenosín trifosfato a través de la glicólisis y el ciclo de Krebs11,15. El 95% del triptófano es catabolizado por la vía de la quinurenina. Esta última ha demostrado tener un rol inmunorregulador y participar en la regulación de la respuesta inflamatoria. El aumento de síntesis de metabolitos de la quinurenina (los ácidos quinurénico y quinolínico) y el uso del triptófano por la activación crónica de las células T en procesos inflamatorios de larga duración11, como la epilepsia16, podría ser una hipótesis que explique el descenso en las concentraciones séricas del triptófano.
La treonina, otro aminoácido esencial, presentó un descenso basal en pacientes con epilepsia, al igual que en el suero analizado posterior a una crisis. Durante una crisis epiléptica, y en la fase posterior, se pueden producir cambios en la expresión y la síntesis de proteínas en el cerebro. Por lo tanto, el aumento de la actividad neuronal durante las crisis puede requerir una mayor síntesis de proteínas4,5, lo que a su vez aumenta el consumo de treonina. Al igual que el triptófano, la treonina participa en la vía metabólica de la glicólisis15, que es una fuente importante de energía para el cerebro. La disminución en la disponibilidad de treonina puede estar relacionada con la necesidad de proporcionar suficiente energía para mantener la actividad neuronal anormalmente alta durante las convulsiones. Tanto el triptófano como la treonina están involucrados en la síntesis de neurotransmisores, como la serotonina y la glicina15, que desempeñan un papel crucial en la transmisión de señales en el sistema nervioso, siendo la serotonina un metabolito que puede disminuir la excitabilidad neuronal y tener propiedades inhibidoras sobre las crisis epilépticas17. La epilepsia puede afectar el equilibrio de neurotransmisores en el cerebro5, lo que puede aumentar la demanda de estos aminoácidos para mantener la síntesis y la liberación adecuada de dichos neurotransmisores.
Otro aminoácido que se encontró disminuido fue la fenilalanina; dicho metabolito es un precursor para la formación de tirosina, que es fundamental para la síntesis de catecolaminas, entre ellas adrenalina y noradrenalina,11 neurotransmisores involucrados en la epileptogénesis18, lo cual podría respaldar su descenso en pacientes con epilepsia. No se encontró más bibliografía disponible que explique la disminución de fenilalanina en el contexto de epilepsia, por lo cual se debería realizar una investigación más profunda sobre dicho aminoácido.
Aminoácidos en sujetos con epilepsia en condiciones basales frente a con posterioridad a las crisis epilépticasEn referencia a los aminoácidos, en los cuales se encontró una disminución de su concentración entre pacientes epilépticos en estado basal y posterior a una crisis, podemos mencionar un descenso de leucina, isoleucina y valina. Estos son conocidos como aminoácidos de cadenas ramificadas, que son esenciales para el funcionamiento de la fisiología humana19. Son derivados de la dieta y cruzan fácilmente la barrera hematoencefálica; a su vez también contribuyen a la producción de glutamato en el cerebro, al correcto funcionamiento de la mitocondria, participan en la vía de señalización mTOR y en la neurodegeneración; algunos de estos procesos están implicados en la fisiopatología de la epilepsia20.
Los aminoácidos de cadena ramificada en el cerebro humano pueden afectar la excitación e inhibición neuronal, específicamente al mejorar el metabolismo y la eliminación de glutamato cerebral, además de facilitar la síntesis de GABA y la neurotransmisión GABAérgica21. Estudios indican que el exceso de aminoácidos de cadena ramificada podría impulsar la síntesis del transmisor glutamato, facilitando así la señalización excitatoria y causar daño cerebral excitotóxico, aumentar la señalización de mTOR y a su vez causar daño tisular oxidativo y pérdida neuronal, resultando en cambios en las redes neuronales que pueden promover o suprimir la iniciación y propagación de crisis epilépticas20. Otros estudios refieren sus efectos moduladores, donde explican la utilización de la dieta glucogénica (valina e isoleucina) y la cetogénica (isoleucina y leucina) como factor protector para evitar crisis epilepticas21.
En nuestro estudio encontramos una disminución de los aminoácidos de cadena ramificada (valina, leucina e isoleucina) séricos con posterioridad a una crisis epiléptica. Se plantea que dicha disminución pueda estar asociada a un aumento de la necesidad metabólica para la síntesis de glutamato. Cabe recalcar que estos aminoácidos representan el 20% de la síntesis de novo del glutamato en el sistema nervioso central21.
Aunque todavía no se conoce exactamente la etiología, se deberían seguir realizando estudios en un futuro en cuanto a los aminoácidos de cadena ramificada para comprender su rol en la fisiopatología de las crisis epilépticas.
ConclusiónSegún los resultados obtenidos en el presente estudio podemos concluir que existe una diferencia significativa al realizar el análisis metabolómico de los distintos aminoácidos en suero en pacientes con epilepsia, poscrisis y controles sanos, lo cual sugiere una alteración metabólica que podría estar relacionada con una desregulación glutamatérgica, neurotoxicidad y aumento de la producción de energía a través de la glicólisis. La disminución de treonina, valina, isoleucina y leucina tras una crisis epiléptica se podría considerar en un futuro como biomarcador de estas, aunque faltan más estudios que involucren un análisis metabolómico más detallado para identificar más metabolitos implicados en la fisiopatología de las crisis epilépticas.
LimitacionesEste estudio presenta algunas limitaciones. En primer lugar, el tamaño muestral reducido, que en un futuro se podría aumentar. En segundo lugar no se realizó una evaluación nutricional previa a los pacientes y controles; si bien ninguno reportó deficiencias nutricionales, no podemos descartar interferencia con los resultados obtenidos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses.