Si bien algunos estudios han objetivado la presencia de disautonomía cardíaca en pacientes con esclerosis lateral amiotrófica (ELA), su relación con la enfermedad es controvertida.
ObjetivoExplorar la disautonomía cardíaca en pacientes con ELA y su posible asociación con la evolución de la enfermedad y la calidad de vida.
Sujetos y métodosSe evaluaron variables epidemiológicas y relacionadas con la ELA, comorbilidades y calidad de vida en 20 pacientes. Se aplicaron escalas de síntomas autonómicos y de calidad de vida (SF-36). Se realizó dinamometría, evaluación ortostática y de la variabilidad del intervalo RR (VIRR) en reposo y respiración profunda. Los resultados fueron comparados con 20 controles sanos pareados por sexo y edad.
ResultadosLa media de edad de los pacientes con ELA fue de 52±14 años. El 75% fueron hombres y el 85% tuvo inicio espinal. Los puntajes medios de ALS-FRS y CVF fueron 25,65±10,55 y 67%±21, respectivamente. Se observó disfunción cardíaca parasimpática en 4 de 16 pacientes (25%) y en ningún control (p=0,031). Los pacientes con pérdida de VIRR no se diferenciaron en ninguna variable de aquellos con respuesta normal. Solo un paciente (6%), y ningún control, presentó hipotensión ortostática (p=0,18).
ConclusionesLa disautonomía cardíaca parasimpática se observó en el 25% de los pacientes con ELA. La falta de asociación con variables de epidemiológicas y de la enfermedad indican que su mecanismo fisiopatogénico es distinto.
Although some studies have shown the presence of cardiac dysautonomia in amyotrophic lateral sclerosis (ALS) patients, its relationship with the disease is still controversial.
ObjectiveTo explore cardiac dysautonomia in ALS and its possible association with disease evolution and patient's quality of life.
Materials and methodsWe evaluated demographics and disease-related variables, comorbidities and quality of life in 20 ALS patients. We performed the autonomic symptoms profile and SF-36 (quality of life) scales. Patients were also evaluated with dynamometry, orthostatic testing and RR interval variability (RRIV) in resting and deep breathing electrocardiograms. Twenty age- and gender- matched healthy individuals served as controls for autonomic cardiovascular measurements.
ResultsThe mean age of ALS patients was 52±14 years, 75% were male and 85% had spinal disease onset. The mean score as per the ALS-FRS and FVC were 25.65±10.55 and 67%±21, respectively. Cardiac parasympathetic dysautonomia was found in 4 out of 17 (25%) ALS patients vs. none of the controls (P=0.031). ALS patients with reduced RRIV did not differ statistically in any variably from those without. Only 1 patient (6%) vs. none of the controls had orthostatic hypotension (P=0.18).
ConclusionParasympathetic cardiac dysautonomia was observed in 25% of the ALS patients. Lack of association with epidemiological or ALS-related variables suggests a different pathological process.
La esclerosis lateral amiotrófica (ELA) es una enfermedad neurodegenerativa poco frecuente caracterizada por la afección progresiva de las motoneuronas superior e inferior y que, por ende, ocasiona debilidad como síntoma principal1,2. La insuficiencia respiratoria y complicaciones asociadas a la postración determinan una mortalidad del 50% a los 3años del inicio sintomático1,3. La mayoría de los casos (90-95%) son esporádicos y su etiología es aún incierta, por lo que se considera una enfermedad multigénica influida por diversos factores ambientales, entre los cuales se encuentra el estrés oxidativo1,2,4. Actualmente las medicaciones internacionales disponibles (riluzol, edaravone y fenilbutirato sódico-taurursodiol) para el tratamiento etiológico de esta enfermedad se calcula que prolongan en aproximadamente 3 meses el tiempo a la traqueostomía o muerte de los pacientes5,6.
Existen publicaciones con evaluaciones anatomopatológicas en otras enfermedades neurodegenerativas (enfermedad de Alzheimer y enfermedad de Parkinson) que demostraron alteraciones diseminadas que afectan a áreas no relacionadas con los síntomas principales de la enfermedad en cuestión7,8. Esto supone una neurodegeneración más difusa a la previamente considerada9,10, lo que explica la existencia de síntomas no cognitivos o no extrapiramidales en esas enfermedades. En la ELA, las inclusiones citoplasmáticas TDP-43 positivas para ubiquitina se observan en áreas motoras y también en otras regiones11, lo que podría explicar la presencia de síntomas sensitivos12, cognitivos13 y disautonómicos14-17 ocasionalmente descritos.
El sistema nervioso autónomo está compuesto por neuronas centrales y periféricas, localizadas en el hipotálamo, tronco encefálico y columna intermediolateral medular en el primer caso y en los ganglios paravertebrales y esplácnicos en el segundo18. El estrés oxidativo ocasiona con frecuencia disfunción de estas estructuras y, por ende, disautonomías19, lo que determina síntomas secundarios a su alteración cardiovascular, sudorípara, salival, lagrimal, gastrointestinal, pupilar o urinaria17.
La evidencia disponible en la ELA indica que algunas funciones se encuentran preservadas (ej.: pupilar) y otras se afectan de modo subclínico (ej.: urinaria, lagrimal, gastrointestinal, etc.)17. Se ha demostrado una respuesta simpática exacerbada con elevados niveles de noradrenalina en sangre y una frecuencia aumentada de crisis hipertensivas en los estadios finales de la enfermedad17. Sin embargo, la hipotensión ortostática (HO), un signo importante de la disautonomía cardíaca simpática, no suele observarse16,20-22. La existencia de compromiso cardíaco parasimpático (con la pérdida de variabilidad del intervalo RR como su manifestación principal) es controvertido, pues existen trabajos previos con resultados tanto normales16,23,24 como patológicos15,20,22,25,26.
El objetivo de este trabajo fue estudiar la presencia de disautonomía cardíaca en pacientes con ELA y su asociación con variables relacionadas con la enfermedad (duración, subtipo, funcionalidad respiratoria y motora) y la calidad de vida.
Materiales y métodosVeinte pacientes consecutivos con diagnóstico de ELA probable o definida, según los criterios del Escorial3, fueron invitados a participar al asistir a su control habitual en una clínica de ELA. Asimismo, fueron incluidos 20controles sanos pareados por sexo y edad para la comparación autonómica cardiovascular. Todos los participantes firmaron el consentimiento informado previamente aprobado, junto con el proyecto, por el Comité de Ética del hospital al que pertenece la clínica.
Se registró el género, edad, tiempo desde el inicio de los síntomas, síntoma de inicio (debilidad espinal o bulbar), última capacidad vital forzada (CVF), comorbilidades y medicaciones actuales. Se consideraron los medicamentos antihipertensivos, antidepresivos, alfabloqueantes, benzodiacepinas, vasodilatadores periféricos, neurolépticos, antipsicóticos, opioides y antimuscarínicos como fármacos asociados al desarrollo de HO. Los antimuscarínicos también se consideraron asociados a disfunción cardíaca parasimpática27.
Se realizó un examen neurológico completo con medición de fuerza según el Medical Research Council sum score (puntaje máximo de 60, que implica fuerza conservada)28 y dinamometría manual (North Coast Hydraulic Hand Dynamometer NC70142 ExactaTM) cuando fue posible. La funcionalidad motora se evaluó mediante la escala ALS functionality rating scale (ALS-FRS)29, la calidad de vida mediante la escala 36-Item short form survey, quality-of-life sale (SF-36)30 y la disautonomía mediante la versión validada en español de la escala Autonomic symptoms profile31,32.
Se midió la frecuencia cardíaca usando un electrocardiógrafo Fukuda Cardimax FX7102TM (filtro muscular 35Hz, filtro de alta frecuencia 150Hz, barrido 25mm/s). Los registros tanto de pacientes como controles fueron obtenidos en una habitación silenciosa y cálida, en sedestación y luego de un reposo de 5 min. Todas las mediciones fueron tomadas por la mañana (entre las 9 y 12 a. m.). El primer registro se realizó en respiración espontánea y el segundo a un ritmo de 6 ciclos por minuto (según la indicación verbal y visual del examinador), este último elevando la mano durante la inspiración y bajándola durante la espiración. Los pacientes que no pudieron seguir adecuadamente los comandos fueron registrados y excluidos del análisis después.
Se evaluó en forma manual un minuto de registro de cada electrocardiograma con una regla milimetrada. El intervalo RR fue medido entre las ondas R del complejo QRS. Las extrasístoles y el QRS subsiguiente fueron excluidas del análisis. La variabilidad de la frecuencia cardíaca fue analizada considerando la diferencia entre el intervalo RR más largo y el más corto con relación a la media de duración de los intervalos RR20,33. Valores patológicos ajustados por edad fueron considerados de aquellos publicados por Stålberg et al.20,34. Los resultados obtenidos de los individuos sanos fueron utilizados, asimismo, como controles.
Por último, se realizó la medición de la presión arterial en reposo luego de un descanso de 5 minutos y dentro de los 3minutos de bipedestación (ayudado por un cuidador cuando fue necesario). Se definió HO como una caída de 20mmHg (30mmHg si el paciente era hipertenso) de la presión arterial sistólica o 10mmHg de la diastólica dentro de los 3minutos de pararse35.
Se usó la prueba t de Student o la prueba de χ2 de Pearson para las comparaciones entre grupos. La heterocedasticidad se compensó mediante la corrección de los grados de libertad en la prueba de t. Si 2o más celdas presentaban menos de 5 casos al evaluar la asociación de variables categóricas se utilizó la prueba de Fisher. Se consideró estadísticamente significativo un α de 0,05 (IBM SPSS v. 23, NY, EE. UU.).
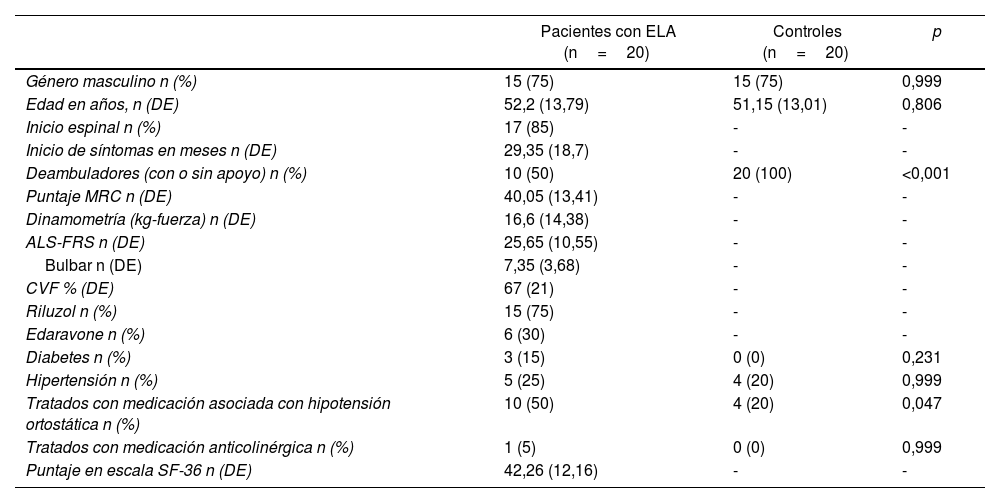
ResultadosEl 75% de los pacientes (n=15) fueron hombres, con una media de edad de 52 años (desvío estándar, DE, de 13,79). También el 75% de los pacientes tuvo un inicio espinal de su enfermedad y el tiempo medio entre el inicio sintomático y la evaluación fue de 29 meses (DE: 18). La media de funcionalidad motora y respiratoria evaluadas por ALS-FRS y CVF fue de 25,65 (DE: 10,55) y 67% (DE: 21), respectivamente. Hubo 15 pacientes (n=75%) tratados con riluzol y 6 (40%) también con edaravone. Cinco pacientes (25%) eran hipertensos y 3 diabéticos (15%), con un solo paciente que presentaba ambas condiciones. La mitad de los pacientes (n=10) estaba siendo tratado con al menos un fármaco asociado a HO, uno de ellos con amitriptilina y 2 con betabloqueantes. La media de calidad de vida medida por la escala SF-36 fue 42% (DE: 12%) y solo un paciente puntuó positivamente en la escala de disautonomía general (también obtuvo valores patológicos en las preguntas de pesquisa psicosomática). Los controles sanos tuvieron la misma distribución etaria y de género que los pacientes con ELA. Las características generales de la muestra se encuentran detalladas en la tabla 1.
Características clínicas y demográficas de la muestra
| Pacientes con ELA (n=20) | Controles (n=20) | p | |
|---|---|---|---|
| Género masculino n (%) | 15 (75) | 15 (75) | 0,999 |
| Edad en años, n (DE) | 52,2 (13,79) | 51,15 (13,01) | 0,806 |
| Inicio espinal n (%) | 17 (85) | - | - |
| Inicio de síntomas en meses n (DE) | 29,35 (18,7) | - | - |
| Deambuladores (con o sin apoyo) n (%) | 10 (50) | 20 (100) | <0,001 |
| Puntaje MRC n (DE) | 40,05 (13,41) | - | - |
| Dinamometría (kg-fuerza) n (DE) | 16,6 (14,38) | - | - |
| ALS-FRS n (DE) | 25,65 (10,55) | - | - |
| Bulbar n (DE) | 7,35 (3,68) | - | - |
| CVF % (DE) | 67 (21) | - | - |
| Riluzol n (%) | 15 (75) | - | - |
| Edaravone n (%) | 6 (30) | - | - |
| Diabetes n (%) | 3 (15) | 0 (0) | 0,231 |
| Hipertensión n (%) | 5 (25) | 4 (20) | 0,999 |
| Tratados con medicación asociada con hipotensión ortostática n (%) | 10 (50) | 4 (20) | 0,047 |
| Tratados con medicación anticolinérgica n (%) | 1 (5) | 0 (0) | 0,999 |
| Puntaje en escala SF-36 n (DE) | 42,26 (12,16) | - | - |
ALS-FRS: ALS functional rating scale; CVF: capacidad vital forzada; DE: desvío estandar; ELA: esclerosis lateral amiotrófica; MRC: Medical Research Council.
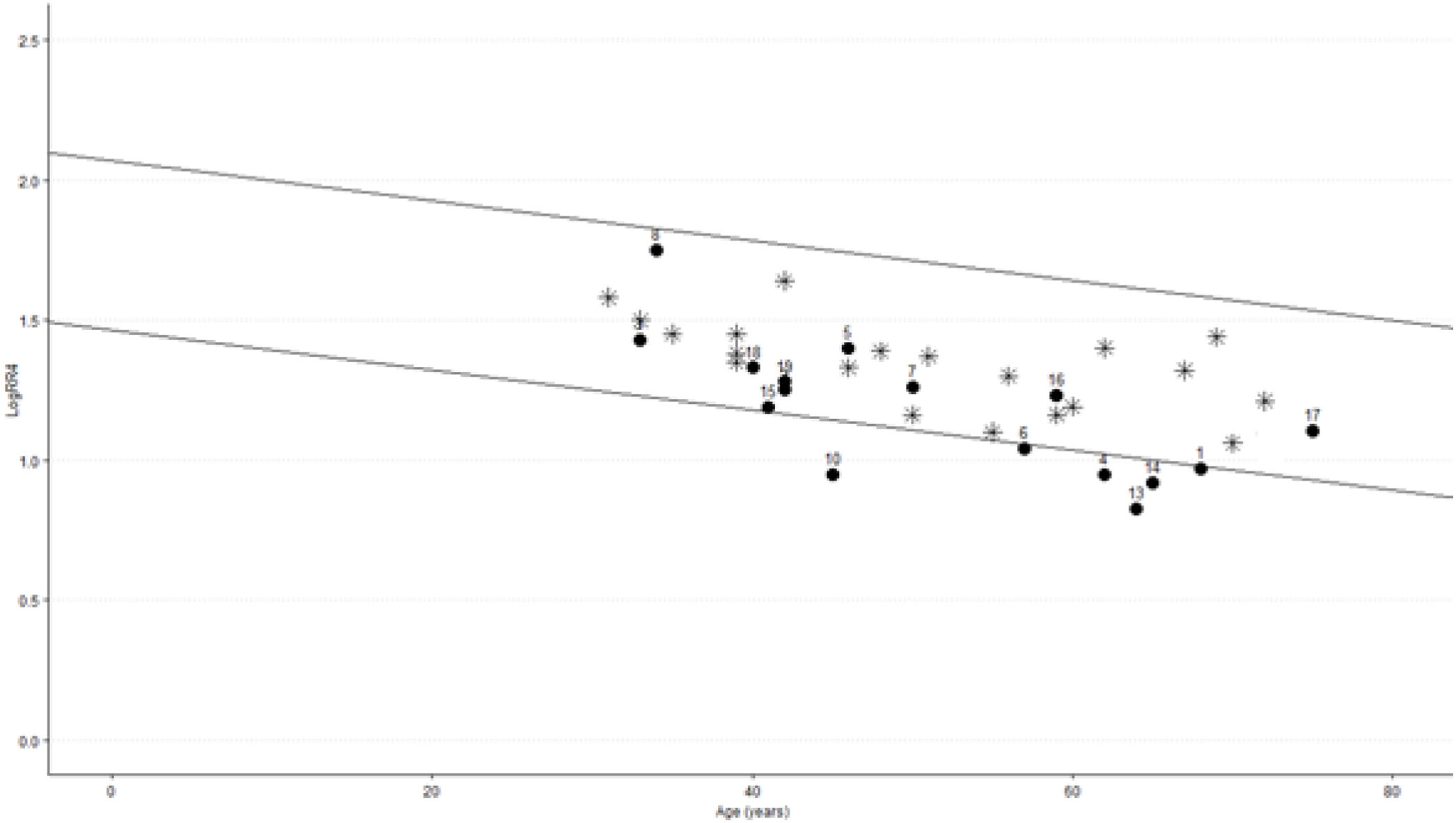
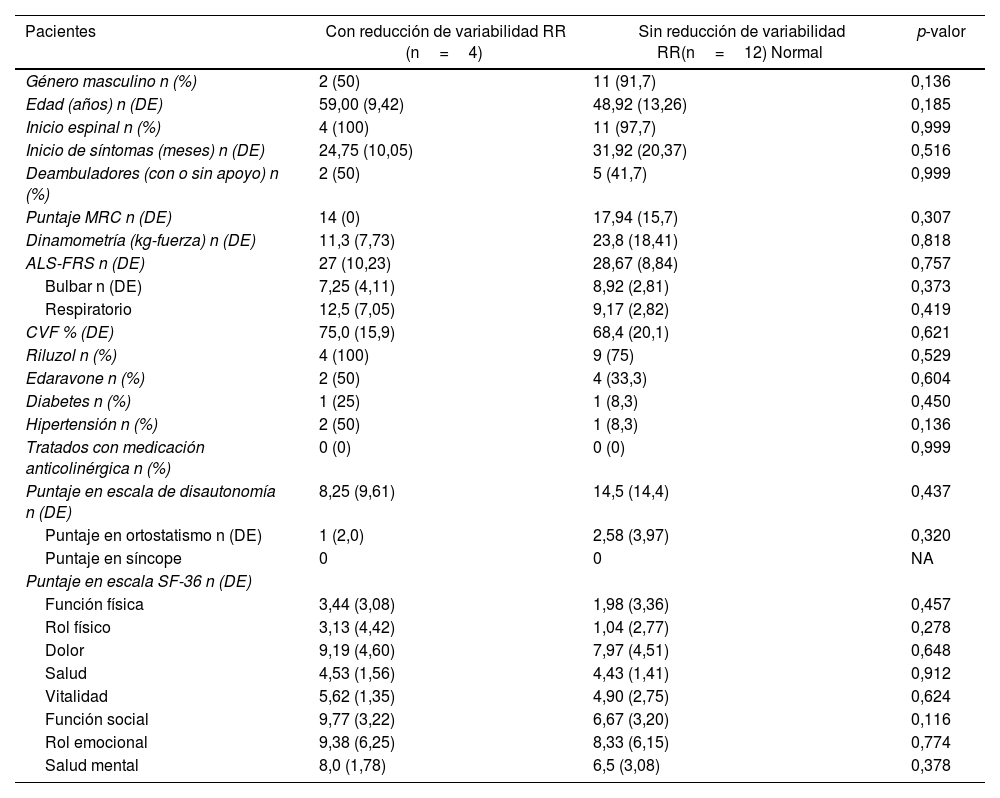
Cuatro pacientes con ELA (20% de los pacientes) no pudieron realizar adecuadamente la maniobra respiratoria. De los restantes 16, en 4 (25%) se objetivó pérdida de la variabilidad del intervalo RR (VIRR) durante la respiración profunda. Ninguno de los controles presentó valores alterados (p=0,031) (tabla 2, fig. 1). Como puede observarse en la tabla 3, no se encontraron diferencias en ninguna variable predictora analizada entre los pacientes con ELA con pérdida de la VIRR y aquellos con respuesta normal. Tras excluir también del análisis a los pacientes que podrían tener una repuesta parasimpática alterada por otra causa (2 pacientes diabéticos, uno de ellos tratado con amitriptilina), 3 de los restantes 14 (21,4%) presentaron pérdida de la VIRR (p=0,061).
Resultados autonómicos de la muestra
| Pacientes con ELA (n=20) | Controles (n=20) | p | |
|---|---|---|---|
| Puntaje en escala de disautonomía n (DE) | 12,95 (11,96) | - | - |
| Positivos para disautonomía n (%) | 1 (5)a | - | - |
| Hipotensión ortostática n (%) | 1/17 (6)b | 0 (0) | 0.181 |
| Alteración cardíaca parasimpática n (%) | 4/16 (25)c | 0 (0) | 0.031 |
DE: desvío estandar; ELA: esclerosis lateral amiotrófica.
Variabilidad del intervalo RR durante la respiración profunda en pacientes con ELA y controles.
RR4 durante respiración profunda (6 ciclos respiratorios por minuto): expresión porcentual de la diferencia entre el intervalo RR más largo y el más corto, con relación a la media de los intervalos RR. Valores normales ajustados por edad comprendidos entre las líneas paralelas20,32. Ni los pacientes 4, 10, 13, 14 ni ningún control presentaron valores patológicos.
*: control; ●: paciente con ELA; ELA: esclerosis lateral amiotrófica; número: identificador del paciente.
Pacientes con ELA que realizaron adecuadamente la maniobra respiratoria para evaluar la disautonomía cardíaca parasimpática (n=16) *
| Pacientes | Con reducción de variabilidad RR (n=4) | Sin reducción de variabilidad RR(n=12) Normal | p-valor |
|---|---|---|---|
| Género masculino n (%) | 2 (50) | 11 (91,7) | 0,136 |
| Edad (años) n (DE) | 59,00 (9,42) | 48,92 (13,26) | 0,185 |
| Inicio espinal n (%) | 4 (100) | 11 (97,7) | 0,999 |
| Inicio de síntomas (meses) n (DE) | 24,75 (10,05) | 31,92 (20,37) | 0,516 |
| Deambuladores (con o sin apoyo) n (%) | 2 (50) | 5 (41,7) | 0,999 |
| Puntaje MRC n (DE) | 14 (0) | 17,94 (15,7) | 0,307 |
| Dinamometría (kg-fuerza) n (DE) | 11,3 (7,73) | 23,8 (18,41) | 0,818 |
| ALS-FRS n (DE) | 27 (10,23) | 28,67 (8,84) | 0,757 |
| Bulbar n (DE) | 7,25 (4,11) | 8,92 (2,81) | 0,373 |
| Respiratorio | 12,5 (7,05) | 9,17 (2,82) | 0,419 |
| CVF % (DE) | 75,0 (15,9) | 68,4 (20,1) | 0,621 |
| Riluzol n (%) | 4 (100) | 9 (75) | 0,529 |
| Edaravone n (%) | 2 (50) | 4 (33,3) | 0,604 |
| Diabetes n (%) | 1 (25) | 1 (8,3) | 0,450 |
| Hipertensión n (%) | 2 (50) | 1 (8,3) | 0,136 |
| Tratados con medicación anticolinérgica n (%) | 0 (0) | 0 (0) | 0,999 |
| Puntaje en escala de disautonomía n (DE) | 8,25 (9,61) | 14,5 (14,4) | 0,437 |
| Puntaje en ortostatismo n (DE) | 1 (2,0) | 2,58 (3,97) | 0,320 |
| Puntaje en síncope | 0 | 0 | NA |
| Puntaje en escala SF-36 n (DE) | |||
| Función física | 3,44 (3,08) | 1,98 (3,36) | 0,457 |
| Rol físico | 3,13 (4,42) | 1,04 (2,77) | 0,278 |
| Dolor | 9,19 (4,60) | 7,97 (4,51) | 0,648 |
| Salud | 4,53 (1,56) | 4,43 (1,41) | 0,912 |
| Vitalidad | 5,62 (1,35) | 4,90 (2,75) | 0,624 |
| Función social | 9,77 (3,22) | 6,67 (3,20) | 0,116 |
| Rol emocional | 9,38 (6,25) | 8,33 (6,15) | 0,774 |
| Salud mental | 8,0 (1,78) | 6,5 (3,08) | 0,378 |
ALS-FRS: ALS functional rating scale; CVF: capacidad vital forzada; DE: desvio estándar; ELA: esclerosis lateral amiotrófica; MRC: Medical Research Council; NA: no aplicable; RR: intervalo RR en el electrocardiograma.
a De los 20 pacientes, 4 no pudieron realizar adecuadamente la maniobra respiratoria.
Tres pacientes no toleraron la evaluación ortostática, por lo que no se consideraron en el análisis. Un paciente (6%) de los 17 restantes presentó HO mientras que ninguno de los controles la presentó (p=0,181).
DiscusiónEl principal hallazgo de este estudio es la presencia de alteración en la VIRR (indicador de disfunción cardíaca parasimpática) en 25% de los pacientes con ELA. Este signo disautonómico se encuentra asociado a un riesgo aumentado de episodios cardíacos, como angina de pecho, infarto de miocardio e insuficiencia cardíaca36; por lo tanto se recomienda su diagnóstico y tratamiento tempranos. No observamos diferencias epidemiológicas, clínicas o en calidad de vida entre pacientes con ELA con disautonomía cardíaca parasimpática y sin ella.
Si bien estudios previos han reportado la mencionada disfunción15,20-22,26,33,37, solo 3han explorado factores predictores. Piccioni et al.15 observaron una asociación con presencia de signos de motoneurona superior (en pacientes con esclerosis lateral primaria y ELA posible –criterios del Escorial– con dicha signología). Pisano et al., en cambio, describieron la falta de asociación de disautonomía cardíaca parasimpática con la presencia de síntomas bulbares, duración de enfermedad y funcionalidad motora (escala de Norris)22. Por último, Dubbioso et al.26 no encontraron asociación entre la disfunción cardíaca parasimpática y el fenotipo clínico de inicio de la enfermedad o la funcionalidad respiratoria. Nuestros resultados complementan los previos y señalan un efecto nulo también para edad, género, funcionalidad motora (ALS-FRS), factores de riesgo cardiovascular (hipertensión y diabetes), sintomatología disautonómica general (escala de Autonomic symptoms profile) y calidad de vida (escala SF-36). Estas observaciones permiten hipotetizar que la disautonomía cardíaca parasimpática en la ELA no se encontraría asociada al mecanismo neurodegenerativo principal de esta enfermedad.
Como en publicaciones previas, la presencia de síntomas subjetivos de disautonomía general no fueron significativos15,17,38. Este hecho hablaría en contra de una degeneración autonómica difusa, como suele observarse en otras enfermedades neurodegenerativas, como la de Parkinson39. Por lo tanto, cabe suponer que el compromiso puede estar circunscrito a las neuronas parasimpáticas preganglionares de los núcleos dorsales del tronco del encéfalo, cuyas proyecciones integran el nervio vago40. En esta línea, Shimizu et al.41 no observaron diferencias morfológicas en las anatomías patológicas de dicho nervio entre pacientes con ELA e individuos controles, mientras que Hartmann et al.42 encontraron cantidades menores de ARN en el núcleo ambiguo de los individuos afectados. Esto puede ser explicado, como mencionan Shimizu et al., por el hecho de que los hallazgos clínicos son sutiles y el sistema nervioso autónomo, complejo y, por lo tanto, las oportunidades de encontrar una traducción en autopsias es baja14. Son necesarios más estudios futuros que evalúen la afección de estas estructuras.
Como ya fue descrito previamente14,21, incluso ante la presencia de factores de riesgo como postración y medicación hipotensora, encontramos una frecuencia de HO del 6%. Todos estos resultados contradicen la teoría de que la disautonomía cardíaca simpática es una afección leve pero frecuente en la ELA15,17,38. Sin embargo, de encontrarse presente, puede ser de riesgo, como es el caso de las crisis hipertensivas en estadios finales de esta enfermedad14,25.
Nuestro estudio tiene limitaciones. Fundamentalmente, el tamaño muestral pequeño y la posibilidad de sesgo de selección determinan la necesidad de una interpretación cautelosa de los resultados. Consideramos que la posibilidad de sesgo de respondedor es mínima, dado que todos los pacientes invitados estuvieron de acuerdo en participar. Las mediciones electrocardiográficas fueron realizadas a mano. Si bien esto puede predisponer a error, Nogués et al. no encontraron diferencias significativas entre las mismas mediciones manuales y las automáticas34. Por último, dado que la variación normal del intervalo RR durante la respiración profunda depende de la realización adecuada de dicha maniobra, su ejecución fue puntualmente supervisada. Además, la falta de asociación entre pérdida de VIRR y CVF y puntajes de ALS-FRS bulbares y respiratorios (tabla 3) indican que los resultados no se encontraban condicionados por debilidad respiratoria o bulbar.
ConclusionesObservamos disautonomía cardíaca parasimpática en el 25% de los pacientes con ELA. No se encontró asociada a ninguna variable epidemiológica, relacionada con la enfermedad ni con la calidad de vida. Estos hallazgos pueden indicar que esta disfunción no es consecuencia del mecanismo fisiopatogénico principal que condiciona el deterioro motor en esta enfermedad. La identificación temprana de pacientes con ELA y disautonomía cardíaca parasimpática puede colaborar a reducir la morbimortalidad global en esta población. Son necesarios estudios de mayor envergadura para confirmar estos hallazgos.
FinanciaciónEste trabajo recibió financiación del Ministerio de Ciencia, Tecnología e Innovación de la República Argentina bajo la beca «Investigación social sobre la esclerosis lateral amiotrófica» y la fundación Esteban Bullrich. EX-2022-132488499--APN-DDYGD#MCT.
Conflicto de interesesNinguno.