La diabetes mellitus tipo 2 (DMT2) es una enfermedad crónica que continúa produciendo complicaciones neurológicas a pesar de las mejorías en las estrategias terapéuticas. Además de la clásica neuropatía diabética periférica (NDP), el deterioro cognitivo (DC), podría considerarse una más de estas complicaciones.
ObjetivoAnálisis del Alzheimer disease assessment scale–cognitive (ADAS-COG), en una población de sujetos con DMT2 y determinar su posible asociación con la presencia de NDP.
Materiales y métodosSe estudiaron 54 pacientes con DMT2, media de edad: 71,1±5,6; varones: 22, mujeres: 32. Grupo control: n=32, media de edad: 70,5±7,2, varones 15, mujeres 17. El grupo con DMT2, se dividió en dos subgrupos: uno con NDP (n=37) y otro sin NDP (n=17). El test de Wilcoxon, para muestras apareadas, se empleó para la comparación de los puntajes del ADAS-COG entre los diferentes subgrupos.
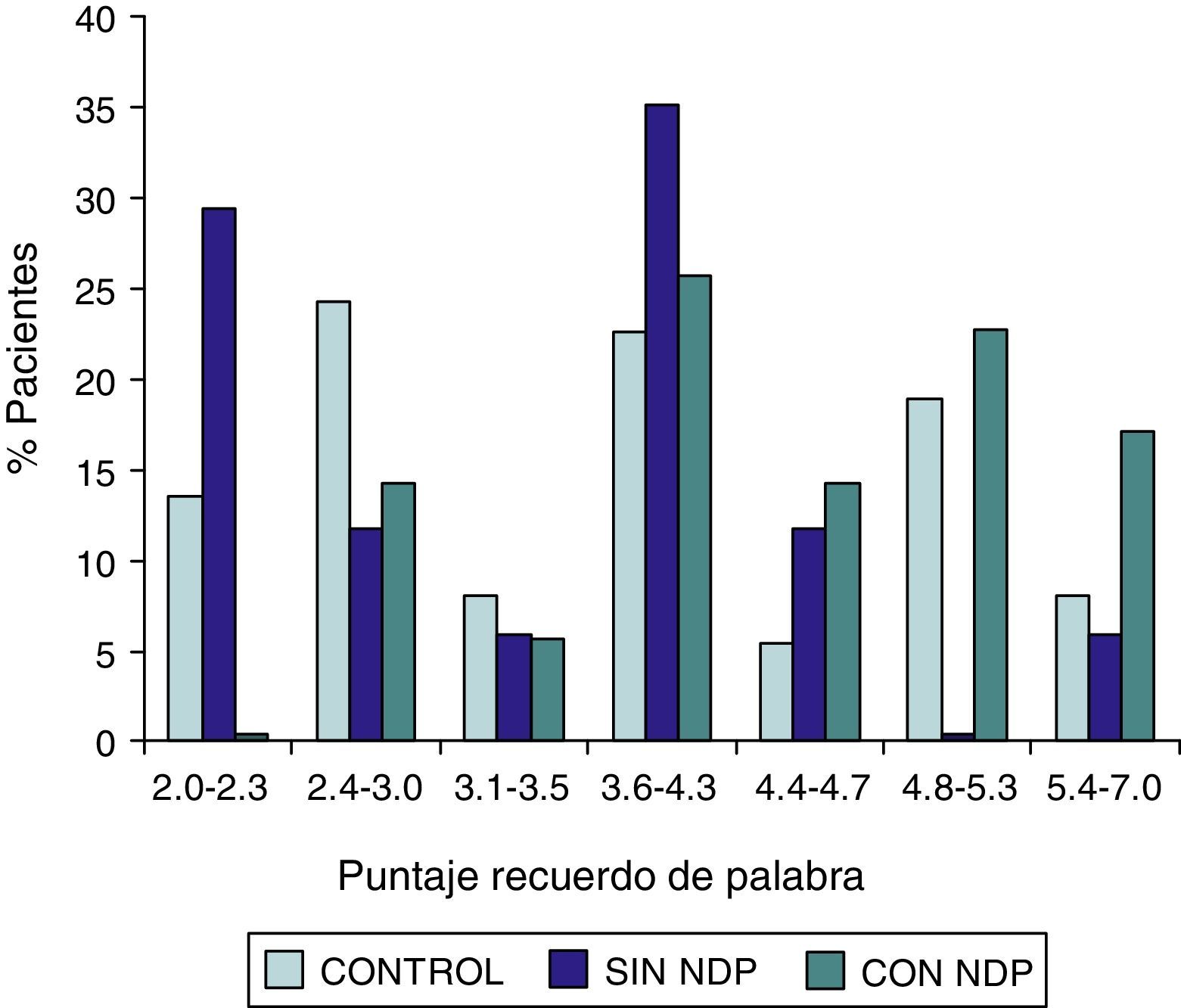
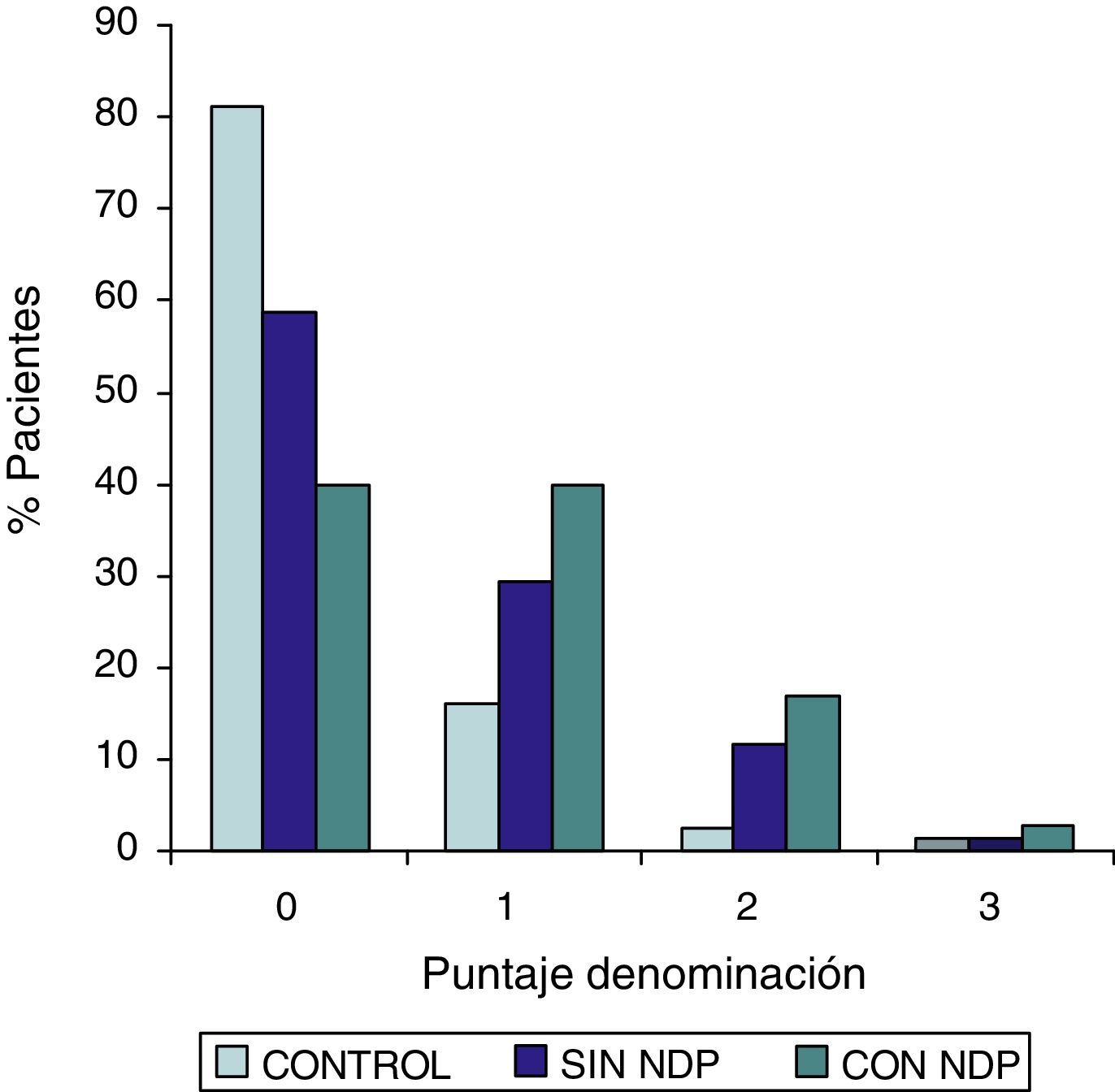
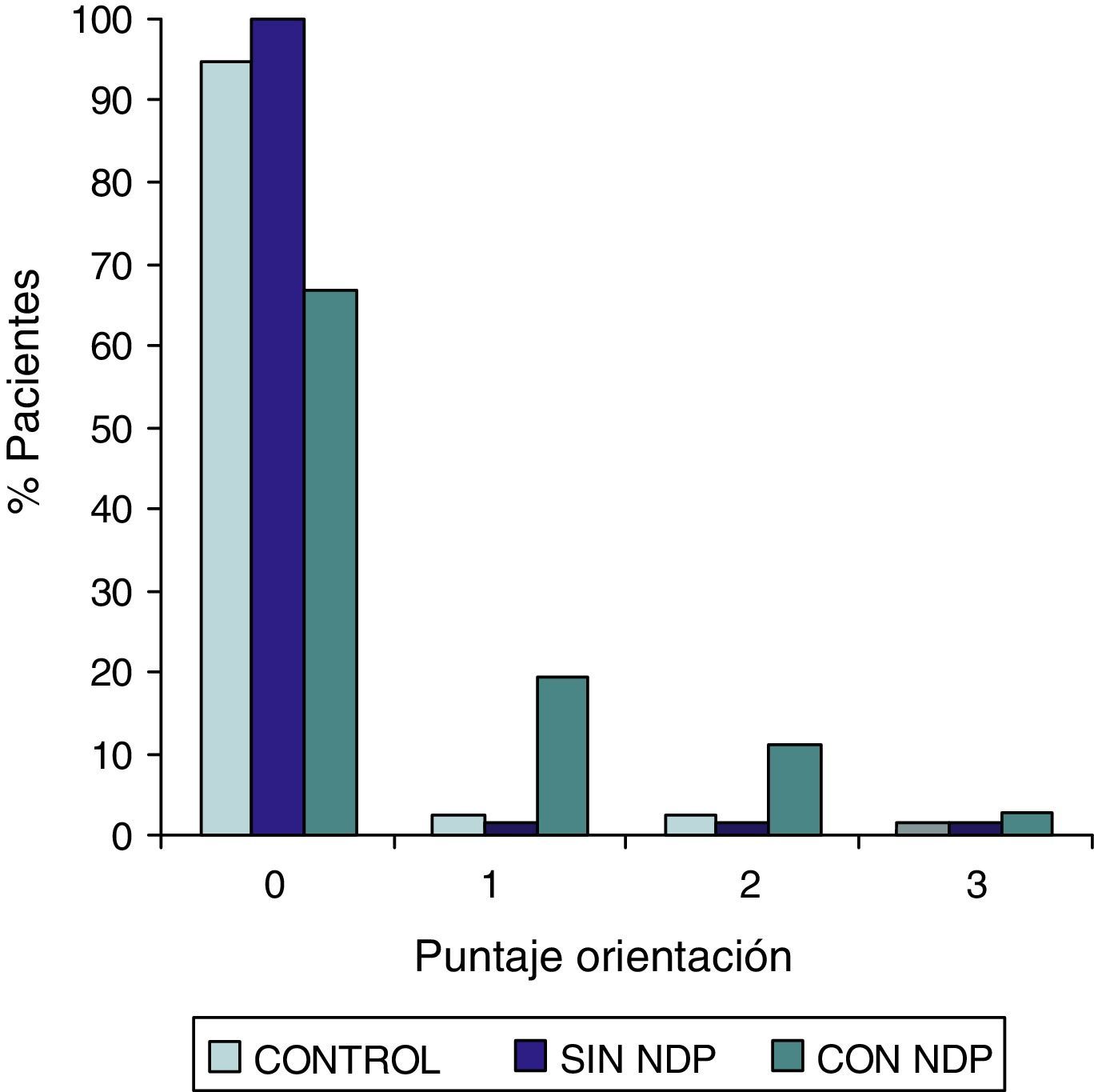
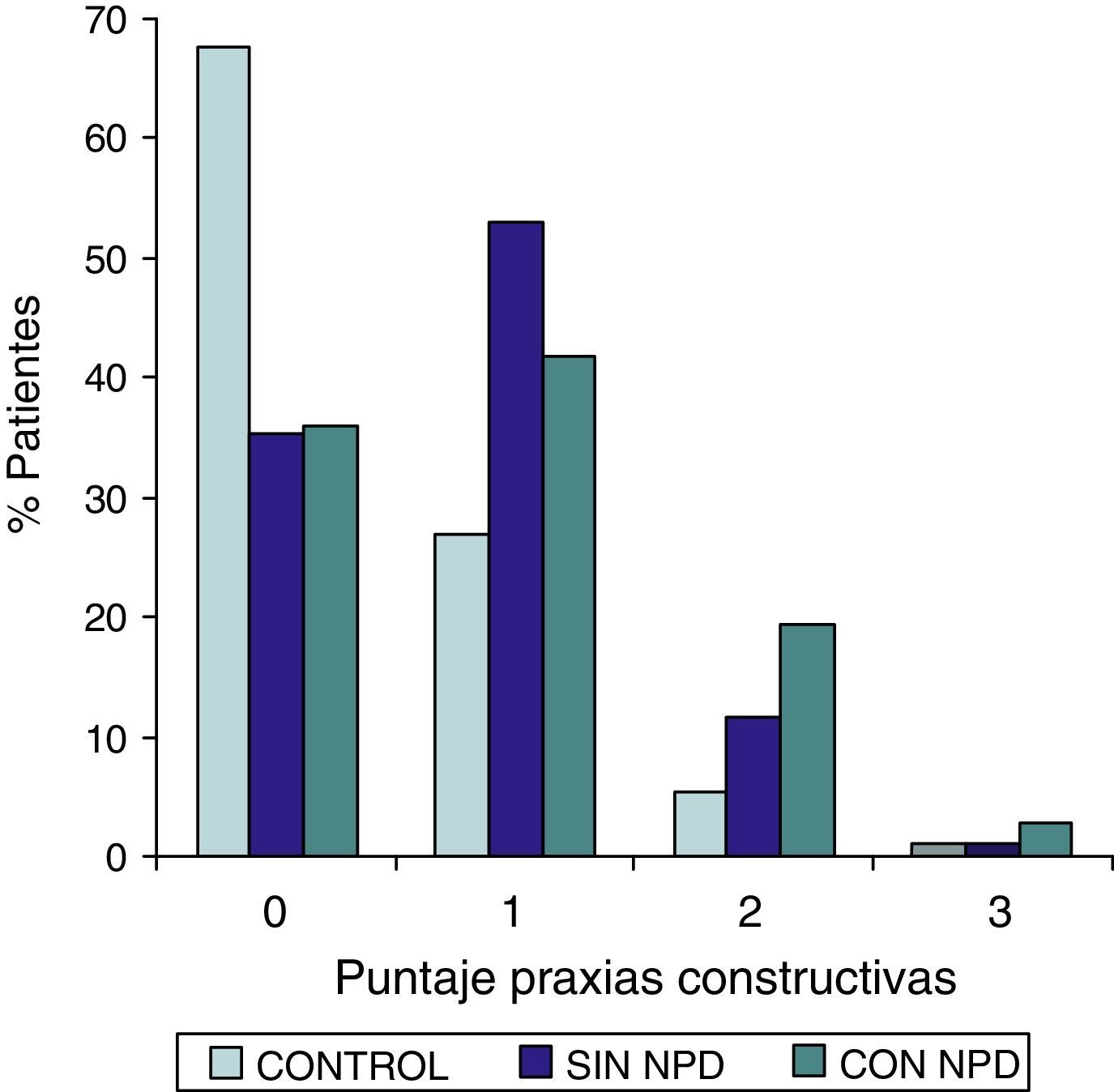
ResultadosLa comparación de los puntajes del ADAS-COG entre los diferentes grupos mostraron: a) diferencias significativas (p<0,05) entre el grupo total con DMt2 y el control; b) dichas diferencias se produjeron a expensas del subgrupo con NDP y c) las mismas se observaron esencialmente en los subítems: recuerdo de palabras, denominación, orientación y praxias constructivas.
ConclusionesNuestros resultados proveen evidencia de la existencia de un DC en algunos pacientes con DMt2. Este deterioro se hallaría asociado a la presencia de NDP. Estas observaciones permitirían plantear la presencia de un DC asociado a la DMt2 y considerar al mismo como una complicación tardía más de la enfermedad.
Type 2 diabetes mellitus (t2DM) is a chronic progressive disease, still producing several neurological complications, despite improving of therapeutic strategies. In addition to peripheral diabetic neuropathy (PDN), cognitive impairment (CI) might be considered as one of those complications.
ObjectiveTo analyze scores of the ADAS-COG, and their possible association with PDN, in patients with t2DM.
Materials and methodsWe studied 54 patients with t2DM: mean age: 71.1±5.6; males: 22, females: 32. Control group: n=32, mean age: 70.5±7.2, males: 15, females: 17. The group with t2DM was divided in two subgroups: with PDN (n=37) and without PDN (n=17). Wilcoxon signed rank test was performed for comparison among subgroups: t2DM with PDN, t2DM without PDN and control group.
ResultsComparison of the ADAS-COG scores among groups showed: a) significant differences (p<0.05) between total t2DM group and control group; b) those differences were due to the PDN subgroup; and c) the ADAS-COG subitems involved were: words recall, naming, orientation and constructional praxis.
ConclusionsOur results provide compelling evidence of CI in some patients with t2DM. This CI seems to be associated with the presence of PDN. Otherwise, the scenario of several pathophisiologic mechanisms is similar in PDN and Alzheimer's disease. These observations should lead to the consideration of CI, like PDN, as a late complication of the t2DM. More information is needed on the issue in order to clarify the meaning of this association.
Es conocido que una serie de factores, tanto genéticos como adquiridos, operarían como vectores causales del deterioro cognitivo (DC) de tipo Alzheimer1,2. Dentro de los adquiridos numerosos estudios, de cohortes y retrospectivos, parecen involucrar a la diabetes mellitus tipo 2 (DMt2) como factor de riesgo para esta enfermedad3–6. Varios de los mecanismos patogenéticos implicados en la enfermedad de Alzheimer, han sido también señalados en la neuropatía diabética periférica (NDP), tal el caso del stress oxidativo, la glucosilación no enzimática de las proteínas, marcadores genéticos de factores de riesgo como la apolipoproteína E y el gen que codifica para la enzima convertidora de angiotensina7–10. Recientemente se ha llamado la atención hacia una estructura, cuya alteración, podría jugar un papel clave en la patogénesis de la enfermedad de Alzheimer, y cuya implicancia en las complicaciones de la DMt2 eran previamente conocidas: el receptor de insulina11,12. Un amplio cuerpo de teoría se ha construido con las llamadas complicaciones tardías de la diabetes mellitus: microangiopatía, retinopatía, nefropatía y neuropatía periférica13–17 Un compromiso del sistema nervioso central asociado a la diabetes mellitus, independiente de las descompensaciones metabólicas, ha sido considerado en diversos estudios anatomopatológicos18,19 y mediante el empleo de los potenciales evocados20–22; desarrollándose la idea de una neuropatía diabética central19. El concepto del deterioro cognitivo como una manifestación tardía más de esta enfermedad, observado preferentemente en pacientes con largo tiempo de evolución de una DMt2, no ha sido aún convenientemente aclarada. El propósito del presente trabajo fue estudiar estas dos complicaciones, que pueden aparecer tardíamente en la DMt2, la NDP y el DC, estimado este último por medio del Alzheimer Disease Assesment Scale–Cognitive (ADAS-COG) y determinar la posible asociación entre ambas variables.
MétodosPoblación y pacientesSe efectuó un análisis retrospectivo de pacientes ambulatorios con DMt2, durante el período 2009-2013. El mismo fue efectuado en la Unidad de Neurología del Hospital General de Agudos Juan A. Fernández. La selección para el estudio se realizó conforme a los siguientes criterios:
Criterios de inclusión: se incluyeron pacientes con DMt2 de más de 5 años de evolución, de ambos sexos, con edades comprendidas entre 60 y 85 años, con y sin deterioro cognitivo.
Criterios de exclusión: se excluyeron los pacientes con edades menores de 60 o mayor de 85 años; tensión arterial diastólica mayor o igual a 90 y sistólica mayor o igual a 140; body mass index por fuera de 18-29; neuroimágenes con evidencias de lesión moderada o severa de tipo vascular (más de dos imágenes lacunares, infartos extensos, leucoaraiosis severa o hemorragias. Asimismo, por los mismos procedimientos de imágenes se excluyeron casos que presentaran evidencias de masas ocupantes o cualquier otro tipo de lesión que pudiera afectar la performance cognitiva. Se excluyeron también aquellos casos que reunieran criterios clínicos para diagnóstico de síndrome demencial y a aquellos con síndrome depresivo en los que el puntaje de la escala de Hamilton se observara en valores iguales o superiores a 11. Finalmente se excluyeron todos aquellos casos con otras patologías que pudieran afectar el SNC o el SNP, con excepción de la DMt2.
En todos los pacientes seleccionados se efectuaron: examen neurológico, estudios neurofisiológicos, evaluaciones neurocognitivas y neuroimágenes.
Examen neurológico: se realizó un examen neurológico convencional. El/los examinadores fueron neurólogos del equipo de trabajo del Consultorio de Demencias de la Unidad de Neurología del Hospital Fernández, los que procedieron en forma ciega a las neuropsicólogas encargadas de realizar las evaluaciones neurocognitivas y al neurofisiólogo que efectuó el estudio electrodiagnóstico. Mediante los estudios neurofisiológicos se exploraron en forma estándar las velocidades de conducción motoras de los nervios: cubitales y ciáticos poplíteos externos bilaterales, y las velocidades sensitivas de los nervios cubitales y surales bilaterales.
El diagnóstico de NDP se definió, en base a criterios estándar, conforme a la determinación de por lo menos dos de las siguientes series de datos:
- 1.
Presencia de síntomas característicos: dolor, parestesias, disestesias, hiperalgesia, alodinia, etc.
- 2.
Presencia de signos característicos: arreflexia aquiliana, déficits sensitivos distales, pérdida de fuerza distal en miembros inferiores, etc.
- 3.
Disminución de las velocidades de conducción de los nervios periféricos en por lo menos 2 de 6 nervios explorados.
Se realizó el ADAS-COG en su forma estándar, en el cual se determinaron los siguientes subítems: inteligibilidad oral, comprensión, falta de palabra, recuerdo de palabra, denominación, orientación, ejecución de órdenes, praxias ideatorias, praxias constructivas, recuperación de palabras y recuerdo de consignas.
Se realizaron neuroimágenes de cerebro (tomografías axiales computarizadas y/o resonancia magnética nuclear), sin contraste, con procedimiento estándar y análisis de laboratorio rutinarios de muestras sanguíneas. Estos estudios estuvieron orientados a confirmar el diagnóstico de la DMt2 y a descartar la existencia de otras patologías, conforme a los criterios de exclusión. El número y/o tipo y/o localización de las lesiones de las neuroimágenes no formaron parte de los objetivos planteados en el estudio. Por este motivo estos parámetros solo fueron considerados a los fines de satisfacer los criterios de exclusión del trabajo.
Análisis estadístico: se efectuó la comparación entre medias, mediante el test de Student, para datos cuantitativos. El test no paramétrico de rangos con signo de Wilcoxon, para muestras apareadas, se empleó para la comparación de los puntajes del ADAS-COG entre los diferentes subgrupos: DMt2 totales, DMt2 con NDP, DMt2 sin NDP y grupo control (tabla 1). El cálculo del tamaño de la muestra en estudio se efectuó con el estadístico de la base de datos Epi Info6.0, considerando un riesgo alfa del 5% y un poder del 80%, proporción de casos/controles de 0,5 y una probabilidad estimada de exposición en controles del 30%.
Comparaciones en el rendimiento de los subítems del ADAS-COG entre los distintos grupos estudiados de pacientes diabéticos y el grupo control
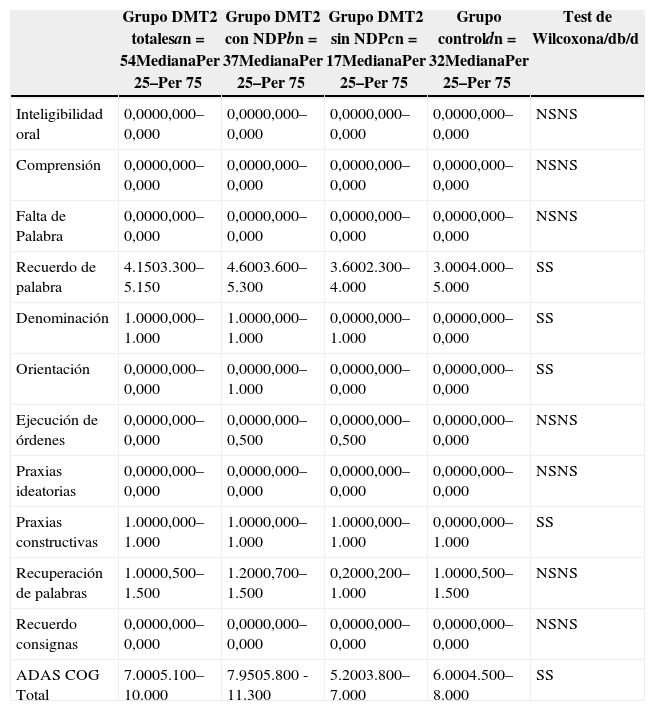
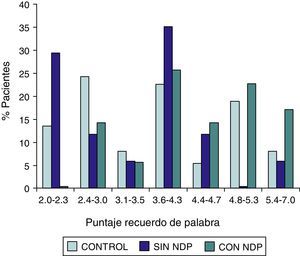
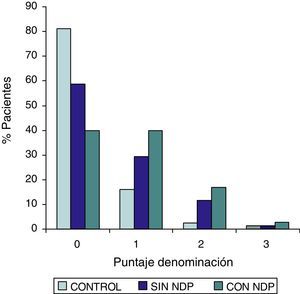
| Grupo DMT2 totalesan=54MedianaPer 25–Per 75 | Grupo DMT2 con NDPbn=37MedianaPer 25–Per 75 | Grupo DMT2 sin NDPcn=17MedianaPer 25–Per 75 | Grupo controldn=32MedianaPer 25–Per 75 | Test de Wilcoxona/db/d | |
|---|---|---|---|---|---|
| Inteligibilidad oral | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | NSNS |
| Comprensión | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | NSNS |
| Falta de Palabra | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | NSNS |
| Recuerdo de palabra | 4.1503.300–5.150 | 4.6003.600–5.300 | 3.6002.300–4.000 | 3.0004.000–5.000 | SS |
| Denominación | 1.0000,000–1.000 | 1.0000,000–1.000 | 0,0000,000–1.000 | 0,0000,000–0,000 | SS |
| Orientación | 0,0000,000–0,000 | 0,0000,000–1.000 | 0,0000,000–0,000 | 0,0000,000–0,000 | SS |
| Ejecución de órdenes | 0,0000,000–0,000 | 0,0000,000–0,500 | 0,0000,000–0,500 | 0,0000,000–0,000 | NSNS |
| Praxias ideatorias | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | NSNS |
| Praxias constructivas | 1.0000,000–1.000 | 1.0000,000–1.000 | 1.0000,000–1.000 | 0,0000,000–1.000 | SS |
| Recuperación de palabras | 1.0000,500–1.500 | 1.2000,700–1.500 | 0,2000,200–1.000 | 1.0000,500–1.500 | NSNS |
| Recuerdo consignas | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | 0,0000,000–0,000 | NSNS |
| ADAS COG Total | 7.0005.100–10.000 | 7.9505.800 - 11.300 | 5.2003.800–7.000 | 6.0004.500–8.000 | SS |
Las comparaciones del grupo DMT2 total con el grupo control, resultaron con diferencias estadísticamente significativas (p<0,05), considerando el puntaje total del ADAS COG, a expensas del grupo con NDP (test de Wilcoxon para muestras apareadas). Lo mismo ocurrió con los subítems: recuerdo de palabras, denominación, orientación y praxias constructivas. La comparación del grupo sin NDP con el grupo control no mostró diferencias significativas en ninguna de las comparaciones.
DMT2: diabetes mellitus tipo 2; NDP: neuropatía diabética periférica; NS: no significativo; S: significativo; Per: percentilo.
Se reclutó un total de 54 pacientes con DMt2. Un grupo de 32 sujetos sanos, constituido por 15 varones y 17 mujeres, fue considerado como grupo control. Los pacientes eran referidos al servicio de Neurología, del consultorio de diabetes, solo por su condición de DMt2, siendo asintomáticos y sin quejas previas de neuropatía periférica ni de compromiso cognitivo. El grupo control fue seleccionado en el mismo período en que se reclutaron los pacientes, en forma consecutiva y no aleatoria. Sus criterios de inclusión y exclusión fueron similares a los probandos, excepto que no tenían diabetes y sus edades y tiempos de instrucción eran similares a las de los pacientes. La media de edad (71,1±5,6) y de los años de educación (9,1±3,6) de los sujetos controles, no mostró diferencias significativas (p>0,05) en relación a las medias de los pacientes con DBt2 (70,5±7,2 y 9,3± 3,2 respectivamente).
El estudio fue aprobado, para su realización en la Unidad de Neurología, por el Comité de Ética del Hospital Fernández y se obtuvo consentimiento informado de los participantes.
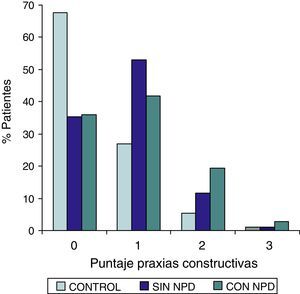
ResultadosEn la tabla puede verse el total de la muestra con los resultados de las comparaciones de los subitems del ADAS-COG entre los distintos grupos estudiados. En síntesis se observó: 1) diferencias significativas (p<0,05) entre el grupo total con DMt2 y el control; 2) dichas diferencias se produjeron a expensas del subgrupo con NDP y 3) las mismas se observaron esencialmente en los subítems: recuerdo de palabras, denominación, orientación y praxias constructivas. En los gráficos de barras de las figuras 1 (recuerdo de palabras), figura 2 (denominación), figura 3 (orientación) y figura 4 (praxias constructivas) pueden observarse los comportamientos comparativos de los puntajes del ADAS-COG para las variables mencionadas. En todos los gráficos puede comprobarse un comportamiento similar, en el que el grupo diabético con NDP se diferencia claramente del grupo sin NDP y del grupo control (p<0,05); 4) los restantes subítems explorados del ADAS-COG no mostraron diferencias significativas entre los grupos (p>0,05).
ConclusionesLa NDP y la enfermedad de Alzheimer parecen compartir una serie de mecanismos comunes tales como el fenómeno del stress oxidativo7 y factores genéticos como la expresión de apolipoproteina E48,9 y el gen de la enzima convertidora de angiotensina8,10. Hoyer et al.12, plantearon la hipótesis de un ambiente de «tipo diabético» en el cerebro de sujetos con enfermedad de Alzheimer, considerando que la alteración del receptor de insulina neuronal en esta enfermedad es la clave que condiciona la falla en los procesos que requieren la señalización endoneural de insulina. Steen et al.23 propusieron el concepto de que la enfermedad de Alzheimer constituye una forma de «diabetes tipo 3», señalando al déficit en la producción de insulina en el SNC como el factor crítico en el desarrollo del DC.
Existen controversias en relación a los posibles mecanismos subyacentes al DC en la DMt2. Algunas evidencias orientan hacia el compromiso microvascular periférico (retinopatía, neuropatía y nefropatía) que se asociaría con hallazgos de enfermedad cerebrovascular en pacientes con diabetes mellitus24–26; mientras que otras ponen el acento en factores «no microvasculares». Así, estudios recientes han demostrado qua una atrofia del lóbulo temporal medial parece asociarse con la diabetes mellitus, independientemente de la carga lesional por enfermedad de pequeños vasos27. Otros mecanismos «no vasculares» pueden asimismo estar implicados, tales como: mecanismos inflamatorios28, productos finales de glucosilación avanzados29, patología amiloidea inducida por insulina30 y formación de ovillos neurofibrilares31.
En nuestros casos se halló que la performance en el ADAS-COG se encontró disminuida en el grupo de diabéticos, comparada con el control; esta disminución (indicadora de DC), se produjo a expensas del subgrupo con NDP, asociación esta que sugiere un vínculo entre ambos sectores: sistema nervioso central y sistema nervioso periférico. Esta reducción en el rendimiento del ADAS-COG tiende a producirse, preferentemente, en determinados subítems, como recuerdo de palabras, denominación, orientación y praxias constructivas; hallazgos estos que requerirán mayor acopio de información futura para su confirmación.
A la luz de las consideraciones previas, probablemente deba redimensionarse la problemática planteada en los siguientes aspectos. 1) En primer lugar, si bien la patogenia microvascular como subyacente a la NDP continúa vigente32, no pueden descartarse factores «no microvasculares» o metabólicos contribuyentes33,34. De hecho; décadas de investigación de la NDP, en su forma más frecuente la polineuropatía axonal, distal y simétrica; han señalado factores, tanto microvasculares isquémicos como metabólicos, que podrían actuar en concierto en la génesis de la misma34,35. 2) En segundo lugar, dada la asociación hallada entre la NDP y el DC en nuestro trabajo, ¿es posible plantear un escenario fisiopatológico similar entre el sector periférico y central del sistema nervioso? Además, en este escenario compartido, ¿sería factible considerar factores tanto microvasculares como metabólicos interactuantes? 3) En tercer lugar, siguiendo la misma línea de razonamiento, ¿podría considerarse al DC como una complicación tardía más, «asociada» a la DMt2, así como lo es la NDP? Algunas líneas de investigación experimental parecen apoyar este concepto36. 4) Finalmente, en caso de que los pacientes con NDP y DC evolucionaran hacia un síndrome demencial, ¿sería lícito plantarse la existencia de una «demencia diabética» con características clínicas y fisiopatológicas propias?
Una limitación de nuestro trabajo es que los pacientes, en el momento del reclutamiento, eran asintomáticos respecto a la presencia o no de la NDP, así como de algún fallo cognitivo. Únicamente se conocía su condición de DBt2, de largo tiempo de evolución. Por este motivo no fue posible determinar el orden de aparición de estas alteraciones. Por el momento solo podemos establecer una asociación estadística entre la NDP y el DC, medido a través del ADAS-COG.
Con el fin de dilucidar estos interrogantes serán necesarias en este sentido un mayor número de investigaciones futuras, que probablemente permitirán aclarar el perfil cognitivo del DC asociado a la DMt2, así como de confirmar y adjudicar su verdadero valor a la relación del DC con la NDP.
FinanciaciónEl presente trabajo ha sido subvencionado por el Instituto Universitario de Ciencias de la Salud, Fundación Barceló (IUCS).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al IUCS el haber hecho posible la realización del presente proyecto.