El control preciso y eficaz de la postura requiere una adecuada integración de los sistemas sensoriales y motores.
ObjetivoIdentificar la contribución de los sistemas sensoriales en el control postural de personas con síndrome de Down (SD).
Material y métodoMuestra compuesta por 104 participantes con SD y desarrollo típico (DT), los cuales fueron divididos en grupos de niños, adolescentes y adultos. El control postural fue medido sobre una plataforma de fuerza en situación de ojos abiertos (OA) y ojos cerrados (OC). Se realizó un análisis espectral de las señales y se obtuvieron las siguientes bandas de frecuencias: 1/16, 1/8, 1/4, 1/2, 1, 2 y 4Hz. Se compararon personas con SD y DT.
ResultadosEn adolescentes, la energía utilizada por las personas con SD fue mayor que las con DT para las bandas de 2Hz (p = 0,015) y 4Hz (p =0,012) en OA y para las bandas 1/4Hz (p = 0,033), 2Hz (p = 0,042) y 4Hz (p = 0,047) en OC. En adultos, las diferencias se observaron en 1/2Hz (p = 0,010), 1Hz (p < 0,001), 2Hz (p < 0,001) y 4Hz (p < 0,001) en OA y 1/4Hz (p = 0,027), 1/2Hz (p = 0,005), 1Hz (p = 0,001), 2Hz (p < 0,001) y 4Hz (p = 0,003) en OC. En niños no se reportaron diferencias significativas entre los grupos.
ConclusionesLos resultados de este estudio muestran que las personas con SD demandan en mayor medida los sistemas sensoriales para mantener la postura bípeda.
The accurate and effective control of posture requires proper integration of the sensory and motor systems.
AimTo identify the contribution of sensory systems in the postural control of people with Down Syndrome (DE).
Material and methodsThe sample was composed of 104 participants, divided into groups of children, teenagers and adults with DS and typical development (TD). Postural control was measured on a forcé platform with open eyes (OE) and closed eyes (CE). A spectral analysis of the signals was performed and the following frequency bands were obtained: 1/16, 1/8, 1/4, 1/2, 1, 2 and 4Hz. People with DS and TD were compared.
ResultsIn teenagers, the energy used by people with DS was higher than those with TD for the bands of 2Hz (P=.015) and 4Hz (P=.012) with OE and for the bands 1/4Hz (P=.033), 2Hz (P=.042) and 4Hz (P=.047) with CE. In adults, the differences were observed at 1/2Hz (P=.010), 1Hz (P<.001), 2Hz (P<.001) and 4Hz (P<.001) with OE and 1/4Hz (P=.027), 1/2Hz (P=.005), 1Hz (P=.001), 2Hz (P<.001) and 4Hz (P=.003) with CE. In children, no significant differences were reported between both groups.
ConclusionsThe results of this study show that people with DS are more demanding on the sensory systems to maintain bipedal posture.
El síndrome de Down (SD), también conocido como trisomía del par 21, corresponde a una alteración genética producida por la presencia de un cromosoma extra en dicho par1. En Latinoamérica, la incidencia reportada de SD alcanza 1,88 casos por 1.000 nacidos vivos, siendo Chile el país con mayores tasas (2,47 por mil nacidos vivos)2.
Dentro de las alteraciones funcionales más comunes que presentan las personas con SD se encuentra el déficit en la fuerza, resistencia muscular e hipotonía, lo que se traduce en el retraso de la adquisición de hitos del desarrollo motor y la dificultad de desarrollar habilidades motoras3. Se ha considerado que un adecuado control postural es la base en el desarrollo de habilidades motoras en personas con SD4. Estudios han reportado que niños, adolescentes y adultos con SD presentan un deterioro del control postural en comparación con sus pares con desarrollo típico (DT)5-7.
El control preciso y eficaz de la postura requiere el funcionamiento adecuado y la integración de múltiples sistemas sensoriales y motores. Como tal, las contribuciones del sistema visual, somatosensorial y vestibular en el control postural se han establecido desde hace mucho tiempo8. Diversas investigaciones han estudiado el control postural en personas con SD a partir de las oscilaciones del centro de presión (CP). Esta variable es medida a través de una plataforma de fuerza, la cual principalmente analiza la amplitud de la señal de oscilación del CP5-7. Sin embargo, el análisis espectral de las oscilaciones posturales ha sido poco estudiado en esta población y, por lo tanto, no existen muchos antecedentes de las contribuciones de los sistemas sensoriales en el control postural de las personas con SD.
El análisis espectral de las oscilaciones posturales ha sido utilizado para investigar la influencia de los sistemas sensoriales sobre el control postural en jóvenes y adultos mayores sanos y con enfermedad (p. ej., esclerosis múltiple y parálisis cerebral)9-12. Para este análisis, el espectro de energía de las excursiones del CP generalmente se dividen en 3bandas de frecuencias: baja (< 0,1Hz), media (0,1 a 1Hz) y alta (> 1Hz)13. Las frecuencias bajas están asociadas con la regulación visual, las frecuencias medias con regulación vestibular y las frecuencias altas con regulación somatosensorial. Redfern et al. (2001) proponen que los sistemas sensoriales son solicitados para mantener el control postural en rangos específicos de frecuencias de oscilación corporal. En frecuencias bajo los 0,1Hz, el cuerpo demandaría principalmente el sistema visual. Los órganos otolíticos serían solicitados entre los 0,1 y 0,5Hz y los canales semicirculares del sistema vestibular entre 0,5Hz y 1Hz. Frecuencias sobre 1Hz solicitarían en mayor medida al sistema somatosensorial14. En este contexto, el análisis espectral de las oscilaciones posturales ayudaría a comprender las posibles alteraciones que sufren los sistemas sensoriales en las personas con SD y su repercusión en el control de la postura y desempeño motor.
Por lo tanto, el propósito de este estudio fue identificar la contribución de los sistemas sensoriales en el control postural de personas con SD.
MétodoEste es un estudio observacional de tipo ex post facto. La muestra fue seleccionada de manera no probabilística y por conveniencia. El grupo con SD fue obtenido de 7 escuelas especiales de las ciudades de Talca y Linares (Región del Maule, Chile). Por su parte, el grupo con DT fue obtenido de 6 escuelas públicas de la misma región. Para seleccionar a los estudiantes con DT se buscó a personas con características basales similares a la muestra con SD (edad, peso, talla e IMC). Todos los participantes con SD y menores de edad con DT fueron autorizados por sus tutores legales mediante un asentimiento informado. Los adultos con DT leyeron y firmaron voluntariamente un consentimiento informado. El asentimiento y el consentimiento informado fueron aprobados por el comité de ética de la Universidad Santo Tomás (Chile) y basado en los principios dispuestos en la Declaración de Helsinki.
ParticipantesLa muestra fue compuesta por 104 participantes pertenecientes a la provincia de Linares, Región del Maule (Chile). Se dividieron en grupos de niños, adolescentes y adultos. Los grupos fueron compuestos por 32 niños entre 6 a 11 años (16 SD; 16 DT), 42 adolescentes entre 12 y 18 años (21 SD; 21 DT) y 30 adultos jóvenes entre 19 y 28 años (15 SD; 15 DT). Los participantes con SD y DT debían ser capaces de comprender instrucciones simples y caminar independientemente. Para ambos grupos, se consideraron los siguientes criterios de exclusión: lesiones musculoesqueléticas, cirugías de miembros inferiores, dolor en cualquier parte del cuerpo en el momento de la evaluación, trastornos vestibulares, trastornos visuales no corregidos y uso de ayuda técnica para la deambulación.
ProcedimientoLas mediciones de las oscilaciones posturales fueron realizadas con una plataforma de fuerza ArtOficio (Artoficio Ltda., Santiago, Chile), tamaño 40×40cm. Los datos fueron adquiridos con una tasa de muestreo de 40Hz. La medición del control postural se realizó en situación de ojos abiertos (OA) y ojos cerrados (OC). Cada una de ellas con una duración de 30 s. Los participantes fueron instruidos en mantener la posición bípeda lo más quieta posible, con los brazos relajados al costado del tronco y con los pies con una separación similar al ancho de los hombros. Se calcularon las variables área y velocidad del CP utilizando el software Matlab r2012a. (Mathworks Inc., Natick, EE. UU.). Para el análisis espectral de las oscilaciones del CP se utilizó el software Igor Pro versión 5.01 (WaveMetrics Inc., Oregon, EE. UU.) y se realizó una operación matemática que transformó la señal de dominio de tiempo a dominio de frecuencia, método denominado transformada de Fourier. A partir de la excursión del CP, se obtuvieron las siguientes bandas de frecuencias: 1/16, 1/8, 1/4, 1/2, 1, 2 y 4 Hz. Se definió que la banda 1/16Hz representaría el aporte del sistema visual, las bandas 1/8, 1/4, 1/2 y 1Hz la participación del sistema vestibular y que las bandas 2 y 4Hz corresponden a las contribuciones del sistema somatosensorial14.
Análisis estadísticoPara el análisis estadístico se utilizó el software SPSS 23.0 para Windows (SPSS Inc., IL, EE. UU.). Se realizaron las pruebas de Shapiro-Wilk y de Levenne para determinar la distribución de normalidad de los datos y la homogeneidad de varianza, respectivamente. Se utilizó la prueba de U de Mann-Whitney para comparar las características basales de la muestra (edad, peso, talla e IMC), variables del CP y las bandas de frecuencia entre los grupos con SD y DT en cada rango etario. Se consideró un nivel alfa de 0,05 para todos los análisis.
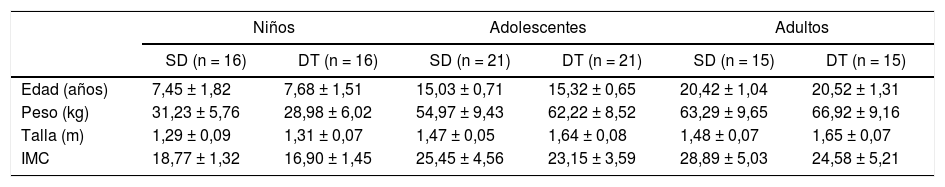
ResultadosEn la tabla 1 se observan las características basales de la muestra (edad, peso y talla e IMC). En niños no se encontraron diferencias significativas en ninguna de las variables comparadas (p > 0,05). En adolescentes se encontraron diferencias significativas en peso (p = 0,032) y talla (p = 0,001), mientras que en adultos las diferencias se dieron en talla (p = 0,003) e IMC (0,026).
Características basales de los participantes (media ± desviación estándar)
| Niños | Adolescentes | Adultos | ||||
|---|---|---|---|---|---|---|
| SD (n = 16) | DT (n = 16) | SD (n = 21) | DT (n = 21) | SD (n = 15) | DT (n = 15) | |
| Edad (años) | 7,45 ± 1,82 | 7,68 ± 1,51 | 15,03 ± 0,71 | 15,32 ± 0,65 | 20,42 ± 1,04 | 20,52 ± 1,31 |
| Peso (kg) | 31,23 ± 5,76 | 28,98 ± 6,02 | 54,97 ± 9,43 | 62,22 ± 8,52 | 63,29 ± 9,65 | 66,92 ± 9,16 |
| Talla (m) | 1,29 ± 0,09 | 1,31 ± 0,07 | 1,47 ± 0,05 | 1,64 ± 0,08 | 1,48 ± 0,07 | 1,65 ± 0,07 |
| IMC | 18,77 ± 1,32 | 16,90 ± 1,45 | 25,45 ± 4,56 | 23,15 ± 3,59 | 28,89 ± 5,03 | 24,58 ± 5,21 |
DT: desarrollo típico; IMC: índice de masa corporal; kg: kilogramos; m: metros; SD: síndrome de Down.
Al comparar las variables del CP se observó un mayor valor de las variables velocidad OC (p = 0,039) y área OC (p = 0,041) en adolescentes con SD. En adultos, el grupo con SD también presentó mayores valores de las variables velocidad OA (p = 0,021), área OC (p = 0,012) y velocidad OC (p < 0,001). A pesar de que los niños con SD tienen mayores valores de las variables del CP en comparación con sus pares con DT, no se encontraron diferencias estadísticamente significativas.
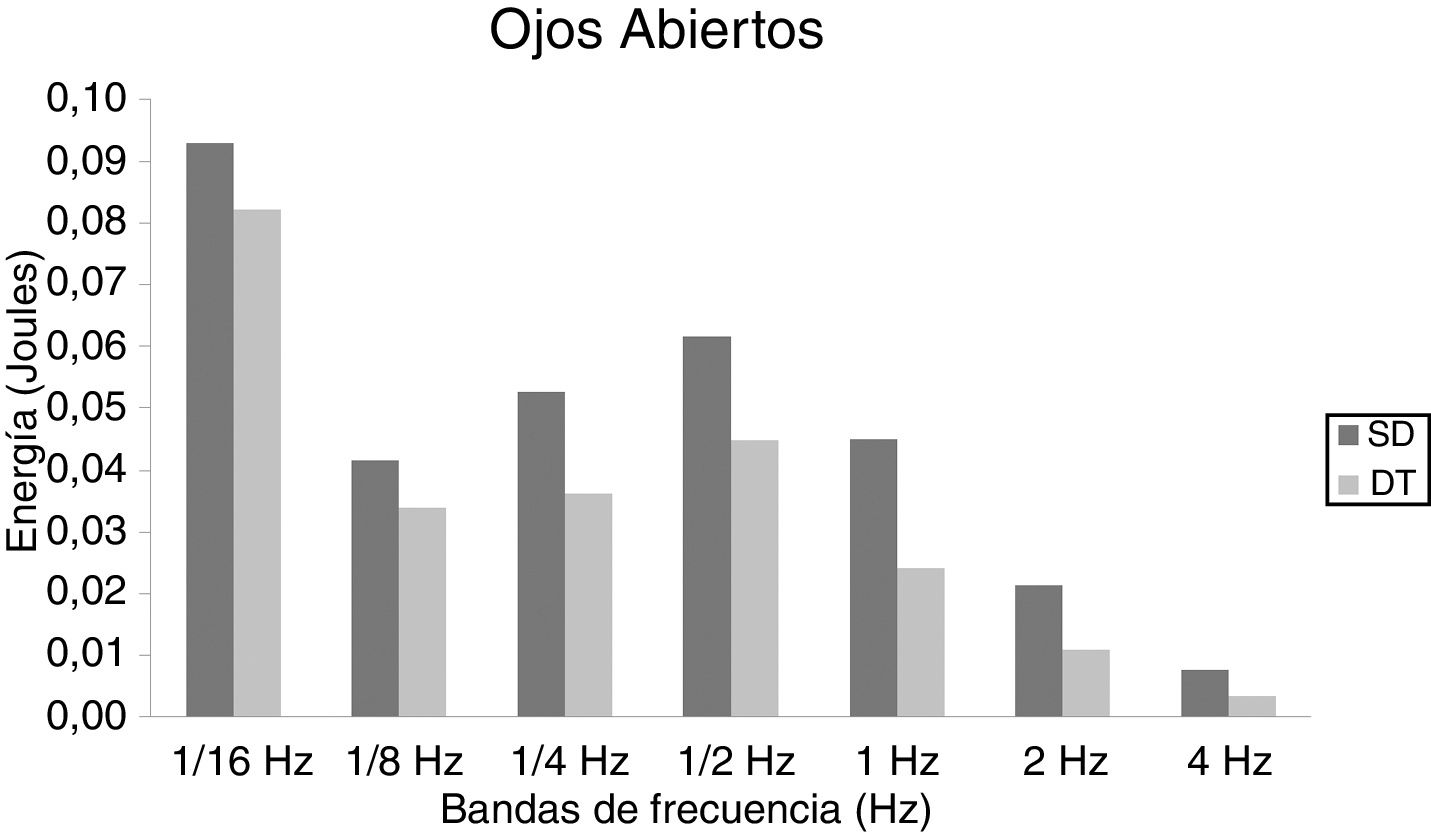
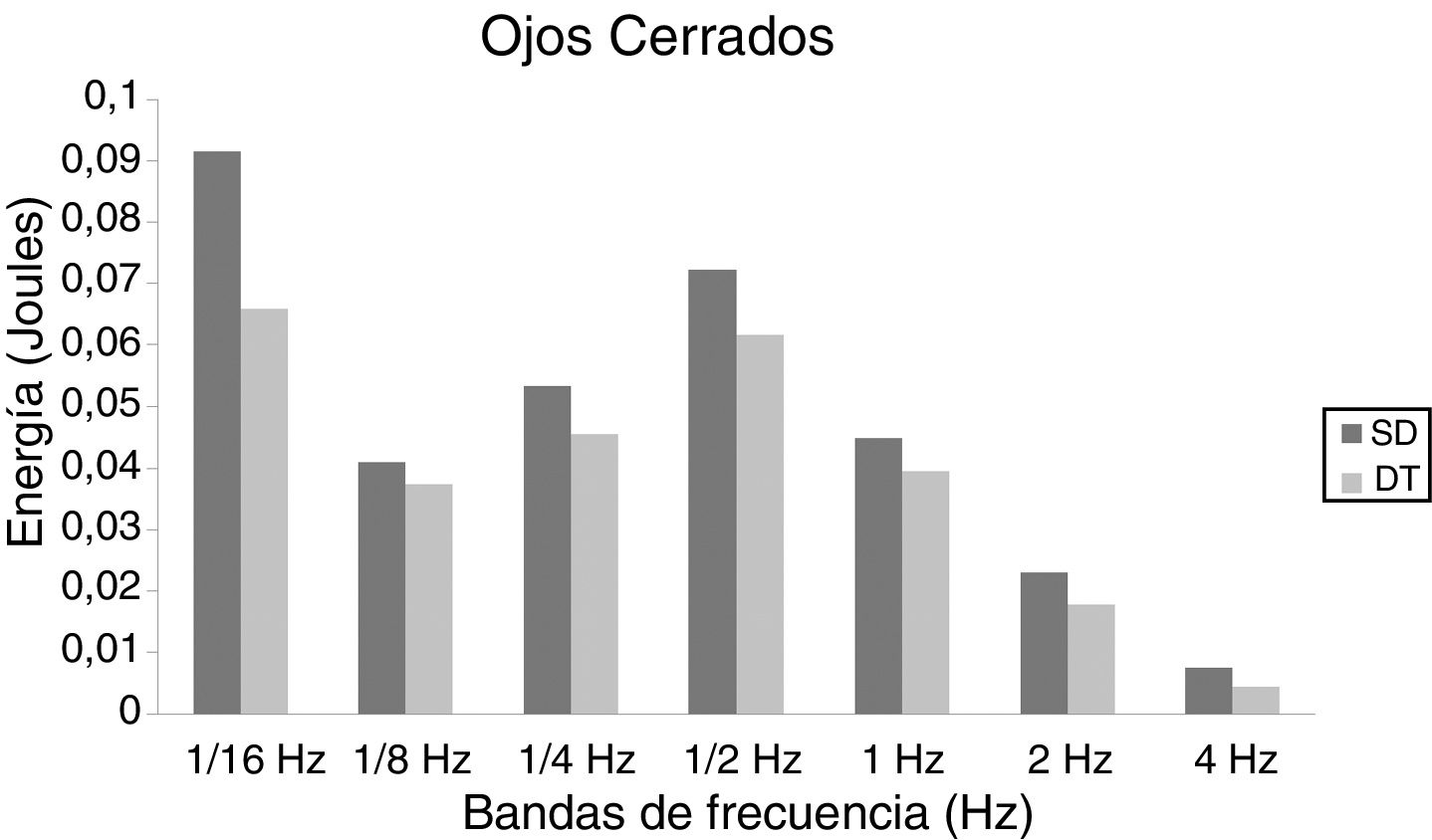
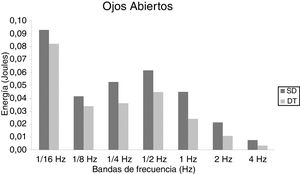
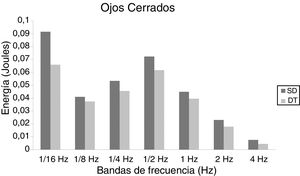
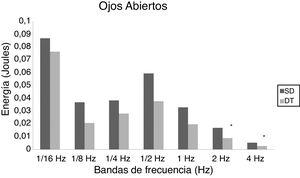
En niños, se observó una mayor energía utilizada por el grupo SD en todas las bandas de frecuencias analizadas. Esto ocurrió tanto en OA (fig. 1) como OC (fig. 2). Sin embargo, no hubo diferencias estadísticamente significativas.
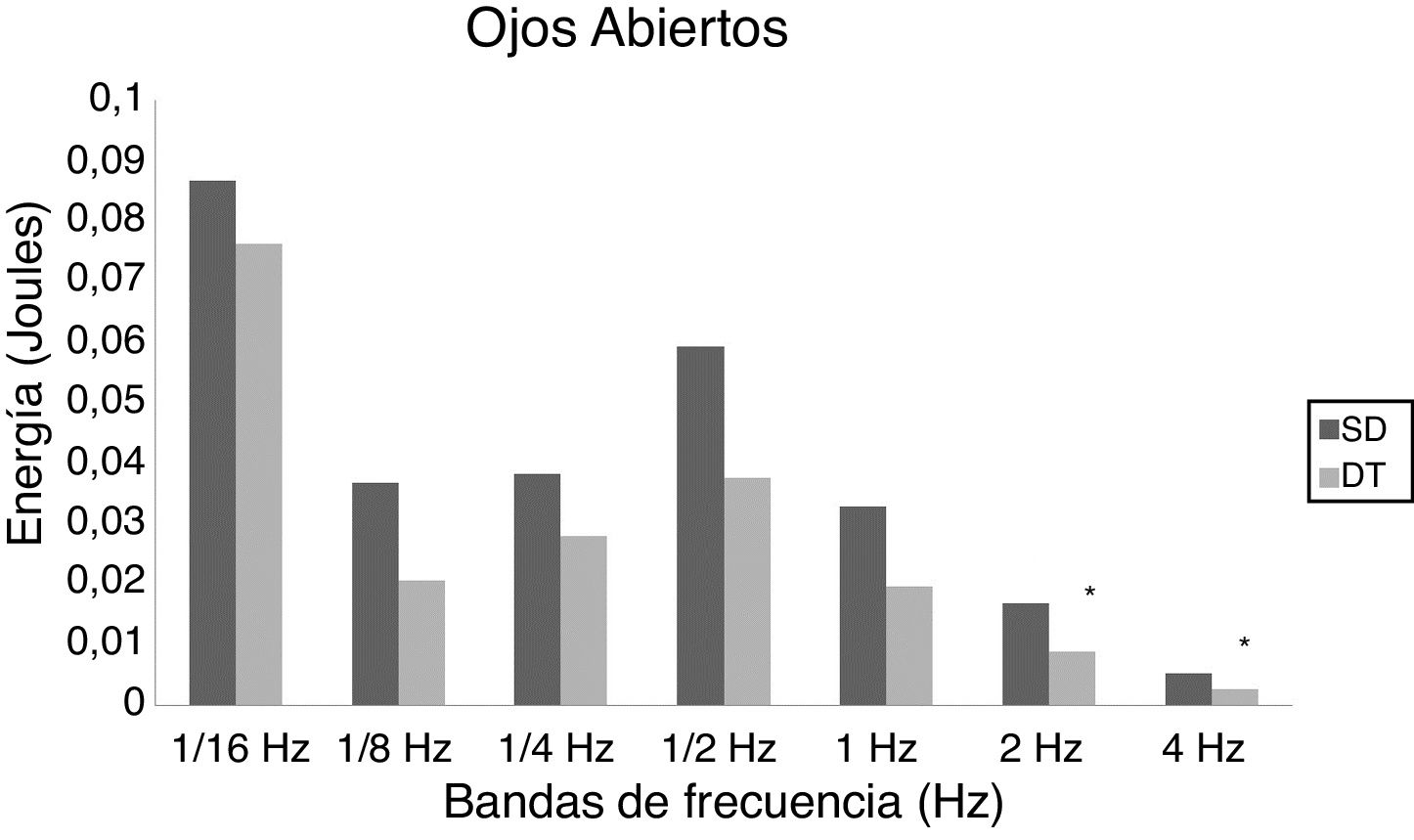
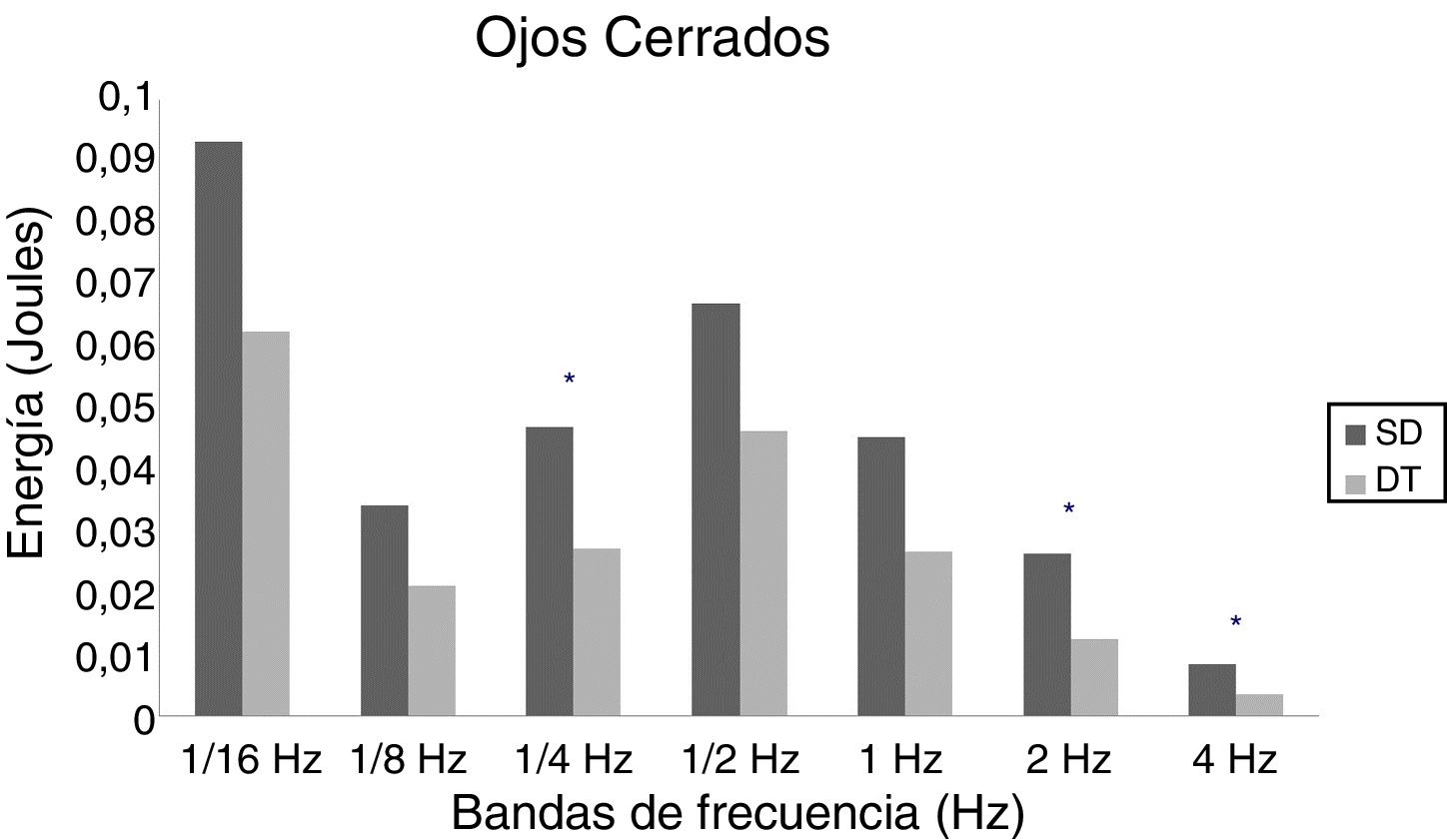
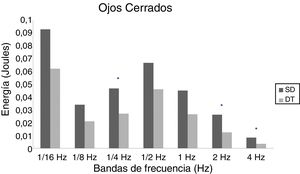
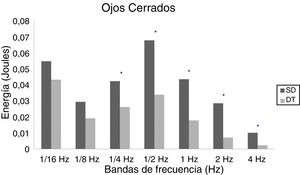
En adolescentes, la energía utilizada por las personas con SD para mantener la postura fue mayor que las con DT, siendo significativa para las bandas de 2Hz (p = 0,015) y 4Hz (p = 0,012) en OA (fig. 3) y para las bandas de 1/4Hz (p = 0,033), 2Hz (p = 0,042) y 4Hz (p = 0,047) en OC (fig. 4).
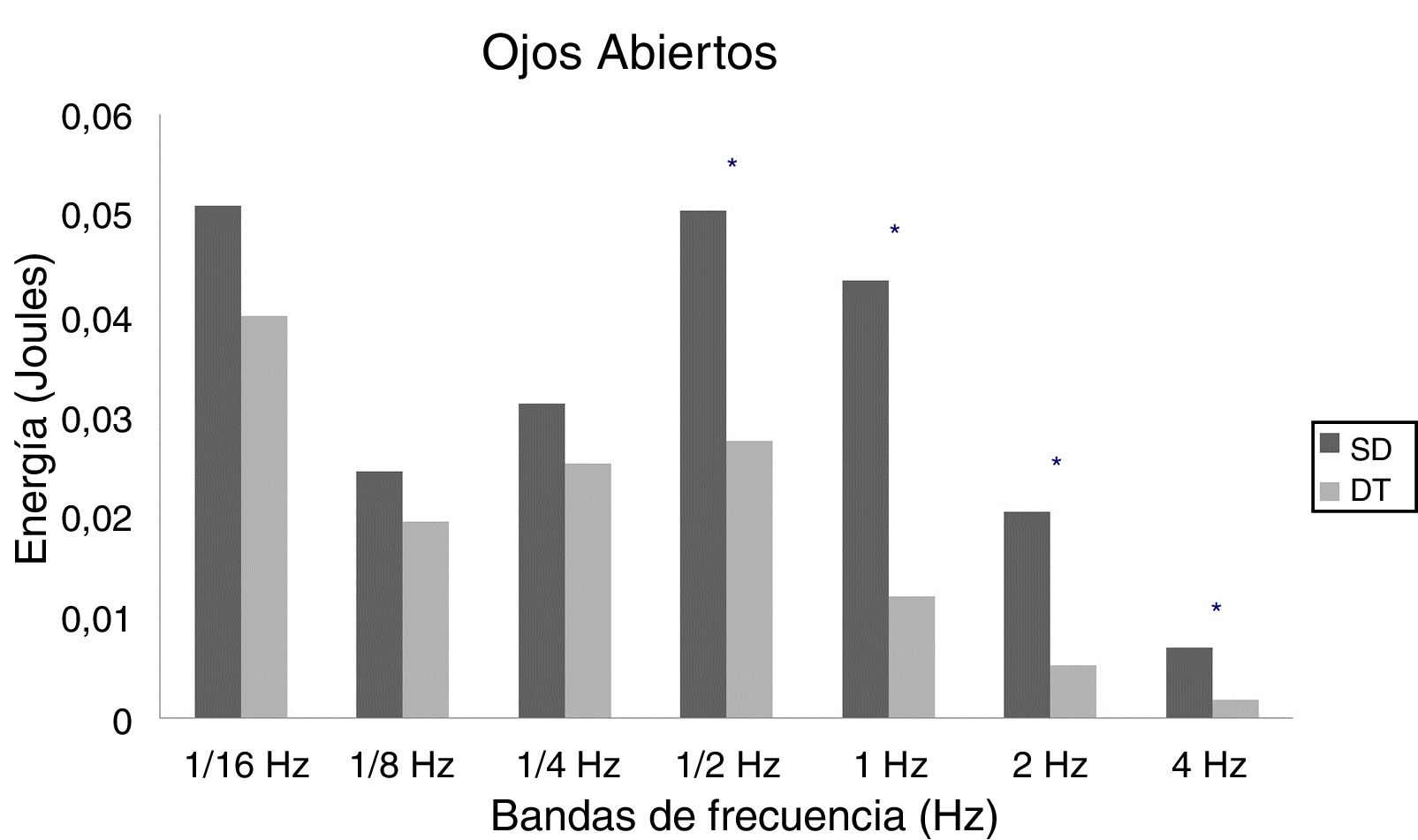
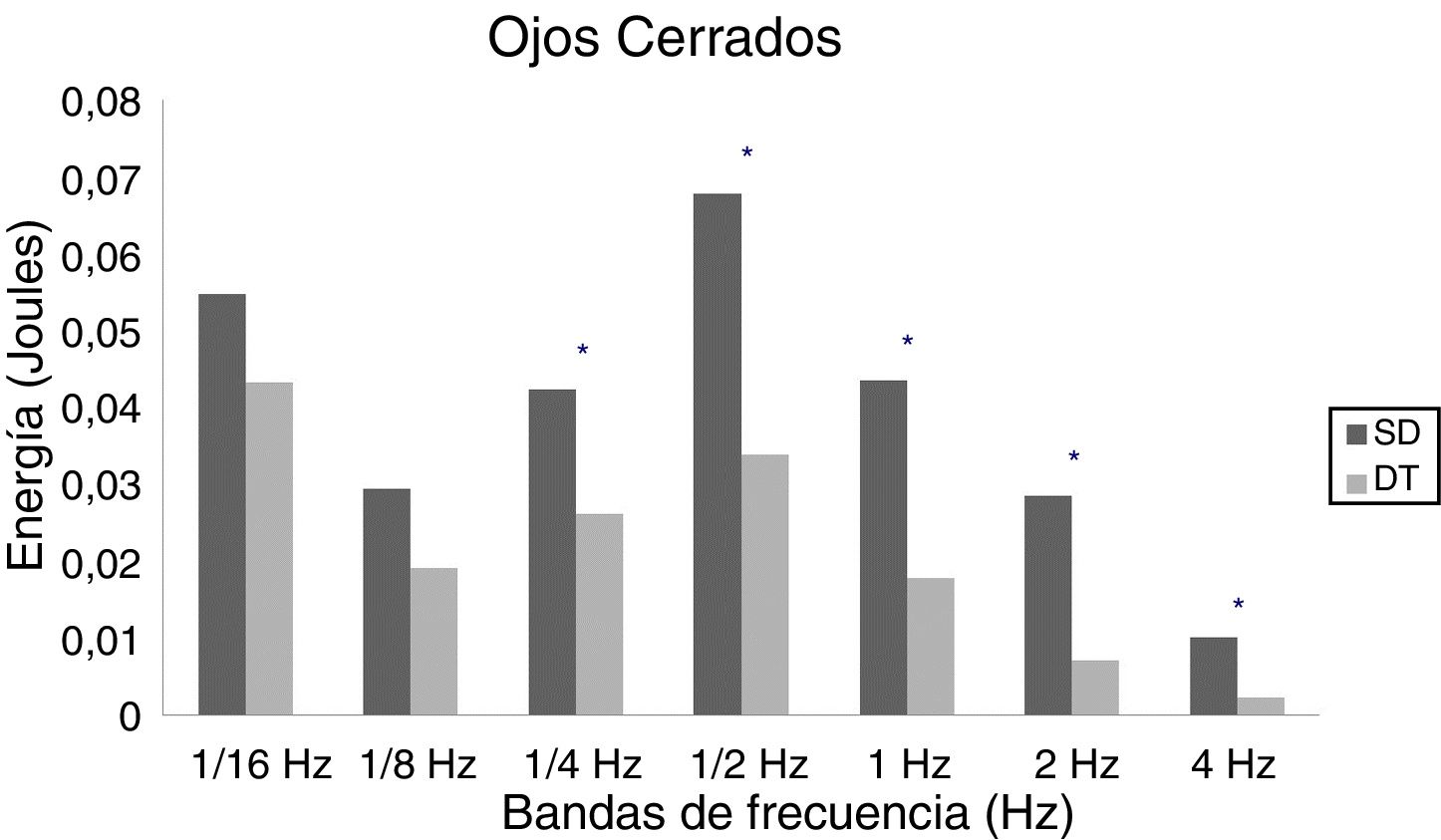
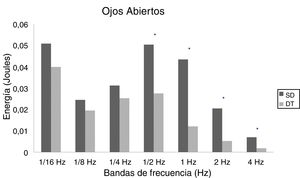
En adultos, se observaron diferencias estadísticas se observaron en 1/2Hz (p = 0,010), 1Hz (p < 0,001), 2Hz (p < 0,001) y 4Hz (p < 0,001) en OA (fig. 5) y 1/4Hz (p = 0,027), 1/2Hz (p = 0,005), 1Hz (0,001), 2Hz (p < 0,001) y 4Hz (p = 0,003) en OC (fig. 6).
Los resultados de este estudio muestran que las personas con SD demandan en mayor medida los sistemas sensoriales para mantener la postura bípeda, lo cual estaría directamente relacionado con el déficit del control postural encontrado en este grupo de personas. Coincidentemente con estudios previos, las alteraciones del control postural se evidencian en adolescentes y adultos, mientras que en niños solo se observan tendencias de un pobre equilibrio postural7. De acuerdo con nuestros resultados, las diferencias entre personas con SD y DT en los aportes sensoriales que contribuyen al control postural están dadas principalmente en los sistemas vestibular y somatosensorial. Si bien el sistema visual tiene una mayor demanda en el grupo con SD, su diferencia no es significativa con el grupo de DT.
Las causas del déficit del control postural en personas con SD son multifactoriales. Algunos autores consideran que las limitaciones cognitivas, desórdenes neurológicos, alteración en la integración sensoriomotora y compromiso del sistema somatosensorial son las causas más influyentes en la pérdida del balance postural15-18. Asimismo, se cree que deficiencias biomecánicas como la hipoplasia del cartílago, hiperlaxitud ligamentosa y debilidad muscular podrían afectar negativamente a la posibilidad de generar torque y fuerza durante las contracciones musculares, lo cual impediría un adecuado control de la postura5,19.
Se ha demostrado en modelos animales y humanos que el SD se asocia con una disminución del volumen cerebeloso debido, entre otras variables, a una reducción en la densidad de células granulosas20. El cerebelo trabaja en conjunto con la corteza y los ganglios basales en tareas cognitivas y motoras de variada complejidad, desde el establecimiento de mapas sensoriales hasta el razonamiento lógico21. Las células granulosas reciben aferencias de la corteza prefrontal dorsolateral (área 46 de Brodmann) que, en relación con la función motora, tiene una participación importante en la planificación, organización y regulación de las respuestas motoras22. Además, estas células también reciben información somatosensorial y vestibular para su posterior procesamiento cerebeloso22, por lo que resulta lógico encontrar una alteración en estos sentidos en tareas asociadas al control postural. A esta deficiencia funcional se le suma potencialmente hallazgos en modelos animales de SD, tales como la sobrerregulación de las concentraciones de la proteína DYRK1A, la cual influye en la disfunción de tareas que involucran coordinación, aprendizaje y control motor23, y una sobreinhibición patológica de la corteza somatosensorial primaria24. Esto de igual forma influye directamente en el control postural.
El mantenimiento del control postural es dependiente de los sistemas sensoriales y de su capacidad de integrar la información en el SNC para generar una respuesta motora adecuada a las necesidades del ambiente25. Existe discrepancia en relación con la maduración fisiológica de los sistemas sensoriales y su contribución en el control postural. Algunos estudios señalan que la maduración de los sistemas sensoriales ocurre entre los 7-10 años, donde los patrones de respuestas son similares a los adultos26,27. Contrariamente, otros autores indican que la maduración de estos sistemas se alcanza alrededor de los 14-15 años de edad25. De acuerdo con nuestros resultados, las diferencias del control postural entre personas con SD y DT podrían estar fuertemente influidas por la maduración de los sistemas sensoriales y su contribución relativa. En este contexto, los niños (sistemas sensoriales inmaduros) no presentaron diferencias tanto en el control postural como en los aportes sensoriales. Por el contrario, los adultos (sistemas sensoriales maduros) con SD fueron poco eficaces en el uso de los sistemas vestibular y somatosensorial, lo cual se relaciona con mayores oscilaciones posturales. En personas con DT, el desarrollo progresivo de los sistemas sensoriales genera un mejor desempeño del control postural, el cual alcanza su mayor rendimiento en las primeras etapas de la adultez27. Aparentemente, a partir de la adolescencia, los individuos con SD sufren un retraso o alteración de sus sistemas vestibular y somatosensorial que afecta al control postural. Esto acrecienta las diferencias entre personas con SD y DT a medida que el individuo madura. Conclusiones similares proponen Carvalho y Vasconcelos, quienes consideran que los individuos con SD presentan un déficit somatosensorial asociado a una mayor dependencia del sistema vestibular28.
Otra perspectiva interesante a considerar es que ambos grupos de niños, DT y SD, están en procesos latentes de remodelación neural para lograr una adaptabilidad funcional29, por lo que es esperable que el rendimiento sea similar; sin embargo, ya en la adolescencia la red neural está bastante más definida y diferenciada, mostrando claras diferencias entre personas con DT y SD29,30. Adultos con SD demostraron marcadas reducciones en la longitud/ramificación dendrítica y en la densidad de las espinas sinápticas en las neuronas piramidales de la corteza parietal y no piramidales de la corteza motora30, lo cual puede potencialmente explicar las diferencias estadísticamente significativas entre los grupos DT y SD de adolescentes y adultos. Estas diferencias entre la red neural adulta de la persona con DT y SD se justifica por la mala regulación de los periodos críticos del desarrollo neural en enfermedades relacionadas con alteraciones del neurodesarrollo, tal como lo es el SD31. Un periodo crítico alterado de base tiene efectos deletéreos en la conformación final de la red neural adulta31, lo cual influirá directamente en tareas de control postural.
La mayor demanda de los sistemas vestibular y somatosensorial en las personas con SD podrían deberse a un mecanismo de compensación a las mayores oscilaciones posturales que presentan durante una postura bípeda. Algunos autores han planteado que el uso de la información sensorial en personas con SD ayuda a disminuir las oscilaciones posturales15,32. Según nuestros resultados, el uso de los sistemas sensoriales en las personas con SD es ineficiente en comparación con los DT, ya que a pesar de requerir en mayor medida la información sensorial, de igual forma su control postural es deficiente en comparación con las personas con DT. Se cree que las escasas experiencias sensoriomotoras experimentadas por los niños con SD influyen paulatinamente en el pobre desarrollo del control postural en etapas posteriores (adolescencia y adultez) y, por consiguiente, una mayor demanda de los sistemas sensoriales4.
Dentro de las limitaciones de este estudio se encuentra la selección por conveniencia de los participantes, lo cual puede restringir la validez externa del estudio. Por lo tanto, se recomienda para futuros estudios realizar un cálculo del tamaño de la muestra y aleatorizar la selección de los participantes.
En conclusión, nuestros resultados indican que las personas con SD demandan ineficazmente los sistemas sensoriales que contribuyen en el control de la postura en comparación con personas con DT. Estas diferencias son observadas en la adolescencia y adultez y, principalmente, en los sistemas vestibular y somatosensorial. Para la rehabilitación de personas con SD recomendamos aplicar intervenciones tempranas enfocadas en promover una estimulación e integración sensoriomotora que reduzca la probabilidad de alteraciones en el desarrollo del control postural.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.