En la angiopatía cerebral de moyamoya (AMM) existe una estenosis progresiva de la arteria carótida interna y/o de sus ramas principales y colaterales «moyamoya».
Caso clínicoGestante de 22 años con DM1 sometida a cesárea urgente por preeclampsia. En el puerperio inmediato presentó cefalea, fotopsias y disartria, el «signo de la hiedra» en la resonancia magnética y una angiografía diagnóstica de AMM.
ConclusionesEl pronóstico de la AMM es más pobre cuando el comienzo es en el embarazo o puerperio. En nuestro caso, la preeclampsia, la DM1 y el descenso de la presión arterial posparto pudieron desempeñar un factor precipitante.
In cerebral moyamoya angiopathy (MMA) there is s progressive stenosis of the internal carotid artery and/or its main branches.
Case reportA 22 year old pregnant with type 1 DM had an urgent cesarean section because of pre-eclampsia. In the early puerperium suffered headache, photopsia and dysarthria, the «ivy sign» in the MRI and a diagnostic angiography for MMA.
ConclusionMAA prognosis is poorer when the onset is during pregnancy or puerperium. In our chase pre-eclampsia, DM, and the blood pressure lowering after delivery could have played a role as precipitating factors.
La angiopatía cerebral de moyamoya (AMM) se caracteriza por la estenosis progresiva de la arteria carótida interna (ACI) intracraneal y/o de sus ramas principales: la arteria cerebral anterior (ACA) y la arteria cerebral media (ACM). La progresión de esta enfermedad estenooclusiva asocia el desarrollo compensatorio de una red de colaterales en la base del cerebro que toma la apariencia en la arteriografía de «bocanada de humo» o «moyamoya» en japonés.
Se debe distinguir entre la enfermedad de moyamoya (EMM), que suele presentarse como una angiopatía aislada y habitualmente bilateral, y los síndromes de moyamoya (SMM), en los que la angiopatía se asocia a otras manifestaciones neurológicas o extraneurológicas, con o sin una condición adquirida o hereditaria conocida. Independientemente de la causa, la AMM incrementa el riesgo de daño cerebral isquémico y hemorrágico.
Presentamos el caso de una paciente con diabetes mellitus tipo 1 (DM1) y preeclampsia con una AMM isquémica que se manifiesta durante el puerperio, tratando de discutir los factores que han podido intervenir en su comienzo en este contexto clínico.
Caso clínicoMujer gestante de 22 años, con antecedente de DM1, diagnosticada en la infancia, y con mal control glucémico. No refería otros antecedentes médicos de interés. Su madre había presentado migrañas.
La paciente fue ingresada en Ginecología en la 33.a semana de gestación por presentar descompensación de la DM1 y cifras tensionales elevadas en contexto de una preeclampsia no conocida, que motivó la realización de una cesárea urgente. Durante las primeras 24 h tras el parto, comenzó con cefalea y fotopsias, y 7 días después se añadió una alteración brusca en el lenguaje. En la exploración neurológica se objetivó una paresia facial inferior derecha y disartria. El nivel de consciencia, la orientación, el resto de pares craneales, el sistema motor y el sensitivo estaban conservados. No presentó nistagmo ni dismetrías y la marcha era normal. La paciente había presentado cifras tensionales elevadas hasta el momento del parto, momento a partir del cual descendieron de forma significativa.
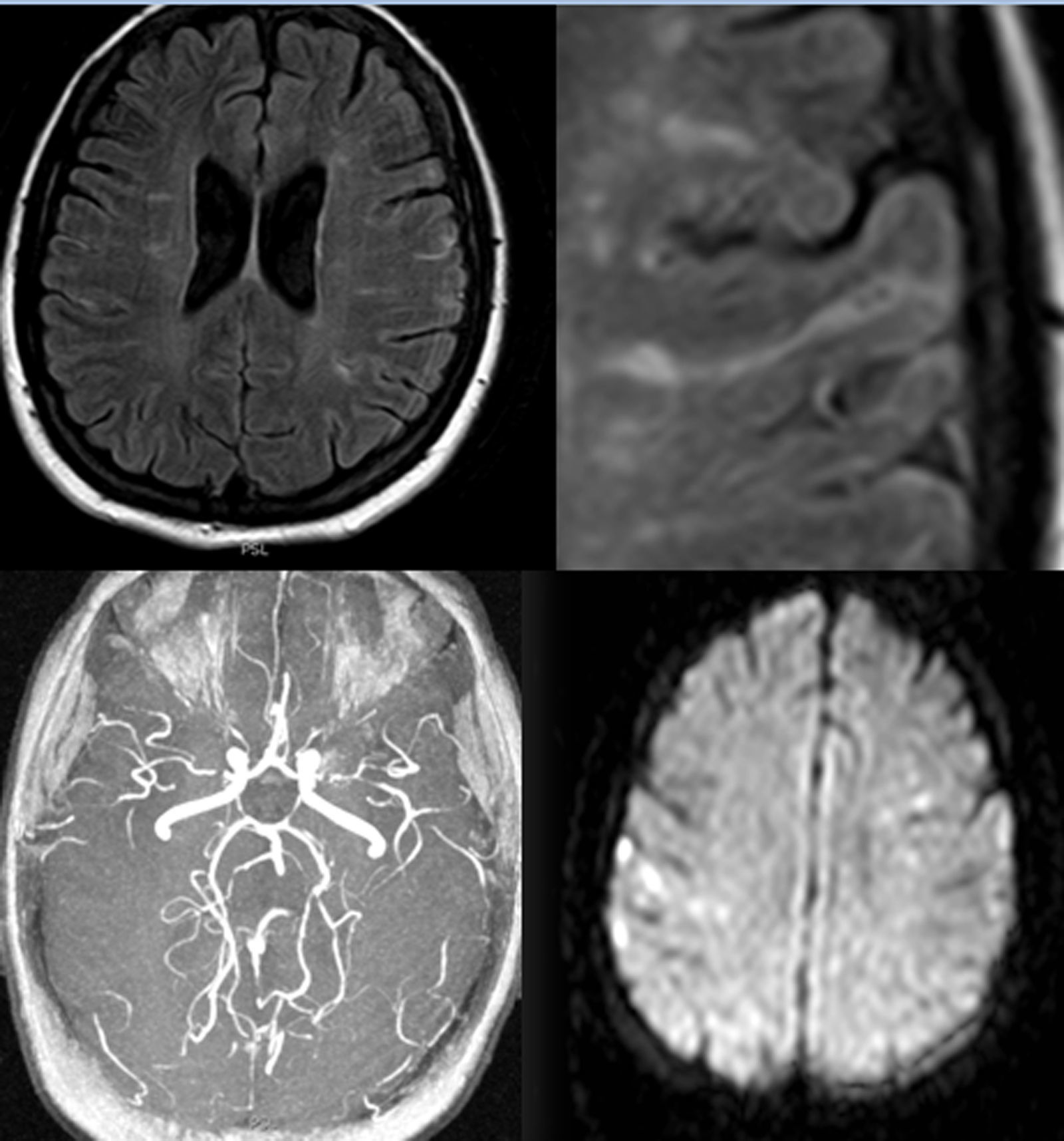
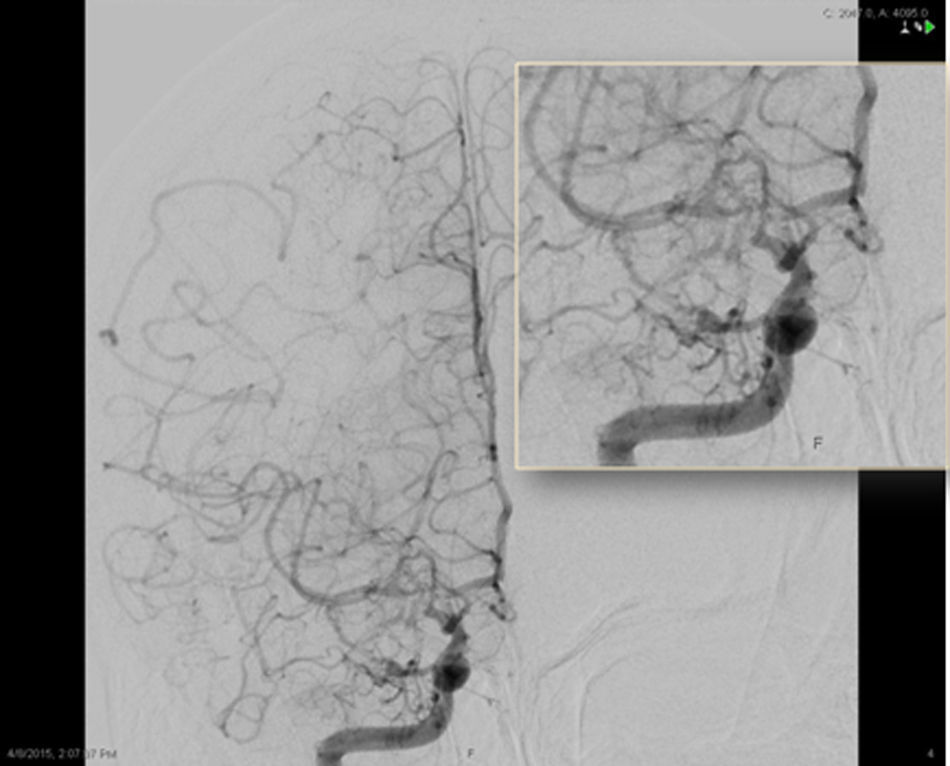
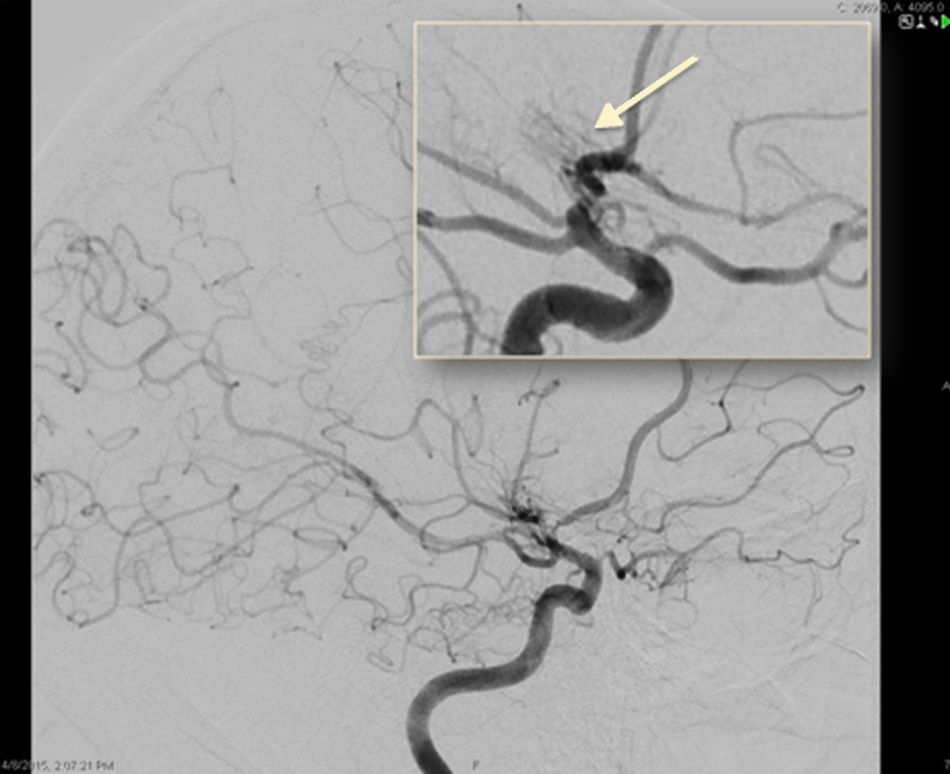
Se realizaron una resonancia magnética (RM) cerebral (fig. 1) y una arteriografía cerebral (figs. 2 y 3). Se completó el estudio etiológico con ecocardiograma, que fue normal; estudio de coagulación, con niveles anticoagulante lúpico en el límite alto de la normalidad que no se confirmó en segunda determinación; analítica incluyendo inmunidad y serologías, sin alteraciones patológicas. Se realizó análisis del líquido cefalorraquídeo con punción traumática que mostró la presencia de 400 hematíes (sin xantocromía), ausencia de pleocitosis, proteínas y glucosa normales.
RM cerebral. Múltiples focos hiperintensos en T2 y FLAIR en la sustancia blanca de ambos hemisferios cerebrales adoptando en algún caso una morfología lineal siguiendo la dirección de los surcos corticales. La secuencia angiográfica Time Of Flight (TOF) del polígono de Willis muestra un calibre reducido en ambas arterias cerebrales medias en su segmento proximal (M1). Focos de restricción de la difusión en relación con pequeños infartos agudos.
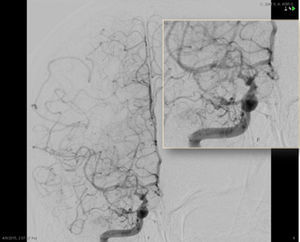
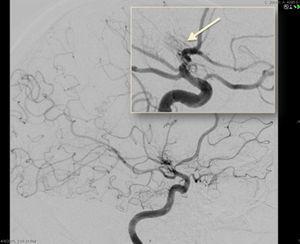
ASD carotídea interna derecha, proyección frontal. Disminución progresiva del calibre de la porción intracraneal de la ACI y sus ramas principales (ACM y ACA), con presencia de múltiples neovasos colaterales finos, tanto en torno al polígono de Willis como en la convexidad, y numerosas anastomosis piales entre los territorios de la ACM y ACA.
Los hallazgos angiográficos permitieron el diagnóstico de AMM, iniciándose tratamiento antiagregante a dosis de 100mg al día como prevención secundaria de las recurrencias, además de recomendaciones higiénico dietéticas para la prevención de la hipoperfusión cerebral. Clínicamente, ha presentado una evolución favorable, con resolución de la clínica neurológica, sin nuevos eventos isquémicos o hemorrágicos hasta la fecha.
DiscusiónLa EMM puede ser considerada una enfermedad rara en países occidentales, siendo 10 veces menos frecuente que en países de asiáticos1-3. La prevalencia e incidencia más alta se encuentran en Japón (3,16-10,5/100.000 y 0,35-1,13/100.000/año, respectivamente). La historia familiar en los países del este de Asia es también más frecuente, hasta en un 15% de los casos comparado con un 7,5% en países occidentales. Es más frecuente en mujeres y la edad de presentación sigue una curva bimodal con un primer pico en la infancia de los 5 a los 10 años y un segundo pico en torno a los 40 años.
La fisiopatología en la EMM es desconocida, pero se sospecha que existe una fuerte contribución genética, habiéndose identificado recientemente el primer gen de susceptibilidad en la EMM en pacientes japoneses4,5 que codifica una proteína con actividad ubiquitin ligasa.
Los adultos pueden comenzar tanto con síntomas de isquemia como de hemorragia cerebrales (siendo las segundas menos frecuentes en países occidentales), mientras que en la infancia predominan los eventos isquémicos.
Es característico que los eventos vasculares se precipiten tras hiperventilación en situación de estrés: deshidratación, fiebre, el llanto en bebés o el parto. En los pacientes con EMM, los vasos corticales están dilatados de forma máxima en estado basal para compensar el estado de isquemia crónica, por lo que la vasoconstricción en respuesta a la disminución del CO2 relacionada con la hiperventilación conduce a una reducción en la perfusión cerebral. En el caso de nuestra paciente, la hiperventilación en el contexto del parto junto con el descenso en las cifras tensionales pudieron jugar un papel desencadenante. Los cambios hemodinámicos durante el puerperio pueden además incrementar el estrés oxidativo a nivel cerebral, llevando a una disregulación del tono vascular, similares a los que intervienen en el síndrome de vasoconstricción cerebral reversible.
Nuestra paciente presentó cefalea de perfil migrañoso, síntoma frecuente en relación con la estimulación de nociceptores durales por colaterales dilatados o como síntoma de hipoxia crónica.
El diagnóstico de la AMM se basa, por un lado, en identificar la estenosis de una o ambas ACI distales y/o de sus amas (ACA y ACM) y, por otro, la neovascularización, reflejando la naturaleza progresiva del proceso de estenosis. La arteriografía cerebral por sustracción digital es el gold standard para el diagnóstico y la clasificación de la AMM, aunque dada su invasividad está siendo progresivamente desplazada por la angio-RM. Los criterios angiográficos y la severidad de la enfermedad según los grados de Suzuki se resumen en la tabla 1.
Criterios angiográficos para el diagnóstico de AMM. Grados angiográficos según la clasificación de Suzuki
| Criterios angiográficos para el diagnóstico de la AMM |
| Estenosis u oclusión de la parte terminal de la ACI y/o la parte proximal de la ACA y/o ACM |
| Visualización de la red vascular anormal en la vecindad de les lesiones estenooclusivas, por ejemplo, en los ganglios basales y tálamo, tomando la apariencia de un «bocanada de humo» |
| El diagnóstico es de EMM definitiva si estos cambios aparecen de forma bilateral y probable si es unilateral |
| La circulación posterior está respetada |
| Grados angiográficos según la clasificación de Suzuki: |
| I. Estrechamiento del ápex de la ACI |
| II. Aparición de «vasos moyamoya» colaterales profundos |
| III. Progresión de las colaterales moyamoya |
| IV. Aparición de colaterales transdurales y reducción de los vasos moyamoya |
| V. Oclusión de la ACI y desaparición de las colaterales moyamoya |
Tomado de Suzuki y Takaku18.
La RM cerebral puede mostrar lesiones vasculares y microsangrados asintomáticos que parecen tener un valor predictivo para riesgo de ictus hemorrágico6,7. La lentitud del flujo en los vasos colaterales piales congestionados se refleja en secuencias FLAIR de la RM como hiperintensidades lineales que siguen los surcos corticales, lo que ha dado en denominarse el «signo de la hiedra»8, como es el caso de nuestra paciente (fig. 1).
El estudio de los pacientes con AMM nunca debe obviar la búsqueda de enfermedades subyacentes o signos neurológicos y extraneurológicos que puedan orientar hacia un SMM. De forma práctica, el estudio del paciente con AMM se resume en la tabla 2.
Diagnóstico del SMM
| Causas de SMM adquirido | Aspectos claves en el diagnóstico |
|---|---|
| Radioterapia de cabeza o cuello | Anamnesis |
| Tumor de la base del cráneo | Imagen de la base del cráneo |
| Ateroesclerosis de las arterias de la base del cráneo | Neuroimagen completa de las arterias cervicales |
| Meningitis crónica (sobe todo TB) Vasculitis SNC 110 | LCR |
| Angitis autoinmune | Estudio autoinmunidad en sangre (ANA) |
| Estados protrombóticos | Antitrombina, PC/PS, resistencia a la PC activada, factor v de Leyden, mutación del gen de la protrombina |
| Causas de SMM hereditario | |
|---|---|
| Enfermedad por células falciformes | EF de Hb Si paciente de origen africano o del Caribe |
Diagnóstico diferencial del SMM y aspectos claves en su diagnóstico.
Tomada de Guey et al.19
Nuestro caso plantea la cuestión de cuánto de determinantes son el embarazo y el puerperio en la progresión de la EMM hasta ese momento asintomática.
Por un lado, existe evidencia de que el pronóstico de la EMM es bueno en aquellas pacientes diagnosticadas antes del embarazo9-11, pero parece más pobre en aquellas pacientes que comienzan con ictus isquémicos durante el embarazo o en el puerperio12.
Por otro lado, se sabe que el embarazo por sí solo supone un aumento de riesgo para algunas enfermedades cerebrovasculares. La hipercoagulabilidad y el aumento de las cifras de presión arterial y de factores angiogénicos durante el embarazo pueden predisponer a eventos vasculares, aumentando la frecuencia de trombosis venosa cerebral, embolismos paradójicos, síndrome HELPP, angiopatía cerebral posparto y, como en el caso de nuestra paciente, preeclampsia y eclampsia.
El desarrollo de enfermedades neurológicas en la preeclampsia se cree relacionada con la vasoconstricción y el deterioro en la autorregulación cerebral secundaria al daño endotelial. Komiyama et al. reportaron un caso similar al nuestro indicando que la preeclampsia puede causar el deterioro clínico en la EMM9. Además, nuestra paciente presentaba otro agente implicado en el daño endotelial: la diabetes.
El curso de la enfermedad es variable, desde «silencio clínico» durante varios años hasta una rápida progresión, llevando a discapacidad grave. En la mayoría de los pacientes pediátricos se ha descrito un empeoramiento progresivo de las lesiones arteriales incluso estando asintomáticos o con lesiones unilaterales13,14, observándose una pérdida de autonomía en un 60% de los pacientes en el seguimiento a 5 años. Sin embargo, en adultos, pese a que la tasa de ictus es elevada (10-15% por año en casos sintomáticos y hasta 3% por año en los casos asintomático), el curso natural de la enfermedad parece ser menos grave, con una pérdida de autonomía de un 20% de los pacientes en los primeros años.
El tratamiento en la fase aguda, ya sea de problemas isquémicos o hemorrágicos, es sintomático. En la AMM isquémica, el uso de rTPA por vía intravenosa está contraindicado por el elevado riesgo de hemorragia intracraneal. Se recomienda la antiagregación a largo plazo tanto en niños como en adultos para prevenir fenómenos trombóticos15,16, tratamiento iniciado en nuestro caso. Lo más utilizado es la aspirina a dosis de 50-100mg/día.
El único tratamiento que parece que puede cambiar el curso de la enfermedad es la cirugía revascularizadora. En varios estudios no comparativos, la incidencia de eventos isquémicos y hemorrágicos se reduce después de la cirugía y la situación funcional parece estabilizarse. La mayoría de los niños son operados debido al peor pronóstico funcional que presenta. En adultos, las indicaciones varían de centro a centro y las decisiones deben individualizarse16,17.
Nuestra paciente, tras plantearle los riesgos y beneficios, se muestra reticente a la cirugía, por lo que, hasta el momento, se ha optado por una actitud conservadora y seguimiento estrecho.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesNinguno.