La congelación de la marcha (CDM) puede definirse como episodios intermitentes y breves de incapacidad para iniciar o mantener la locomoción o realizar un giro. La CDM en la enfermedad de Parkinson idiopática (EPI) podría estar relacionada con un compromiso funcional del lóbulo frontal. Diversos estudios durante los últimos años indican que la afectación del lóbulo frontal o una desconexión entre el lóbulo frontal y los ganglios de la base podrían ser factores implicados en la aparición de la CDM.
Pacientes y métodoHemos estudiado, mediante una batería de test neuropsicológicos de funciones del lóbulo frontal, a un grupo de 39 pacientes con EPI avanzada, analizando la diferencias entre los 19 pacientes que presentaban CDM (grupo 1) y los 20 que no tenían CDM (grupo 2).
El estudio se realizó estando los pacientes en situación off (por la mañana, media hora antes de tomar la medicación) y on (una hora después de tomar su tratamiento).
ResultadosAmbos grupos de pacientes presentaron peor rendimiento que la población control en las pruebas cognitivas frontales. En los pacientes con CDM, la disfunción ejecutiva fue mayor.
DiscusiónNuestros resultados apoyan la hipótesis, ya planteada en estudios previos, de mayor afectación frontal en pacientes parkinsonianos con CDM.
Freezing of Gait (FOG) is typically a transient episode, lasting less than a minute, in which gait is halted and the patient complains that his/her feet are glued to the ground. Frontal lobe involvement or a disconnection between the frontal lobe and basal ganglia seem to be involved in the onset of FOG.
Patients and methodWe studied 39 patients with advanced PD, 19 of them presenting FOG and 20 without suffering such episodes. Patients were assessed with a frontal functions tests battery. We analyzed the differences between both groups (with and without FOG). For that purpose patients were studied in an off-state (in the morning, and half an hour before taking the medication) and in an on-state (one hour after having their treatment).
ResultsWe found worse results in both groups in executive tests compared with normal population. Patients with FOG had worse results in executive function test.
DiscussionPatients with FOG had worse results in dorsolateral frontal functions, presents a frontal cortical component stronger than patients without FOG, as has been described in the literature in recent articles.
El «freezing», bloqueo de la marcha o congelación de la marcha (CDM) puede definirse como episodios intermitentes breves (rara vez superan los 30 s) de incapacidad para iniciar o mantener la locomoción o realizar un giro. Suelen presentarse al inicio de marcha, al encontrarse con obstáculos, con el giro…1. En los pacientes con EPI empezó a describirse sobre todo a partir de 1970, cuando el beneficio motor conseguido con la levodopa (LD) en otros síntomas de la enfermedad de Parkinson no era tan evidente para este peculiar trastorno2. Diferentes aspectos de los trastornos de la marcha, como la marcha a pequeño paso, la pérdida de los reflejos posturales y la festinación, eran bien conocidos en la época prelevodopa; en cambio, la CDM, aunque también ha sido mencionado en la literatura clásica, parece ser mucho más evidente tras el tratamiento crónico con LD3.
Los bloqueos de la marcha pueden ocurrir al inicio de la EPI, pero son mucho más frecuentes en pacientes con EP avanzada; en la mayoría de los enfermos observamos este fenómeno tras años de enfermedad y de tratamiento, cuando presentan también complicaciones, como fluctuaciones motoras (FM) y discinesias4,5 De hecho, episodios de CDM al inicio de la enfermedad cuestionan el diagnóstico de EPI.
Diversos estudios durante los últimos años indican que la afectación del lóbulo frontal o una desconexión entre el lóbulo frontal y los ganglios de la base podrían ser factores implicados en la aparición de la CDM6–8. Recientemente, Kostić et al.9 estudiaron con RM funcional y morfometría a 20 pacientes con EPI sin CDM frente a 17 con EPI y CDM, y observaron un compromiso estructural con atrofia de sustancia gris cortical a nivel frontal y periacueductal, en pacientes con EPI y CDM.
La función ejecutiva es una actividad propia de los lóbulos frontales, más específicamente de sus regiones más anteriores, las áreas prefrontales, y sus conexiones recíprocas con otras zonas del córtex cerebral y otras estructuras subcorticales, tales como los núcleos de la base, el núcleo amigdalino, el diencéfalo y el cerebelo10.
La función ejecutiva es un conjunto de habilidades cognoscitivas que permiten la anticipación y el establecimiento de metas, el diseño de planes y programas, el inicio de las actividades y de las operaciones mentales, la autorregulación y la monitorización de las tareas, la selección precisa de los comportamientos y las conductas, la flexibilidad en el trabajo cognoscitivo y su organización en el tiempo y en el espacio.
Desde un punto de vista neuropsicológico, el deterioro cognitivo asociado a la EPI se caracteriza por una disfunción de las habilidades ejecutivas y un enlentecimiento progresivo de los procesos cognitivos11. Dentro de las funciones ejecutivas que se han encontrado alteradas en los pacientes con EP, se incluyen las dificultades en la planificación, los problemas de inhibición de respuestas, el decremento en la flexibilidad conceptual y la reducción de la iniciativa y la fluidez verbal12,13.
Estos déficits se han encontrado tanto en pacientes diagnosticados de EP con demencia, como en aquellos diagnosticados de deterioro cognitivo leve (DCL) con EPI sin demencia.
Hay autores que incluso han equiparado los déficits encontrados en los pacientes con EP con los encontrados en pacientes con daño en el lóbulo frontal, específicamente los relacionados con el córtex prefrontal14,15.
Estudios previos han mostrado que los pacientes con EP y CDM tienen mayor alteración del lóbulo frontal desde el punto de vista neuropsicológico que los pacientes sin CDM y que son más susceptibles a desarrollar demencia15–19.
Nuestro estudio pretende corroborar estos resultados mediante una batería de test neuropsicológicos, que valoran las funciones frontales, en 19 pacientes con EPI con episodios de CDM y 20 pacientes con EPI sin CDM, esperando encontrar una mayor disfunción frontal en pacientes con EP y CDM.
Material y métodosSe estudiaron 2 grupos de pacientes con EPI moderada-severa con y sin CDM respectivamente (grupo 1: 19 pacientes con CDM; grupo 2: 20 pacientes sin CDM).
Todos los pacientes, procedentes de consulta externa del Hospital General Universitario de Ciudad Real, firmaron un consentimiento informado para entrar en el estudio. La evaluación motora de los pacientes la realizaron neurólogos expertos en trastornos del movimiento y en la valoración neuropsicológica participó la neuropsicóloga del Servicio de Neurología del hospital.
Los criterios de inclusión para entrar en el estudio fueron: pacientes con EP con un máximo de 80 años de edad, con un minimental test igual o superior a 24 y un test del reloj normal, para excluir a pacientes con deterioro cognitivo evidente. Se excluyó a pacientes con comorbilidad que pudiese interferir con el estudio y a aquellos con tratamiento anticolinérgico.
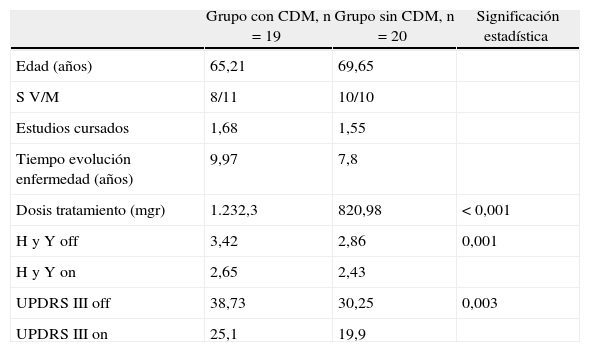
Las características de los pacientes quedan recogidas en la tabla 1.
Características de los pacientes
| Grupo con CDM, n = 19 | Grupo sin CDM, n = 20 | Significación estadística | |
| Edad (años) | 65,21 | 69,65 | |
| S V/M | 8/11 | 10/10 | |
| Estudios cursados | 1,68 | 1,55 | |
| Tiempo evolución enfermedad (años) | 9,97 | 7,8 | |
| Dosis tratamiento (mgr) | 1.232,3 | 820,98 | < 0,001 |
| H y Y off | 3,42 | 2,86 | 0,001 |
| H y Y on | 2,65 | 2,43 | |
| UPDRS III off | 38,73 | 30,25 | 0,003 |
| UPDRS III on | 25,1 | 19,9 |
CDM: congelación de la marcha; H y Y: Hoehn y Yahr; V/M: varón/mujer.
Se puntuó de 0 a 3 a los pacientes, según los estudios cursados de la siguiente manera: analfabeto (no sabe leer ni escribir) 0; sabe leer y escribir 1; estudios básicos 2, y estudios superiores 3.
Calculamos la dosis diaria equivalente de LD para todas las dosis de levodopa en las diferentes formulaciones (LD-carbidopa, LD-benseracida, LD retardada, LD-carbidopa-entacapone) y la dosis diaria total equivalente de levodopa para los agonistas dopaminérgicos, según descripciones previas (20) (100mg de LD = 130 de LD retardada = 70 de LD + entacapona = 1mg de pramipexol = 5 mg de rotigotina = 5 mg de ropirinol = 10 mg de apomorfina)20.
Los pacientes se evaluaron desde el punto de vista motor durante el «on» y el «off» mediante las escalas de Hoenh y Yarh y la UPDRS parte iii. También se cuantificaron los bloqueos de la marcha en «off» y «on».
Se cuantificaron los episodios de CDM que presentaban los pacientes al caminar una distancia de 7 m, volviendo de nuevo al punto de salida, pasando tanto en el trayecto de ida como en el de vuelta, por una puerta entornada y sorteando un obstáculo, llevando un vaso de agua en el camino de vuelta (modificado de Mathias)21. Cuantificamos estos episodios en «off» (tras estar 12 h sin tomar la medicación para la EP) y «on» (1 h tras la toma de la medicación).
La batería de test de funciones frontales se realizó por la mañana, media hora después de tomar la medicación (en situación «on») e incluyó: 1) test de Stroop (interferencia); 2) Trail Making Test partes A y B (TMT-A y TMT-B); 3) dígitos del WAIS-III (directos e inversos), 4) localización espacial de la WMS-III; 5) aritmética del WAIS-III (A); 6) cubos del WAIS-III; 7) test de fluencia verbal (fonológica y semántica); 8) test de los cinco dígitos (lectura, conteo, elección, alternancia, inhibición y flexibilidad), y 9) go-no go (secuencias motoras [SM], puño-palma-canto [PPC] y secuencias gráficas). Las puntuaciones de los test fueron corregidas por valores normativos22-27.
El go-no go se puntuó de la siguiente manera: si lo realizaban bien 0 puntos, si tenían un fallo, un punto, y 2 si tenían más de un fallo. El subapartado de las secuencias gráficas se puntuó con un 0 si no levantaban el lápiz del papel y con un 1 si levantaban, y con un 0 si no tenían efecto «closing in» y un punto si lo tenían.
Para el estudio de la inferencia estadística de los resultados, se utilizó la prueba de la t de Student, para variables cuantitativas normales, y la prueba de Mann-Whitney para variables no normales y cuantitativas ordinales. Para la comparación de proporciones se utilizó el test de la chi al cuadrado de Pearson. Cuando no se cumplieron las condiciones de aplicación, se utilizaron la razón de verosimilitud y el test exacto de Fisher.
ResultadosLos pacientes del grupo 1 tenían una edad media ± desviación estándar de 65,21 ± 9,22, la media de los estudios cursados fue de 1,68 ± 0,74), estaban en un estadio de Hoehn y Yahr en «on» de 2,65 ± 0,47 de media y una media en «off» de 3,42 ± 0,6. La media de la UPDRS III en «on» era de 25,1 ± 10,24 y en «off» de 38,73 ± 9,45, el tiempo medio de evolución de la enfermedad era de 9,97 ± 5,76 y la dosis media de miligramos de LD 1.232,3 ± 229,74.
Los pacientes del grupo 2 tenían una media de edad de 69,65 ± 6,46, la media de los estudios cursados fue de 1,55 ± 0,94 estaban en un estadio de Hoehn y Yahr en «on» de 2,43 ± 0,35 y en «off» de 3,42 ± 0,6 y una UPDRS III en «on» de 19,9 ± 6,12 y en off de 30,25 ± 7,29, una media de tiempo de evolución de la enfermedad de 7,8 ± 5,42 años y una dosis media de 820,98 ± 343,04 mg de LD.
En relación con estos datos, comparando ambos grupos, se encontraron diferencias, aunque no estadísticamente significativas, en el tiempo de evolución de la enfermedad, que fue mayor en el grupo 1. La dosis de LD era significativamente mayor en los pacientes del grupo 1 (p < 0,001). También hubo diferencias significativas en el estadio de Hoehn y Yahr en off (p = 0,001), en la UPDRS motora en off (p = 0,003) y en el tiempo en realizar la prueba de la CDM en «on» (p = 0,022) y «off» (p = 0,002), obteniendo peores resultados en dichas pruebas los pacientes con CDM. No hubo diferencias significativas en la edad, si bien el grupo de pacientes con CDM tenía una media de edad menor que los que sI tenían CDM (tabla 1).
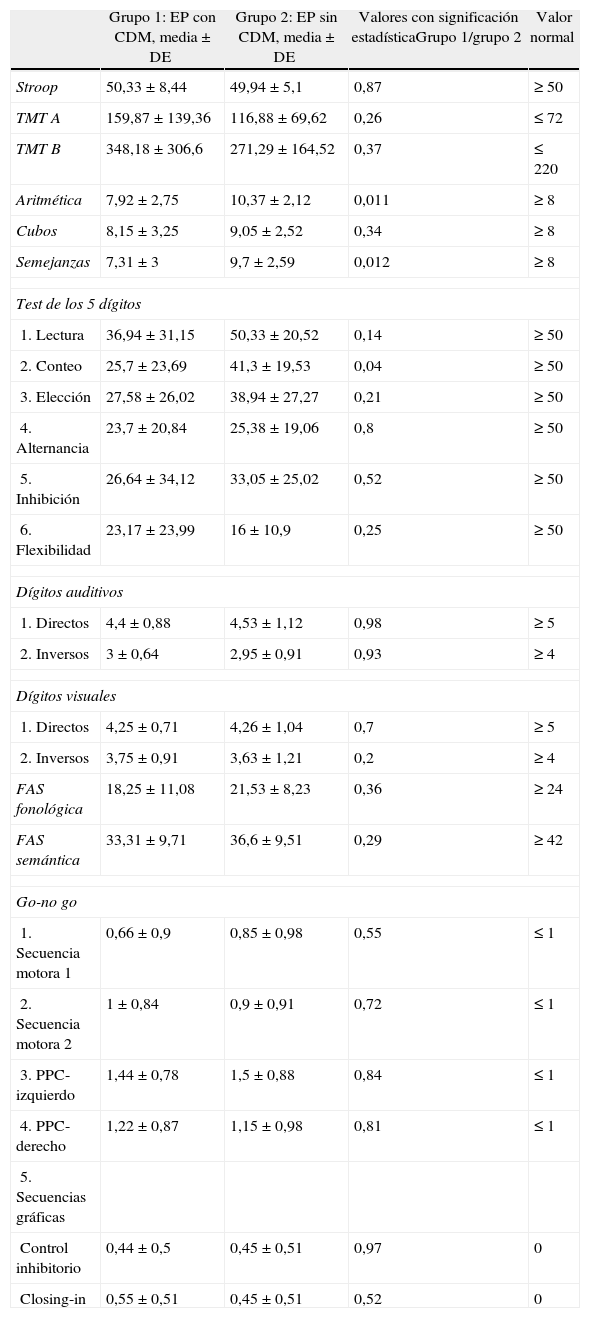
Los resultados de los test neuropsicológicos de los 2 grupos de pacientes, así como los valores normativos de la población general (PG) de edad similar, quedan recogidos en la tabla 2.
Resultados de los test neuropsicológicos
| Grupo 1: EP con CDM, media ± DE | Grupo 2: EP sin CDM, media ± DE | Valores con significación estadísticaGrupo 1/grupo 2 | Valor normal | |
| Stroop | 50,33 ± 8,44 | 49,94 ± 5,1 | 0,87 | ≥ 50 |
| TMT A | 159,87 ± 139,36 | 116,88 ± 69,62 | 0,26 | ≤ 72 |
| TMT B | 348,18 ± 306,6 | 271,29 ± 164,52 | 0,37 | ≤ 220 |
| Aritmética | 7,92 ± 2,75 | 10,37 ± 2,12 | 0,011 | ≥ 8 |
| Cubos | 8,15 ± 3,25 | 9,05 ± 2,52 | 0,34 | ≥ 8 |
| Semejanzas | 7,31 ± 3 | 9,7 ± 2,59 | 0,012 | ≥ 8 |
| Test de los 5 dígitos | ||||
| 1. Lectura | 36,94 ± 31,15 | 50,33 ± 20,52 | 0,14 | ≥ 50 |
| 2. Conteo | 25,7 ± 23,69 | 41,3 ± 19,53 | 0,04 | ≥ 50 |
| 3. Elección | 27,58 ± 26,02 | 38,94 ± 27,27 | 0,21 | ≥ 50 |
| 4. Alternancia | 23,7 ± 20,84 | 25,38 ± 19,06 | 0,8 | ≥ 50 |
| 5. Inhibición | 26,64 ± 34,12 | 33,05 ± 25,02 | 0,52 | ≥ 50 |
| 6. Flexibilidad | 23,17 ± 23,99 | 16 ± 10,9 | 0,25 | ≥ 50 |
| Dígitos auditivos | ||||
| 1. Directos | 4,4 ± 0,88 | 4,53 ± 1,12 | 0,98 | ≥ 5 |
| 2. Inversos | 3 ± 0,64 | 2,95 ± 0,91 | 0,93 | ≥ 4 |
| Dígitos visuales | ||||
| 1. Directos | 4,25 ± 0,71 | 4,26 ± 1,04 | 0,7 | ≥ 5 |
| 2. Inversos | 3,75 ± 0,91 | 3,63 ± 1,21 | 0,2 | ≥ 4 |
| FAS fonológica | 18,25 ± 11,08 | 21,53 ± 8,23 | 0,36 | ≥ 24 |
| FAS semántica | 33,31 ± 9,71 | 36,6 ± 9,51 | 0,29 | ≥ 42 |
| Go-no go | ||||
| 1. Secuencia motora 1 | 0,66 ± 0,9 | 0,85 ± 0,98 | 0,55 | ≤ 1 |
| 2. Secuencia motora 2 | 1 ± 0,84 | 0,9 ± 0,91 | 0,72 | ≤ 1 |
| 3. PPC-izquierdo | 1,44 ± 0,78 | 1,5 ± 0,88 | 0,84 | ≤ 1 |
| 4. PPC- derecho | 1,22 ± 0,87 | 1,15 ± 0,98 | 0,81 | ≤ 1 |
| 5. Secuencias gráficas | ||||
| Control inhibitorio | 0,44 ± 0,5 | 0,45 ± 0,51 | 0,97 | 0 |
| Closing-in | 0,55 ± 0,51 | 0,45 ± 0,51 | 0,52 | 0 |
FAS: test fluidez verbal; PPC: puño-palma-canto; TMT: Trail making test.
Se obtuvieron resultados normales en el test de Stroop en los pacientes del grupo 1, aunque comparándolo con la PG estaban en el límite bajo de la normalidad, y muy leve alteración en el grupo 2, sin encontrar diferencias entre los 2 grupos ni con la PG.
El TMT A y B estaba alterado en ambos grupos con respecto a la PG, encontrándose afectación importante en ambos grupos, aunque mayor alteración en los pacientes con CDM, sin encontrar diferencias estadísticamente significativas.
El test de aritmética y el subapartado de lectura del test de los 5 dígitos fueron normales con respecto a la PG en los pacientes sin CDM, encontrándose alterados en los pacientes con CDM. Se encontraron diferencias significativas (p = 0,011) en el test de aritmética y no significativas en el subapartado de lectura del test de los 5 dígitos.
El test de cubos fue normal con respecto a la PG en los 2 grupos de pacientes, obteniendo mejores puntuaciones los pacientes del grupo 2, sin encontrar diferencias estadísticamente significativas entre ambos grupos.
El test de semejanzas se encontró alterado en los pacientes del grupo 1 y normal con respecto a la PG en los del grupo 2, sin encontrar diferencias estadísticamente significativas entre ambos grupos.
El test de los 5 dígitos (apartados C, E, A, I), test de dígitos (apartados AD y VD), FAS fonético y semántico, se encontraron alterados en ambos grupos de pacientes, aunque obtuvieron peores puntuaciones los pacientes del grupo 1, encontrándose diferencias significativas en el test de semejanzas (p = 0,012) y el apartado C del test de los 5 dígitos (p = 0,04).
El test de los 5 dígitos (subapartado F) y el test de dígitos (apartados VI y AI) se encontraron alterados en ambos grupos de pacientes, aunque obtuvieron peores puntuaciones los pacientes del grupo 2. No se encontraron diferencias estadísticamente significativas en estos test.
En el go-no go, las SM 1 (programación) y 2 (sensibilidad a la interferencia) se encontraron dentro de la normalidad, mientras que la secuencia PPC estaba alterada en ambos grupos de pacientes; el test del dibujo también estaba alterado en ambos grupos, sin encontrar diferencias estadísticamente significativas entre ellos.
DiscusiónPresentamos un grupo de 39 pacientes con EPI avanzada, analizando la diferencias encontradas en los resultados de los test neuropsicológicos que estudian funciones frontales entre los 19 pacientes que presentaban CDM (grupo 1) y los 20 que no tenían CDM (grupo 2).
Diversos estudios durante los últimos años indican que la afectación del lóbulo frontal o una desconexión entre el lóbulo frontal y los ganglios de la base podrían ser factores implicados en la aparición de la CDM.
Matsui et al.6, ya en el 2005, realizaron un estudio con técnicas de SPECT utilizando como radiotrazador la inyección intravenosa de N-isopropil-p-123 I, y observaron que la perfusión del flujo cerebral en el área 11 de Brodman bilateral y en el área medial frontal era menor en los pacientes con episodios de CDM que en los pacientes con EPI sin episodios de CDM. Bartels y Leenders7 revisaron, en el 2008, estudios de neuroimagen funcional (PET y RM funcional) en pacientes con EPI con y sin CDM, analizando las claras diferencias observadas entre ambos grupos. Los autores, tras esta revisión, señalan la existencia de un hipometabolismo orbitofrontal y parietal, sobre todo en el hemisferio derecho, en pacientes parkinsonianos con CDM respecto a los pacientes sin CDM. En el 2011, Snijden et al.8 realizaron estudios con RM funcional comparando un grupo de 12 pacientes parkinsonianos con CDM con otro grupo de 12 pacientes sin CDM y con controles. Durante la marcha «virtual» (el paciente imagina que camina por un pasillo con diversos obstáculos), la activación del lóbulo frontal fue similar a la de los controles en pacientes con EP sin CDM, y mucho menor en el grupo de pacientes con CDM que activaban, mucho más que los controles y que los pacientes sin CDM, áreas del troncoencéfalo (mesencéfalo).
En contraposición a lo descrito en la literatura19, en nuestra serie de pacientes, los que presentaban CDM tenían una edad media menor que el grupo sin CDM, si bien esta diferencia no llegó a ser significativa, aunque, como era de esperar, el tiempo de evolución de la enfermedad, así como la dosis de LD y la severidad de la enfermedad evaluada mediante las escalas motoras, eran superiores en el grupo 128. Ambos grupos de pacientes presentaron peor rendimiento que la población control en las pruebas cognitivas frontales. En los pacientes del grupo 1, la disfunción ejecutiva fue mayor. Petrova et al.13 investigaron a 25 pacientes con EP que cumplían además con el diagnóstico de DCL y encontraron que, comparados con los controles normales, estos presentaban puntuaciones significativamente más bajas en pruebas de fluidez verbal, interferencia tipo Stroop, flexibilidad (TMT B y WCST) y retención de dígitos.
Estos hallazgos, según los autores, confirman la disfunción del control atencional y ejecutivo en la EPI, que es compatible con la disfunción córtico-subcortical que presentan estos pacientes. El tamaño de nuestra muestra hace que algunos valores no lleguen a significación estadística, aunque haya diferencias entre ambos grupos en varios de los test cognitivos realizados.
El grupo 1 tiene peor funcionamiento en aritmética (p < 0,01) y semejanzas que el grupo 2, que obtuvo puntuaciones normales con respecto a la PG. Estas pruebas valoran la memoria operativa y la formación de conceptos, respectivamente. Estos 2 procesos están típicamente relacionados con regiones frontales dorsolaterales29.
Ambos grupos manifiestan un rendimiento más pobre que la población de referencia en pruebas atencionales, como el test de los Cinco Dígitos (FDT), TMTA y TMTB. Presentan una marcada lentitud de procesamiento respecto al grupo normal. En el apartado de conteo del FDT, el grupo 1 presenta una diferencia estadísticamente significativa (p = 0,04) con respecto al grupo 2. Esta diferencia indica que el grupo 1 es más vulnerable a la fatiga atencional.
No hay diferencias estadísticamente significativas entre los grupos en las pruebas de fluidez verbal, pero sí se observa una tendencia en el grupo 1 a presentar un rendimiento más pobre, tanto en la fluidez fonológica como en la semántica.
Las tareas de fluidez verbal implican capacidades cognitivas tales como atención focalizada y sostenida, velocidad de procesamiento, inhibición de respuestas, memoria de trabajo, etc.30, por lo que son muy valiosas para analizar las funciones ejecutivas. La fluidez ante consigna fonética se ha asociado especialmente al lóbulo frontal, mientras que la fluidez ante consigna semántica, al lóbulo temporal31.
No se han hallado diferencias estadísticamente significativas en el Stroop, ni en el go-no go. Estos test miden la capacidad para inhibir estímulos. El Stroop se articula en la inhibición con un componente verbal, y el go-no go en un componente motor (funciones premotoras)32.
En relación con la prueba de dígitos auditivos (directos e inversos), ambos grupos presentan peores puntuaciones que la PG, pero no se han encontrado diferencias significativas entre los grupos. El test de los dígitos directos auditivos mide atención, una función subcórtico-parietal, y los inversos, memoria de trabajo33, capacidad muy relacionada con la codificación de información y con las regiones frontales dorsolaterales.
A diferencia de los resultados obtenidos por otros autores32, los grupos 1 y 2 obtienen puntuaciones dentro de la normalidad en los cubos de Kosh, prueba que valora la capacidad visuoconstructiva.
En resumen. y corroborando estudios previos. nuestros pacientes presentan, en relación con la población control, una mayor afectación de las funciones ejecutivas relacionadas con el lóbulo frontal, siendo mayor el compromiso en el grupo 1. El grupo 1 presenta peor rendimiento en pruebas que afectan a funciones frontales dorsolaterales, es decir, que además de presentar un importante componente subcortical inherente a la EP, también presenta un mayor componente cortical frontal que los pacientes que no tienen CDM. Estos hallazgos se correlacionan con estudios de neuroimagen funcional8,9, ya discutidos en la introducción.
Amboni et al.15, en 2007, publicaron un estudio con 24 pacientes (12 con CDM y 12 sin CDM), en el que concluyeron que los pacientes con CDM presentan mayor disfunción ejecutiva que los que no tienen CDM. Tras 2 años de seguimiento16, la disfunción ejecutiva había evolucionado más rápido en el grupo de pacientes con CDM, llegando a tener un diagnóstico de demencia asociada a EP en 4 de 12 pacientes con CDM y en ninguno de los 12 sin CDM, indicando que la CDM debe ser considerada un marcador de disfunción ejecutiva temprana y un factor de riesgo para la evolución a demencia.
Recientemente, Filling et al.34 señalan las diferencias estructurales mediante tractografía (imágenes por tensión de difusión de RM craneal) en la conectividad entre el lóbulo frontal y el núcleo pedunculopontino (NPP) entre pacientes parkinsonianos con y sin CDM, corroborando la importancia del lóbulo frontal en la fisiopatología de la CDM, a través de su función moduladora no solo sobre ganglios basales, si no también sobre el NPP, estructura muy implicada en aspectos de control postural y marcha.
Nuestro trabajo, como estudios previos, señala la importancia de la evaluación de las funciones corticales frontales para valorar adecuadamente la CDM, fenómeno complejo y de fisiopatología posiblemente multifactorial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.