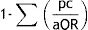La enfermedad de Parkinson (EP) es una patología neurodegenerativa que afecta al paciente de múltiples maneras. La esfera motora es la más frecuente y conocida, sin embargo, estos pacientes presentan también síntomas psiquiátricos y neuropsicológicos asociados. La cirugía de estimulación cerebral profunda (ECP) es un tratamiento que se utiliza para pacientes con estadios fluctuantes y avanzados de la EP.
El objetivo de este trabajo es la detección de signos y síntomas tanto psiquiátricos como neuropsicológicos en pacientes con EP seleccionados para la cirugía de ECP.
Pacientes y métodosEstudio observacional de cohorte transversal. Se evaluaron 41 pacientes con diagnóstico de EP. Se les realizó una entrevista neuropsiquiátrica semiestructurada y se les administraron escalas neuropsiquiátricas y una batería neuropsicológica completa.
Análisis estadísticoSe realizó un análisis estadístico descriptivo completo, se evaluaron correlaciones con el test de Pearson.
ResultadosSe evaluaron 41 pacientes con EP, edad 65,39 (DE 8,34), escolaridad 11,95 años (DE 4,37). Un 65,8% de los pacientes presentaron trastornos psiquiátricos previos. Se encontraron síntomas depresivos de grado leve y síntomas de ansiedad de grado leve-moderado. La impulsividad y los comportamientos nocturnos fueron síntomas frecuentes. Se observó un deterioro cognitivo de tipo amnésico, con alteraciones en pruebas ejecutivas y visuoconstructivas. Se hallaron correlaciones significativas entre las escalas neuropsiquiátricas y neuropsicológicas.
ConclusionesLos pacientes con EP presentan una asociación frecuente con trastornos psiquiátricos y deterioro cognitivo. Es importante realizar una evaluación neuropsicológica y neuropsiquiátrica con escalas adaptadas y validadas para la selección de pacientes para este tipo de cirugía.
Parkinson's disease (PD) is a neurodegenerative disease that combines motor and non-motor symptoms. The motor symptoms are cardinal, however, these patients also present associated psychiatric and neuropsychological symptoms. Deep brain stimulation surgery (DBS) is a treatment used for patients in fluctuating and advanced phases of PD.
The objective of this work is to detect psychiatric and neuropsychological signs and symptoms in patients with PD who are candidates for DBS surgery.
Patients and methodsAn observational cross-sectional cohort study was performed. Forty-one patients with a diagnosis of PD were evaluated. Patients were assessed with a semi-structured neuropsychiatric interview, neuropsychiatric scales, and a complete neuropsychological battery.
Statistical analysisA complete descriptive statistical analysis was carried out, correlations were evaluated with the Pearson test.
ResultsForty-one patients with PD were evaluated, age 65.39 (SD 8.34), educational level of 11.95 years (SD 4.37). Previous psychiatric disorders were highly prevalent (68.5%). Mild-degree depressive symptoms and mild–moderate anxiety symptoms were observed, and impulsive symptoms and nocturnal behaviors were frequently reported. Patients presented amnesic-type cognitive impairment, with poor scores on executive and visuoconstructive tests. Significant correlations (p<0.05) were found between the neuropsychiatric and neuropsychological scales.
ConclusionsPD patients present frequently psychiatric disorders and cognitive impairment. It is of relevance to carry out a neuropsychological and neuropsychiatric evaluation with adapted and validated scales for the selection of patients for this type of surgery.
La enfermedad de Parkinson (EP) se define principalmente como un trastorno del movimiento, con síntomas típicos como temblor en reposo, rigidez, bradicinesia e inestabilidad postural. Se caracteriza patológicamente por la degeneración de las neuronas dopaminérgicas nigroestriatales y la presencia de cuerpos de Lewy (α sinucleína mal plegada) en las neuronas supervivientes. Sin embargo, además de definir los síntomas motores relacionados con la dopamina, la EP se reconoce cada vez más como un trastorno multisistémico heterogéneo que involucra otros sistemas de neurotransmisores, como los circuitos serotoninérgicos, noradrenérgicos y colinérgicos. Por lo tanto, una amplia variedad de síntomas no motores (SNM) relacionados con estos neurotransmisores se observan comúnmente en pacientes con EP. A la luz de esta variabilidad, se ha propuesto el subtipo colinérgico en la EP, que se caracteriza por predominar deterioro cognitivo según el tiempo de inicio y la persistencia del deterioro cognitivo1, el cual se encuentra entre los SNM más comunes e importantes.
La evidencia indica que, en comparación con controles sanos de la misma edad, las personas con EP muestran una disminución más rápida en una serie de dominios cognitivos, en particular, los dominios ejecutivos, atencionales y visuoespaciales, pero también en la memoria. El espectro completo de las capacidades cognitivas se puede observar en la EP desde la cognición normal, pasando por el declive subjetivo y objetivo temprano llamado deterioro cognitivo leve (DCL), hasta la demencia por EP (DEP) de grado leve, moderado e incluso severo. Un grupo de trabajo de la Sociedad de Movimientos Anormales (MDS) evaluó recientemente la literatura relacionada con el DCL en la EP y determinó que el DCL es común en pacientes con EP no dementes y está asociado con la edad, la duración de la enfermedad y la severidad de la enfermedad. Además, el DCL asociado a EP predice el desarrollo de demencia, que puede ocurrir en hasta el 80% de los pacientes con EP a largo plazo2.
La razón de la alta frecuencia de depresión y ansiedad en la EP es poco conocida. La degeneración de los sistemas de neurotransmisores distintos de la dopamina podría desempeñar un papel específico en la aparición de estos trastornos afectivos. Algunos autores3 sugieren que la depresión y la ansiedad en la EP podrían estar asociadas con una pérdida específica de inervación de dopamina y noradrenalina en el sistema límbico, mientras que otros4 le adjudican un papel prominente a la degeneración serotoninérgica en la expresión de los síntomas neuropsiquiátricos que ocurren al inicio de la EP.
A medida que la enfermedad avanza, algunos de estos pacientes presentan dificultades debido a la ocurrencia de fluctuaciones motoras, tales como deterioro de fin de dosis, periodos off resistentes, disquinesias problemáticas y/o temblor, que interfiere en la calidad de vida de los pacientes. Cuando estas fluctuaciones no pueden ser neutralizadas por la medicación para esta patología, se plantea la posibilidad de un tratamiento neuroquirúrgico como es la cirugía de estimulación cerebral profunda5.
La estimulación cerebral profunda convencional del núcleo subtalámico o el globo pálido interno es un tratamiento establecido para la EP en estadio fluctuante y avanzado6.
Para poder realizar esta cirugía el paciente no debe tener diagnóstico de demencia ni padecer de depresión mayor no controlada o manifestaciones psiquiátricas no estabilizadas como psicosis, alucinaciones, etc. Es por ello que para poder evaluar y diagnosticar estas patologías se debe realizar un examen psiquiátrico y neurológico completo acompañado de escalas neuropsiquiátricas y una batería de evaluación neuropsicológica.
El objetivo de este trabajo es la detección y determinación de signos y síntomas tanto psiquiátricos como neuropsicológicos a través de la observación clínica, el examen neuropsiquiátrico, la aplicación de escalas neuropsiquiátricas y la administración de una batería neuropsicológica en pacientes con EP seleccionados para la cirugía de estimulación cerebral profunda.
Pacientes y métodoTipo de estudio: estudio observacional, descriptivo, de cohorte transversal de 2 años de duración.
PacientesSe evaluaron 41 pacientes de ambos sexos con diagnóstico de EP que fueron seleccionados como candidatos para la cirugía de estimulación cerebral profunda, mayores de 40 años de edad.
El estudio fue llevado a cabo entre el año 2017 y 2019 en el Hospital Universitario CEMIC. Departamento de Medicina, Sección Neurología, Área de Neurología Cognitiva y Neuropsiquiatría y Área de Movimientos anormales. El estudio fue aprobado por el comité de ética del CEMIC y el comité de ética central del GCBA. Los pacientes firmaron un consentimiento informado.
Criterios de inclusión:
- •
Paciente con más de 5 años de evolución de la EP.
- •
Pacientes mayores de 40 años.
- •
Pacientes con EP en fase fluctuante que no haya podido ser neutralizada por los ajustes de medicación.
- •
Pacientes con temblor problemático que interfieren en la calidad de vida.
Aclaración: se entiende como fase fluctuante a pacientes con deterioro de fin de dosis, periodos off resistentes y/o disquinesias problemáticas.
Criterios de exclusión:
- •
Parkinsonismo atípico.
- •
Lesiones estructurales en la RMN cerebral.
- •
Edad mayor de 75 años.
A la población en estudio se les efectuó una entrevista neuropsiquiátrica semiestructurada que incluyó la aplicación de escalas afectivas, escalas que evalúan neuropsiquiátricas, impulsividad, riesgo suicida y autonomía funcional. Asimismo, se les administró una batería de evaluación neuropsicológica completa.
Protocolo de evaluación:
- 1.
Entrevista neuropsiquiátrica semiestructurada que incluyó datos demográficos, antecedentes personales y familiares, y un examen clínico-neurológico. Se realizó un examen psiquiátrico completo evaluando: La orientación del paciente, en tiempo y espacio y autopsíquica. La afectividad: hipertimia, hipotimia, distimia, aplanamiento afectivo, apatía. La voluntad: normobulia, hiperbulia, hipobulia. El pensamiento, evaluando su curso: normal, acelerado, enlentecido, disgregado, debilitado; su contenido: presencia de ideas depresivas, ideas de suicidio, ideas delirantes. El juicio: debilitado, disminuido, desviado, normal. La sensopercepción, para evaluar la presencia o no de alucinaciones: visuales, auditivas, sensoperceptivas, olfativas, gustativas.
- 2.
Para el registro de los síntomas neuropsiquiátricos se completaron las siguientes escalas:
- -
Inventario de Depresión de Beck7 que responde el propio paciente y que se utilizará para determinar el nivel de depresión (leve: puntaje de 10 a 15; moderada: de 16 a 24; y grave: de 25 a 63).
- -
Cuestionario PHQ9 (Patient Health Questionnarire). El PHQ-9 es una medida de autoinforme de 9 ítems que evalúa la presencia de síntomas depresivos basados en los criterios del DSM-IV para el episodio depresivo mayor. Refiere a los síntomas experimentados por los pacientes durante las 2 semanas previas a la entrevista. En este caso, se utilizó la versión en español de la escala. Las puntuaciones del PHQ-9 se califican con una escala Likert que va de 0 (nunca), a 1 (varios días), 2 (más de la mitad de los días) y 3 (casi todos los días), por lo que el puntaje total va en un rango de 0 a 27. La gravedad de los síntomas puede organizarse en 4 categorías: 0-4 (mínimo), 5-9 (leve), 10-14 (moderado), 15-19 (moderado a grave), 20-27 (grave). El PHQ-9 se desarrolló como una herramienta de tamizaje, siendo los puntajes de corte recomendados entre 8 y 11 para un probable caso de depresión mayor8,9.
- -
Escala de Beck para la Ansiedad: El Inventario de ansiedad de Beck (conocido por sus siglas en inglés «BAI») es un cuestionario de autoinforme creado por el psicólogo Aaron T Beck el cual consiste en 21 preguntas con modalidad múltiple choice y permite medir el grado de ansiedad tanto en niños como adultos. Cada pregunta posee una escala del 0 al 3, siendo la más baja y la más alta, respectivamente. Por consiguiente, un puntaje alto es indicador de una elevada ansiedad en el individuo. Las medidas del cuestionario son las siguientes: 0-7: ansiedad mínima; 8-15: ansiedad leve; 16-25: ansiedad moderada; 26-63: ansiedad grave10.
- -
Escala de Trastorno de Ansiedad Generalizada (Generalized Anxiety Disorder [GAD 7]): este instrumento ha sido creado para servir de screening en el trastorno de ansiedad generalizada. Está compuesto por 7 ítems de respuesta tipo Likert de 0 a 3 que incluyen los síntomas y la discapacidad asociada al trastorno. Para su corrección se obtiene una puntuación total de la suma de puntuaciones de todos los ítems, que puede oscilar entre 0 y 21. No existen puntos de corte establecidos para la versión española11. En la versión original, los autores proponen un punto de corte mayor o igual a 1012.
- -
Escala de Suicidabilidad de Okasha: diseñada por Okasha et al.13, autoadministrada, tipo Likert, formada por 4 ítems, donde los tres primeros exploran ideación suicida y el cuarto consulta sobre intento de suicidio. Las respuestas de los ítems de ideas suicidas se recogen en una escala de frecuencia de categorías que se puntúa de 0 a 3 puntos para cada ítem: nunca, casi nunca, algunas veces, muchas veces. La suma de estos tres ítems conforma el subpuntaje de ideación suicida, que puede oscilar entre 0 y 9 puntos. El punto de corte de la ideación suicida para determinar la presencia de intento de suicidio fue de 5 puntos, con una sensibilidad del 90% y una especificidad del 79%14.
- -
Escala de Apatía. Esta escala fue desarrollada por Marin et al. (1991)15 para evaluar los síntomas de apatía en pacientes con depresión. Luego fue validada al español por Starkstein et al., 199216 para la detección de síntomas de apatía en pacientes con EP.
- -
Escala de Impulsividad de Barret: es uno de los instrumentos más ampliamente utilizados para la valoración de impulsividad. Fue diseñada por Barratt (1995)17 y en nuestro medio ha sido adaptada por Oquendo et al. (2001)18. Su aplicación es autoadministrada. Consta de 30 cuestiones, agrupadas en tres subescalas: Ítems impulsividad cognitiva: 4, 7, 10, 13, 16, 19, 24 y 27. Ítems impulsividad motora: 2, 6, 9, 12, 15, 18, 21, 23, 26 y 29. Ítems impulsividad no planeada: 1, 3, 5, 8, 11, 14, 17, 20, 22, 25, 28 y 30. Cada una de las cuestiones tiene 4 posibles respuestas (raramente o nunca, ocasionalmente, a menudo y siempre o casi siempre) que puntúan como 0-1-3-4, salvo los ítems inversos (1, 5, 6, 7, 8, 10, 11, 13, 17, 19, 22 y 30) que lo hacen al revés (4-3-1-0). La puntuación total es la suma de todos los ítems y las de las subescalas la suma de los correspondientes a cada una de ellas. Posee mayor valor la puntuación total que la de las subescalas. No existen puntos de corte, aunque se ha propuesto la mediana de la distribución.
- -
Inventario Neuropsiquiátrico (NPI) (Cummings, 1994)19, que completa el familiar del paciente acerca de la frecuencia y severidad de los síntomas neuropsiquiátricos en el paciente. Esta escala es administrada al familiar del paciente para que describa los síntomas presentes en el paciente. Consta de 12 síntomas a los cuales hay que puntuarlos de acuerdo a la severidad del síntoma, frecuencia en la cual se produce ese síntoma, y la sobrecarga que ese síntoma le produce al familiar a cargo. Los síntomas se puntúan multiplicando la frecuencia por la severidad.
3. Para el registro de los síntomas cognitivos se realizó una Evaluación Cognitiva que consta de diferentes tests para evaluar cada función cognitiva:
- -
Tests para evaluar memoria verbal: Test de aprendizaje auditivo verbal de Rey. (Rey, 196420; Miranda y Valencia, 199721).
- -
Test para evaluar lenguaje: Fluencia verbal (Benton, 198322), Test de Vocabulario de Boston (Allegri, 199723, Serrano y Allegri 200124).
- -
Tests para evaluar función ejecutiva: Trail making test parte B (Reitan, 1958)25, Fluencia Fonológica (Benton, 198322), Escala de FAB (Frontal Assessment Battery) (Dubois et al., 2000)26.
- -
Tests para evaluar visuoespacialidad: Figura compleja de Rey (1997)27.
- -
Tests para evaluar atención: Trail making test parte A (Reitan, 1958)25, Span de dígitos (Wechsler 1988, 1997)28,29.
4. Para evaluar la funcionalidad del paciente se administró la Escala de Actividades Instrumentales de la Vida Diaria (Lawton, 1969)30. Para esto se utilizaron dos escalas que se llaman escala de actividades de la vida diaria (AVD). Una la completa el paciente y la otra la completa el familiar. Las dos tienen la misma información. Lo que se busca es comparar las respuestas que da el paciente y las que da el familiar. Cada ítem se puntúa con tres valores: 0: independiente, 1: dependencia parcial, 2: dependencia total.
También se utilizó el Cuestionario de Anosognosia-Demencia (Conde-Sala et al., 2014)31 (Anosognosia Questionnaire-Dementia, Migliorelli et al., 1995)32. Conceptos medidos: Estado funcional o actividades de la vida diaria. Consta de 30 ítems. El cuestionario está dividido en dos. Un apartado que corresponde a rendimientos cognitivos y un apartado que corresponde a cambios conductuales. Se administra tanto al paciente como al familiar y se evalúan los resultados obtenidos por cada uno.
Análisis estadísticoLos resultados fueron ingresados en una base de datos informatizada, específicamente preparada para este protocolo, sobre un programa Excel 2010.
Para el estudio estadístico se efectuó, en primer término, un análisis descriptivo de la población en estudio. Para el caso de variables categóricas, se estableció la distribución de frecuencias y se expresaron los resultados como porcentajes. En el caso de variables continuas se determinó la media con su correspondiente desvío estándar. Cuando la distribución fue no paramétrica se describió la variable mediante la mediana y el percentil 10 y 90. Se realizó un estudio de correlaciones de las diferentes variables en estudio con el test de Pearson. El procesamiento de la información se realizó mediante el programa estadístico informático SSPS 25 advanced.
Para el análisis de las pruebas neuropsicológicas se utilizó el puntaje Z score (z), determinado por el valor promedio para la edad y escolaridad de los pacientes evaluados utilizando la siguiente fórmula: Media obtenida del puntaje de los pacientes evaluados (x)−Media de la población para esa edad (u) y escolaridad dividido el desvío estándar (θ).
Reglas de buenas prácticas clínicasTodo el trabajo clínico estuvo sujeto a las Reglas ICH de buenas prácticas clínicas, a las últimas revisiones de las declaraciones de Helsinki (última modificación – Fortaleza, 2013) y a las reglamentaciones de la Secretaría de Salud del GCBA según Ley 3301.
ResultadosDatos demográficosSe evaluaron 41 pacientes con EP. La media de edad fue de 65,39 (DE 8,34). La escolaridad media fue de 11,95 (DE 4,37). De los pacientes, 18 eran mujeres y 23 hombres. El promedio de años de enfermedad fue de 11 (DE 7,65) (ver tabla 1).
Síntomas inicialesSegún lo manifestado por los pacientes, el más frecuente fue el temblor en miembros superiores (22 pacientes, 57,9%) seguido de rigidez (14 pacientes, 36,8%). Solo el 5,3% de los pacientes (n=2) presentaron otros síntomas de inicio.
AntecedentesLos antecedentes clínicos más frecuentes fueron HTA (29,3%) y tabaquismo (26,8%). También se mencionaron otros menos usuales, como hipotiroidismo (12,2%) y cardiacos (12,5%).
Con respecto a los antecedentes familiares neurológicos (47,5%) y psiquiátricos (25%), no presentan niveles significativos (ver tabla 2).
Antecedentes clínicos, psiquiátricos y familiares
| Antecedentes clínicos | Frecuencia | Porcentaje |
|---|---|---|
| Sí/No | Sí/No | |
| HTA | 12/29 | 29,3%/70,7% |
| DBT | 03/38 | 7,3%/92,7% |
| Dislipemia | 06/35 | 14,6%/85,4% |
| Tabaquismo | 11/30 | 26,8/73,2% |
| Hipotiroidismo | 05/36 | 12,2%/87,8% |
| Cardiacos | 05/36 | 12,2%/87,8% |
| Antecedentes psiquiátricos | 25/16 | 60,9%/39,1% |
| Antecedentes familiares neurológicos | 19/22 | 46,4%/53,6% |
| Antecedentes familiares psiquiátricos | 11/30 | 25%/75% |
DBT: diabetes; HTA: hipertensión arterial.
Se mencionan las frecuencias y porcentajes de los antecedentes clínicos, psiquiátricos y neurológicos.
En la entrevista psiquiátrica semiestructurada que se les realizó a los pacientes se observó que la presencia de antecedentes de trastornos psiquiátricos previos fue my frecuente (65,8%). En las escalas administradas, se pudo observar que los pacientes presentaron los siguientes síntomas: depresión en grado leve (observado en la Escala de Beck de Depresión y en el Cuestionario PHQ9), apatía en grado leve (observado en la Escala de Apatía), ansiedad grado leve-moderado (observado en la Escala de Beck de Ansiedad y la Escala de Trastorno de Ansiedad Generalizada GAD 7), impulsividad grado leve-moderado (observado en la Escala de Impulsividad de Barret: en todos los subítems: impulsividad cognitiva, impulsividad motora, impulsividad no planeada y puntaje total de la escala determinado por la variable impulsividad total). En el Inventario Neuropsiquiátrico (NPI) administrado a los informantes se observaron los siguientes síntomas como más prevalentes: comportamientos nocturnos, depresión, ansiedad, irritabilidad y labilidad afectiva y alteraciones en el apetito e ingesta. Cabe aclarar que se detectó un paciente con síntomas de riesgo suicida con puntaje elevado (mayor de 5 puntos) en la Escala de Suicidabilidad (ver tabla 3).
Síntomas neuropsiquiátricos
| Escalas neuropsiquiátricas | Media | DE |
|---|---|---|
| Depresión | ||
| Beck Depresión | 13,03 | 6,73 |
| PHQ9 | 9,44 | 5,31 |
| Suicidabilidad | 0,79 | 1,52 |
| Apatía | 9,44 | 7,02 |
| Ansiedad | ||
| Beck Ansiedad | 16,19 | 12,07 |
| GAD 7 | 7,22 | 4,11 |
| Impulsividad | ||
| Impulsividad cognitiva | 12,92 | 4,73 |
| Impulsividad motora | 14,53 | 6,85 |
| Impulsividad no planeada | 15,92 | 7,07 |
| Impulsividad total | 39,02 | 19,36 |
| Anosognosia | ||
| Paciente: rendimiento cognitivo | 9,78 | 5,35 |
| Paciente: cambios conductuales | 5,11 | 3,14 |
| Informante: rendimiento cognitivo | 10,80 | 5,76 |
| Informante: cambios conductuales | 6,60 | 3,70 |
| AVD | ||
| Paciente: AVD | 1,63 | 1,99 |
| Informante: AVD | 3,80 | 2,16 |
| NPI | ||
| Delirios | 0,24 | 0,53 |
| Alucinaciones | 0,19 | 0,51 |
| Agitación/Agresión | 0,38 | 0,80 |
| Depresión | 0,59 | 0,90 |
| Ansiedad | 0,48 | 0,81 |
| Euforia | 0,24 | 0,76 |
| Apatía | 0,33 | 0,79 |
| Desinhibición | 0,43 | 0,81 |
| Irritabilidad/Labilidad | 0,57 | 0,74 |
| Alteraciones motoras | 0,33 | 0,57 |
| Comportamientos nocturnos | 0,86 | 0,91 |
| Apetito/Ingesta | 0,90 | 1,11 |
AVD: actividades de la vida diaria; DE: desvío estándar; NPI: inventario neuropsiquiátrico; PHQ: Patient Health Questionnarire.
Se describen las escalas neuropsiquiátricas de los estudios realizados sobre depresión, ansiedad e impulsividad informando la media y DE.
En las escalas neuropsicológicas los pacientes presentaron un deterioro de tipo amnésico, mostrando alteraciones predominantemente en el área de memoria (aprendizaje verbal de la lista A y lista B, recuerdo diferido de la lista A). Igualmente aunque presentan alteraciones en memoria, se observa una buena recuperación de la misma, mostrando un perfil de memoria más del tipo subcortical. Asimismo, si bien según los criterios diagnósticos de DCL los puntajes Z deben encontrarse por debajo de −1,5, otros criterios diagnósticos como el DSM V sugieren que el deterioro cognitivo menor puede justificarse si el puntaje Z se encuentra entre −1 y −2 desvíos estándar; en este sentido podemos observar que nuestros pacientes presentan deterioro cognitivo en los dominios del funcionamiento ejecutivo y visuoespacial en el puntaje total de una batería frontal (FAB) con peor rendimiento en pruebas de control inhibitorio, sensibilidad a la interferencia y programación motora, y un test de visuoespacialidad y visuoconstrucción evaluada mediante la copia de una figura compleja (FCR). Esto se puede observar en la tabla 4. Por otro lado, se hallaron correlaciones significativas entre síntomas depresivos y otras variables neuropsiquiátricas, entre síntomas depresivos y algunas variables neuropsicológicas y entre síntomas depresivos y autonomía funcional (ver tabla 5).
Manifestaciones neuropsicológicas
| Variables neuropsicológicas | Media | DE | Puntaje Z |
|---|---|---|---|
| Memoria verbal | |||
| Aprendizaje verbal lista A (RAVLT) | 36,55 | 11,37 | −1,71 |
| Aprendizaje verbal lista B | 3,55 | 1,73 | −1,71 |
| Intrusiones | 0,43 | 0,87 | |
| Recuerdo libre lista A | 6,55 | 2,90 | −1,24 |
| Recuerdo diferido lista A | 6,43 | 3,12 | −1,51 |
| Intrusiones | 0,35 | 0,62 | |
| Reconocimiento lista A | 12,48 | 2,13 | 0,42 |
| Intrusiones | 2,53 | 2,27 | |
| Falsos reconocimientos | 1,55 | 1,88 | |
| Lenguaje | |||
| Denominación | 47,43 | 10,00 | −0,64 |
| Fluencia semántica | 17,98 | 6,43 | −0,67 |
| Atención | |||
| Dígitos directos | 5,83 | 1,41 | −0,48 |
| TMTA | 60,24 | 42,99 | −0,75 |
| Funcionamiento ejecutivo | |||
| Dígitos indirectos | 3,85 | 1,31 | −0,50 |
| TMTB | 155,50 | 215,35 | −0,75 |
| FAB total | 14,88 | 2,94 | −1,04 |
| Conceptualización | 2,67 | 0,48 | |
| Flexibilidad cognitiva | 2,76 | 0,43 | |
| Programación motora | 2,43 | 0,74 | |
| Sensibilidad a la interferencia | 2,43 | 1,02 | |
| Control inhibitorio | 1,71 | 1,05 | |
| Conducta de prehensión | 3,00 | 0,00 | |
| Fluencia fonológica | 13,83 | 5,92 | −0,34 |
| Visuoconstrucción | |||
| Figura compleja de Rey | 26,34 | 9,06 | −1,06 |
Se describen las medias y desvíos (DE) del desempeño de los pacientes con enfermedad de Parkinson en la batería neuropsicológica utilizada para evaluar memoria, atención, lenguaje y visuoconstrucción.
Correlaciones entre síntomas depresivos y otras variables neuropsiquiátricas, variables neuropsicológicas y autonomía funcional
| Síntomas neuropsiquiátricos | ||||||
|---|---|---|---|---|---|---|
| Beck - Ansiedad | GAD 7 | Escala de Apatía | AVD | Anosognosia (Conducta) | ||
| Beck - Depresión | Correlación de Pearson | 0,67 | 0,89 | 0,66 | 0,82 | 0,98 |
| Significación bilateral (p) | <0,01 | <0,01 | <0,01 | 0,02 | <0,01 | |
| Inventario Neuropsiquiátrico (NPI) | ||||||
|---|---|---|---|---|---|---|
| Delirios | Alucinaciones | Apatía | Irritabilidad | Desinhibición | ||
| Beck - Depresión | Correlación de Pearson | 0,58 | 0,56 | 0,62 | 0,57 | 0,60 |
| Significación bilateral (p) | <0,01 | 0,01 | <0,01 | <0,01 | <0,01 | |
| Evaluación Neurocognitiva | ||||||
|---|---|---|---|---|---|---|
| AprendizajeLista A | Intrusiones | FluenciaSemántica | FluenciaFonológica | FCR | ||
| Beck - Depresión | Correlación de Pearson | −0,36 | 0,45 | −0,32 | −0,35 | −0,32 |
| Significación bilateral (p) | 0,02 | <0,01 | 0,04 | 0,03 | 0,04 | |
AVD: actividades de la vida diaria; FCR: figura compleja de Rey; GAD: Escala de ansiedad generalizada.
Se pueden observar las escalas que fueron tomadas que presentaron correlaciones significativas. La p es significativa a nivel <0,05.
Los síntomas no motores son de alta frecuencia en pacientes con EP. Se sabe que los síntomas no motores impactan en la calidad de vida del paciente y de su entorno social, familiar y laboral. El objetivo de esta investigación fue la detección y el estudio de signos y síntomas tanto psiquiátricos como neuropsicológicos a través de la observación clínica, el examen neuropsiquiátrico, la administración de escalas neuropsiquiátricas y batería de evaluación neuropsicológica en pacientes con EP seleccionados para la cirugía de estimulación cerebral profunda.
Con este estudio se propuso investigar estos síntomas en pacientes para desarrollar a futuro un protocolo diagnóstico estandarizado para la detección de síntomas no motores tales como depresión, ansiedad, síntomas psicóticos, deterioro cognitivo y demencia en pacientes con EP. La falta de instrumentos de medición adaptados y validados en nuestro medio es un factor que contribuye al subdiagnóstico de la depresión en estos pacientes. Esto agrava la falta de conocimiento sobre el tema y la dificultad y complejidad en evaluar el estado mental con los métodos tradicionales.
Se evaluaron 41 pacientes con EP en estadio avanzado de la enfermedad. La media de edad fue de 65,39 (DE 8,34) con una escolaridad promedio de 11,95 (DE 4,37). Del total de los pacientes, 18 eran mujeres y 23 eran hombres.
Respecto de la cantidad promedio de años de enfermedad, esta fue de 11 (DE 7,65). Entre los síntomas iniciales el más frecuente fue el temblor en miembros superiores (22 pacientes), seguido de rigidez (14 pacientes). Los antecedentes clínicos más frecuentes fueron HTA (29,3%) y tabaquismo (26,8%). Un 65,8% de los pacientes presentaron trastornos psiquiátricos previos. En consonancia con estos hallazgos, Anang et al.33 en un estudio prospectivo de seguimiento de pacientes con EP encontraron que la HTA y las alteraciones del sueño REM son factores de riesgo para conversión a demencia en la EP (Parkinson's disease dementia o PDD)33.
Respecto de las escalas administradas para evaluar trastornos del estado del ánimo, estas arrojaron síntomas depresivos de grado leve y síntomas de ansiedad de grado leve a moderado. Asimismo, presentaron sintomatología impulsiva y comportamientos nocturnos de manera frecuente. Algunos pacientes presentaron síntomas de riesgo suicida.
Como se dijo en la introducción, para poder realizar esta cirugía el paciente no debe tener diagnóstico de demencia ni padecer de depresión mayor no controlada o manifestaciones psiquiátricas no estabilizadas como psicosis y/o alucinaciones. Cabe aclarar que en la población estudiada se detectó un paciente con síntomas de riesgo suicida con puntaje elevado (mayor de 5 puntos) en la Escala de Suicidabilidad y puntaje compatible con depresión severa en las escalas que evalúan síntomas depresivos: Escala de Beck de Depresión y PHQ9. Estos resultados, en conjunto con el diagnóstico psiquiátrico realizado, determinaron el diagnóstico psiquiátrico de depresión mayor severa, lo cual fue informado al equipo tratante (neurología y neurocirugía) para ser excluido del tratamiento de estimulación cerebral profunda por presentar criterios de exclusión «depresión mayor severa».
Con respecto a las escalas más sensibles para la detección de síntomas neuropsiquiátricos, uno de los diagnósticos que es criterio de exclusión para la neurocirugía de estimulación cerebral profunda es la presencia de depresión mayor severa. Por este motivo las escalas administradas para evaluar síntomas de depresión como la Escala de Beck de Depresión (BDI) presentaron en un estudio para evaluar su validez34, tomando 18,5 o 19,5 como punto de corte del BDI para el diagnóstico de depresión mayor, una sensibilidad del 87,5% y una especificidad del 98,21%. Por otro lado, el Cuestionario PHQ-9 demuestra una sensibilidad de un 92% y especificidad del 89% en la detección de pacientes depresivos, al compararla con la Escala de Hamilton-D35. En conjunto con esto, otra escala con una alta significación para el estudio de la gravedad de síntomas depresivos es la Escala de Suicidabilidad de Okasha. El punto de corte de la ideación suicida para determinar la presencia de intento de suicidio fue de 5 puntos, con una sensibilidad del 90% y una especificidad del 79%14.
En relación con la evaluación de otros síntomas como, por ejemplo, el control de los impulsos determinado por la Escala de Impulsividad de Barret. Teniendo en cuenta que la población estudiada tiene características de una distribución normal, se observó que en estos pacientes los resultados de todos los subítems de la escala: impulsividad cognitiva (media 12,92, DE 4,73), impulsividad motora (media 14,53, DE 6,85), impulsividad no planeada (media 15,92, DE 7,07) y el puntaje total de la misma (media 39,02, DE 19,36) estaban por encima de los valores de las medianas que se obtuvieron en el estudio de validación española de esta escala18. En el mismo se analizó una muestra de pacientes psiquiátricos, los cuales arrojaron los siguientes resultados: impulsividad cognitiva: mediana 9,5; impulsividad motora: mediana 9,5; impulsividad no planeada: mediana 14, puntuación total: mediana 32,518.
Los trastornos en el control de los impulsos (TCI) se observan en el 6-15% de pacientes con EP y se caracterizan por una pérdida del control voluntario sobre los impulsos o tentaciones relacionadas con el comportamiento hedónico excesivo. Hay estudios que sugieren que los agonistas dopaminérgicos se relacionan con TCI, aunque no todos los estudios sustentan esta observación36,37.
Los estudios con marcadores biológicos de imágenes como la resonancia magnética demostraron diferencias sustanciales en las características neuronales entre pacientes con EP con y sin TCI, sugiriendo que la impulsividad estaba relacionada con alteraciones en los circuitos afectivos de los ganglios basales. Específicamente, la conectividad frontal-estriatal reducida y el volumen de GPe se asociaron con una mayor impulsividad, así como con alteraciones en las redes estriatales sensoriomotoras, lo cual indica que estos cambios afectan la toma de decisiones y resultan en una preferencia por acciones riesgosas o inapropiadas36.
Poletti y Bonuccelli38 analizaron varios estudios respecto de la alteración en el control de los impulsos y su asociación con la EP. Ellos encuentran que la personalidad previa y la ingesta de agonistas dopaminérgicos en la EP podrían estar profundizando estas conductas. Encuentran evidencia empírica preliminar que sugiere la hipótesis de que tanto la personalidad (rasgo de afecto negativo, altos niveles premórbidos de impulsividad) como las características cognitivas (mal funcionamiento ejecutivo, especialmente del control inhibitorio) pueden representar factores de riesgo para el desarrollo de déficit en el control de los impulsos en pacientes con EP medicados38. Este rasgo fue encontrado en nuestro estudio junto con la alteración en el control inhibitorio, la alteración del estado de ánimo y los comportamientos nocturnos. Respecto de este último síntoma, en una revisión llevada a cabo por Brandão et al., los autores encuentran que el reporte de alteraciones del sueño REM en pacientes con EP es frecuente39.
Los trastornos del control de los impulsos (TCI) son prominentes en la EP y, a pesar de 20 años de investigación, todavía hay debate en curso sobre si la estimulación cerebral profunda subtalámica (STN DBS) puede exacerbar o mejorar estos síntomas. En la mayoría de los estudios comparativos de pacientes antes y después de recibir cirugía STN DBS, la cirugía STN DBS se asoció con una disminución en los TCI40.
Esto se interpreta que podría vincularse con una disminución en las dosis de medicamentos dopaminérgicos, aunque también se ha observado que la STN DBS mejora la flexibilidad del comportamiento sin afectar el aprendizaje de retroalimentación negativa y el control inhibitorio, siempre que la estimulación esté restringida al STN dorsal. Por el contrario, la cirugía STN DBS puede impulsar acciones impulsivas cuando un sujeto se enfrenta a opciones en competencia, en el caso de presentar mayor afectación de circuitos STN ventral, dado que el STN dorsal presenta conectividad con áreas motoras y prefrontales motoras, mientras que el STN ventral está relacionado con circuitos límbicos que regulan el control motivacional. Esto sugiere que para pacientes con EP e impulsividad, la estimulación debería restringirse a las vías de STN dorsal40.
En la batería neuropsicológica presentaron un deterioro de tipo amnésico, mostrando alteraciones en el área de memoria predominantemente con un perfil de tipo subcortical (con buena recuperación de la misma) y puntajes levemente descendidos en visuoespacialidad y funcionamiento ejecutivo, con mayor impacto en el control inhibitorio, sensibilidad a la interferencia y programación motora. Respecto de este resultado, encontramos un estudio de revisión del año 2020 realizado en Brasil39, donde algunos autores refieren que la alteración de la memoria episódica y las fallas en el control inhibitorio son fuertes predictores de conversión a demencia, mientras que otros estudios concluyeron que el desempeño en las tareas de funcionamiento ejecutivo, memoria de trabajo, fluidez verbal fonológica y el lenguaje no predijeron la demencia en la EP. Asimismo, la presencia de DCL en la EP observado durante la evaluación inicial predijo un riesgo 6 veces mayor de demencia en 5 años39.
El estudio noruego de ParkWest generó varias publicaciones al respecto. Al inicio, el 19% de los pacientes fueron diagnosticados con EP y deterioro cognitivo leve (EP-DCL), y luego de 3 años de seguimiento, el 27% de los que inicialmente cumplían los criterios de EP-DCL se convirtieron en pacientes con demencia en EP (DEP). El diagnóstico de EP-DCL, por lo tanto, trajo un riesgo relativo 39 veces mayor de DEP. El bajo rendimiento en el control inhibitorio (prueba de color y palabras de Stroop [SCWT]) y las pruebas de memoria (prueba de aprendizaje verbal de California [CVLT-II]) fueron los predictores de conversión más fuertes41,42. Otro estudio de cohorte33 realizado en Canadá siguió a 80 pacientes que informaron el desarrollo de DEP en el 37% durante 4,4 años33. Los factores de riesgo más importantes fueron el trastorno de conducta del sueño REM, la disautonomía, la pérdida de la capacidad de discriminación del color y la disfunción de la marcha. De estos, la alteración del sueño REM fue el predictor más significativo de resultados adversos.
Se hallaron correlaciones significativas entre las escalas neuropsiquiátricas, entre las pruebas neuropsicológicas y las escalas de Beck de depresión y ansiedad y entre los diferentes dominios neuropsicológicos entre sí (áreas de memoria con lenguaje, atención y funciones ejecutivas).
Según un estudio de revisión, los déficits de dominios cognitivos específicos en pacientes con EP deprimidos implicaron principalmente el deterioro de las funciones ejecutivas, la atención y la memoria. En términos de disfunción ejecutiva, varios estudios han informado que los pacientes con depresión se desempeñaron significativamente con mayores dificultades que los pacientes no deprimidos en las pruebas de función ejecutiva. Por otro lado, en la literatura se ha demostrado que la apatía está asociada con disfunción cognitiva, depresión y ansiedad. Aunque la apatía y la depresión pueden coexistir en la EP, varios estudios han encontrado que la apatía puede ocurrir de forma aislada en ausencia de depresión43. Otro estudio realizado en California examinó la asociación entre los síntomas cognitivos y los síntomas neuropsiquiátricos (depresión, ansiedad y apatía) en pacientes con EP encontrando una alta correlación entre ansiedad y alteraciones en las funciones ejecutivas, mientras que los síntomas depresivos y apatía se asociaron fuertemente con niveles bajos de atención y funcionamiento ejecutivo44. Arsland et al. (1999)45 encontraron en pacientes con EP correlaciones positivas entre síntomas depresivos, ansiedad y apatía44. Otro estudio demostró que en las pruebas univariadas, las puntuaciones más altas de los ítems del Inventario de Depresión de Beck (BDI) cognitivo-afectivo se asociaron con valores más bajos de cognición general y también con peores resultados en cada una de las pruebas cognitivas individuales, lo que indica una asociación entre síntomas depresivos más severos y peor rendimiento cognitivo46.
La detección precoz de los síntomas no motores en pacientes con EP a través de un protocolo estandarizado tendría una repercusión sociosanitaria de importancia, ya que ayudaría a hacer diagnósticos tempranos de síntomas neuropsiquiátricos y cognitivos e iniciar rápidamente un tratamiento efectivo para disminuir el impacto en la calidad de vida de estos pacientes y su entorno, como así también promover la autonomía funcional de los pacientes.
La determinación de depresión de manera precoz en estos pacientes implica la identificación de un sujeto en riesgo potencial y la instalación de un tratamiento oportuno que podría ser capaz de prevenir una mayor afectación en calidad de vida, así como en algunos casos detectar un riesgo suicida inminente.
La detección y el posterior tratamiento de síntomas psicóticos de manera efectiva y precoz ayudarían a la mejoría de la calidad de vida del paciente y a disminuir la sobrecarga que genera en su entorno. Por otro lado, la identificación de los síntomas neuropsiquiátricos y neuropsicológicos podría ser el marco de referencia para una adecuada psicoeducación dirigida a familiares y cuidadores con la finalidad de mejorar el impacto de estos síntomas en la esfera social, familiar y laboral.
Hasta la fecha, los medicamentos se han orientado al tratamiento sintomático, aunque con efectos modestos, y el campo espera tratamientos curativos o modificadores de la enfermedad que sean exitosos. El tratamiento del deterioro cognitivo en la EP comprende muchos componentes diferentes, incluido el diagnóstico; el asesoramiento y el pronóstico adecuados; la incorporación de estrategias farmacológicas, no farmacológicas y psicosociales; y abordar las necesidades de la persona que vive con EP y sus cuidadores47.
La estimulación eléctrica continua ha demostrado una notable reducción de los síntomas motores de los pacientes con la EP avanzada y fluctuaciones motoras en menores de 75 años. Esta mejoría se traduce en aumento de la movilidad y disminución de las discinesias con impacto en la calidad de vida, el desarrollo de las actividades diarias y mayor bienestar emocional. No obstante, no se modifican en forma directa los aspectos cognitivos, neuropsiquiátricos, conductuales y emocionales. La neuroestimulación es una buena estrategia terapéutica para los pacientes seleccionados cuidadosamente con la EP avanzada en quienes el beneficio sintomático será mayor que el riesgo quirúrgico48.
LimitacionesEn el presente estudio se evaluó a los pacientes seleccionados para la cirugía de estimulación cerebral profunda; los resultados de dicho estudio no pueden extrapolarse de igual manera a todos los pacientes con diagnóstico de EP, ya que esta muestra ha sido específicamente seleccionada.
Por otro lado, sería pertinente ampliar los instrumentos utilizados en la batería neurocognitiva para abordar las alteraciones de las habilidades atencionales y funciones ejecutivas con instrumentos de medición más específicos y sensibles.
ConclusionesLos pacientes con EP presentan una asociación frecuente con trastornos psiquiátricos y deterioro cognitivo, que deberían ser diagnosticados y tratados para una mejor calidad de vida del paciente. Existe también riesgo suicida y presentan en general síntomas de impulsividad, por lo cual es importante la evaluación neuropsicológica, neuropsiquiátrica y de riesgo suicida con escalas adaptadas y validadas, como las utilizadas en este estudio (Escala de Beck de Depresión, Cuestionario PHQ9 y Escala de Suicidabilidad de Okasha, Escala de Impulsividad de Barret).
Es importante la evaluación de estos pacientes previos a la cirugía de estimulación cerebral profunda a fin de ver su estado neuropsicológico y neuropsiquiátrico para determinar si están aptos para dicha cirugía, como también es importante tener estos datos prequirúrgicos para poder evaluar la evolución de los mismos luego de la cirugía.
FinanciaciónEste estudio no recibió financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Servicio de Neurología. Servicio de Neurocirugía. Departamento de Medicina. Hospital Universitario CEMIC (Centro de Educación Médica e Investigaciones Clínicas). Buenos Aires, Argentina.
Dr. Hugo Krupitzki, Comité de ética. Hospital Universitario CEMIC. Buenos Aires, Argentina.
Centro de Investigación en Neurociencia y Neuropsicología. Facultad de Ciencias Sociales de la Universidad de Palermo. Buenos Aires, Argentina.
Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Argentina.