Los pacientes con esclerosis lateral amiotrófica necesitan un enfoque multidimensional para aliviar su disminución en el desempeño respiratorio. Con el objeto de describir el soporte ventilatorio (VNI) implementado en hospital de día y el consumo de recursos de salud, revisamos nuestra experiencia durante 4 años.
Pacientes y métodos Incluimos 27 pacientes; 19 hombres (70,4%), edad media de 62,0±14,1 años. El 48,1% comenzó con síntomas bulbares (ELAB), y la forma espinal (ELAE) representó el 51,9%.
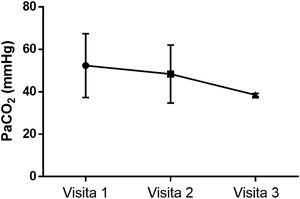
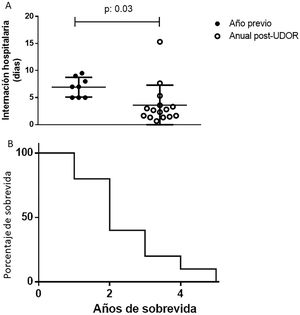
ResultadosDieciséis pacientes recibieron VNI en la primera visita y 7 durante el seguimiento. Cuatro (14,8%) aceptaron la traqueostomía. El modo ventilatorio más utilizado fue el barométrico con frecuencia de respaldo (S/T) sin O2 suplementario. La presión positiva espiratoria fue 5,6cmH2O (percentil 25-75 de 5-7) y la presión positiva inspiratoria 14,7cmH2O (percentil 25-75 de 12-17). Se utilizaron predominantemente máscaras oronasales. El cumplimiento fue 8,7±2,6h/día. La PaCO2 en las primeras 3 visitas (9 meses de VNI) se mantuvo (47,5 vs. 49,0 vs. 38,5mmHg; p=0,27). Se consignaron 24 hospitalizaciones (1,1±1,4 episodios/paciente) sin diferencias entre el año previo y el seguimiento (p=0,78), aunque la estancia hospitalaria se redujo (p=0,03) sin diferencias entre ELAB y ELAE. Registramos 12 fallecimientos en durante el seguimiento (mortalidad 52,2%), 10 de ellas en domicilio por directivas anticipadas.
ConclusionesEsta población mostró aceptación para el uso de VNI y los días de hospitalización se redujeron en el seguimiento. El cumplimiento fue adecuado y se relacionó con estabilidad gasométrica a mediano plazo.
Patients with amyotrophic lateral sclerosis need a multidimensional approach to alleviate their decreased respiratory performance. In order to describe the ventilatory support (NIV) implemented in a day hospital and health resources consumption, we review our experience during 4 years.
Patients and methodsWe included 27 patients; 19 men (70.4%), mean age 62.0±14.1 years. A percentage of 48.1 debuted due to bulbar symptoms (ELAB) and the spinal form (ELAS) represented 51.9%.
ResultsSixteen received NIV on the first visit and 7 during follow-up. Four (14.8%) accepted the tracheostomy. The most used ventilatory mode was barometric with backup rate (S/T) without supplemental O2. Expiratory positive pressure was 5.6 cmH2O (25-75 percentile of 5-7) and inspiratory positive pressure was 14.7 cmH2O (25-75 percentile of 12-17). Oronasal masks were used predominantly. Compliance of NIV was 8.7±2.6h/day. PaCO2 in the first 3 visits (9 months with NIV) was maintained stable (47.5 vs. 49.0 vs. 38.5 mmHg; P=.27). Twenty-four hospitalizations were recorded (1.1±1.4 episodes/patient) without differences between previous year and follow-up (P=.78), although the hospital stay was reduced (P=.03) without differences between ELAB and ELAS. We registered 12 deaths during follow-up (mortality 52.2%), 10 of them at home due to advance directives.
ConclusionsThis population showed acceptance of NIV and the hospitalization days were reduced in the follow-up. Compliance was adequate and related to gasometric stability in the medium term.
La esclerosis lateral amiotrófica (ELA) es una enfermedad neurológica caracterizada por la degeneración de la neurona motora superior e inferior1, lo que determina debilidad muscular progresiva que compromete la motricidad, la comunicación, la deglución y la función respiratoria. La supervivencia media es de 2 a 5 años2 desde el diagnóstico, siendo el desenlace frecuentemente debido a insuficiencia respiratoria. En algunos casos, la evolución puede presentarse aceleradamente3.
Los músculos afectados incluyen: el diafragma, los músculos auxiliares de la respiración y los músculos espiratorios y del abdomen que intervienen en el mecanismo de la tos4. La alteración de la musculatura orofaríngea contribuye a la tos ineficaz5 y causa trastornos de la fonación y la deglución, con riesgo de broncoaspiración e insuficiencia respiratoria3–5. En etapas avanzadas suelen aparecer disnea y ortopnea2–4.
La debilidad muscular diafragmática conduce a un aumento de la presión parcial de dióxido de carbono (PaCO2), inicialmente durante la noche y finalmente durante el día, con síntomas clínicos de deterioro de la calidad del sueño, somnolencia diurna y trastornos neurocognitivos. La hipoventilación nocturna es progresiva, aunque en ocasiones aparece de forma aguda en el contexto de una infección respiratoria, favorecida por la retención de secreciones6 o la broncoaspiración.
La ventilación no invasiva (VNI) es la administración de soporte ventilatorio sin vía respiratoria artificial, como intubación endotraqueal o traqueostomía. Habitualmente se realiza mediante un dispositivo generador de flujo conectado a una máscara nasal, oronasal o almohadillas nasales7. En ocasiones, también puede ser ofrecida de manera intermitente mediante una pieza bucal.
A largo plazo, los objetivos de la ventilación no invasiva de uso domiciliario (VMD) son: corregir la hipoventilación alveolar en pacientes en situación de insuficiencia respiratoria hipercápnica, disminuir el trabajo respiratorio y enlentecer la declinación funcional de los músculos respiratorios8. Asimismo, la importancia de tratar la hipercapnia radica en disminuir las hospitalizaciones y mejorar la calidad de vida8–10 y la sobrevida sin asistencia respiratoria mecánica por traqueostomía11,12.
En la decisión de iniciar VMD entran en juego: la edad del paciente, la gravedad del deterioro fisiológico y la voluntad del paciente10. En vista de su naturaleza reversible y no invasiva, así como de su tolerabilidad, la VNI se considera un componente terapéutico esencial en la ELA4,10. Es necesario un enfoque multidimensional para aliviar los síntomas, por lo que estos pacientes son considerados para cuidados paliativos13,14.
Escasos datos están disponibles acerca de VNI en pacientes con ELA en nuestro país15. Con el objetivo de describir el soporte ventilatorio y su tolerancia desde un modelo de hospital de día, así como el consumo de recursos de salud en esta población específica, revisamos nuestra experiencia durante 4 años.
Pacientes y métodosDiseñoEstudio retrospectivo sobre una base de datos de recogida sistemática basados en un hospital de día de único centro universitario. El protocolo fue aprobado por el Comité de Ética y Revisión Institucional de acuerdo con los principios éticos de Helsinki (protocolo CRI# 1052, marzo de 2020).
PoblaciónSe incluyeron pacientes con ELA según criterios clínicos y electromiográficos de El Escorial16, evaluados por médicos neurólogos especializados en enfermedades neuromusculares. Los pacientes con sospecha o evidencia de compromiso respiratorio en la espirometría fueron referidos a la Unidad de Observación Respiratoria (UDOR) entre julio de 2015 y julio de 2019 (4 años) e incluidos en el estudio.
Programa de hospital de díaEl programa UDOR se desarrolló durante un módulo asistencial de 4-6h de duración. Los pacientes fueron referidos desde la consulta externa o al alta de la hospitalización. El protocolo de seguimiento vigente contempla visitas cada 3-6 meses.
Se obtuvo información de la historia clínica confeccionada durante la permanencia en el programa (historia clínica electrónica única, SAP®). Se registraron datos demográficos, antropométricos, antecedentes clínicos, indicación de VNI, traqueostomía o asistencia respiratoria invasiva (ARM).
La indicación de VNI se realizó según criterios internacionales4–10,13. Cuando el paciente no presentaba evidencias de disfunción diafragmática, se continuaron las evaluaciones periódicas en visitas sucesivas. Los pacientes y sus familias participaron en las decisiones del tipo de soporte respiratorio. La provisión de equipamiento se realizó a través de los respectivos sistemas de cobertura social.
MedicionesSe realizaron gases en sangre arterial (matinal y sin el uso de dispositivos de ventilación u O2 suplementario) y espirometría computarizada (espirómetro MedGraphics, Saint Paul, MN, EE. UU.) utilizando la ecuación de referencia NHANES III.
Las presiones bucales máximas (inspiratoria y espiratoria) fueron realizadas en sedestación durante esfuerzos voluntarios máximos con manovacuómetro, válvulas unidireccionales y boquilla de buceo.
La fecha de inicio de la VNI, así como el modo y los parámetros del ventilador, se registraron al ingreso en la unidad y se descargaron los datos de software interno de los ventiladores, clasificados como:
- -
Dispositivos básicos de nivel i: generadores de flujo continuo, para ventilación barométrica con monitorización básica de cumplimiento, sin batería ni alarmas.
- -
Dispositivos de nivel ii intermedio: generadores de flujo continuo con batería y alarmas, monitorización de cumplimiento y eficacia, para ventilación barométrica.
- -
Dispositivos avanzados con soporte vital (nivel iii): con posibilidad de ventilar por volumen o por presión, alarmas de diferente prioridad, disponibilidad de batería interna y externa, y monitorización completa.
Las visitas incluyeron otras actuaciones, a saber: confección de plan de cuidados kinésicos, entrenamiento en el uso del ventilador y máscaras, interconsultas con especialidades afines y anticipación de directivas según voluntad del paciente. El equipo estuvo compuesto por médicos neumonólogos y kinesiólogos respiratorios. Cuando fue necesario se solicitó la consulta de disciplinas afines (neurología, cuidados paliativos, nutrición, etc.).
En marzo de 2021 se recopiló información de hospitalizaciones y modalidad de las mismas (sala de internación general o Unidad de Terapia Intensiva), y mortalidad hospitalaria, utilizando el programa de gestión hospitalaria (SAP®), considerando un año calendario previo a la visita inicial y el periodo posterior hasta marzo del 2021. Finalmente, todos los pacientes o sus familias fueron contactados telefónicamente a fin de verificar su situación clínica: vivo o fallecido.
Análisis estadísticoLos resultados se presentaron como porcentajes en las variables categóricas o media y desvío estándar en las variables numéricas.
Para comparar las diferencias entre 2 grupos se utilizó el test de Mann-Whitney o χ2 para variables cuantitativas y cualitativas, respectivamente, y cuando se compararon los resultados categóricos de 2 o más grupos se utilizó el test no paramétrico de Kruskal-Wallis y ANOVA para la comparación de la media en 2 o más grupos. La supervivencia se analizó mediante el estimador no paramétrico de Kaplan-Meier.
El análisis de los datos se realizó utilizando el software Prism 7 (GraphPad, La Jolla, CA, EE. UU.).
ResultadosDurante 48 meses, incluimos 27 pacientes; 19 hombres (70,4%), edad media de 62,0±14,1 años y un índice de masa corporal de 24,3±5,7kg/m2. El 48,1% comenzó con síntomas bulbares (ELAB), mientras que la forma espinal (ELAE) representó el 51,9% (14 pacientes).
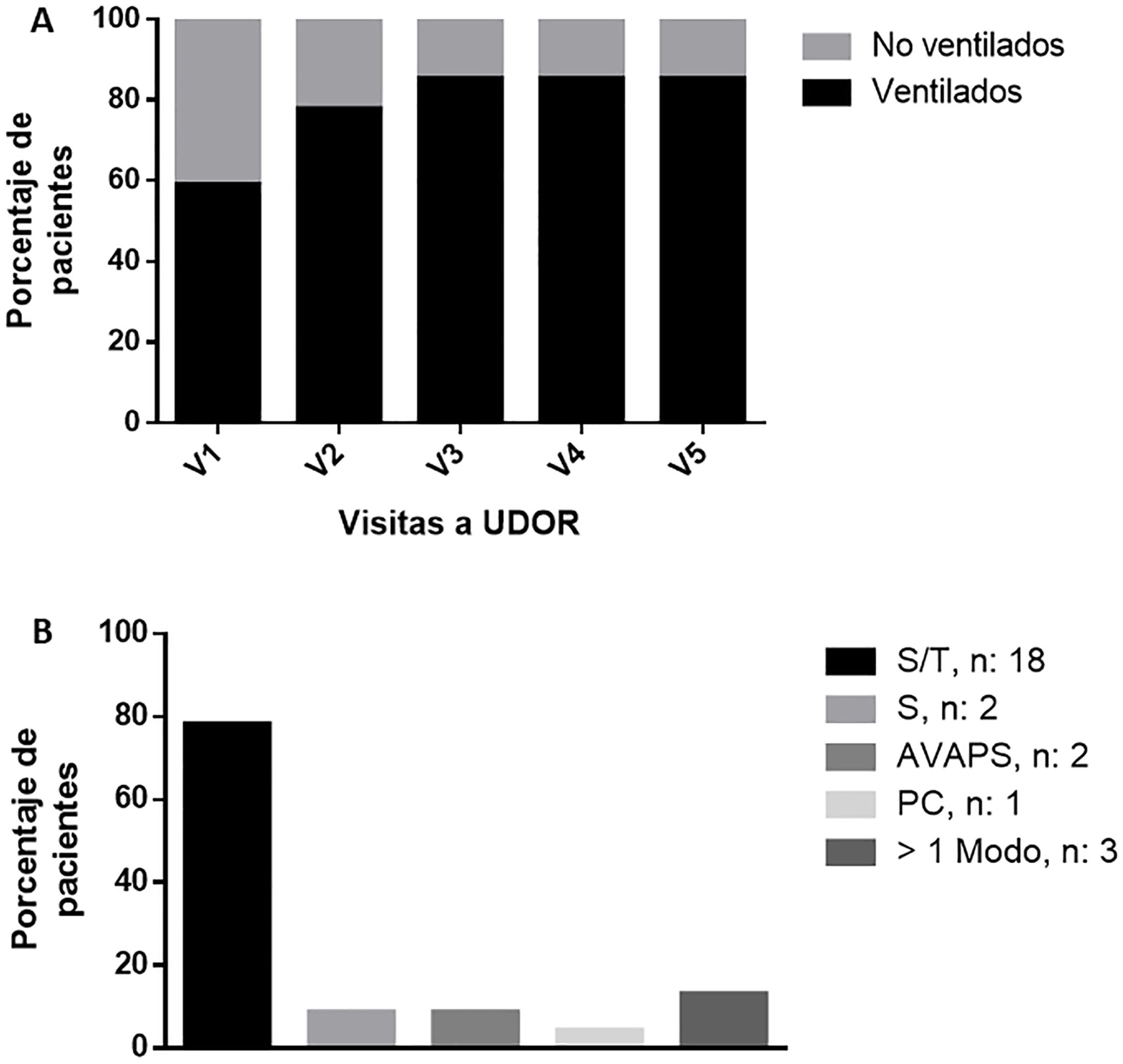
El tiempo entre la confirmación diagnóstica y la evaluación respiratoria fue de 11 meses. La PaCO2 basal fue de 46,1±18,1mmHg. Dieciséis pacientes recibieron VMD desde la primera visita (59,2% del total) y 7 durante el seguimiento (fig. 1A). En total, 23/27 (82,2%) recibieron soporte ventilatorio. Cuatro (14,8%) aceptaron la traqueostomía y/o ARM, debido a compromiso bulbar (2 casos) o progresión de la disfunción respiratoria (2 casos).
Los pacientes con VNI (GVNI) vs. aquellos sin soporte ventilatorio (NVent) fueron más jóvenes (61,8±11,4 vs. 66,0±27,2 años; p=0,03) y tenían mayor grado de hipercapnia basal (50,1±14,2 vs. 47,0±20,1mmHg; p=0,04).
Las mediciones funcionales no fueron diferentes en ELAB y ELAE (tabla 1), aunque expusieron defectos indicativos de disfunción diafragmática en ambos.
Mediciones funcionales en estado basal según inicio bulbar o espinal
| Mediciones basales | Inicio como ELABn=13 | Inicio como ELAEn=14 | p |
|---|---|---|---|
| Espirometría basal | |||
| CVF, litros | 2,2±0,9 | 1,7±0,6 | 0,162 |
| CVF, % | 53,9±23,2 | 47,8±17,9 | 0,447 |
| FEV1, litros | 1,40±0,48 | 1,6±0,6 | 0,271 |
| FEV1, % | 55,7±18,1 | 50,0±18,7 | 0,512 |
| Cociente FEV1/CVF | 80,1±13,8 | 81,7±9,9 | 0,735 |
| Presiones bucales máximas | |||
| PiMáx, cmH2O | 33,2±15,4 | 34,5±17,3 | 0,844 |
| PeMáx, cmH2O | 40,2±21,4 | 41,2±13,8 | 0,899 |
| Pico flujo espiratorio | |||
| Pico flujo clásico, l/seg | 213,9±100,9 | 182,2±72,0 | 0,460 |
| Pico flujo tosido, l/seg | 190,6±88,6 | 200,0±54,5 | 0,839 |
| Gases arteriales | |||
| pH | 7,39±0,03 | 7,39±0,03 | 0,901 |
| PaCO2 | 51,9±17,5 | 46,9±11,2 | 0,425 |
| PaO2 | 75,3±19,5 | 79,8±16,8 | 0,647 |
| HCO3 | 26,5±2,8 | 26,6±4,0 | 0,943 |
| EB+ | 1,7±1,7 | 1,7±2,9 | 0,995 |
| Saturación O2 | 95,9±1,2 | 95,0±2,2 | 0,243 |
Resultados expresados como media±desvío estándar.
CVF: capacidad vital forzada; EB+: exceso de base positivo; ELAB: esclerosis lateral amiotrófica de comienzo bulbar; ELAE: esclerosis lateral amiotrófica de comienzo espinal; FEV1: volumen espiratorio forzado en el primer segundo; HCO3: bicarbonato arterial; PaCO2: presión parcial de dióxido de carbono arterial; PaO2: presión parcial de oxígeno arterial; PeMáx: presión bucal máxima espiratoria; PiMáx: presión bucal máxima inspiratoria.
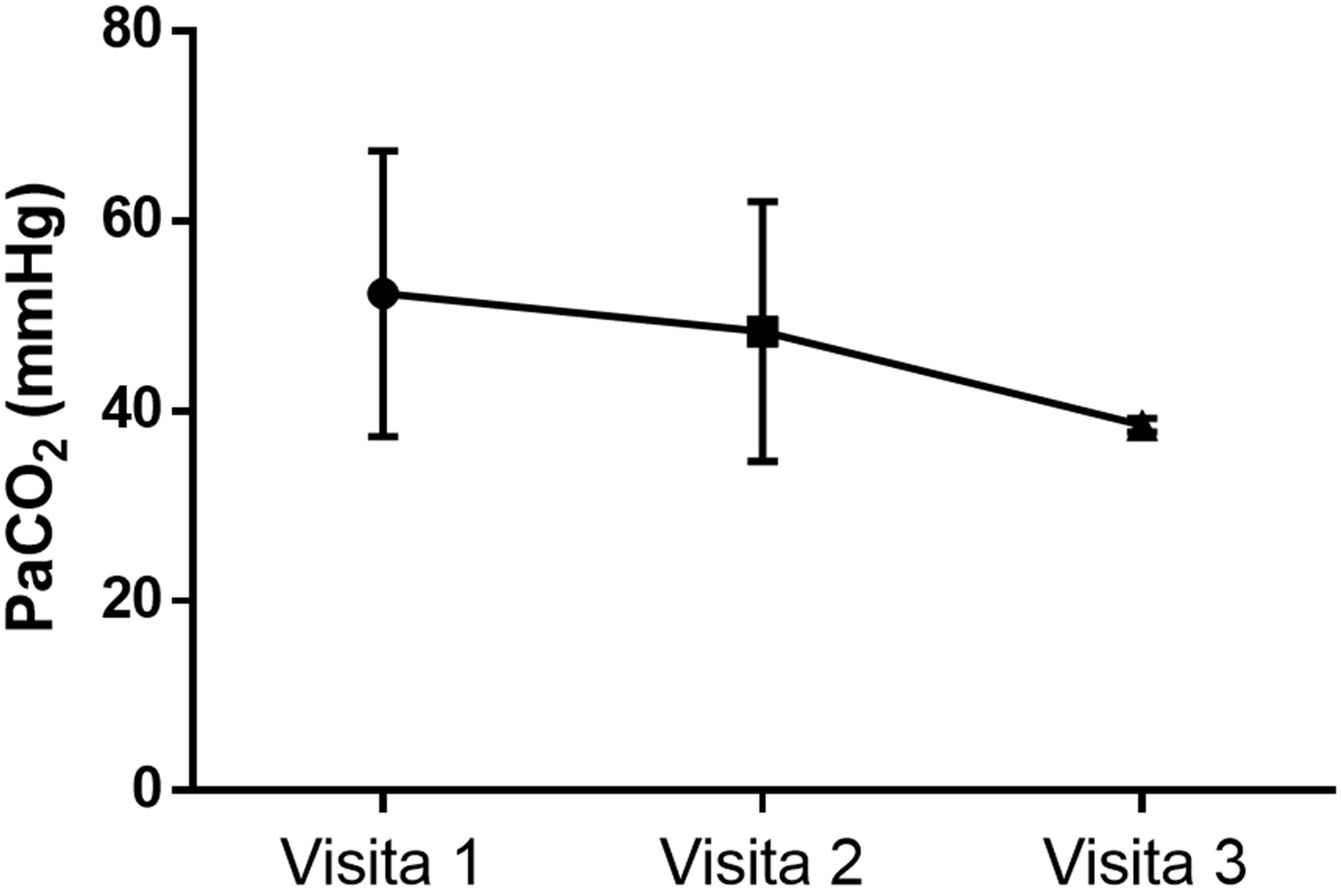
El modo ventilatorio más utilizado fue el barométrico con frecuencia (S/T) sin O2 suplementario (tabla 2 y fig. 1B). Tres pacientes utilizaron más de un modo. La presión positiva espiratoria fue de 5,6cmH2O (percentil 25-75 de 5-7) y la presión positiva inspiratoria de 14,7cmH2O (percentil 25-75 de 12-17). Se utilizaron predominantemente máscaras oronasales. El cumplimiento de la VNI fue de 8,7±2,6h/día (tabla 3). La PaCO2 arterial en 3 determinaciones (primeros 9 meses con VNI) se mantuvo estable: 47,5 vs. 49,0 vs. 38,5mmHg, p=0,27 (fig. 2).
Características del soporte ventilatorio no invasivo (n=23)
| Tipo de equipamiento, n (%) | |
| Nivel I | 17 (73,9) |
| Nivel II | 3 (13,0) |
| Nivel III con soporte vital | 3 (13,0) |
| Modos ventilatorios, n (%) | |
| Modo S/T | 18 (78,2) |
| Modo barométrico espontáneo | 2 (8,7) |
| Modo barométrico con volumen asegurado | 2 (8,7) |
| Modo presión control | 1 (4,3) |
| Más de un modo ventilatorio | 3 (13) |
| O2 suplementario | - |
| Máscara oronasal | 16 (69,6) |
| Máscara nasal | 7 (30,4) |
| Pieza bucal | 3 (13) |
| Parametrización básica, mediana (rango) | |
| IPAP (cmH2O) | 14,7 (12-17) |
| EPAP (cmH2O) | 5,6 (5-7) |
| Frecuencia respiratoria (rpm) | 15 (12-18) |
| Datos de monitorización, media±DE | |
| Uso medio del soporte (adherencia en h/día) | 8,7±2,6 |
| Volumen corriente medio (ml) | 655±119,0 |
| Fuga media (l/min) | 29,2±15,5 |
DE: desvío estándar; EPAP: presión espiratoria; IPAP: presión inspiratoria; S/T: modo ventilatorio barométrico espontáneo con frecuencia de respaldo (spontaneous/timed).
Consumo de recursos previos al programa hospital de día y en el seguimiento
| Pacientes con soporte ventilatorio (n=23) | ||||
|---|---|---|---|---|
| Año previo a UDOR | Media anual indexadaa | Seguimiento | p | |
| Episodios de hospitalización, n | 9 | 8 | 24 | 0,76 |
| Hospitalizaciones en ELAB, n | 3 | 2 | 6 | 0,50 |
| Ingresos por paciente, media±DE | 0,39±0,6 | 0,35±0,4 | 1,12±1,4 | 0,78 |
| Días de internación por episodio, media±DE | 6,9±1,8 | 3,6±3,8 | 11,2±12,5 | 0,03 |
| Ingresos a UTI | 2 | 3 | 9 | 0,63 |
| Días de internación en UTI, media±DE | 6,5±2,1 | 4,1±5,8 | 12,3±15,4 | 0,54 |
| Traqueostomía, n (%) | 4/23 (17,4) | |||
| Fallecimientos en ELAB con soporte ventilatorio, n (%) | 4/9 (44,4) | |||
| Fallecimientos en ELAE con soporte ventilatorio, n (%) | 6/14 (42,8) | |||
| Total fallecimientos con soporte ventilatorio, n (%) | 10/23 (43,4) | |||
DE: desvío estándar; ELAB: esclerosis lateral amiotrófica de comienzo bulbar; ELAE: esclerosis lateral amiotrófica de comienzo espinal; UDOR: Unidad de Observación Respiratoria; UTI: Unidad de Terapia Intensiva.
El valor de p corresponde al test T entre eventos del año calendario previo a UDOR y la media anual posterior.
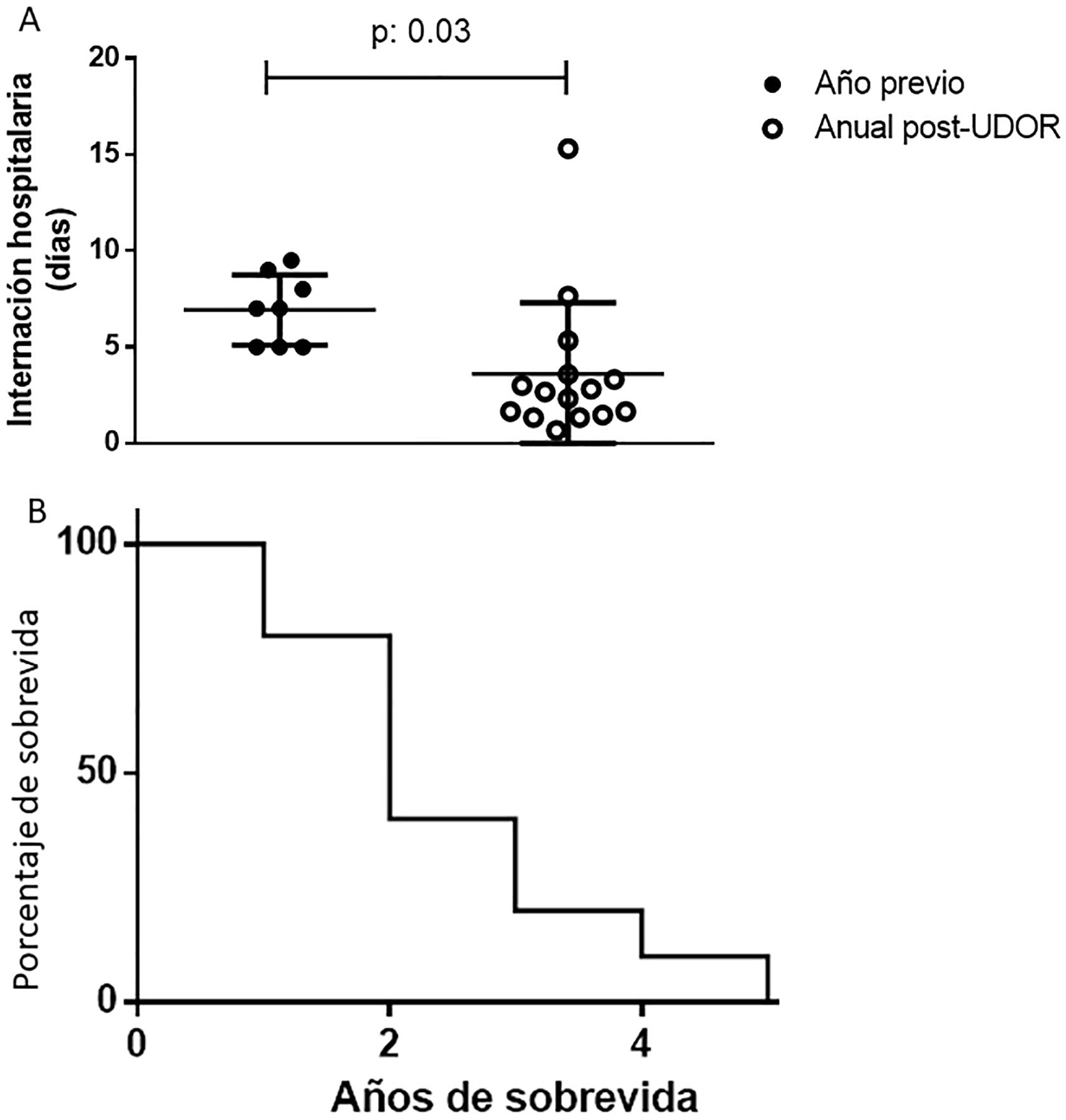
Se consignaron 24 hospitalizaciones debido a intercurrencias (cirugías, gastrostomías, traqueostomías, etc.), con 1,1±1,4 episodios/paciente. No existieron diferencias entre el año previo al inicio de la VNI y el seguimiento en cuanto al número de internaciones (p=0,78), aunque la estancia hospitalaria (días/episodio) se redujo (p=0,03), sin diferencias entre ELAB y ELAE, p<0,65 (fig. 3A y tabla 3). Se registraron 12 fallecimientos (mortalidad del 52,2%). Diez decesos se produjeron en el domicilio por progresión de la enfermedad con directivas anticipadas de limitación de los esfuerzos. La sobrevida media fue de 2 años (fig. 3B).
DiscusiónEste análisis describe el tratamiento ventilatorio y el consumo de recursos de salud en pacientes con ELA y expone una elevada aceptación de la VNI en nuestro medio, con alta tasa de cumplimiento efectivo y estabilidad gasométrica en el corto y mediano plazo.
Generalmente, se recomienda que la VNI se inicie cuando se presentan síntomas clínicos de insuficiencia respiratoria. Sin embargo, estudios recientes proponen el inicio de la VNI en etapas precoces, teniendo en cuenta que la técnica de VNI requiere entrenamiento y adaptación del paciente y su entorno17–19.
Métricas funcionales como CVF, capacidad vital lenta, presión inspiratoria nasal con maniobra de olfateo (sniff nasal), PFT, presiones bucales máximas inspiratoria y espiratoria, gases en sangre arterial, oximetría nocturna, capnografía y velocidad de conducción del nervio frénico se han propuesto para determinar el momento para iniciar el soporte ventilatorio20. En algunos países europeos se tiende a iniciar la VNI con síntomas mínimos incluso antes de la declinación de la CVF y sin síntomas evidentes21.
Un estudio aleatorizado y controlado en 54 pacientes con ELA mostró que la puesta en marcha de soporte ventilatorio precoz (CVF>80%) tuvo el efecto de enlentecer la declinación funcional18. Del mismo modo, un estudio retrospectivo en 194 pacientes halló mejor supervivencia con VNI en fases tempranas19. Nuestros pacientes mostraban deterioro respiratorio basal ostensible21 y más de la mitad iniciaron VNI en ese momento, aunque puede estar relacionado con la forma en que se seleccionaron. No obstante, la totalidad de los pacientes que recibieron VNI lo hicieron entre la primera y la segunda visita, demostrando posiblemente una derivación tardía y una necesidad de mejora en el proceso de evaluación funcional respiratoria.
Hemos elegido el modo barométrico (S/T) con frecuencia de respaldo en el 80% de los pacientes; de manera similar, la ventilación domiciliaria por presión continua, siendo el modo más frecuente de soporte en Europa y EE. UU.4–22.
El cumplimiento terapéutico de la VMD fue elevado (8,7h/día). Es de destacar que la mayoría de los pacientes usaban equipos de bajo costo y complejidad (nivel i). La financiación y cobertura por parte del sistema de salud (muchas veces parcial) podría haber influido en el proceso de selección del equipamiento.
Se ha planteado que no existe correlación entre el grado de hipercapnia y la intensidad de la utilización de la VNI en ELA15. Existen pacientes con dependencia a la VMD, aunque sin hipercapnia. En nuestra serie, los valores basales de PaCO2 no eran críticos y la desviación del pH fue tolerable, evidenciando estabilidad en los primeros 9 meses. Sin embargo, una significativa proporción de pacientes continuó con hipercapnia, demostrando un grado avanzado de disfunción diafragmática.
En nuestra experiencia, los pacientes aceptaron bien la VMD, incluso hasta el punto de que algunos la utilizaban con régimen nocturno y diurno extendido, junto con tratamientos concurrentes para alivio de la disnea, y la mayoría (83%) falleció en el domicilio en compañía de familiares debido a la progresión de la enfermedad. Nosotros no utilizamos cuestionarios de calidad de vida o cuestionarios específicamente diseñados para enfermedades neuromusculares, aunque siempre revisamos las opciones y evaluamos las preferencias del paciente junto con su familia.
Un trabajo aleatorizado y controlado, basado en 92 pacientes con ELA, concluyó que la VNI mejora la supervivencia y la calidad de vida11. Este efecto parece ser marginal en pacientes con ELA bulbar13. Similares hallazgos fueron descriptos en una reciente revisión sistemática de la literatura12. En este estudio, el estatus funcional fue similar, independientemente de la forma de inicio, permitiendo que la mitad de los pacientes continuaran con VMD a 48 meses.
Finalmente, hemos documentado que la estrategia de VMD y hospital de día no disminuyó las hospitalizaciones, representando esta población un subgrupo con alta demanda de recursos de salud. Sin embargo, este punto puede estar influido por el estadio de la enfermedad, la organización y calidad de los cuidados domiciliarios, el tipo de cobertura social y el entrenamiento del personal en el manejo de situaciones que representan complicaciones. Un programa institucional ha demostrado que puede reducir las hospitalizaciones en pacientes con VMD y EPOC en nuestro medio23, aunque la dinámica y la evolución natural radicalmente distintas de ambas enfermedades podrían explicar estas diferencias pese a programas similares de seguimiento.
El uso de ARM por traqueostomía en la ELA varía entre el 0% en el Reino Unido, el 14% en EE. UU., el 3% en Alemania, el 2-5% en Francia, el 11% en Italia y el 27-45% en Japón, reflejando aspectos culturales, económicos, legales y organizativos, tanto dentro como fuera del sistema sanitario24–26. En nuestra serie, una proporción minoritaria aceptó y accedió a la traqueostomía, mostrando un comportamiento similar al observado en países desarrollados. Estos casos representaron pacientes con alto grado de motivación para continuar el tratamiento, en general acompañados por familias continentes.
Nuestro estudio presenta múltiples limitaciones. Primero, esta experiencia se circunscribe a un único centro privado con gran fragmentación (diversas obras sociales y sistemas de medicina prepaga, etc.), que hace difícil la extrapolación a otras organizaciones. Segundo, el análisis de consumo de recursos se realizó de forma retrospectiva con las típicas limitantes de este tipo de diseño. Tercero, varias condiciones en el tiempo de obtención de los datos pudieron influir en la tasa de admisión hospitalaria y las decisiones al final de la vida. Cuarto, algunos pacientes con ELA no fueron evaluados en hospital de día en etapas tempranas, por lo que nuestro universo se limita a la población derivada para evaluación respiratoria. Finalmente, no analizamos otras actuaciones (desempeño de intermediarios, política de las aseguradoras de salud, equipamiento accesorio, calidad de los recursos humanos en el domicilio, manejo de urgencias, etc.).
A pesar de estos problemas, los resultados exponen una aproximación al problema del consumo de recursos, las admisiones hospitalarias y las preferencias en pacientes con ELA ventilados en domicilio, que en nuestro conocimiento representan la primera comunicación de este tipo en nuestro país. Son necesarios estudios prospectivos longitudinales para evaluar el alcance de este tipo de intervenciones a largo plazo.
En resumen, los pacientes con ELA mostraron aceptación y adherencia para el uso de VNI por sobre los procedimientos de ARM invasiva, y los días de hospitalización se redujeron en el seguimiento. El cumplimiento del tratamiento ventilatorio fue adecuado y se relacionó con estabilidad gasométrica a mediano plazo.
FinanciaciónNuestro trabajo no contó con ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.