El uso combinado de actividad cognitiva (AC) y actividad física (AF) parece modular los factores asociados a la incidencia de Alzheimer leve.
ObjetivosExaminar los efectos de una intervención combinada de AC y AF sobre el rendimiento cognitivo en ancianos con EA leve.
MétodoDiseño cuasiexperimental con asignación aleatoria al grupo de intervención y grupo control.
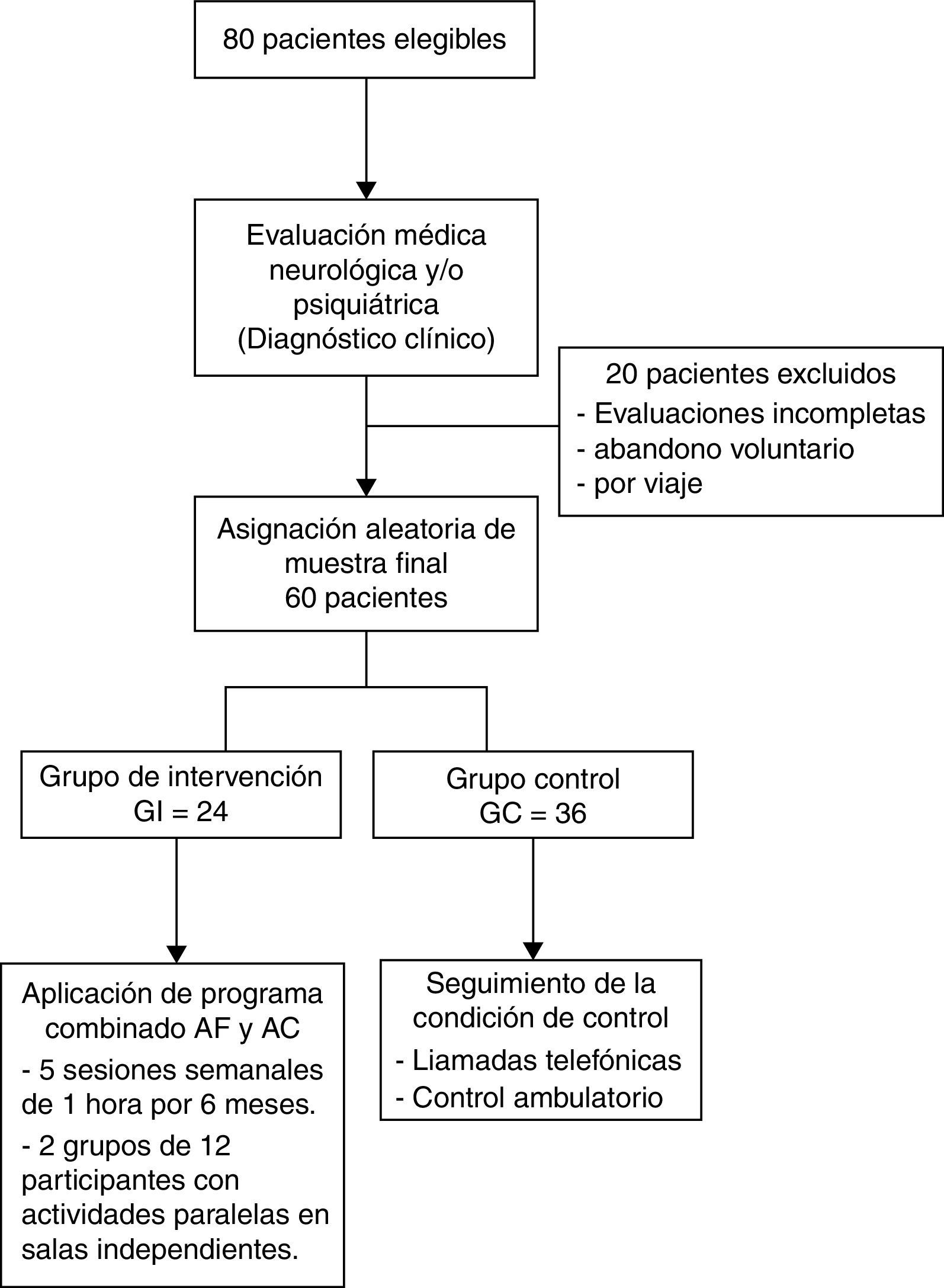
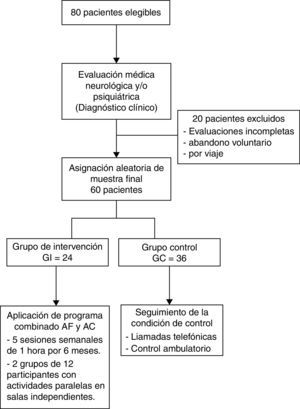
ParticipantesOchenta sujetos ≥ 60 años con diagnóstico neurológico de demencia tipo Alzheimer de grado leve, de los cuales 60 concluyeron el estudio (19 hombres y 41 mujeres). Los participantes fueron divididos de forma aleatoria en un grupo de intervención (GI: n=24, M ± DE 71,8 ± 5,5 años) sometido a un programa combinado de entrenamiento cognitivo y actividad física de 6 meses de duración y un grupo control (GC: n = 36) integrado por sujetos sedentarios (M ± DE 73,8 ± 6,3 años) que no realizaron actividad física ni estuvieron sometidos a entrenamiento cognitivo durante el estudio.
ResultadosLa t de Student inter e intragrupal reportó diferencias significativas en MMSE, TFCR, TAAVR y TMT-A y B a favor del GI, mostrando un incremento en las medias de desempeño de todas las dimensiones evaluadas después del programa de AF y AC, respecto del GC. El ANCOVA reportó evidencia a favor del impacto de la AC y la AF en la función cognitiva del GI vs. controles (f=17,378; p<0,000).
ConclusionesSe encontraron resultados favorables que muestran una diferencia significativa en los grupos de estudio, revelando como la AC y AF mejora el desempeño cognitivo de los ancianos con demencia.
The combined use of cognitive activity (CA) and physical activity (PA) seems to modulate the factors associated to the incidence of mild Alzheimer.
ObjectivesTo examine the effects of a combined intervention of CA and PA on cognitive performance in the elderly with mild AD.
MethodQuasi-experimental design, single blind evaluation with groups comparison.
Participants80 subjects=60 years with neurological diagnosis of mild Alzheimer's dementia, of whom 60 completed the study (19 men and 41 women). Participants were randomly divided into an intervention group (IG: n=24, M=71.8 years, SD=5.5) subjected to a combined program of cognitive training and physical activity for 6 months, and a control group (CG: n=36, M=73.8 years, SD=6.3) composed of sedentary subjects who didn’t do any physical activity or were subjected to cognitive training during the study.
Resultsinter and intragroup t-student tests reported significant differences in MMSE, TRCF, TAAVR and TMT-A and B for the GI, an increase in the mean performance of all dimensions evaluated after AF program and BC, in the CG. The ANCOVA reported favorable evidence of the impact of AC and AF on cognitive function of GI versus controls (f=17,378, P<.000).
Conclusionsfavorable results showing a significant difference in the study groups, emerging as the CA and PA improves cognitive performance of the elderly with dementia were found.
Las demencias degenerativas son enfermedades irreversibles que afectan a 35,6 millones de personas en el mundo1,2 y la enfermedad de Alzheimer (EA) es la causa más frecuente de demencia y la más prevalente entre los ancianos3,4. Se caracteriza por la acumulación del péptido amiloide-β (Aß) como principal responsable de los cambios fisiológicos durante el desarrollo y la progresión de la enfermedad, incluyendo la desincronización de los potenciales de acción neuronal, con desarrollo de ritmos anormales del cerebro, relevantes para la cognición y la aparición definitiva de los déficits cognitivos5,6. La aparición tardía de EA está asociada a la edad avanzada, siendo esta el factor de riesgo más importante, el genotipo APOE ¿4, traumatismo craneoencefálico, historia familiar, bajo nivel educativo y baja participación en actividades cognitivamente estimulantes7. La etiología exacta de la EA aún es desconocida, por lo que se reconoce que es multifactorial, resultado del envejecimiento, la genética, los factores ambientales y los estilos de vida3,8. El aumento en la prevalencia de EA es < 1% por debajo de los 60 años y > 40% por encima de los 85 años de edad9.
Los factores asociados a EA son identificados en la literatura como el «riesgo atribuible a la población» (RAP) para presentar EA10. El consenso científico reconoce 7 factores de riesgo que tienen una evidencia consistente de asociación con EA: diabetes, hipertensión arterial y obesidad de la mediana edad, inactividad física, depresión, tabaquismo y bajo nivel instruccional10-14. Los estudios de Norton et al.10 calcularon a nivel mundial un RAP combinado de factores asociados a EA, estimando que de los 33-35 millones de casos de demencia, 9 millones son atribuibles a los 7 factores de riesgo de la enfermedad. Los factores bajo nivel educativo e inactividad física correspondían a los factores más altos relacionados con EA. Alrededor de un tercio de la EA podría ser atribuible a los factores de riesgo modificables.
La incidencia de EA y los factores asociados se han tratado de reducir en la última década, a través de medidas farmacológicas centradas en los déficits de neurotransmisores del trastorno neurocognitivo, proporcionando un alivio sintomático de breve duración, pero incapaces de detener el proceso neurodegenerativo15. Se han intentado diversas estrategias terapéuticas orientadas a prevenir la formación y deposición de β-amiloide y tau o acelerar su eliminación, con éxito limitado16. Sin embargo, la evidencia disponible indica que medidas terapéuticas no farmacológicas combinadas, como la actividad cognitiva (AC) y la actividad física (AF), durante la mediana edad y en personas mayores, reduce el riesgo de presentar enfermedades neurodegenerativas y mejora la función cognitiva en la fase prodrómica de la EA17-21.
Estudios en animales con inducción de EA con inyección intracerebroventricular de péptido Aβ1-40, sometidos a entrenamiento físico y cognitivo, confirmarían la hipótesis de que la AF y la AC pueden ejercer protección contra algunos mecanismos de neurotoxicidad inducida por Aβ1-40, convirtiéndose en potenciales factores neuroprotectores de EA22-25. Estudios longitudinales y ensayos clínicos han indicado que la AC y la AF se asocian a un menor riesgo de demencia en sujetos ancianos, mejorando la función cardiovascular y muscular, disminuyendo el nivel de fragilidad y mejorando la función cognitiva18,26-28.
Las personas mayores con EA que son física e intelectualmente activas acumulan mayor función neuroprotectora contra la enfermedad, mejorando su rendimiento en fases preclínicas o leves del Alzheimer17,18. Por tanto, la incidencia de EA podría reducirse mediante el uso de métodos combinados de AF y AC, dirigidos a reducir la prevalencia de los factores asociados a EA y mejorar la función cognitiva en esta condición, teniendo en cuenta los efectos positivos reportados en la literatura4,10,29,30.
El objetivo del estudio es examinar los efectos de una intervención combinada, de entrenamiento cognitivo y ejercicio físico sobre el rendimiento cognitivo en personas mayores con EA leve. Se espera que los resultados muestren una diferencia significativa en los grupos de estudio, revelando cómo la AC y la AF mejoran el desempeño cognitivo de los ancianos con demencia.
MétodoDiseño cuasiexperimental con asignación aleatoria al grupo de intervención (GI) y al grupo control (GC). Se incluyó a 80 participantes; solo concluyeron el estudio 60 sujetos (19 hombres y 41 mujeres). Todos ≥ 60 años, con diagnóstico neurológico de demencia tipo Alzheimer de grado leve (Clinical Dementia Rating Scale [CDR]=1), divididos de forma aleatoria en un GI=24 ancianos (M ± DE 71,8 5,5 años), sometidos a un programa combinado de AF y AC, de 6 meses de duración, y un GC=36 sujetos sedentarios (M ± DE 73,8 ± 6,3 años) que no realizaron AF ni estuvieron sometidos a entrenamiento cognitivo durante el estudio. Para el diagnóstico de EA probable se utilizaron los criterios del DSM-IV-TR31, los criterios clínicos NINCDS-ADRDA32 y la escala de severidad CDR (CDR=1). Los criterios de inclusión fueron Mini Examen del Estado Mental (MMSE)=10-24, presentar de demencia leve (CDR=1). Se excluyó a todos los individuos con evidencia clínica de ECV, otros tipos de demencias, Parkinson, antecedentes de injuria cerebral, otros tipos de enfermedades neurológicas y contraindicaciones para las actividades físicas o de grupo. Los participantes provienen del sector de atención primaria rural de la comuna de Temuco.
InstrumentosSe administró la versión validada del MMSE para Chile33, la parte A y B del test del trazo (TMT), para valorar atención y flexibilidad cognitiva34. El test de la figura compleja de Rey (TFCR), para analizar el procesamiento perceptivo visual y el grado de fidelidad de la memoria visual. Se trabajó con la copia y el recuerdo a corto plazo34, y el Test de aprendizaje auditivo verbal de Rey (TAAVR), que valora la evocación inmediata, el aprendizaje y la consolidación del aprendizaje verbal de una lista de palabras34. La versión utilizada consistió en la administración de una lista de 15 palabras en 5 ensayos consecutivos, valorando, luego de cada ensayo, el número de palabras recordadas por el sujeto. Se tomó el ensayo 1 (A1) como evocación, el ensayo 5 (A5) de etapa de aprendizaje y el recuerdo libre a largo plazo (A7) como consolidación del aprendizaje.
ProcedimientoEl diagrama de flujo de los participantes del estudio se muestra en la figura 1. Se realizó una intervención combinada de AF y entrenamiento cognitivo, de 5 sesiones semanales, cada una de 60 min, durante 6 meses. El GI fue dividido en 2 grupos de 12 participantes que trabajaron de forma paralela en 2 salas independientes, del Estadio Municipal de la ciudad de Temuco, con el fin de reducir la interferencia ambiental y la resultante de la actividad grupal. Las sesiones de AF fueron divididas en 4 series de ejercicios. Primera serie: 10 min de calentamiento, de ejercicios de flexibilidad. Segunda serie: 20 m de caminatas. Tercera serie: 10 min de ejercicios de equilibrio y cuarta serie: 20 min de resistencia cardiovascular moderada, guiada por instructor.
Mientras los sujetos cumplían con las series 1 y 2 de AF, escuchaban por un altavoz 3 palabras (manzana, pala, trompeta), a razón de una palabra por segundo, que luego debían evocar de memoria. Cumplida la tarea, se aumentaban los estímulos (6, 9, 12, 15), hasta llegar a un máximo de 18 reactivos. Se esperó como techo mínimo de evocación auditiva 12 palabras evocadas. Concluida la segunda serie de ejercicios, se efectuó un examen rápido, tipo checklist, para corroborar el aprendizaje auditivo verbal en los participantes, solicitando la evocación de memoria de las palabras aprendidas. Entre la tercera y la cuarta series de ejercicios, al frente de los participantes se proyectaban fotografías simples a color en grupo de 3 reactivos (flor, bebé, auto), que luego debían ser reconocidas dentro de una lista que contenía imágenes de interferencia (2 reactivos: pez y luna). Resuelta la actividad, se duplicaba el número de estímulos (6, 9, 12, 15), así como las imágenes de interferencia (4, 6, 8 y 10), con un máximo de 18 fotografías y 12 estímulos de interferencia. Se esperó como techo mínimo de reconocimiento visual 12 imágenes. Finalizada la AF, se efectuó un testeo rápido de las imágenes previamente presentadas y aprendidas, para confirmar el aprendizaje visual. En promedio, todos los participantes lograron el techo mínimo de evocación auditiva y visual. Los reactivos auditivos y visuales utilizados fueron renovados cada semana.
El GI y GC fueron evaluados con instrumentos neuropsicológicos, al inicio y al final de la intervención. Los participantes del estudio firmaron un consentimiento informado donde declararon su participación voluntaria y la asistencia al total de las sesiones.
Análisis estadísticoSe utilizó el estadístico paramétrico t de Student para grupos relacionados para verificar la existencia de diferencias en los desempeños de cada grupo de estudio (GI y GC), de forma separada en la pre y posprueba, y t de Student para grupos independientes para verificar la existencia de diferencias entre GI y GC, en la pre y posprueba. Se realizaron ANCOVA con el puntaje del MMSE postintervención como variable dependiente, el género y los grupos de estudio como factores fijos, y la escolaridad y la edad como covariables para evaluar el efecto de estas variables sobre la función cognitiva. El análisis de datos se realizó con el programa estadístico SPSS v. 19.
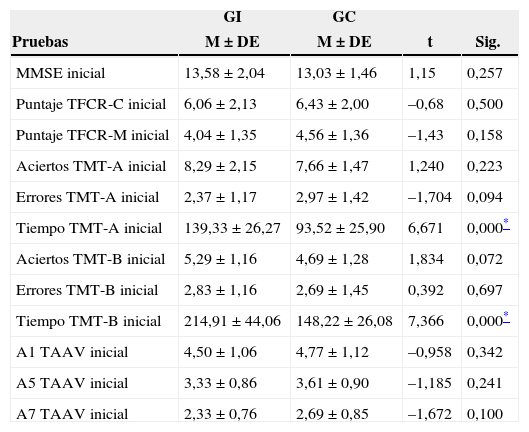
ResultadosComo se observa en la tabla 1, no se reportan diferencias significativas en la mayoría de los indicadores antes de la intervención, exceptuando el tiempo en la parte A (t=6,671; p<0,000) y B (t=–7,366; p<0,000) del TMT. En la fase inicial del estudio, el GI tarda más tiempo para resolver el instrumento.
Comparaciones intergrupales antes de la intervención física y cognitiva
| GI | GC | |||
|---|---|---|---|---|
| Pruebas | M ± DE | M ± DE | t | Sig. |
| MMSE inicial | 13,58 ± 2,04 | 13,03 ± 1,46 | 1,15 | 0,257 |
| Puntaje TFCR-C inicial | 6,06 ± 2,13 | 6,43 ± 2,00 | –0,68 | 0,500 |
| Puntaje TFCR-M inicial | 4,04 ± 1,35 | 4,56 ± 1,36 | –1,43 | 0,158 |
| Aciertos TMT-A inicial | 8,29 ± 2,15 | 7,66 ± 1,47 | 1,240 | 0,223 |
| Errores TMT-A inicial | 2,37 ± 1,17 | 2,97 ± 1,42 | –1,704 | 0,094 |
| Tiempo TMT-A inicial | 139,33 ± 26,27 | 93,52 ± 25,90 | 6,671 | 0,000* |
| Aciertos TMT-B inicial | 5,29 ± 1,16 | 4,69 ± 1,28 | 1,834 | 0,072 |
| Errores TMT-B inicial | 2,83 ± 1,16 | 2,69 ± 1,45 | 0,392 | 0,697 |
| Tiempo TMT-B inicial | 214,91 ± 44,06 | 148,22 ± 26,08 | 7,366 | 0,000* |
| A1 TAAV inicial | 4,50 ± 1,06 | 4,77 ± 1,12 | –0,958 | 0,342 |
| A5 TAAV inicial | 3,33 ± 0,86 | 3,61 ± 0,90 | –1,185 | 0,241 |
| A7 TAAV inicial | 2,33 ± 0,76 | 2,69 ± 0,85 | –1,672 | 0,100 |
DE: desviación estándar; GC: grupo control; GI: grupo de intervención; TAAVR: test de aprendizaje auditivo verbal de rey; TFCR: test de la figura compleja de rey, TMT: trail making test.
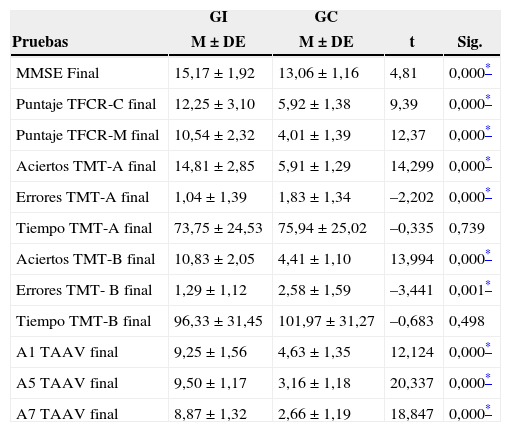
En la tabla 2 se evidencian diferencias estadísticamente significativas entre el GI y GC en el MMSE, en la dimensión copia y memoria del TFCR, en la evocación (A1), el aprendizaje o recuerdo (A5) y la consolidación (A7) del TAAVR, y en los aciertos y errores del TMT-A y B, exceptuando el tiempo que toman los grupos de estudio para resolver la tarea. Cabe destacar que ambos grupos consumen en promedio el mismo tiempo para resolver la parte A y B del TMT, pero el GI consigue mayor puntaje y genera menos errores que el GC. Además, el GI disminuye el consumo promedio de tiempo en la postintervención para resolver la parte A y B del test respecto del GC, que no lo consigue. Situación potencialmente asociada a una mayor velocidad de respuesta del GI producto de la AF y AC.
Comparaciones intergrupales después de la intervención física y cognitiva
| GI | GC | |||
|---|---|---|---|---|
| Pruebas | M ± DE | M ± DE | t | Sig. |
| MMSE Final | 15,17 ± 1,92 | 13,06 ± 1,16 | 4,81 | 0,000* |
| Puntaje TFCR-C final | 12,25 ± 3,10 | 5,92 ± 1,38 | 9,39 | 0,000* |
| Puntaje TFCR-M final | 10,54 ± 2,32 | 4,01 ± 1,39 | 12,37 | 0,000* |
| Aciertos TMT-A final | 14,81 ± 2,85 | 5,91 ± 1,29 | 14,299 | 0,000* |
| Errores TMT-A final | 1,04 ± 1,39 | 1,83 ± 1,34 | –2,202 | 0,000* |
| Tiempo TMT-A final | 73,75 ± 24,53 | 75,94 ± 25,02 | –0,335 | 0,739 |
| Aciertos TMT-B final | 10,83 ± 2,05 | 4,41 ± 1,10 | 13,994 | 0,000* |
| Errores TMT- B final | 1,29 ± 1,12 | 2,58 ± 1,59 | –3,441 | 0,001* |
| Tiempo TMT-B final | 96,33 ± 31,45 | 101,97 ± 31,27 | –0,683 | 0,498 |
| A1 TAAV final | 9,25 ± 1,56 | 4,63 ± 1,35 | 12,124 | 0,000* |
| A5 TAAV final | 9,50 ± 1,17 | 3,16 ± 1,18 | 20,337 | 0,000* |
| A7 TAAV final | 8,87 ± 1,32 | 2,66 ± 1,19 | 18,847 | 0,000* |
DE: desviación estándar; GC: grupo control; GI: grupo de intervención; TAAVR: test de aprendizaje auditivo verbal de rey; TFCR: test de la figura compleja de rey, TMT: trail making test.
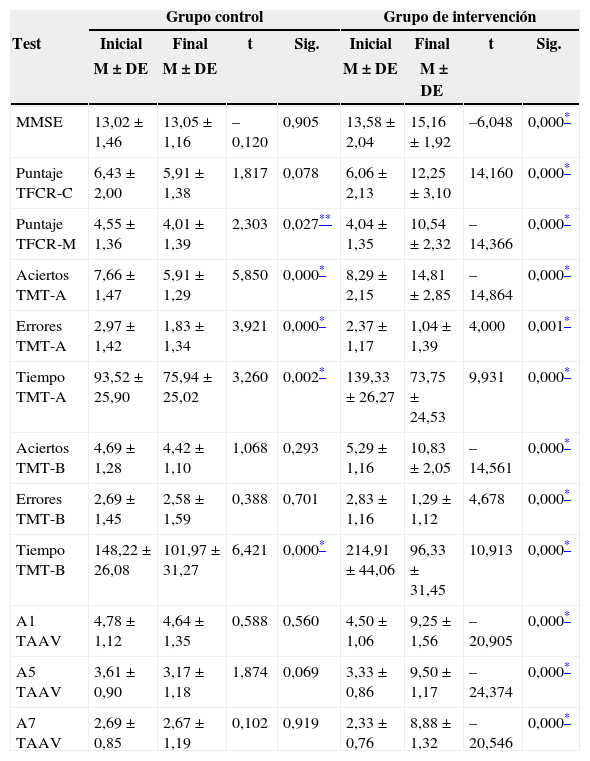
La tabla 3 muestra que mientras el puntaje en la dimensión memoria del TFCR y los aciertos en TMT-A del GC bajan en el postest, los desempeños promedios del GI suben, siendo estas diferencias estadísticamente significativas. En los errores y el tiempo del TMT-A y el tiempo en TMT-B, hay diferencia significativa, siendo mayor en el GI. En este grupo se descubren aumentos en las medias de desempeño en todas las dimensiones evaluadas, después del programa de AF y AC, revelando un incremento promedio en el estado cognitivo del GI sometido al programa de entrenamiento físico y cognitivo.
Comparaciones intragrupales entre GC y GI, antes y después de la AF y AC
| Grupo control | Grupo de intervención | |||||||
|---|---|---|---|---|---|---|---|---|
| Test | Inicial | Final | t | Sig. | Inicial | Final | t | Sig. |
| M ± DE | M ± DE | M ± DE | M ± DE | |||||
| MMSE | 13,02 ± 1,46 | 13,05 ± 1,16 | –0,120 | 0,905 | 13,58 ± 2,04 | 15,16 ± 1,92 | –6,048 | 0,000* |
| Puntaje TFCR-C | 6,43 ± 2,00 | 5,91 ± 1,38 | 1,817 | 0,078 | 6,06 ± 2,13 | 12,25 ± 3,10 | 14,160 | 0,000* |
| Puntaje TFCR-M | 4,55 ± 1,36 | 4,01 ± 1,39 | 2,303 | 0,027** | 4,04 ± 1,35 | 10,54 ± 2,32 | –14,366 | 0,000* |
| Aciertos TMT-A | 7,66 ± 1,47 | 5,91 ± 1,29 | 5,850 | 0,000* | 8,29 ± 2,15 | 14,81 ± 2,85 | –14,864 | 0,000* |
| Errores TMT-A | 2,97 ± 1,42 | 1,83 ± 1,34 | 3,921 | 0,000* | 2,37 ± 1,17 | 1,04 ± 1,39 | 4,000 | 0,001* |
| Tiempo TMT-A | 93,52 ± 25,90 | 75,94 ± 25,02 | 3,260 | 0,002* | 139,33 ± 26,27 | 73,75 ± 24,53 | 9,931 | 0,000* |
| Aciertos TMT-B | 4,69 ± 1,28 | 4,42 ± 1,10 | 1,068 | 0,293 | 5,29 ± 1,16 | 10,83 ± 2,05 | –14,561 | 0,000* |
| Errores TMT-B | 2,69 ± 1,45 | 2,58 ± 1,59 | 0,388 | 0,701 | 2,83 ± 1,16 | 1,29 ± 1,12 | 4,678 | 0,000* |
| Tiempo TMT-B | 148,22 ± 26,08 | 101,97 ± 31,27 | 6,421 | 0,000* | 214,91 ± 44,06 | 96,33 ± 31,45 | 10,913 | 0,000* |
| A1 TAAV | 4,78 ± 1,12 | 4,64 ± 1,35 | 0,588 | 0,560 | 4,50 ± 1,06 | 9,25 ± 1,56 | –20,905 | 0,000* |
| A5 TAAV | 3,61 ± 0,90 | 3,17 ± 1,18 | 1,874 | 0,069 | 3,33 ± 0,86 | 9,50 ± 1,17 | –24,374 | 0,000* |
| A7 TAAV | 2,69 ± 0,85 | 2,67 ± 1,19 | 0,102 | 0,919 | 2,33 ± 0,76 | 8,88 ± 1,32 | –20,546 | 0,000* |
TAAVR: test de aprendizaje auditivo verbal de rey; TFCR: test de la figura compleja de rey, TMT: trail making test.
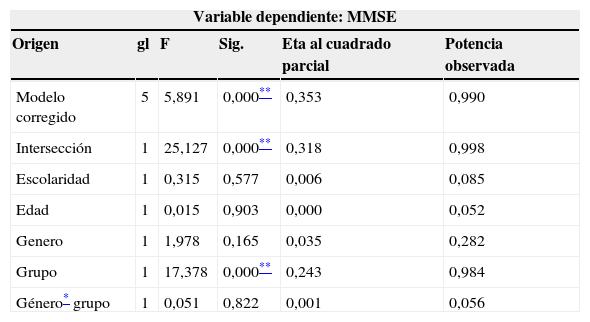
Los niveles de significación asociados a los efectos principales y las covariables muestran que solo la variable grupo (con/sin AF y AC) tiene un efecto significativo sobre el estado cognitivo. Como se puede observar, el tamaño de efecto (0,243) y la potencia observada (0,984) de la variable grupo entregan más evidencia a favor del impacto de la AC y la AF en la función cognitiva del GI (tabla 4).
Análisis ANCOVA sobre la función cognitiva Post-intervención
| Variable dependiente: MMSE | |||||
|---|---|---|---|---|---|
| Origen | gl | F | Sig. | Eta al cuadrado parcial | Potencia observada |
| Modelo corregido | 5 | 5,891 | 0,000** | 0,353 | 0,990 |
| Intersección | 1 | 25,127 | 0,000** | 0,318 | 0,998 |
| Escolaridad | 1 | 0,315 | 0,577 | 0,006 | 0,085 |
| Edad | 1 | 0,015 | 0,903 | 0,000 | 0,052 |
| Genero | 1 | 1,978 | 0,165 | 0,035 | 0,282 |
| Grupo | 1 | 17,378 | 0,000** | 0,243 | 0,984 |
| Género* grupo | 1 | 0,051 | 0,822 | 0,001 | 0,056 |
R cuadrado: 353 (R cuadrado corregida=293).
Se encontró evidencia que indica un impacto positivo del entrenamiento físico y cognitivo sobre el estado cognitivo en población con demencia leve. Los resultados de esta investigación apuntan en dirección a la AF y la AC como principales responsables del aumento en la respuesta cognitiva del GI vs. GC en MMSE, TFCR, TAAVR y TMT-A y B. Y aunque el análisis intragrupal reportó diferencias significativas en el TFCR y el TMT en el grupo control, las diferencias encontradas y el rendimiento observado se refieren a desempeños promedios inferiores en el postest respecto de la evaluación inicial. Es decir, hay una disminución en la tasa de respuesta cognitiva, visuoespacial y atencional en el GC, asociado a un incremento en la latencia de respuesta, la dificultad para resolver los instrumentos, la reducción del Span atencional y la condición clínica. Por otra parte, la pobre curva de aprendizaje observada en el GC puede estar asociada, además de a la condición clínica, a los años de escolaridad35 y a un efecto de primacía y recencia bastante menoscabado en estos pacientes, lo que les dificultaría consolidar información a largo plazo36. A pesar de estas observaciones, parece que los pacientes con Alzheimer leve tienen un aprendizaje pobre pero estable en el tiempo, sobre todo a partir de las observaciones hechas en la dimensión A7 del TAAVR.
Por otro lado, el GI posterior a la intervención de 6 meses aumentó significativamente su memoria auditiva-verbal, optimizando la capacidad de retención y consolidación de palabras. Mejoró significativamente la capacidad de procesar imágenes visuoespaciales, guardar la información en la memoria de trabajo y tener una buena evocación visual. Del mismo modo, ocurrió un incremento del enfoque atencional, sostenibilidad y flexibilidad cognitiva.
Lo anterior se respalda en estudios multimodales en animales y humanos que apoyan una acción neuroprotectora de la AF y AC en ancianos con demencia17. En animales sometidos a AF realizando tareas cognitivas, se redujo el estrés oxidativo y la neuroinflamación inducida por Aβ1-40. En sujetos que realizaban AF durante más de 3 meses, se cuadriplicaron los niveles de factor neurotrófico derivado del cerebro, mejorando el flujo sanguíneo cerebral y la disminución de la inflamación sistémica37,38. Estudios donde se realizaron ejercicios estructurados, de intensidad alta, de larga duración y de varios componentes, entre ellos AC, reportaron resultados prometedores para la preservación de la función cognitiva en personas mayores con EA39.
Ahora bien, aunque este es un estudio de intervención, los sujetos se incluyeron de forma aleatoria y la evaluación y la intervención se realizaron de forma ciega; los resultados finales deben tomarse con cautela, por varias razones. En primer lugar, se destaca la disparidad entre el grado de deterioro cognitivo (CDR-1) reportado por el diagnóstico médico y el puntaje promedio de los participantes en el MMSE y demás pruebas cognitivas (véanse las tablas de resultados). Frente a esto, la literatura ha demostrado que los médicos de atención primaria no logran diagnosticar la demencia leve a moderada al menos el 50% de las veces40,41. Entre las causas que explican el bajo diagnóstico, está la falta de pruebas fáciles de administrar y calificar, la baja sensibilidad diagnóstica de algunos instrumentos42,43, la falta de tiempo y las limitaciones de personal capacitado y equipos especializados44,45, que no suelen estar disponibles a nivel de atención primaria.
En Chile hay un problema con la objetivación del deterioro cognitivo y la comunicación diagnóstica de la demencia46, y los planes nacionales de salud (así como de los servicios privados de salud) son escasos y poco claros para enfrentar la problemática de la neurodegeneración, en el nivel diagnóstico y terapéutico46. Además, existen muy pocos instrumentos y procedimientos diagnósticos validados para la detección de deterioro cognitivo y demencia. En la actualidad, se trabaja con la validación del MMSE33, que reporta un puntaje de corte de 21 para discriminar entre deterioro cognitivo (≤ 21) y controles sanos (> 22). Pero no hay estudios de baremación o normalización del instrumento (o de otros) que ayuden a clasificar o graduar el rango de deterioro cognitivo de un anciano con sospecha de demencia. Recientemente, se vienen realizando estudios preliminares de validación de instrumentos diagnósticos de uso breve, que definen mejor la demencia y discriminan con mayor claridad los grados de severidad del deterioro cognitivo, como el Eurotest, el ACE-R, el IFS-Ch y el MIS47-50.
En segundo lugar, el ruido ambiental y la interferencia asociada a una AF y cognitiva grupal. Nos fue imposible realizar una intervención individualizada debido a los altos costos asociados. Sin embargo, una forma que encontramos para reducir el efecto de interferencia, y posibilitar el aprendizaje, fue dividir el GI en 2 grupos de 12 personas y realizar pruebas de chequeo, una vez terminada cada actividad de entrenamiento cognitivo, para corroborar que se habían conseguido los mínimos de aprendizaje verbal y visual.
En tercer lugar, es recomendable ampliar la muestra, realizar mediciones con varios grupos de intervención: un con sólo AF, otro con AC y un último grupo, combinando AF+AC, con el fin de establecer cuál de las modalidades de intervención ejerce un mayor efecto sobre la función cognitiva. En cuarto lugar, cautelar otras variables como las actividades de ocio, que ha reportado tener un resultado beneficioso para prevenir o disminuir la prevalencia de demencia51. Por último, se recomienda realizar estudios controlados, con periodos de seguimiento lo suficientemente largos, acompañados de medidas fisiológicas, para observar los cambios en la respuesta cognitiva y el efecto de las variables socioeducativas, físicas y personales.
Teniendo en cuenta lo anterior, se puede concluir que un programa combinado de AF y AC tiene un efecto positivo sobre la función cognitiva en personas mayores con demencia leve. Es posible apoyar la hipótesis de que la AC y la AF pueden ser utilizadas como una herramienta no farmacológica para reducir los síntomas de la EA. Las pruebas estadísticas confirman la diferencia entre los grupos de estudio, demostrando que el efecto en el aumento del estado cognitivo viene dado en mayor medida por la AC y AF.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener conflictos de interés en relación con este artículo.