La terapia de movimiento inducido por restricción (TMIR) es una técnica utilizada para favorecer la recuperación sensitivomotora del miembro superior en pacientes con accidente cerebrovascular (ACV). El objetivo fue diseñar una fase piloto de un ensayo clínico controlado para evaluar la eficacia de la TMIR en el desempeño motor y la incorporación del miembro superior afectado en tareas de la comunidad en pacientes con ACV con menos de 3 meses de evolución.
Pacientes y métodosTras la evaluación basal, los participantes fueron asignados a 2 grupos: TMIR (n=7) y terapia convencional (n=6). Se repitió la evaluación a las 2 semanas utilizando: Fugl-Meyer Motor Assessment (FMA); dinamometría; Functional Independence Measure (FIM); Arm Motor Ability Test (AMAT); Motor Activity Log (MAL); y Community Activities Scale (CAS).
ResultadosEn la evaluación basal, ambos grupos no mostraron diferencias en variables demográficas, clínicas y escalas (p <0,05). El grupo experimental evidenció mejorías significativas en la evaluación a los 15 días en las escalas AMAT (p < 0,05), MAL (p < 0,05) y CAS (p = 0,05). No se observó mejoría significativa en FIM (p = 0,508), FMA (p = 0,880) y dinamometría (p = 0,356). La escala CAS se correlacionó con pruebas que valoran la funcionalidad del miembro superior, siendo alta la relación con la escala FMA (rho = 0,673) y las subescalas de tiempo (rho=–0,627), habilidad funcional (rho = 0,784) y calidad de movimiento (rho = 0,735) de AMAT.
ConclusionesLa TMIR es eficaz para mejorar la incorporación y la calidad de movimiento del miembro superior afectado en actividades de la vida diaria y de la comunidad en sujetos con ACV.
Constraint-Induced Movement Therapy (CIMT) is one of the techniques used to promote sensory-motor recovery of the upper limb in patients with stroke. The aim of this study was to design a pilot phase randomized controlled clinical trial to assess the efficacy of CIMT in the motor performance, and the incorporation of the affected upper limb in community tasks in stroke patients with less than 3 months of evolution.
Materials and methodsThe sample was randomly assigned to either CIMT (n=7) or a control group (n=6). The outcome measures were assessed pre- and post-intervention by using the Fugl-Meyer Motor Assessment (FMA); dynamometry; Functional Independence Measure (FIM); Arm Motor Ability Test (AMAT); Motor Activity Log (MAL); and Community Activities Scale (CAS).
ResultsBoth groups were similar on demographics, clinical and baseline outcome scales. Significant effects were noted post-intervention in the CIMT group on AMAT (P<.05), MAL (p<.05), and CAS (P=.05). There were no differences on FMA (P=.880), dynamometry (P=.356), and FIM (P=.508) scores. CAS scale was correlated with tests for assessing the functionality of the upper limb. The relationship was high with the FMA scale (rho=.673) and time (rho=–.627), functional ability (rho=.784) and quality of movement (rho=735) subscales of AMAT.
ConclusionsCIMT is effective to improve the integration and quality of movement of the affected upper limb in daily life activities and community tasks in individuals with stroke.
El accidente cerebrovascular (ACV) es la primera causa de discapacidad en la población adulta en todo el mundo, produciendo déficits que pueden durar meses o años y alterando la calidad de vida de la persona y de su familia. Las secuelas más frecuentes en pacientes que han presentado un ACV son las motoras, las cognitivas y/o las sensoriales.
Después de un ACV, los pacientes pueden presentar paresia o parálisis del miembro superior y, aunque se mantenga algún control motor, puede utilizarse menos que el brazo no afectado. Dicha secuela motora hace que los movimientos selectivos del miembro superior, como alcanzar, agarrar y manipular los objetos, sean difíciles. A su vez, estas limitaciones impactan en las actividades cotidianas de la vida diaria como bañarse, vestirse, comer y usar el baño.
Dentro del abordaje de los déficits motores, la repetición de las actividades funcionales con un propósito (entrenamiento) constituye la base del aprendizaje motor1,2, siendo de suma importancia en el desarrollo de destrezas y habilidades. Dicho aprendizaje condiciona la reorganización funcional luego de una lesión adquirida del sistema nervioso central3, según el concepto de plasticidad neuronal. Varias técnicas se utilizan en los centros de neurorrehabilitación con el objetivo de favorecer la recuperación tanto sensitiva como motora del miembro afectado, entre las cuales se encuentra la terapia de movimiento inducido por restricción (TMIR) para miembros superiores. Dicha técnica fue descripta en monos desaferentados por rizotomía dorsal, los cuales experimentaban un desuso de la extremidad superior por falta de percepción sensitiva. Ello desencadenaba un aprendizaje del no uso4. Cuando la extremidad desaferentada era restituida, los monos lograban revertir el compromiso motor del miembro afectado e integrarlo en las actividades5-7.
Desde las primeras descripciones de la TMIR hasta la actualidad, se han desarrollado diferentes experiencias en humanos. Por ejemplo, Wolf et al.8 realizaron un estudio para demostrar que el «aprendizaje del no uso» o «no uso aprendido» ocurre en una serie de pacientes con daño neurológico adquirido y es una conducta que puede ser revertida a través de la aplicación del paradigma del «uso forzado». Con este propósito evaluaron la TMIR en humanos durante 14 días con la intención de incrementar el uso del miembro superior afectado en las actividades de la vida diaria4,8; realizaron un estudio en el cual se incluyó a 4 pacientes con ACV en un grupo experimental y 5 en un grupo control. Los pacientes tenían más de un año de evolución, presentando hemiparesia derecha como secuela motora. Al grupo terapéutico se le restringió el miembro superior intacto con una férula y un cabestrillo, los cuales utilizaban el 90% de las horas diarias, durante 14 días, mientras realizaban un programa de entrenamiento intensivo del miembro superior afectado de 6 h diarias (los días hábiles). El grupo control fue incentivado a focalizar su atención en el miembro superior afectado y a realizar en su hogar ejercicios de automovilización pasiva de la extremidad afectada. Los resultados del estudio indicaron mejoras significativas en la restitución de la función motora del grupo experimental en relación con el grupo control.
En 1993, el grupo de investigación de la universidad de Alabama en Birmingham4 agregó a la intervención el componente de «entrenamiento» a la TMIR. La inclusión de dicha modalidad de tratamiento permitió que los pacientes con ACV incluidos en este estudio incrementaran de forma significativa la habilidad motora para revertir el «aprendizaje del no uso». La teoría del «aprendizaje del no uso» establece que para revertir el «no uso» se debe buscar incrementar la motivación en el uso del miembro afectado.
Existe evidencia de que la TMIR es eficaz en pacientes con ACV en estadio subagudo y crónico con paresia moderada del miembro superior9. Entre dichos trabajos, se destaca el ensayo clínico Extremity Constraint Induced Therapy Evaluation (EXCITE, por su sigla en inglés), un estudio multicéntrico que incluyó a 222 pacientes con paresia moderada del miembro superior que habían presentado un ACV con una evolución de 3 a 9 meses. Se aplicó la TMIR del lado sano del 90% del tiempo de vigilia, con un protocolo de entrenamiento de 6 h diarias, 5 días a la semana, durante 2 semanas. Se obtuvieron mejorías significativas en la función motora, valoradas mediante las escalas Wolf Motor Function Test8 y Motor Activity Log (MAL)4, las cuales se mantuvieron a los 12 y 24 meses de seguimiento9.
En un reciente metanálisis10 de 13 ensayos clínicos (278 participantes) se demostró que un protocolo de TMIR modificado con un entrenamiento intensivo del miembro afectado entre 30 min y 3 h diarias de duración, y una restricción del lado sano de 6 h diarias, mejora significativamente la funcionalidad del miembro superior comparado con un tratamiento de rehabilitación convencional. En otro metaanálisis11 de ensayos clínicos aleatorios realizados en pacientes con ACV de 6 o más meses de evolución también se confirmó el efecto beneficio de la TMIR en la etapa crónica de la enfermedad.
El equipo de investigadores Cochrane12 identificó 42 estudios relevantes con 1.453 participantes. Los participantes en estos estudios tenían algún control del brazo afectado y generalmente fueron capaces de abrir la mano afectada al extender la muñeca y los dedos. La metodología utilizada fue heterogénea entre los estudios, siendo la calidad de las pruebas utilizadas muy baja. La conclusión general de la revisión fue que la TMIR se asoció a mejorías limitadas en la deficiencia motora y la función motora, pero que estos efectos beneficiosos no redujeron la discapacidad (el uso efectivo del brazo en la vida cotidiana) de forma convincente. Este resultado12 difiere del resultado de los metaanálisis publicados con anterioridad10,11.
A pesar de los resultados de los ensayos clínicos mencionados, algunos aspectos de la eficacia de la TMIR continúan siendo debatidos. Así, con respecto a la eficacia a largo plazo, los resultados del estudio EXCITE9 en cuanto al efecto sostenido de la terapia muestran una mejoría funcional mantenida hasta 2 años después de haber aplicado el tratamiento7. Por el contrario, en una revisión Cochrane que examinó los resultados de 19 ensayos clínicos con un total de 619 pacientes, se llegó a la conclusión de que la funcionalidad del miembro superior medida al cabo de 3 a 6 meses después del tratamiento no mostró beneficio persistente13.
Otro aspecto controvertido de la TMIR es el momento más conveniente para su inicio. En un estudio realizado con pacientes en fase aguda sometidos a un protocolo intensivo de TMIR, a TMIR convencional o a rehabilitación tradicional, no se hallaron diferencias funcionales significativas entre grupos e incluso el grupo que recibió tratamiento intensivo mostró peores resultados14. Por el otro lado, cuando se compararon pacientes en los que se inició el tratamiento dentro de los 3 a 9 meses posteriores al ACV con pacientes en los que la terapia fue iniciada un año después, los mejores resultados funcionales se consiguieron en el grupo tratado más precozmente15.
Con respecto al impacto de la recuperación motora luego de una TMIR en actividades de la vida diaria, es poca la evidencia disponible. Un metaanálisis realizado en el 201116 concluye que la TMIR y el protocolo modificado son eficaces para la recuperación de la movilidad de la mano y para algunas actividades de cuidado propio descriptas en la Clasificación Internacional de Funcionamiento, Discapacidad y Salud de la Organización Mundial de la Salud.
La revisión de la literatura confirma el beneficio de la TMIR original y modificada en términos de función motora, actividades realizadas con el miembro superior afectado y el autorreporte de funcionalidad de la vida diaria, inmediatamente después del ACV y a largo plazo10-13. Sin embargo, pocos estudios han analizado la incorporación de las destrezas adquiridas durante la TMIR en actividades de la vida real17,18.
Si bien el objetivo de cualquier programa de rehabilitación después del ACV es el de optimizar y fomentar la participación y la independencia en la comunidad19, aproximadamente el 50% de las personas que han sufrido un ACV no recuperan el uso funcional del brazo parético, lo que puede dar lugar a dificultades en las actividades de la vida diaria y en la participación en la vida comunitaria20. Por otro lado, a pesar del hecho de que muchas personas con ACV recuperan la independencia en las actividades básicas tales, como ducharse, vestirse, y la movilidad, menos personas se vuelven independientes en la realización de actividades más complejas, como las tareas del hogar, compras, ocio y salidas sociales, que son esenciales para la plena participación en la comunidad y en el mundo real.
El verdadero efecto de la TMIR en la incorporación del miembro superior afectado en las diferentes actividades instrumentales de la vida diaria que permiten un adecuado desempeño en la comunidad y en la vida real es desconocido. La observación y la medición directa del grado de incorporación del brazo afectado en actividades cotidianas es importante ya que, en determinadas condiciones, las personas con secuela de ACV presentan discrepancias entre la capacidad motora del miembro afectado, medida por pruebas de rendimiento en laboratorio, y el uso de esa capacidad en la vida diaria. Hasta la fecha, no existe una herramienta simple que haya permitido establecer la eficacia de la TMIR en la utilización de la extremidad superior afectada por el ACV en el entorno de la comunidad.
En relación con esto, nosotros hipotetizamos que la TMIR en pacientes con secuela de ACV dentro de los 3 meses del evento incrementa el uso del miembro superior afectado en actividades del mundo real, como también mejora la calidad del movimiento.
El objetivo del presente estudio fue diseñar una fase piloto de un ensayo clínico controlado para evaluar la eficacia de la TMIR en el desempeño motor y la incorporación del miembro superior afectado en tareas de la comunidad en pacientes que han presentado un ACV con menos de 3 meses de evolución, comparado con pacientes que reciban solo terapia de rehabilitación convencional.
Pacientes y métodosParticipantesEstudio clínico aleatorizado, controlado, simple ciego. Se ingresó a pacientes con secuela de ACV con menos de 3 meses de evolución que fueron atendidos en modalidad de internación en el Centro de Rehabilitación del Instituto de Investigaciones Neurológicas Raúl Carrea (FLENI) de Escobar, provincia de Buenos Aires, Argentina, en el período comprendido entre enero del 2010 y diciembre del 2011.
Los criterios de inclusión considerados fueron: 1) diagnóstico de primer episodio de ACV isquémico o hemorrágico realizado por un neurólogo con menos de 3 meses de evolución; 2) edad mayor o igual a 18 años; 3) rango de movilidad activo de 10° de extensión de muñeca, de 10° de extensión de la articulación metacarpofalángica e interfalángicas de 2 dedos y abducción del pulgar de al menos 10° desde una posición de flexión relajada de los dedos; 4) puntuación mayor o igual a 5 en el Box & Block Test21; 5) control del tronco sin supervisión o apoyos durante 2 min, y 6) capacidad de comprender el protocolo a implementar.
Fueron excluidos aquellos sujetos con: 1) otra condición neurológica o psiquiátrica asociada; 2) enfermedad clínica inestable; 3) puntaje mayor o igual a 5 en la escala análoga visual de dolor; 4) puntaje mayor o igual a 3 en la Escala Modificada de Ashworth en el miembro superior afectado22, y 5) excesivos trastornos cognitivos y/o de lenguaje que no le permitan comprender el protocolo.
AleatorizaciónLos participantes elegibles fueron apareados por edad y por sexo, y luego se asignaron al azar al grupo de TMIR o al grupo de tratamiento convencional. El procedimiento de aleatorización se realizó mediante el método de asignación aleatoria simple. La persona que realizó la asignación al azar no estaba involucrada en ninguna de las evaluaciones de inclusión y de resultados.
CegamientoEste es una fase piloto de un ensayo clínico controlado aleatorizado simple ciego. Los profesionales de investigación (VL, MG) que llevaron a cabo las evaluaciones de resultado estaban cegados a la asignación a los grupos. Los participantes, sin embargo, no estaban cegados a la asignación de grupos. Para minimizar el sesgo sistemático debido a la falta de cegamiento de los participantes, los participantes fueron instruidos para no decir a los evaluadores sobre la asignación de grupo o el tratamiento que recibieron.
IntervenciónLos participantes se dividieron en 2 grupos: experimental y control.
Los pacientes que ingresaron en el grupo experimental recibieron tratamiento convencional de terapia ocupacional y kinesiología con un entrenamiento específico del miembro superior afectado. La TMIR se llevó a cabo durante 14 días. Se utilizó una restricción con un soporte, el cual mantuvo el miembro superior no afectado junto al cuerpo del paciente de manera que permitiera la restricción de los movimientos del brazo y de la mano durante todo el día, salvo en horas de sueño, baño, uso de sanitario, y en asociación con un entrenamiento específico del miembro superior afectado que se llevó a cabo en 3 sesiones de terapia ocupacional diarias de 25 min y 3 de terapia física de 50 min cada una. Esta intervención fue basada en los mismos principios terapéuticos utilizados para el EXCITE6,7,9,15. Se dieron instrucciones para continuar el resto de las horas diarias. Para el resto de las actividades de la vida diaria utilizaron la restricción y, en caso de no poder realizar las actividades, todos los sujetos fueron asistidos por un tercero durante el período de TMIR. Las diferentes actividades de la vida diaria fueron supervisadas por el terapista ocupacional a cargo para favorecer el uso del miembro superior afectado, disminuyendo así al máximo posible los patrones de movimiento compensatorios.
Los pacientes del grupo control recibieron solamente terapia convencional de terapia ocupacional y kinesiología con entrenamiento específico del miembro superior afectado que se llevó a cabo en 3 sesiones de terapia ocupacional diarias de 25 min y 3 de terapia física de 50 min cada una.
Ambos grupos recibieron la terapia de neurorrehabilitación convencional constituida por 2 tipos de terapia.
Terapia física convencional: consistió en una serie de ejercicios que permiten maximizar la actividad motora voluntaria y funcional, incluyendo: 1) movilización pasiva y asistida de tronco y extremidades; 2) movilización de nervios periféricos; 3) estabilidad y movilidad de tronco; 4) tolerancia progresiva a la sedestación y a la bipedestación; 5) reeducación y entrenamiento de la marcha; 6) actividades funcionales con los miembros superiores, y 7) estimulación eléctrica funcional en caso de pacientes con atrofia y debilidad en grupos musculares comprometidos.
Terapia ocupacional convencional: consistió en una serie de ejercicios que permiten optimizar: 1) cuidados posicionales; 2) entrenamiento en actividades básicas de la vida diaria; 3) entrenamiento de actividades prefuncionales; 4) reeducación sensitivo-motora del miembro superior en actividades funcionales; 5) entrenamiento en actividades instrumentales de la vida diaria; 6) clínicas familiares, 7) adaptaciones ambientales.
Este protocolo se realizó durante 2 semanas de forma consecutiva.
Medidas de resultadosTodos los resultados se midieron por los mismos profesionales entrenados inmediatamente antes del inicio del estudio (semana 0) y de nuevo inmediatamente después de la terminación de las intervenciones (semana 2).
- –
Componente para miembro superior del Fugl-Meyer Motor Assessment (FMA)23: escala específica de medida del déficit motor secundario a ACV que valora la movilidad activa del miembro superior afectado. El rango de puntuación del componente para miembro superior oscila entre 0 y 66. Permite determinar la severidad del compromiso motor, a lo largo de los diferentes momentos de recuperación del ACV. La puntuación de esta escala se realiza por medio de una escala ordinal, en donde el valor 0 corresponde a la no realización de la prueba, 1 a la realización parcial y 2 a su completa realización.
- –
Functional Independence Measure (FIM)24: escala de 7 niveles que designa graduaciones en el comportamiento del paciente al efectuar una actividad de la vida diaria. Consta de 18 ítems, cada uno de los cuales tiene un puntaje máximo de 7 y un puntaje mínimo de 1. La escala total puede oscilar entre 18 y 126. Los ítems son: alimentación; arreglo personal (aseo); baño; vestimenta de la parte superior del cuerpo; vestimenta de la parte inferior del cuerpo; uso de sanitarios; evacuación urinaria; evacuación intestinal; traslados de la cama/silla/silla de ruedas; traslados en el baño (sanitarios); traslados de bañadera y ducha; locomoción de silla de ruedas/caminando; uso de escaleras; comprensión; expresión; interacción social; resolución de problemas; y memoria.
- –
Dinamometría25: la fuerza de prensión fue medida con dinamómetro Jamar en kilogramos.
- –
Berg Balance Scale (BBS)26-28: escala desarrollada como una medida cuantitativa del estado funcional del equilibrio en ancianos, cuya validez, fiabilidad y sensibilidad al cambio han sido demostradas también en pacientes hemipléjicos. Comprende 14 ítems, cada uno con una puntuación entre 0 y 4. La puntuación total puede oscilar entre 0 (equilibrio gravemente afectado) y 56 (excelente equilibrio). Los pacientes deben completar 14 tareas mientras el examinador califica el desempeño del paciente en cada tarea. Los elementos de la prueba son representativos de las actividades diarias que requieren equilibrio, como sentado, de pie, inclinación y dar un paso.
- –
Arm Motor Ability Test (AMAT)29: evaluación diseñada para valorar limitaciones funcionales de los miembros superiores durante las actividades de la vida diaria, utilizando medidas cualitativas y cuantitativas. Consiste en 13 actividades de la vida diaria que incluyen de 1 a 3 segmentos de movimiento o componentes de tareas, medidos por separado, que son realizados inconscientemente. El sistema de puntuación cuenta con 2 escalas: una escala de calidad de movimiento (0 a 5) y otra de habilidad funcional (0 a 5). La puntuación total se calcula con el promedio del puntaje de cada una de las actividades para cada escala. Simultáneamente, se mide el tiempo para cada componente de cada tarea en segundos. Se calcula un promedio global. La evaluación es grabada y para su análisis e interpretación se asignó a un terapeuta entrenado en la puntuación de esta escala.
- –
MAL30-32: consiste en una entrevista semiestructurada que evalúa la cantidad de uso y la calidad de movimiento de la mano y brazo paréticos en actividades de la vida diaria en individuos con secuela de ACV. Esta medida se basa en el autorreporte del paciente y no en una evaluación directa de la ejecución motora. Cada uno de los componentes de la mal se puntúa de 0 a 6. La puntuación total se calcula con el promedio del puntaje de cada una de las actividades para cada escala.
- –
Escala de actividades en comunidad (Community Activities Scale [CAS]): la CAS fue diseñada exclusivamente para este protocolo con el objetivo de medir la incorporación y la calidad del movimiento del miembro superior afectado en actividades comunitarias. Se eligieron 3 actividades: uso de cajero automático, uso de teléfono público y compra en supermercado (alcances de objetos y pago en caja). Estas actividades fueron seleccionadas ya que son tareas habituales en personas adultas activas durante la rutina diaria. Dichas actividades fueron subdivididas en componentes de tareas ya que son actividades complejas con múltiples pasos. Se utilizó el formato de la escala AMAT para dicha subdivisión. Los componentes dentro de cada tarea compleja involucran diferentes movimientos de los 2 brazos o de la musculatura distal y proximal del brazo afectado, o no son de igual dificultad y, por lo tanto, se evaluaron por separado, pero en forma continua, como una unidad, sin que el paciente percibiera la parcelación de cada componente. De esta manera, se pudo cuantificar la actividad comunitaria en forma de laboratorio sin interferir con el flujo natural de los movimientos de la actividad. El formato de puntuación utilizado fue similar al de la escala de cantidad y calidad de la MAL, ya que el objetivo fue medir cuánto y cómo el paciente incorpora el brazo afectado en las actividades observadas. Se puede considerar la escala CAS como una prueba ecológica, donde se evaluó mediante la observación directa el desempeño del paciente en el contexto real. Se realizó una salida basal y una a las 2 semanas con cada uno de los participantes de los grupos experimental y control. Para la salida a la comunidad no se dieron pautas al paciente de cómo desempeñarse en las tareas ni tampoco qué brazo debía utilizar en cada una de ellas. Se le explicaron las consignas de las actividades y se observó y se filmó el desempeño del paciente.
El estudio fue aprobado por el comité de Ética e Investigación del Instituto de Investigaciones Neurológicas Raúl Carrea (FLENI). El trabajo clínico estuvo sujeto a las reglas de buena práctica clínica, según la Declaración de Helsinki de la Asociación Médica Mundial33. El diseño y la presentación de resultados del estudio se presentaron cumpliendo las recomendaciones CONSORT34 para los estudios experimentales.
Método estadísticoLos datos se analizaron con el paquete estadístico SPSS® para Windows (versión 19.0). Las variables categóricas se presentaron en forma de porcentajes y valor absoluto. Se obtuvieron promedios±desviación estándar para describir las variables continuas analizadas. Las pruebas de contraste utilizadas fueron: el test de la chi al cuadrado o test de Fisher para las variables categóricas, y el test de t de Student o U de Mann-Whitney para las variables cuantitativas. El nivel de significación estadística aceptada para todos los contrastes de hipótesis fue del 0,05.
ResultadosLa muestra estuvo formada por 13 pacientes (2 mujeres y 11 hombres), de los cuales 7 realizaron TMIR y 6 formaron parte del grupo control. La tabla 1 muestra las características basales de todos los participantes. La edad promedio de los sujetos fue de 56,15±11,74. Once (76.9%) eran hombres. La dominancia manual fue derecha en todos los pacientes incluidos. El promedio de días de evolución desde el evento agudo fue de 47±22,41. Cinco pacientes presentaron lesión cerebrovascular de tipo hemorrágica y el resto fueron de origen isquémico (61,5%). El lado de la hemiparesia fue derecho en el 61,5% de los casos.
Características basales sociodemográficas, clínicas y medidas de resultado de la muestra previo al inicio de la terapia de movimiento inducido por restricción para miembros superiores
| Variables | |
|---|---|
| N | 13 |
| Demográficas | |
| Sexo, masculino, % | 76,9 |
| Edad, años, promedio ± DE | 56,15 ± 11,74 |
| Dominancia manual, derecho, % | 100 |
| Clínicas | |
| Tiempo de evolución, días, promedio ± DE | 47 ± 22,41 |
| Lado de hemiparesia, derecha, % | 61,5 |
| Tipo de ACV, isquémico, % | 61,5 |
| Escalas, promedio ± DE | |
| FIM | 92,92 ± 14,71 |
| BBS | 45,08 ± 9,07 |
| FMA | 43,15 ± 11,42 |
| Dinamometría, kg | 8,77 ± 6,43 |
| AMAT, tiempo, promedio ± DE | 11,36 ± 4,46 |
| AMAT, habilidad funcional, promedio ± DE | 2,61 ± 0,74 |
| AMAT, calidad de movimiento, promedio ± DE | 2,59 ± 0,74 |
| MAL, cantidad de uso, promedio ± DE | 0,83 ± 0,53 |
| MAL, validad de movimiento, promedio ± DE | 0,83 ± 0,57 |
| CAS, cantidad de uso, promedio ± DE | 1,28 ± 1,25 |
| CAS, calidad de movimiento, promedio ± DE | 1,24 ± 1,26 |
Variables categóricas expresadas en porcentajes (%). Variables numéricas expresadas en promedio ± DE.
ACV: accidente cerebrovascular; AMAT: Arm Motor Ability Test; BBS: Berg Balance Scale; CAS; Community Activities Scale; DE: desviación estándar; FIM: Functional Independence Measure; FMA: Fugl-Meyer Motor Assessment; MAL: Motor Activity Log.
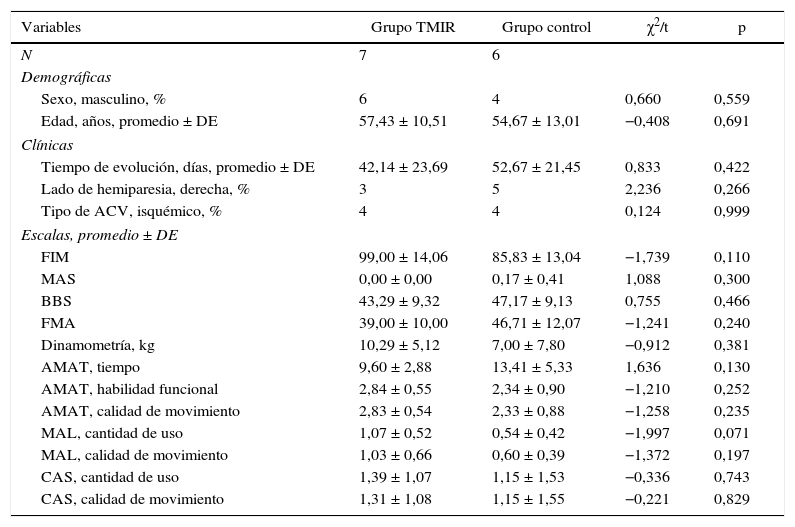
En la tabla 2 se muestra la comparación de las características basales entre los grupos intervinientes. Los 2 grupos (control y experimental) no mostraron diferencias en características sociodemográficas (edad, sexo) ni clínicas (lado de hemiparesia, tiempo de evolución en días, tipo de ACV isquémico o hemorrágico) (p > 0,05). En la evaluación basal, ambos grupos no mostraron diferencias en las escalas utilizadas para valorar la funcionalidad del miembro superior (FIM global, FMA, dinamometría, BBS, MAS, AMAT, MAL y CAS).
Características basales del grupo control y del grupo experimental
| Variables | Grupo TMIR | Grupo control | χ2/t | p |
|---|---|---|---|---|
| N | 7 | 6 | ||
| Demográficas | ||||
| Sexo, masculino, % | 6 | 4 | 0,660 | 0,559 |
| Edad, años, promedio ± DE | 57,43 ± 10,51 | 54,67 ± 13,01 | −0,408 | 0,691 |
| Clínicas | ||||
| Tiempo de evolución, días, promedio ± DE | 42,14 ± 23,69 | 52,67 ± 21,45 | 0,833 | 0,422 |
| Lado de hemiparesia, derecha, % | 3 | 5 | 2,236 | 0,266 |
| Tipo de ACV, isquémico, % | 4 | 4 | 0,124 | 0,999 |
| Escalas, promedio ± DE | ||||
| FIM | 99,00 ± 14,06 | 85,83 ± 13,04 | −1,739 | 0,110 |
| MAS | 0,00 ± 0,00 | 0,17 ± 0,41 | 1,088 | 0,300 |
| BBS | 43,29 ± 9,32 | 47,17 ± 9,13 | 0,755 | 0,466 |
| FMA | 39,00 ± 10,00 | 46,71 ± 12,07 | −1,241 | 0,240 |
| Dinamometría, kg | 10,29 ± 5,12 | 7,00 ± 7,80 | −0,912 | 0,381 |
| AMAT, tiempo | 9,60 ± 2,88 | 13,41 ± 5,33 | 1,636 | 0,130 |
| AMAT, habilidad funcional | 2,84 ± 0,55 | 2,34 ± 0,90 | −1,210 | 0,252 |
| AMAT, calidad de movimiento | 2,83 ± 0,54 | 2,33 ± 0,88 | −1,258 | 0,235 |
| MAL, cantidad de uso | 1,07 ± 0,52 | 0,54 ± 0,42 | −1,997 | 0,071 |
| MAL, calidad de movimiento | 1,03 ± 0,66 | 0,60 ± 0,39 | −1,372 | 0,197 |
| CAS, cantidad de uso | 1,39 ± 1,07 | 1,15 ± 1,53 | −0,336 | 0,743 |
| CAS, calidad de movimiento | 1,31 ± 1,08 | 1,15 ± 1,55 | −0,221 | 0,829 |
Variables categóricas expresadas en porcentajes (%). Variables numéricas expresadas en promedio ± DE.
ACV: accidente cerebrovascular; AMAT; Arm Motor Ability Test; BBS: Berg Balance Scale; CAS: Community Activities Scale; DE: desviación estándar; FIM: Functional Independence Measure; FMA: Fugl-Meyer Motor Assessment; MAL: Motor Activity Log; TMIR: terapia de movimiento inducido por restricción.
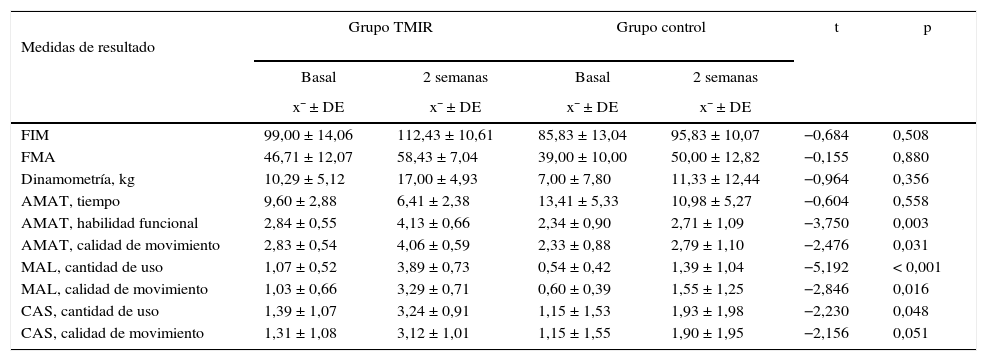
La tabla 3 y la figura 1 muestran las puntuaciones promedios pre y postevaluación en las escalas utilizadas en los grupos control y experimental, y la diferencia entre ambas evaluaciones para cada uno de los grupos. Los pacientes del grupo experimental mostraron mejorías estadísticamente significativas en la evaluación a los 15 días (es decir, mejoraron) en la puntuación de las escalas AMAT (habilidad funcional y calidad de movimiento; p < 0,05), MAL (cantidad de uso y calidad de movimiento; p < 0,05) y CAS (cantidad de uso y calidad de movimiento; p = 0,05). No mostraron mejoría estadísticamente significativa en las escalas FIM (t=–0,684, p = 0,508), FMA (t=– 0,155, p = 0,880), dinamometría (t=–0,964, p = 0,356) y AMAT (tiempo de desempeño; t=–0,604, p = 0,558).
Características basales del grupo control y del grupo experimental
Medidas de resultado | Grupo TMIR | Grupo control | t | p | ||
|---|---|---|---|---|---|---|
| Basal | 2 semanas | Basal | 2 semanas | |||
| x¯ ± DE | x¯ ± DE | x¯ ± DE | x¯ ± DE | |||
| FIM | 99,00 ± 14,06 | 112,43 ± 10,61 | 85,83 ± 13,04 | 95,83 ± 10,07 | −0,684 | 0,508 |
| FMA | 46,71 ± 12,07 | 58,43 ± 7,04 | 39,00 ± 10,00 | 50,00 ± 12,82 | −0,155 | 0,880 |
| Dinamometría, kg | 10,29 ± 5,12 | 17,00 ± 4,93 | 7,00 ± 7,80 | 11,33 ± 12,44 | −0,964 | 0,356 |
| AMAT, tiempo | 9,60 ± 2,88 | 6,41 ± 2,38 | 13,41 ± 5,33 | 10,98 ± 5,27 | −0,604 | 0,558 |
| AMAT, habilidad funcional | 2,84 ± 0,55 | 4,13 ± 0,66 | 2,34 ± 0,90 | 2,71 ± 1,09 | −3,750 | 0,003 |
| AMAT, calidad de movimiento | 2,83 ± 0,54 | 4,06 ± 0,59 | 2,33 ± 0,88 | 2,79 ± 1,10 | −2,476 | 0,031 |
| MAL, cantidad de uso | 1,07 ± 0,52 | 3,89 ± 0,73 | 0,54 ± 0,42 | 1,39 ± 1,04 | −5,192 | < 0,001 |
| MAL, calidad de movimiento | 1,03 ± 0,66 | 3,29 ± 0,71 | 0,60 ± 0,39 | 1,55 ± 1,25 | −2,846 | 0,016 |
| CAS, cantidad de uso | 1,39 ± 1,07 | 3,24 ± 0,91 | 1,15 ± 1,53 | 1,93 ± 1,98 | −2,230 | 0,048 |
| CAS, calidad de movimiento | 1,31 ± 1,08 | 3,12 ± 1,01 | 1,15 ± 1,55 | 1,90 ± 1,95 | −2,156 | 0,051 |
Variables categóricas expresadas en porcentajes (%). Variables numéricas expresadas en promedio ± DE.
ACV: accidente cerebrovascular; AMAT: Arm Motor Ability Test; BBS: Berg Balance Scale; CAS: Community Activities Scale; DE: desviación estándar; FIM: Functional Independence Measure; FMA: Fugl-Meyer Motor Assessment; MAL: Motor Activity Log; TMIR: terapia de movimiento inducido por restricción.
Gráficos de barras de error de la puntuación promedio del cambio entre la evaluación basal y la evaluación a las 2 semanas en el grupo control y experimental en las medidas de resultados.
AMAT: Arm Motor Ability Test; CAS: Community Activities Scale; MAL: Motor Activity Log; TMIR: terapia de movimiento inducido por restricción.
Al analizar el resultado de la CAS en el grupo control, la puntuación promedio basal fue de 1,15±1,53 para la subescala cantidad de uso y de 1,15±1,55 para la subescala calidad de movimiento, mientras que la puntuación promedio a los 15 días de la terapia convencional fue de 1,93±1,98 para la subescala cantidad de uso y de 1,90±1,95 para la subescala calidad de movimiento, siendo no estadísticamente significativa la diferencia entre ambas puntuaciones (t=–0,757, p = 0,467 y t=–0,737, p = 0,478, respectivamente).
Al analizar el resultado de la CAS en el grupo experimental, la puntuación promedio basal fue de 1,39±1,07 para la subescala cantidad de uso y de 1,31±1,08 para la subescala calidad de movimiento, mientras que la puntuación promedio a los 15 días de la terapia de restricción fue de 3,24±0,91 para la subescala cantidad de uso y de 3,12±1,01 para la subescala calidad de movimiento, siendo estadísticamente significativa la diferencia entre ambas puntuaciones, observándose una mejoría a las 2 semanas con respecto a su rendimiento basal en el grupo de participantes que recibieron TMIR (t=–3.474, p = 0,005 y t=–3.216, p = 0,007, respectivamente).
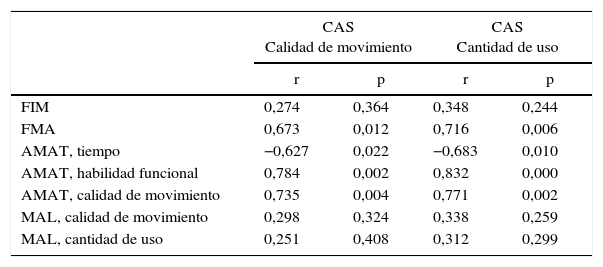
La tabla 4 muestra los coeficientes de correlación de la escala CAS con el resto de las pruebas utilizadas que valoran la funcionalidad del miembro superior y la figura 2 los diagramas de dispersión. La relación fue particularmente alta con la escala FMA (rho = 0,673) y las subescalas de tiempo (rho=–0,627), habilidad funcional (rho = 0,784) y calidad de movimiento (rho = 0,735) de la escala AMAT.
Coeficientes de correlación de Spearman entre la puntuación de escala CAS con el resto de las pruebas utilizadas que valoran la funcionalidad del miembro superior
| CAS Calidad de movimiento | CAS Cantidad de uso | |||
|---|---|---|---|---|
| r | p | r | p | |
| FIM | 0,274 | 0,364 | 0,348 | 0,244 |
| FMA | 0,673 | 0,012 | 0,716 | 0,006 |
| AMAT, tiempo | −0,627 | 0,022 | −0,683 | 0,010 |
| AMAT, habilidad funcional | 0,784 | 0,002 | 0,832 | 0,000 |
| AMAT, calidad de movimiento | 0,735 | 0,004 | 0,771 | 0,002 |
| MAL, calidad de movimiento | 0,298 | 0,324 | 0,338 | 0,259 |
| MAL, cantidad de uso | 0,251 | 0,408 | 0,312 | 0,299 |
r: Coeficiente de correlación de Spearman.
AMAT: Arm Motor Ability Test; CAS: Community Activities Scale; FIM; Functional Independence Measure; FMA; Fugl-Meyer Motor Assessment; MAL: Motor Activity Log.
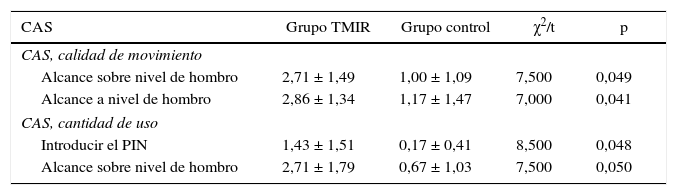
En la tabla 5 se muestran los subítems de la escala CAS, cuya diferencia entre la evaluación basal y a los 15 días fue estadísticamente significativa. La comparación entre los 2 grupos de estudio (experimental vs. control) de cada uno de los subítems de la escala CAS evidenció que en la subescala de calidad de movimiento en tareas de supermercado (alcance sobre el hombro y a nivel del hombro) y en la subescala cantidad de movimiento en tareas de cajero automático (introducir el pin) y supermercado (alcance sobre el hombro), se observaron diferencias estadísticamente significativas (p < 0,05).
Subítems de la escala CAS con diferencia estadísticamente significativa entre la evaluación basal y a los 15 días
| CAS | Grupo TMIR | Grupo control | χ2/t | p |
|---|---|---|---|---|
| CAS, calidad de movimiento | ||||
| Alcance sobre nivel de hombro | 2,71 ± 1,49 | 1,00 ± 1,09 | 7,500 | 0,049 |
| Alcance a nivel de hombro | 2,86 ± 1,34 | 1,17 ± 1,47 | 7,000 | 0,041 |
| CAS, cantidad de uso | ||||
| Introducir el PIN | 1,43 ± 1,51 | 0,17 ± 0,41 | 8,500 | 0,048 |
| Alcance sobre nivel de hombro | 2,71 ± 1,79 | 0,67 ± 1,03 | 7,500 | 0,050 |
Variables categóricas expresadas en porcentajes (%). Variables numéricas expresadas en promedio ± DE.
CAS: Community Activities Scale; DE: desviación estándar; TMIR: terapia de movimiento inducido por restricción.
La finalidad de este estudio fue presentar los resultados de la fase piloto de un estudio clínico simple ciego controlado con placebo en pacientes con ACV en estadio subagudo. La muestra fue dividida de forma aleatoria y aleatorizada en 2 grupos: el grupo experimental sometido a TMIR y terapia convencional, y el grupo control, sometido a terapia convencional. El objetivo principal fue comparar el desempeño motor del miembro superior afectado en ambos grupos y específicamente determinar si existen diferencias significativas en la incorporación y la calidad de movimiento del miembro superior en tareas de la comunidad.
Las medidas de resultado en este estudio mostraron una diferencia estadísticamente significativa en el grupo que recibió TMIR después de 2 semanas de entrenamiento, indicando que la TMIR mejora la función motora del miembro superior afectado en pacientes que se encuentran en un estadio subagudo de un ACV. Se demostró un aumento significativo en la cantidad de uso y la calidad del movimiento del brazo medido por la escala MAL y en la habilidad funcional y la calidad de movimiento medido por el AMAT. Asimismo, se demostraron diferencias significativas en la cantidad de uso y la calidad del movimiento del brazo en actividades desarrolladas en la comunidad, como, por ejemplo, hablar por teléfono, hacer una compra en el supermercado o sacar dinero de un cajero automático. Dichas actividades en la comunidad fueron evaluadas con la escala CAS, diseñada específicamente para este protocolo de investigación. Tanto en las escalas de autorreporte de incorporación del brazo afectado en actividades de la vida diaria como en la escala CAS de valoración en tiempo real de actividades en la comunidad, se observaron diferencias significativas entre la evaluación basal y a las 2 semanas. Globalmente, los sujetos pertenecientes al grupo experimental mejoraron luego de haber completado 2 semanas de TMIR con respecto al grupo control.
Con respecto a los resultados en escalas globales de funcionalidad del miembro superior, no se observaron cambios entre el grupo experimental y el grupo control a las 2 semanas de la evaluación basal en fuerza de prensión medida con un dinamómetro, el grado de movilidad activa medido por la escala FMA y el impacto funcional en actividades de la vida diaria medido con el FIM. Podemos observar que, a pesar de la implementación de los 14 días de restricción del brazo no afectado, los pacientes del grupo experimental mantuvieron la curva de mejoría en el desempeño de sus actividades de la vida diaria, pudiendo implementar estrategias compensatorias durante ese período.
Estos resultados son comparables con otros estudios que comparten algunas evaluaciones. Así, en una revisión sistemática y un metaanálisis realizado por Shi et al.10 con 13 estudios aleatorizados controlados, se evidenció que los protocolos de restricción modificada (hasta 6 h de restricción y entre 30 min y 3 h de entrenamiento del miembro afectado) aumentan la habilidad funcional para utilizar el miembro superior afectado medido por el Action Research Arm Test y el Wolf Motor Function Test, y aumenta el uso del brazo afectado en actividades de la vida diaria evaluado mediante la escala MAL.
En otra revisión sistemática y metaanálisis de estudios aleatorizados controlados16 fue evaluada la efectividad de la TMIR dividiendo los estudios según la intensidad de la restricción y de las terapias. Comparando los resultados del subgrupo de estudios que implementaron la misma intensidad de restricción y terapias que nuestro estudio, podemos observar que en el caso de los estudios aleatorizados hallaron moderada evidencia de la TMIR para mejorar la movilidad de la mano, moderada evidencia para mejorar la percepción de uso de la mano en las actividades de la vida diaria y, al igual que en nuestro estudio, no hubo evidencia de que la restricción produzca mejores resultados en la independencia personal de los pacientes en el grupo experimental, comparados con el grupo control.
El estudio realizado por Thrane et al.35 no evidenció diferencias significativas en la escala de FMA entre el grupo control y el experimental. Sin embargo, observaron diferencias estadísticamente significativas en las evaluaciones funcionales del miembro superior utilizando la escala Wolf Motor Function Test en las evaluaciones posterior al tratamiento. El efecto positivo inicial no se mantuvo en el seguimiento a los 6 meses. Cabe destacar que en dicho estudio el número de casos fue de 47, con tiempo de evolución promedio de 17,3 ± 6,9 días, o sea pacientes en estadio más agudo que en nuestra población de pacientes. También dicho estudio difiere del nuestro en el tiempo de tratamiento, ya que ellos utilizaron la terapia de restricción durante 10 días; en cambio, en este estudio fue de 14 días consecutivos.
Otro hallazgo importante es que no se observó disminución en la funcionalidad del miembro afectado, como fue reportado en el estudio VECTORS14. Esto puede deberse a que en los criterios de inclusión de dicho estudio no se requería que el paciente tuviera movimiento activo en la muñeca y los dedos, por lo cual es posible que hayan ingresado al protocolo pacientes con peor desempeño motor que la población de nuestro estudio. Este punto pudo haber influido negativamente en las compensaciones no deseadas para el grupo de restricción intensiva. También el promedio del tiempo de evolución del estudio VECTORS fue menor (9,7±4,6 días).
Con respeto a los resultados positivos, en cuanto a la incorporación del miembro afectado a las actividades de la vida diaria, nuestro estudio coincide con los resultados de otros estudios10. En los 6 ensayos clínicos controlados en esta revisión, los cuales incluyeron a 173 sujetos, la puntuación global de la escala MAL fue más alta en el grupo de terapia de restricción comparado a los controles, tanto en la subescala de calidad de movimiento como en la de cantidad de uso, a pesar de la heterogeneidad en el diseño y la metodología de los trabajos considerados.
No hemos encontrado estudios que evalúen el desempeño motor de los pacientes con ACV en tiempo real y en forma objetiva en actividades instrumentales de la comunidad con pruebas ecológicas.
Como fue mencionado anteriormente, se observaron correlaciones de moderadas a fuertes entre la escala CAS y otras pruebas externas que evalúan funcionalidad del miembro superior. La relación fue particularmente alta con las subescalas tiempo, habilidad funcional y cantidad de uso del AMAT. Creemos que esta correlación se debe a que las actividades valoradas en el AMAT están subdivididas en componentes de tareas simples, ya que son actividades de más de un paso. Las actividades incorporadas en la escala CAS también fueron subdivididas en componentes de tareas más simples y con progresión a tareas más complejas. En nuestro estudio, la escala CAS no se correlacionó con la escala MAL, probablemente debido a que la escala MAL no fue diseñada en función de grados de complejidad de tareas, sino más bien como una medida de frecuencia de uso. Por otra parte, si bien el sistema de puntuación utilizado para la escala CAS se basó en el sistema utilizado en las subescalas de cantidad de uso y calidad de movimiento de la MAL, estas fueron puntuadas por los profesionales por observación de la grabación de la salida comunitaria, al igual que en el AMAT.
Los resultados de este estudio muestran que algunos de los subítems de la escala CAS presentaron mejoría a los 15 días en el grupo que recibió terapia de restricción y se correlacionaron con escalas globales de función motora del miembro superior (AMAT, MAL). Si bien es difícil interpretar estos resultados en una fase piloto con una muestra reducida de participantes suponemos que otras variables no contempladas en esta parte del estudio pudieron influir en la selectividad de las tareas en las que se objetivaron las mejorías.
Consideramos que nuestro estudio presenta algunas fortalezas. En primer lugar, la muestra es homogénea en cuanto a características sociodemográficas y clínicas, y no es necesario ajustar el análisis a estos aspectos que podrían haber sido variables confundidoras. En segundo lugar, es considerada una fase piloto de un estudio clínico controlado simple ciego, donde los participantes fueron incluidos de forma aleatorizada a cada uno de los grupos, teniendo en cuenta que este tipo de diseño de estudio brinda la mejor evidencia disponible de una intervención terapéutica. Además, todas las medidas de resultados fueron evaluadas por terapistas entrenados, ciegos al tratamiento recibido por los participantes, y las escalas utilizadas fueron puntuadas basadas en la observación del profesional interviniente. Finalmente, para nuestro conocimiento, no existen trabajos que valoren el efecto de la terapia de restricción en actividades en la comunidad. Pocos estudios logran analizar la incorporación de las destrezas adquiridas durante el TMIR en la vida real. Conocer estos beneficios adicionales de la TMIR permitirá mejorar los programas de rehabilitación y la calidad de vida de los pacientes y sus familias.
Por otra parte, existen ciertas limitaciones en este estudio. En primer lugar, la inclusión de una muestra reducida y probablemente no representativa. En segundo lugar, los pacientes incluidos se encontraban en un estadio temprano de la enfermedad, en modalidad de internación. Por último, consistió en una evaluación basal y una a las 2 semanas, sin el seguimiento longitudinal a largo plazo, por lo tanto, no se puede establecer la duración del beneficio logrado.
ConclusionesEl presente estudio se diseñó con el objetivo de demostrar los beneficios de la terapia de restricción para la mejoría funcional y motora del miembro afectado posterior a un ACV. Al igual que en la literatura publicada, observamos que la terapia de restricción del miembro superior es una técnica de tratamiento que favorece la incorporación y la calidad de movimiento del miembro afectado.
Paralelamente, nuestra intención fue evaluar la eficacia de la terapia de restricción para mejorar la funcionalidad e incorporación del miembro superior afectado en tareas de la comunidad (alcances, uso de cajero automático, pago en supermercado y uso de teléfono público). Observamos que el grupo experimental se benefició en dichas tareas y, si bien este trabajo representa el primer reporte en nuestro medio y no es extrapolable a otras muestras, los resultados preliminares de esta fase piloto permitirán el diseño de un ensayo clínico controlado con una mayor número de casos y un seguimiento longitudinal que permita confirmar el efecto beneficio de la TMIR en pacientes en estadio temprano posterior a un ACV en el desempeño de las actividades en la comunidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.