Las técnicas ultrasonográficas son utilizadas de manera habitual en la evaluación del paciente con ictus agudo. Hasta ahora, la más utilizada es el Doppler, cuya aplicación fundamental es en el diagnóstico y tratamiento del ictus isquémico. El eco-Doppler color transcraneal (EDCTC) es una técnica no invasiva, barata y rápida, con enorme desarrollo en los últimos años, que amplía el espectro de posibilidades de estudio de la enfermedad cerebrovascular en la fase aguda, tanto isquémica como hemorrágica.
Desarrolloel EDCTC puede realizarse mediante dispositivos portátiles, en el servicio de urgencias, Unidad de Ictus o sala de Neurología para la evaluación de los pacientes con isquemia cerebral aguda, evaluando en tiempo real la situación de la circulación cerebral, monitorizando la recanalización arterial tras la administración de trombolíticos, mostrando y monitorizando el edema cerebral o evaluando la presencia de cortocircuito derecha-izquierda. Además, en las hemorragias cerebrales puede mostrar la presencia de malformaciones arteriovenosas o fístulas así como ser de utilidad en la monitorización del tamaño del hematoma cerebral.
Conclusiónel EDCTC es una herramienta diagnóstica excelente en la evaluación del paciente con un ictus agudo isquémico o hemorrágico que, además de evaluar el flujo sanguíneo en tiempo real, nos permite observar la anatomía cerebral.
Nowadays, ultrasound techniques are part of the conventional study of acute ischemic stroke patients. To date, transcranial Doppler (TCD) is the most experienced technique, as it has been used in both diagnostic and treatment of acute stroke. The recent development and introduction in clinical practice of transcranial color-coded sonography (TCCS) has amplified the diagnostic and therapeutic possibilities of ultrasounds, as it could be used not only for ischemic stroke, but also hemorrhages. Moreover, the new portable devices, which can easily be used in emergency rooms, stroke units and neurology departments, provide the possibility of a rapid evaluation of the brain vessels, to determine the patient's prognosis and help to select the best treatment option. They could also be used for brain edema detection or right to left shunt monitoring. Moreover, brain hemorrhages can be detected, as well as arterial-venous malformations or cerebral fistules. TCCS is an excellent diagnostic tool for the evaluation in both acute ischemic or hemorrhagic stroke patients evaluation, useful not only to evaluate brain vessel state but also its anatomy in real time.
El ictus agudo es una urgencia neurológica cuyo diagnóstico rápido es vital para el paciente, ya que permite la aplicación de tratamientos específicos que mejoren su pronóstico. Por ello, el uso de técnicas diagnósticas rápidas y fiables que permitan la valoración de la circulación cerebral de forma precisa es de gran utilidad para la elección del tratamiento idóneo del paciente, determinar la necesidad de técnicas invasivas e incluso establecer su pronóstico1–5.
Las técnicas ultrasonográficas, el Doppler y el eco-Doppler color (EDC) son herramientas diagnósticas rápidas y fáciles de utilizar, presentando como ventajas añadidas su bajo coste, su portabilidad, el no requerir colaboración por parte del paciente y su escasa invasividad. Además de su demostrada utilidad para el diagnóstico del estado vascular de manera fiable, pueden utilizarse para la monitorización del paciente (especialmente la recanalización arterial) y su posterior seguimiento3.
En la actualidad existen una amplia experiencia con el Doppler transcraneal (DTC) en el ictus agudo, tanto en la valoración de la circulación cerebral como en la monitorización de la recanalización, su acción terapéutica -la sonotrombotricia-, la detección de microembolias e incluso la detección de cortocircuito derecha- izquierda3,5–15. Además, en múltiples ocasiones dicha técnica ha sido validada con otras técnicas de neuroimagen, como el angioTC, la angioRM e incluso la arteriografía cerebral3,10,15.
El EDC transcraneal (EDCTC) o dúplex transcraneal se ha introducido de forma más reciente en el diagnóstico del ictus agudo, experimentando un gran auge en los últimos años. Además, diversos trabajos han validado los hallazgos del EDCTC con otras pruebas de imagen convencionales, confirmando su alta especificidad y sensibilidad en la valoración de la circulación sanguínea cerebral16. El transductor utilizado en el ECDTC, al igual que en el caso del DTC, posee una frecuencia generalmente de 2MHz.
En este trabajo de revisión no sistemática se expondrá la utilidad del EDCTC en el estudio del paciente con ictus agudo, tanto isquémico como hemorrágico, así como sus aplicaciones para el estudio vascular cerebral.
Exploración básica del sistema vascular mediante EDCTCLa principal ventaja del EDCTC sobre el DTC es la disponibilidad del modo B, que añade la modalidad de imagen anatómica, posibilitando la visualización del parénquima cerebral y los vasos cerebrales17–19. Esta característica añade 2 ventajas: por un lado, permite determinar con seguridad el vaso que está siendo insonado y, por otra parte, es posible realizar una corrección del ángulo de insonación, lo que se traduce en una medida más exacta de la velocidad del flujo en el vaso sanguíneo, que es especialmente de interés en la determinación de estenosis arteriales intracraneales15,19–21. No obstante, en la actualidad existen controversias acerca de la necesidad de angular en el EDCTC, como se explicará posteriormente en este artículo.
Además, el EDCTC supone un avance frente al DTC en los siguientes puntos15:
- 1.
Presenta una mayor sensibilidad y especificidad en la determinación de circulación colateral, ya que detecta la existencia de las arterias comunicantes anterior (ACoA) y posterior (ACoP) de forma prácticamente inequívoca.
- 2.
Mejora la detección de estenosis intracraneales, especialmente si se utilizan ecopotenciadores.
- 3.
Posibilita la detección de sangrado intracraneal, El EDCTC puede detectar la presencia de diferentes tipos de sangrado, como una hemorragia subaracnoidea o un hematoma intraparenquimatoso, pudiendo utilizarse para confirmar una sospecha de transformación hemorrágica tras un ictus isquémico (aunque el EDCTC no puede diferenciar un hematoma intraparenquimatoso de una transformación hemorrágica con total seguridad).
- 4.
Algunos autores sugieren que puede ser útil para detectar la presencia de aneurismas cerebrales ≥ 6mm e incluso menores de 5mm si se añaden ecopotenciadores, aunque en la práctica clínica no es habitual utilizar esta técnica.
- 5.
También puede detectar signos de herniación subfalcial mediante la medición del desplazamiento de la línea media, lo cual tiene especial importancia para el pronóstico de pacientes con infartos completos de la arteria cerebral media (ACM)22.
En la actualidad no existen guías que estandaricen el estudio con EDCTC del paciente con ictus agudo. Sin embargo, se recomienda realizar el estudio de manera sistemática para evitar errores en los registros (por ejemplo, olvido en la visualización de todos los vasos que conforman el polígono de Willis). Además, basándonos en los estudios previos realizados con DTC, es recomendable iniciar el estudio por el lado asintomático.
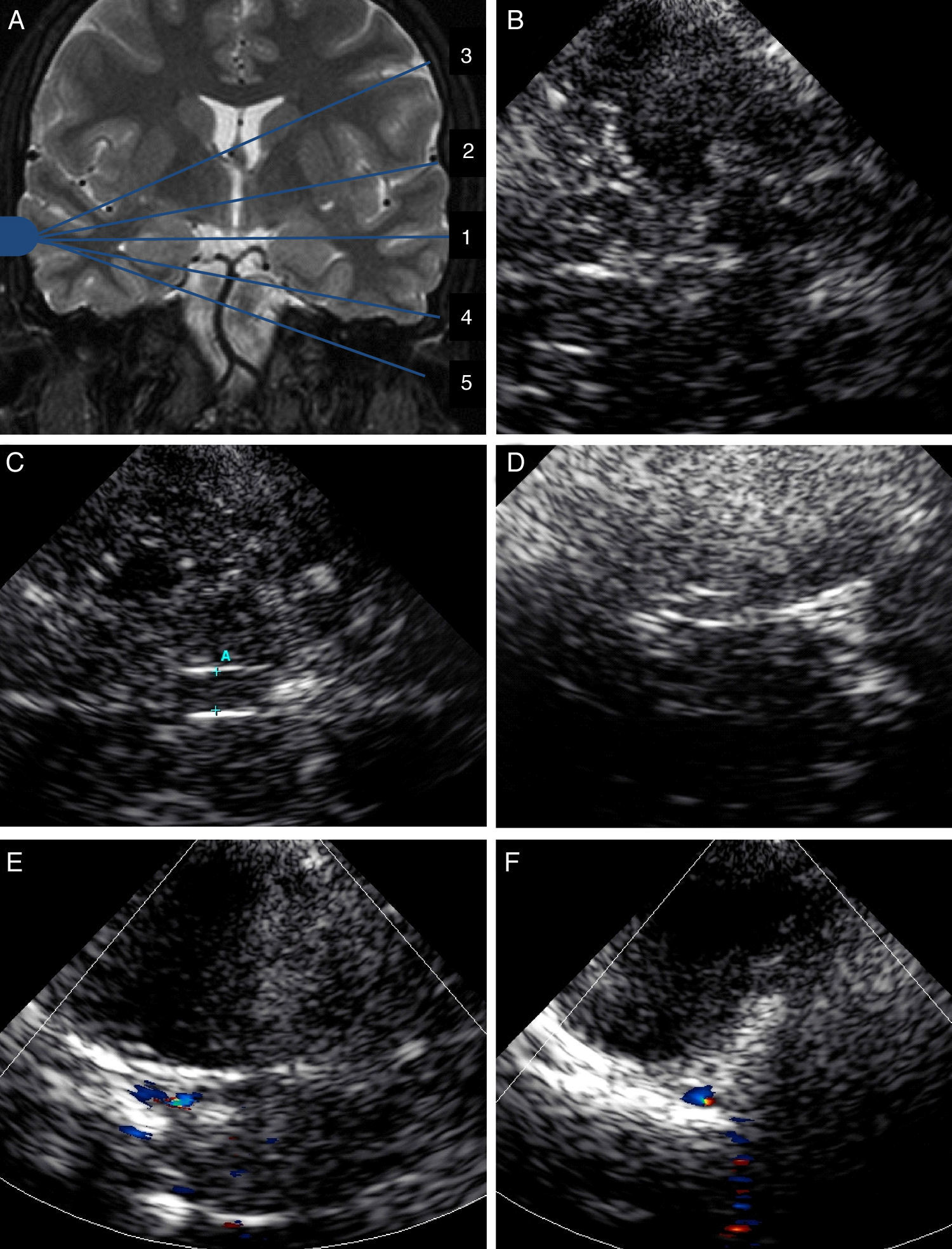
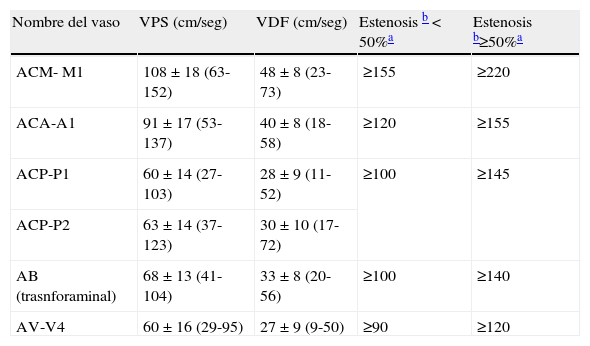
Antes de comenzar la exploración, deben reconocerse los diferentes planos de insonación. Se iniciará el estudio con planos axiales, colocando el transductor en la ventana temporal, localizada en el área preauricular, en relación con el arco cigomático. Así se distinguen 5 planos (fig. 1A)23:
- 1.
El plano mesencefálico, caracterizado por la imagen de mariposa hipoecoica correspondiente al mesencéfalo, rodeado de la cisterna basal hiperecoica (fig. 1B).
- 2.
Una vez localizado el plano mesencefálico, mediante basculación del transductor pueden identificarse los demás planos. Así, si inclinando 10° la sonda hacia la zona craneal se obtiene el plano diencefálico, caracterizado por la visualización del tercer ventrículo (doble línea hiperecoica) y la glándula pineal (hiperecoica) (fig. 1C)
- 3.
Por encima de este plano, con una nueva inclinación, se obtiene el plano ventricular, donde se localizan las astas anteriores de los ventrículos laterales, (hipoecoicas) (fig. 1D)
- 4.
Volviendo al plano mesencefálico y basculando ligeramente la sonda en dirección caudal se encuentra el plano esfenoidal o protuberancial alto, donde puede visualizarse el sifón carotídeo en la zona del ala menor del esfenoides (hiperecoica) (fig. 1E)
- 5.
En un plano más caudal, denominado protuberancial bajo, se observa la arteria carótida interna (ACI) distal en su porción horizontal petrosa (hiperecoico)24 (fig. 1F)
A) Planos de estudio en EDCTC: 1 mesencefálico; 2 diencefálico; 3 ventricular; 4 protuberancial alto; 5 protuberencial bajo. B) Plano mesencefálico. C) Plano diencefálico en el que se observan el tercer ventrículo, tálamos y glándula pineal. D) Plano ventricular en el que se observan los ventrículos laterales. E) Plano protuberancial alto en el que se observa el ala menor del esfenoides. F) Plano protuberancial bajo en el que se observa el peñasco temporal.
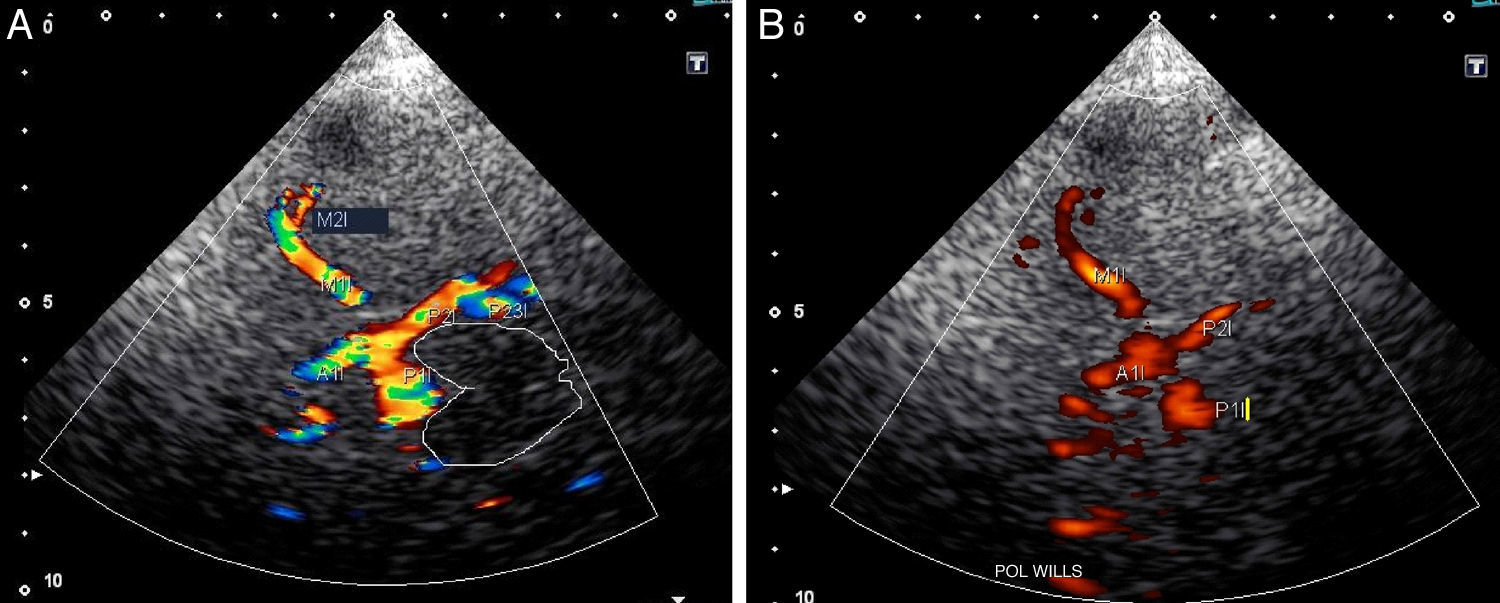
Los planos mesencefálico, diencefálico y protuberancial alto son los más utilizados en el diagnóstico vascular, ya que en ellos se consigue visualizar el polígono de Willis (fig. 2A y B).
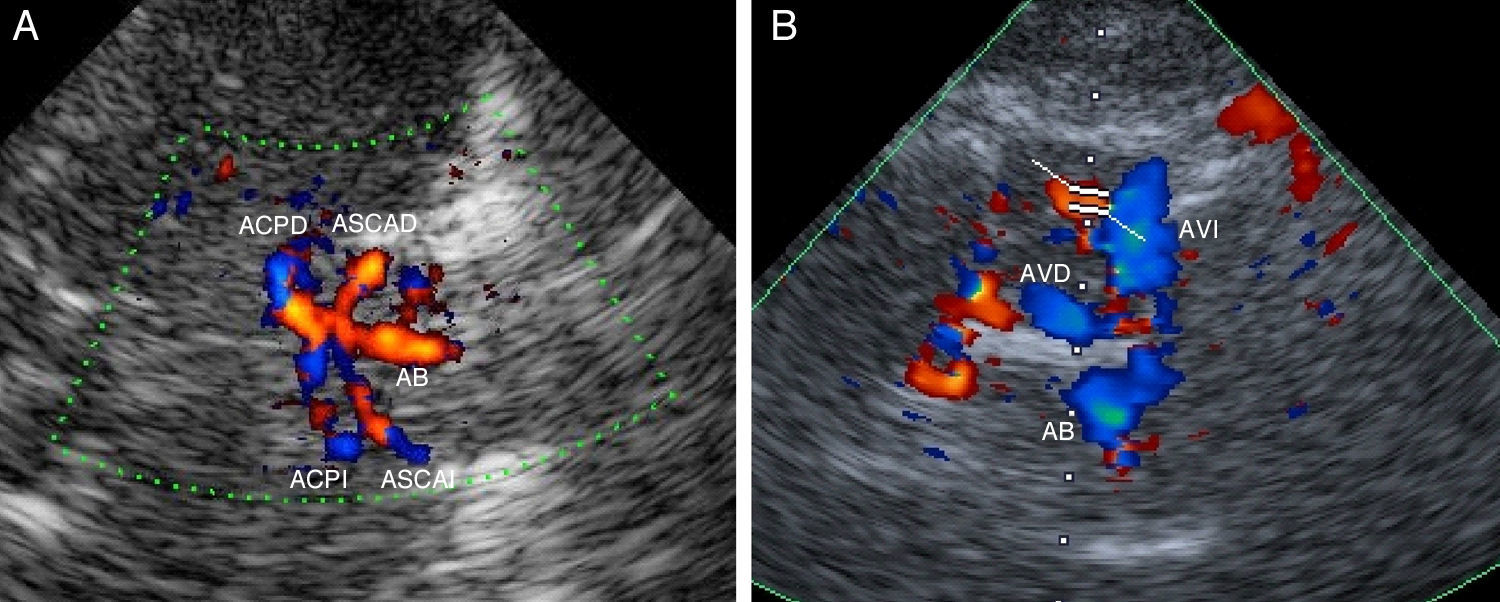
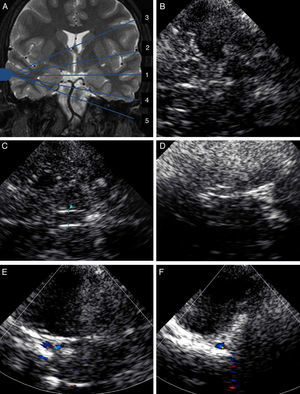
Adicionalmente se dispone de 2 planos coronales para poder completar el estudio: el plano coronal anterior donde se identifica la ACI distal y su división en arteria cerebral anterior (ACA) y ACM; y el plano coronal posterior donde se registran el segmento distal de la arteria basilar (AB), ambas arterias cerebelosas superiores (ASCA) y las arterias cerebrales posteriores (ACP) (fig. 3A).
A) Plano coronal posterior, a través de la ventana transtemporal, donde se registra el segmento distal de la arteria basilar (AB), ambas arterias cerebelosas superiores (ASCA) y las arterias cerebrales posteriores (ACP). B) Plano suboccipital con la visualización de ambas arterias vertebrales (AV) y arteria basilar (AB).
Por último, para el estudio de la circulación posterior, se utiliza la ventana suboccipital, localizada en la nuca del paciente, aproximadamente en la línea media. A través de esta ventana se reconoce el foramen magnum (estructura redondeada hipoecoica) y, en sus inmediaciones, se registran los segmentos V3 y V4 de ambas arterias vertebrales (AV), la confluencia de las mismas en la AB y los segmentos proximal y medial de esta arteria (fig. 3B). En ocasiones es posible identificar otros vasos como la arteria cerebelosa postero-inferior (PICA), las arterias cerebelosas antero-inferiores (AICA), las ASCA e incluso la terminación de la AB en ambas ACP.
Adicionalmente se puede utilizar el plano transorbital para la valoración del segmento extracraneal de la arteria oftálmica, especialmente de interés en pacientes con oclusión carotídea, cuya inversión indica la existencia de circulación colateral23.
Debe tenerse en cuenta que la ventana temporal es mejor en pacientes jóvenes, varones y en la raza blanca (comparada con las razas negra y asiática).
Una vez conocidos los planos de estudio, se propone para el estudio del paciente con ictus agudo la sistemática metodológica descrita en la tabla 1:
Estudio rápido de pacientes con ictus mediante EDCTC
| 1. Isquemia en el territorio anterior: |
| • Paciente en decúbito supino con cabecero de la cama elevado (35-45°). Se recomienda que el ecografista se coloque en la cabecera del paciente, justo detrás del mismo. |
| • Iniciar la exploración con un corte axial en el plano mesencefálico en el lado asintomático a través de la ventana transtemporal (visualización del mesencéfalo en forma de mariposa -hipoecoica- rodeado de la cisterna basal -hiperecoica- en el modo B). Conviene identificar asimismo el ala menor del esfenoides (hiperecoico) y la fisura lateral. |
| • Una vez obtenida una correcta orientación espacial, valorar la ACM (segmentos M1 y M2) y la ACA, sifón carotídeo, ACI intracraneal y ACP (P1 y P2). También se puede visualizar, si existiera, circulación colateral (arterias comunicantes). |
| • Tras la valoración rápida de la circulación indemne, se realizará una valoración rápida del lado sintomático, localizando las áreas de estenosis u oclusión (si las hubiera). También conviene confirmar (si el tiempo lo permite) los hallazgos de circulación colateral si los hubiera. |
| • En caso de no poder visualizar de forma correcta alguna de las arterias del polígono de Willis, se puede completar el estudio con un plano coronal o añadir ecopotenciadores (EP) |
| • El estudio intracraneal siempre debe acompañarse de un estudio carotídeo. |
| 2. Isquemia en el territorio vértebro-basilar: |
| • Colocar al paciente en decúbito lateral o con giro de cabeza hacia un lado y leve flexión del cuello sobre el tronco. |
| • Localizar el foramen magnum y el clivus. |
| • Localizar ambas arterias vertebrales y el origen de la AB (típica imagen en Y). |
| • Determinar las áreas de estenosis (si las hubiera) o de oclusión arterial. |
Deben tenerse en cuenta algunas consideraciones especiales:
- 1.
Se recomienda iniciar el estudio por el plano mesencefálico en modo B y, una vez localizado el mesencéfalo, aplicar el modo color para identificar los vasos del polígono de Willis. Alguna pista que puede servir para identificar los vasos es que el sifón carotídeo se encuentra en las inmediaciones del ala menor del esfenoides y que la circulación posterior rodea al mesencéfalo.
- 2.
El segmento M1 de la ACM se localiza a nivel esfenoidal, mientras que el M2 se localiza a nivel insular. Los segmentos P1 y P2 de la ACP se diferencian por el punto en el que nace la ACoP.
En 2009 un grupo de expertos propuso un consenso para realizar un EDCTC en un estudio de investigación21:
- 1.
Realizar siempre un estudio carotídeo.
- 2.
La evaluación de la arteria oftálmica no debe ser rutinaria, realizándose solo en aquellos casos de oclusión/estenosis de la ACI para detectar circulación colateral o en aquellos casos en los que no exista ventana temporal suficiente.
- 3.
Respecto a la exploración de la velocidad de flujo con angulación, se utilizará un ángulo menor de 60°, cuando se cumplan las siguientes condiciones:
- a.
segmentos rectilíneos del vaso y
- b.
cuando tenga una longitud de ≥ 2cm y
- c.
evitando las áreas donde el vaso se curve y
- d.
teniendo en cuenta que dicha angulación puede suponer un incremento del 20-30% en el registro de la velocidad del mismo15,20.
- a.
Si no se cumplen los requisitos anteriormente mencionados, se evitará angular para medir la velocidad de flujo en el vaso objeto de estudio. En caso de utilizarse, dicho ángulo será notificado en las publicaciones21.
Uso de ecopotenciadoresEn condiciones basales, hasta un 30% de los pacientes sometidos a EDCTC no tendrán ventana acústica suficiente, por lo que el estudio resultará incompleto18–20,25. Esto se cumple especialmente en pacientes ancianos y en mujeres19. Para solventar esta aparente limitación técnica, muchos autores sugieren el uso de ecopotenciadores (EP).
Los EP son fundamentalmente microburbujas de gas inerte con propiedades acústicas no lineales y resistentes al paso del la circulación sanguínea por el pulmón, que aumentan la señal acústica hasta 1.000 veces, por lo que podríamos decir que funcionan de «amplificador» del sonido de la circulación vascular. Además, aumentan el coeficiente de reflexión del ultrasonido a 0,99 (frente al 0,03 de los tejidos blandos biológicos)26–28.
Los EP consiguen una mejora sustancial de la visualización de la vascularización cerebral, reduciendo hasta un 10-13% el total de pacientes en los que no se puede obtener un estudio transcraneal de calidad19,25,29,30. Son más eficaces en aquellos pacientes con insuficiente ventana acústica (aquellos en los que es posible identificar alguna estructura cerebral o algún vaso) que en los pacientes en los que no existe ventana (visualización del 96% con EP en pacientes con ventana acústica parcial frente al 50% con EP en pacientes con ausencia completa de ventana acústica).
Existen múltiples estudios que han comprobado la utilidad de dichos EP, siendo Levovist® (compuesto por galactosa y ácido palmítico) el que más experiencia acumula en las publicaciones. Todos los autores coinciden en que su uso es inocuo para el paciente, no habiendo sido comunicado ningún efecto adverso hasta la actualidad, por lo que aumentan la sensibilidad diagnóstica sin aumentar los riesgos31,32.
Además, Nedelmann et al.,21 sugieren que su uso en los estudios clínicos se limite también a aquellos pacientes sin ventana acústica, tanto en la inclusión del paciente como en los posteriores controles ecográficos a los que deba someterse.
Aunque como hemos dicho anteriormente el Levovist® es el EP que tiene más experiencia acumula, dado que es uno de los primeros ecopotenciadores utilizados, en la actualidad ha sido sustituido por nuevos tipos de EP, siendo muy utilizado y apreciado en Europa el Sonovue® (hexafluoruro de azufre). La recomendación actual no establece predilección por un EP sobre otro, ahora bien, se prefiere su uso en perfusión continua o en pequeños bolos para alargar su vida media, que en general es escasa (aproximadamente 5 minutos19).
Por otra parte, los EP también juegan un papel interesante en el manejo del infarto cerebral agudo, que comentaremos más adelante.
El EDCTC en la isquemia cerebral agudaDiversas publicaciones han utilizado el EDCTC para la localización y gradación de la lesión vascular (oclusión/estenosis), así como para la monitorización de la recanalización arterial en el paciente con ictus isquémico agudo, con resultados favorables para esta técnica, superando incluso al DTC24. Además, varios estudios han comparado el uso del EDCTC en el infarto agudo con técnicas de imagen convencionales, como angioRM, angioTC e incluso arteriografía cerebral, obteniendo buenas correlaciones con todos ellos, especialmente si se utilizan EP16,19,20,29,31,32.
El mayor problema que presenta el uso del EDCTC en el estudio diagnóstico del ictus en su fase aguda, es la ausencia de ventana temporal que, como se ha explicado con anterioridad, puede solventarse mediante el uso de EP. Algunos autores recomiendan su uso desde el momento inicial de la valoración del paciente, antes incluso de comprobar si presenta suficiente ventana acústica, ya que, por una parte ayuda a conseguir diagnósticos más fiables y, por otra, acorta el tiempo de estudio. En general, el tiempo invertido en la valoración del paciente con infarto agudo cerebral mediante EDCTC, con y sin EP, no difiere mucho del consumido para realizar una DTC, no superando en total más de 20 minutos, lo que lo hace equiparable al tiempo de adquisición de una TC Craneal, si contabilizamos el tiempo desde que el paciente llega a Urgencias hasta que se obtienen las imágenes mediante dicha técnica25,29,32. Por otra parte, también debe tenerse en cuenta que la experiencia del ecografista, ya que se trata de una técnica operador-dependiente, al igual que el DTC.
Valoración de oclusiones y estenosis arteriales intracranealesPara establecer el diagnóstico de oclusión de la ACM hay que delimitar la localización exacta. En el caso de una oclusión proximal de M1, la ausencia de señal de color y de flujo mediante Doppler sería en teoría suficiente, aunque en ocasiones dicha ausencia puede ser debida a una estenosis de muy alto grado (preoclusiva) de la propia ACM. En otras ocasiones la principal duda que se plantea para el correcto diagnóstico de una oclusión es la existencia de suficiente ventana temporal, por lo que la visualización de las demás arterias del polígono de Willis ipsilaterales a la ACM ausente son considerados criterios muy específicos para diferenciar una oclusión de la ausencia de ventana temporal37. Además, para identificar la oclusión de ramas distales a la ACM–M1 - ramas perforantes - puede ser útil la detección de una velocidad diastólica final (VDF) ≤ 25cm/seg y una proporción de VDF<2,7 (calculado como velocidad diastólica final de las ACM sana dividida por la velocidad diastólica final de la ACM patológica). La oclusión de M1 puede mostrar una VDF ≤ 25cm/seg con un proporción de VDF ≥ 2,7. Sin embargo, una lesión no oclusiva de ACM muestra una VDF>25cm/seg38.
Por otra parte, también debe considerarse que la existencia de asimetrías ≥ 21% en la comparación de las velocidades medias del lado sano y el enfermo sugiere la presencia de una oclusión distal en el tronco principal de la ACM o en alguna de sus ramas distales respecto al lugar donde se examina el flujo39,40. Para facilitar dicha valoración, es recomendable utilizar la velocidad pico sistólica obtenida mediante EDCTC. En la tabla 2 se resumen los valores de normalidad para las velocidades de la circulación intracraneal, así como la gradación de estenosis intracraneal.
Rangos de normalidad en las velocidades de los diferentes vasos intracraneales y criterios de estenosis intracraneal
| Nombre del vaso | VPS (cm/seg) | VDF (cm/seg) | Estenosis b<50%a | Estenosis b≥50%a |
| ACM- M1 | 108±18 (63-152) | 48±8 (23-73) | ≥155 | ≥220 |
| ACA-A1 | 91±17 (53-137) | 40±8 (18-58) | ≥120 | ≥155 |
| ACP-P1 | 60±14 (27-103) | 28±9 (11-52) | ≥100 | ≥145 |
| ACP-P2 | 63±14 (37-123) | 30±10 (17-72) | ||
| AB (trasnforaminal) | 68±13 (41-104) | 33±8 (20-56) | ≥100 | ≥140 |
| AV-V4 | 60±16 (29-95) | 27±9 (9-50) | ≥90 | ≥120 |
AB: arteria basilar; ACA: arteria cerebral anterior; ACM: arteria cereb ral media; ACP: arteria cerebral posterior;; VDF: velocidad diastólica final;VPS: velocidad pico sistólica.
Además, en la valoración urgente del paciente con infarto cerebral agudo, el EDCTC podría ser de utilidad en la selección de pacientes más idóneos a priori para someterse a terapia trombolítica, esto es, aquellos en los que existan mayores posibilidades de éxito una vez que conocemos el estado de la circulación cerebral, aunque las guías actuales para el tratamiento del ictus agudo no incluyan entre los criterios de trombolisis, el conocer dicha situación de la circulación cerebral del paciente33-36.
Por otra parte, el EDCTC no solo es útil para el diagnóstico de oclusiones arteriales intracraneales sino también para realizar un seguimiento de la evolución de las mismas hasta en el 90% de los pacientes con ictus, por lo que constituye un método de elección dada su rapidez, bajo coste y nula invasión31,32. Al igual que el DTC, el EDCTC es útil para la valoración del proceso dinámico de la isquemia cerebral, ya que además de detectar la arteria afectada, se puede monitorizar el tiempo hasta la recanalización de la misma, en caso de producirse19. Dicha valoración se ha correlacionado con la gravedad y el pronóstico del paciente, de modo que aquellos casos en los que existe ausencia o disminución importante de flujo en la ACM, suelen acompañarse de mayor déficit neurológico y mayor gravedad al ingreso. Además, una recanalización más temprana se asocia a mayor mejoría clínica y mejor pronóstico funcional al alta19,25. Incluso se podría ajustar el tratamiento de la hipertensión en la fase aguda del ictus una vez que se conoce el estado de recanalización del vaso.
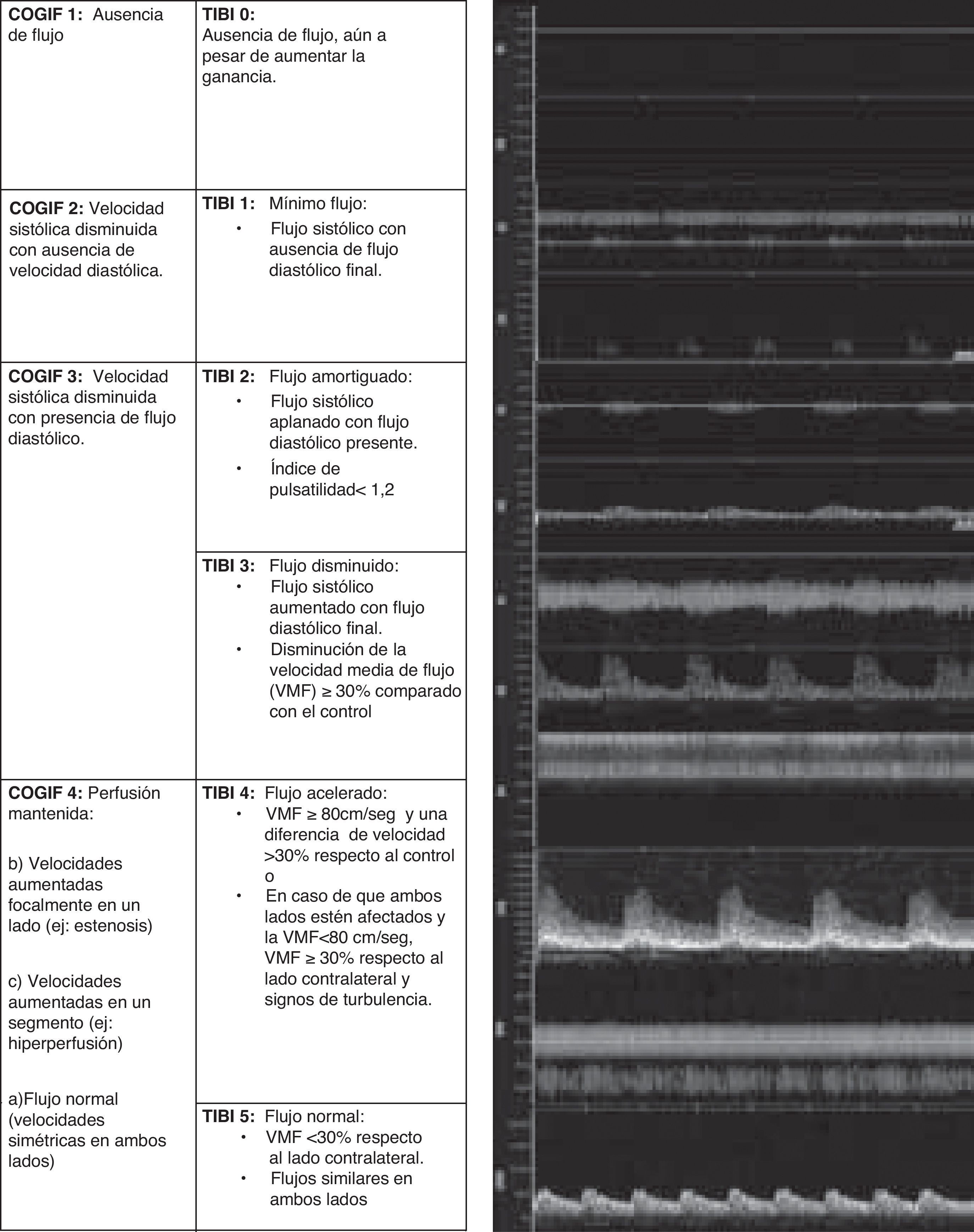
El EDCTC en la valoración del flujo residual en la isquemia aguda: de los criterios TIBI a los criterios COGIFEn el ictus isquémico se produce una oclusión de una arteria cerebral, lo que se caracteriza por la ausencia o reducción muy significativa del flujo arterial en el lugar donde se encuentre dicha oclusión. Los criterios de oclusión arterial establecidos en el DTC se basan en la detección del flujo residual del vaso afecto, habiendo sido establecidos los criterios TIBI (thrombolysis in brain ischemia) como una escala eficaz para gradar dicho flujo residual. La escala recoge 6 grados diferentes de anomalías hemodinámicas, siendo 0 la ausencia de flujo y 5 la total normalidad del mismo3,9,41,42. Esta gradación es útil tanto para la valoración inicial del paciente con ictus agudo, como para el posterior seguimiento de una eventual recanalización.
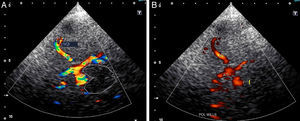
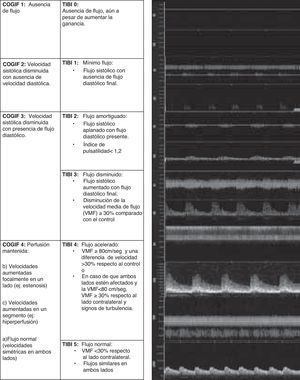
Los expertos en EDCTC proponen reducir dichos criterios a una gradación de 4 categorías, naciendo así los criterios Consensus On Grading Intracranial Flow obstruction (COGIF)21: así, un COGIF 1 implicaría la oclusión completa del vaso (equivale al TIBI 0), el COGIF 2 supone la ausencia de flujo diastólico (equivale a TIBI 1) y sugiere una canalización parcial; en el COGIF 3 coexisten bajas velocidades sistólica y diastólica y también sugiere una recanalización parcial (equivale a los TIBI 2-3) y por último el COGIF 4 corresponde a una perfusión completa, diferenciando en este grupo 3 subcategorías: flujo normal, flujo estenótico (con aumento de velocidades focales) y flujo aumentado en un segmento o hiperperfusión (engloba los criterios TIBI 4-5) (fig. 4).
La aplicación de estos criterios es exactamente igual a la de los criterios TIBI21. Además, al igual que en estos, es posible valorar la recanalización del vaso en función de los cambios de la circulación cerebral valorados mediante EDCTC. Así, se considerarán las siguientes situaciones:
- 1.
Recanalización: existe una mejoría en el grado COGIF respecto a la situación basal:
- a)
Recanalización parcial: mejoría en ≥1 grado COGIF respecto al COGIF basal.
- b)
Recanalización completa: mejoría desde cualquier grado COGIF basal hasta un grado COGIF 4 final.
- a)
- 2.
No hay cambios: no existe una diferencia entre el grado COGIF basal y el final.
- 3.
Empeoramiento: deterioro ≥ 1 grado en la escala COGIF que en ocasiones es debido a re-estenosis/oclusión del vaso sujeto a estudio21.
En la tabla 3 se recogen diferentes criterios obtenidos mediante EDCTC para establecer el diagnóstico de diferentes lesiones vasculares.
Criterios mediante EDTC para cribaje de lesiones vasculares propuestos por los expertos
| Oclusión completa ACM (oclusión a nivel del segmento M1) | Ausencia de color y espectro Doppler en la ACM junto con:• visualización de la A1 y/o C1 ipsilateral o• visualización de las venas ipsilaterales (vena cerebral media profunda) o• visualización de la circulación anterior contralaterala |
| Oclusión en tándem (ACA/ACM) en oclusión de la carótida en T | 1. Ausencia de color y espectro Doppler en ACM- M1, en la ACI intracraneal y en A1 ipsilateral junto con:• Visualización de la vena cerebral media profunda o visualización del segmento de la A2 ipsilateral o visualización de la circulación anterior contralaterala2. Adicionalmente existirán velocidades de flujo disminuidas, especialmente la velocidad diastólica final o existencia de un flujo oscilante en la ACI cervical y en la ACC en comparación con el lado contralateral no afecto |
| Oclusión de ACI proximal (extracraneal) | Disminución variable de las velocidades de flujo en ACM y ACA sin datos de estenosis en esos vasos con aumento compensatorio de las velocidades de flujo A1-ACA contralateral o ACP ipsilateral |
| Oclusión de ramas de la ACM | • Una reducción de la velocidad pico sistólica y asimetría entre las VMF ≥21% se relaciona con oclusiones de varias ramas intracraneales de la ACM o de una oclusión de una rama principal |
| Existencia de flujo colateral | • Existe ACoA funcionante cuando encontramos una inversión de la A1 ipsilateral a la oclusión• Existe ACoP funcionante cuando existe paso desde P1 a ACM/ACI ocluida y una clara diferencia entre las velocidades de P1 y P2 |
ACA: arteria cerebral anterior; ACC: arteria carótida común; ACI: arteria carótida interna; ACM: arteria cerebral media; ACoA: arteria comunicante anterior; ACoP: arteria comunicante posterior; C1: arteria carótida en segmento 1; M1: arteria cerebral media, segmento M1; A1: arteria cerebral anterior, segmento A1; P1: arteria cerebral posterior, segmento P1, P2: arteria cerebral posterior, segmento P2; VMF: velocidad media de flujo.
Además de las estenosis y oclusiones arteriales, el pronóstico del paciente con infarto cerebral se relaciona la aparición de edema cerebral, sobre todo si se produce desviación de la línea media22. Por ello, la monitorización del desplazamiento de la línea media mediante EDCTC es de especial interés en el seguimiento de pacientes con ictus agudo, sobre todo a partir de las 16 horas de evolución, constituyendo un método diagnóstico rápido y fiable de herniación subfalcial, lo cual sería útil para identificar al grupo de pacientes que pueden beneficiarse de una craniectomía descompresiva22.
Así, el EDCTC es una técnica útil en la predicción del pronóstico del paciente con infarto cerebral ya que, además de observar alteraciones en el flujo arterial, puede detectar una eventual afectación secundaria del parénquima cerebral19,22,25,26,33–35.
El EDCTC como potenciador de la trombólisis: sonotrombotriciaEl poder trombolítico de los ultrasonidos es bien conocido. Múltiples estudios experimentales y ensayos clínicos han utilizado el ultrasonido solo o en combinación con el rtPA como arma terapéutica para favorecer la recanalización arterial, aunque la mayoría como fuente emisora de ultrasonidos al DTC5,7,14,41–45. Además, algunos han utilizado adicionalmente los EP, obteniéndose con ellos una mayor tasa de recanalización arterial7,46.
Dado que el EDCTC aporta mayor información que el DTC, parece razonable también utilizarlo para la sonotrombotricia en el ictus agudo. Así, algunos estudios han demostrado la utilidad de la monitorización continua con EDCTC, incluso con utilización conjunta de EP, muchos de ellos interrumpidos prematuramente tras detectarse un mayor número de sangrado intracraneal, por lo general asintomático, que en los estudios realizados con DTC47-50. En un metaanálisis reciente que ha analizado los estudios existentes con DTC y con EDCTC tanto randomizados como no randomizados, combinados con la aplicación de rtPA con o sin EP, los datos obtenidos confirman esa mayor tendencia al sangrado en los pacientes sometidos a EDCTC respecto a DTC (hemorragia intraparenquimatosa mediante DTC: OR 3,8%; IC 95% 0-7,5%, frente a EDCTC: OR 9,7%; IC 0-20,7%), sin que exista realmente un aumento significativo de las hemorragias sintomáticas, ya sea con DTC o con EDCTC (OR 2,99; IC 95% 0.44-3,60 p=0,67)51. Tampoco se encontraron grandes diferencias a favor del DTC o el EDCTC en cuanto a la tasa de recanalización obtenida tras la aplicación de ultrasonido51. La utilización de EP sin embargo, aumentó la tasa de recanalización arterial frente al uso de rtPA solo, sin aumentar de forma significativa las hemorragias intracraneales. No obstante, se trata de series pequeñas, por lo que sería necesario realizar estudios más amplios para establecer dichos riesgos.
El EDCTC en la valoración del sistema vertebrobasilarEl sistema vertebrobasilar suele ser menos accesible a la visualización con técnicas de ultrasonidos que la circulación anterior, muchas veces debido a la complexión del paciente, y otras a la imposibilidad de realizar un correcto seguimiento de los vasos debido a la tortuosidad de los mismos.
Desde hace décadas se ha demostrado que el EDCTC puede suponer una mejora respecto al DTC dado que los registros de las velocidades se consiguen bajo visualización directa, lo que asegura su veracidad52. Las diferentes publicaciones existentes coinciden en que es relativamente sencillo y fiable insonar ambas AV en sus segmentos V3 y V4, y los tercios proximal y medial de la arteria basilar (AB), aunque la visualización del tercio distal se consigue con menor frecuencia. Un interesante estudio ha comparado la longitud de la AB visualizada mediante EDCTC con la longitud de dicha arteria en un análisis posmortem, concluyendo que solo se consigue insonar de manera excepcional el tercio distal de la AB mediante EDCTC, muchas veces debido a su tortuosidad53.Para solucionar este problema, algunos autores proponen la utilización de EDCTC potenciado con EP, que ha demostrado un aumento de la sensibilidad para la valoración del flujo de la AB del 76,4 al 98,2%, sin aumento del riesgo para el paciente. De esta manera se incrementa considerablemente la correlación entre los hallazgos del EDCTC con EP y los obtenidos mediante arteriografía, confirmando que se trata de un método fiable y útil para el diagnóstico de estenosis y oclusiones de la AB20,54,55
EDCTC en la detección del cortocircuito derecha-izquierdaEn este momento, los estudios que han utilizado el EDCTC para establecer la detección de cortocircuito derecha-izquierda (CDI) son muy escasos, aunque es una técnica prometedora en este ámbito. Blersch et al. publicaron un estudio que incluyó a 40 pacientes que fueron sometidos a EDCTC con EP (Echovist®, compuesto por galactosa) y ecografía transesofágica (ETE) con el mismo EP, encontrando una sensibilidad para el diagnóstico de CDI del 91% y una especificidad del 88%. Estos datos muestran que el EDCTC podría ser comparable e incluso superior al DTC para la detección del CDI56.
El EDCTC en el ictus hemorrágico agudoLa posibilidad de visualizar en el mismo tiempo anatomía vascular, su circulación y el parénquima cerebral, ha permitido al ECDTC ser una técnica útil en el diagnóstico del ictus hemorrágico agudo, la monitorización de su evolución y la detección de malformaciones vasculares subyacentes.
EDCTC en la valoración del hematoma cerebralSeidel et al. observaron una alta sensibilidad (90%) y especificidad (97,4%) del EDCTC en la detección de transformación hemorrágica en aquellos pacientes con infarto cerebral, tanto en los que habían recibido trombólisis como los que no, y demostraron su aparición en las primeras 60 horas tras el inicio de los síntomas40. También se ha demostrado su validez en el diagnóstico y el seguimiento de la evolución de los hematomas intraparenquimatosos, con buena correlación con las imágenes obtenidas mediante TC craneal. Esto supone una ventaja para el seguimiento de los pacientes con hematoma cerebral, ya que podría evitar una radiación innecesaria en dicho seguimiento, ahorrando el traslado de los pacientes graves a la sala de radiología, pudiendo realizar esta técnica a pie de cama57,58.
EDCTC y valoración de vasoespasmo en la hemorragia subaracnoideaLa detección de vasoespasmo arterial es de especial interés para los pacientes que presenta una hemorragia subaracnoidea (HSA). Algunos autores sugieren que el EDCTC presenta una mayor sensibilidad frente al DTC para la detección de vasoespasmo en la ACM, no así en la ACA59,60.
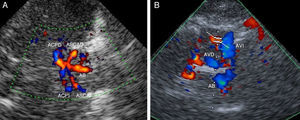
EDCTC y detección de malformaciones vascularesEl EDCTC, con y sin EP, ha sido utilizado recientemente en el diagnóstico de las malformaciones arteriovenosas cerebrales (MAV), tanto por la valoración de la imagen y el color que determina la dirección del flujo vascular como por la medida de diferentes parámetros hemodinámicos, demostrando su utilidad en el seguimiento tras la embolización de las MAV61–64. Así, mediante esta técnica es posible identificar los drenajes venosos de la fístula donde se encuentran incrementadas las velocidades pico sistólicas (VPS) del sistema venoso (VPS>50cm/seg). Además, tras la embolización de la MAV se puede detectar la reducción de la VPS de forma fiable63.
Otras aplicaciones del EDCTCExisten algunos trabajos que muestran la utilidad del ECDTC en la detección de estenosis de la ACI intracraneal65 y el diagnóstico del síndrome de hiperperfusión tras endarterectomía carotídea66. Probablemente, el EDCTC sea también útil en la detección de microembolias en los pacientes con ictus agudo y en la valoración de la reserva hemodinámica, aunque se requieren estudios que lo avalen.
ConclusiónEl EDCTC es una técnica sencilla, rápida, barata (comparada con otras técnicas de neuroimagen) y no invasiva para la valoración integral del paciente con ictus agudo, que proporciona información diagnóstica fiable cuando se realiza por expertos. La principal limitación del estudio es la ausencia de ventana acústica temporal o suboccipital, que puede ser eliminada mediante la aplicación de EP. Su principal ventaja respecto a otras técnicas ultrasonográficas es la posibilidad de observar la anatomía de los vasos sanguíneos y del parénquima cerebral, por lo que sus aplicaciones están experimentando una enorme expansión en la actualidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.