En la actualidad existe un importante número de opciones en terapias modificadoras de la enfermedad en esclerosis múltiple (EM), las cuales pueden ser categorizadas como de baja, moderada y alta eficacia según su capacidad para controlar la actividad de la enfermedad. Al existir pocos estudios comparativos entre terapias de alta eficacia (TAE), existe incertidumbre sobre cuál es el mejor momento para indicarlas o reemplazarlas.
ObjetivoAsistir a los médicos tratantes en la toma de decisiones sobre la elección y uso de terapias de alta eficacia, en diferentes escenarios frente a la persistencia de actividad, progresión de la discapacidad, presencia de factores de mal pronóstico o efectos adversos bajo tratamiento.
ComentariosUn grupo de neurólogos argentinos con experiencia en el manejo de pacientes con EM fue convocado para debatir e identificar opciones válidas para la estrategia de indicaciones y manejo de las TAE (cladribine, ocrelizumab, ofatumumab, natalizumab y alemtuzumab).
ConclusionesEste trabajo pretende servir de orientación para los médicos tratantes en caso de presentar dudas de manejo de TAE, de acuerdo con lo que harían en su consultorio referentes en manejo de la EM en Argentina.
There are currently a significant number of options for disease-modifying therapies in multiple sclerosis (MS), which can be categorized as low, moderate, or highly effective based on their ability to control disease activity. As there are few comparative studies between high-efficacy therapies (HET), there is uncertainty about the best time to indicate or replace them.
ObjectiveTo assist treating physicians in making decisions about the choice and use of highly effective therapies, in different scenarios regarding persistence of activity, progression of disability, presence of poor prognostic factors, or adverse effects under treatment.
CommentsA group of Argentine neurologists with experience in the management of patients with MS was convened to discuss and identify valid options for the strategy of indications and management of HETs (cladribine, ocrelizumab, ofatumumab, natalizumab, and alemtuzumab).
ConclusionsThis work aims to serve as a guide for treating physicians in case of doubts about the management of SAD, according to what they would do in their office referring to the management of MS in Argentina.
La esclerosis múltiple (EM) es una enfermedad autoinmune con una fisiopatología compleja, que incluye mecanismos inflamatorios y neurodegenerativos. El proceso inflamatorio agudo se manifiesta por el desarrollo de lesiones inflamatorias en el sistema nervioso central, evidenciables en la resonancia magnética por imágenes (RMI) y eventualmente por manifestaciones clínicas caracterizadas por exacerbaciones y remisiones de los síntomas. En forma paralela a la actividad inflamatoria aguda, se desarrolla desde el inicio de la enfermedad, un proceso neurodegenerativo, principal responsable de la progresión de la discapacidad1. De esta manera, se pueden configurar diversos fenotipos clínicos, considerando la presencia de actividad (recaídas, nuevas lesiones en RMI) y de progresión (medida fundamentalmente por el empeoramiento en la escala de discapacidad expandida [EDSS])2.
Considerando la actividad de la enfermedad medida por recaídas y desarrollo de nuevas lesiones, aumento del tamaño de lesiones en T2 o a la aparición de nuevas lesiones con realce, se puede identificar un subgrupo de pacientes que muestran una mayor predisposición a desarrollar una mayor actividad de la enfermedad durante el seguimiento. No existe una definición universal consensuada sobre alta actividad de la enfermedad, aunque sí existe acuerdo en considerar a los dos factores mencionados como principales marcadores3,4.
Desde la década de 1990 se dispone de una amplia variedad de terapias modificadoras de la enfermedad (TME), con diversos perfiles de eficacia y seguridad5. En los ensayos clínicos pivotales, la eficacia suele medirse usando la tasa anualizada de recaídas. La capacidad de modificar esta tasa nos permite clasificar los tratamientos en baja y alta eficacia, o en baja, moderada y alta eficacia. Los puntos de corte entre unas y otras no están universalmente consensuados, considerando incluso que probablemente existe cierta superposición en la eficacia comparativa de unas terapias con otras. La escasez de estudios comparativos directos dificulta la precisión de estas estimaciones. Sin embargo, diversas revisiones sistemáticas y metaanálisis en red permiten armar un orden de eficacia entre las alternativas terapéuticas6–9.
En la actualidad existen guías de práctica clínica y consensos formales sobre los lineamientos generales para plantear el inicio y cambio de TME en EM, sin embargo, las recomendaciones y la evidencia publicada es escasa como para asesorar al médico tratante en escenarios más específicos10–12.
ObjetivoEl objetivo de este trabajo es mostrar a los médicos tratantes las opciones que un grupo de expertos considerarían válidas en el uso de terapias de alta eficacia (TAE), en diferentes escenarios frente a la persistencia de actividad, progresión de la discapacidad, presencia de factores de mal pronóstico o efectos adversos bajo tratamiento.
MétodosUn grupo de 18 neurólogos argentinos con experiencia en el manejo de pacientes con EM fue convocado por uno de los autores (AB, jefe del Programa Provincial de Esclerosis Múltiple, Mendoza) para debatir e intentar dar respuesta a algunos de los interrogantes que surgen a partir de las decisiones diagnósticas a las que se somete el médico tratante a la hora de indicar terapias de alta eficacia. El criterio de selección de los especialistas invitados contempló el lugar de trabajo (centros asistenciales de referencia en el tratamiento de pacientes con EM), la trayectoria (años de experiencia en el manejo de la patología), las publicaciones en revistas nacionales e internacionales, participación en consensos argentinos de manejo de EM y la presencia en eventos científicos, que los posicionan como referentes de consulta por neurólogos de distintos puntos del país, asignándose para este grupo el nombre de Foro Argentino de Líderes de Opinión. Se realizó una ronda de preguntas que fueron respondidas en forma individual, en caso de acuerdo mayor a 60% la recomendación se consideraba válida. Aquellas respuestas que lograron un 40-60% de acuerdo fueron repetidas en una segunda ronda. Posteriormente se realizó una reunión plenaria para exponer los puntos a favor y en contra de aquellas decisiones que persistían en ese rango de acuerdo, y se procedió a una tercera ronda individual.
El presente documento no pretende el formato de consenso formal ni de guía de práctica, sino simplemente intentar buscar respuestas a interrogantes que se plantean con frecuencia en la práctica clínica. El nivel de evidencia que aportan estos comentarios es el de opinión de expertos. Para las definiciones de actividad y progresión de la enfermedad, factores pronósticos y falla terapéutica fueron considerados los consensos argentinos de manejo de EM y de falla terapéutica13,14. En la tabla 1 pueden verse las definiciones operativas consideradas para la discusión.
Definiciones operativas
| Actividad: recaídas, nuevas lesiones que captan contraste o en T2, o aumento de tamaño de lesiones T2 (definido por consenso argentino de falla terapéutica [14]). |
| Progresión: empeoramiento sostenido de la EDSS (durante al menos seis meses) en dos puntos si EDSS menor a 5,5, en 0,5 puntos si EDSS mayor o igual a 5,5 (definido por consenso argentino de falla terapéutica14). |
| Factores de mal pronóstico: edad mayor de 40, sexo masculino, lesiones medulares, bandas oligoclonales, ataques multifocales que incluyen afectación motora, cerebelosa, esfinteriana; alta frecuencia de las recaídas en los primeros 2-5 años, severidad de las recaídas, déficit residual luego de recaídas, recaídas que requieren internación o esteroides, afroamericanos –afrolatinoamericanos–, inicio progresivo, corto tiempo para llegar a EDSS 3 (antes de los cinco años), alta carga lesional T2 al inicio, más de dos lesiones con realce al inicio, presencia de black holes, atrofia discernible temprana, alta carga lesional infratentorial, comorbilidades (obesidad, tabaquismo, hipovitaminosis D), intervalo corto entre la primera y segunda recaídas, EDSS alto al momento del diagnóstico, déficit cognitivo temprano, afinamiento de capa de fibras nerviosas de la retina en tomografía de coherencia óptica13,15,16. |
EDSS: escala de discapacidad expandida.
Para la discusión solo se consideraron los perfiles de eficacia y seguridad de las TAE. No se tuvo en cuenta el costo ni el acceso a los tratamientos. Debe aclararse que en la elección de cada terapia es fundamental tener en cuenta diversas características particulares de cada paciente individual.
Comentarios¿Cuáles deberían ser consideradas TAE?Cien por ciento (100%) acordó que alemtuzumab, natalizumab, ocrelizumab, ofatumumab y cladribine pueden ser consideradas TAE. Si bien los moduladores S1P (fingolimod, siponimod, ozanimod) fueron superiores a comparadores activos en los ensayos clínicos, 72% del panel consideró que no reúnen criterios suficientes como para considerarse terapias de alta eficacia.
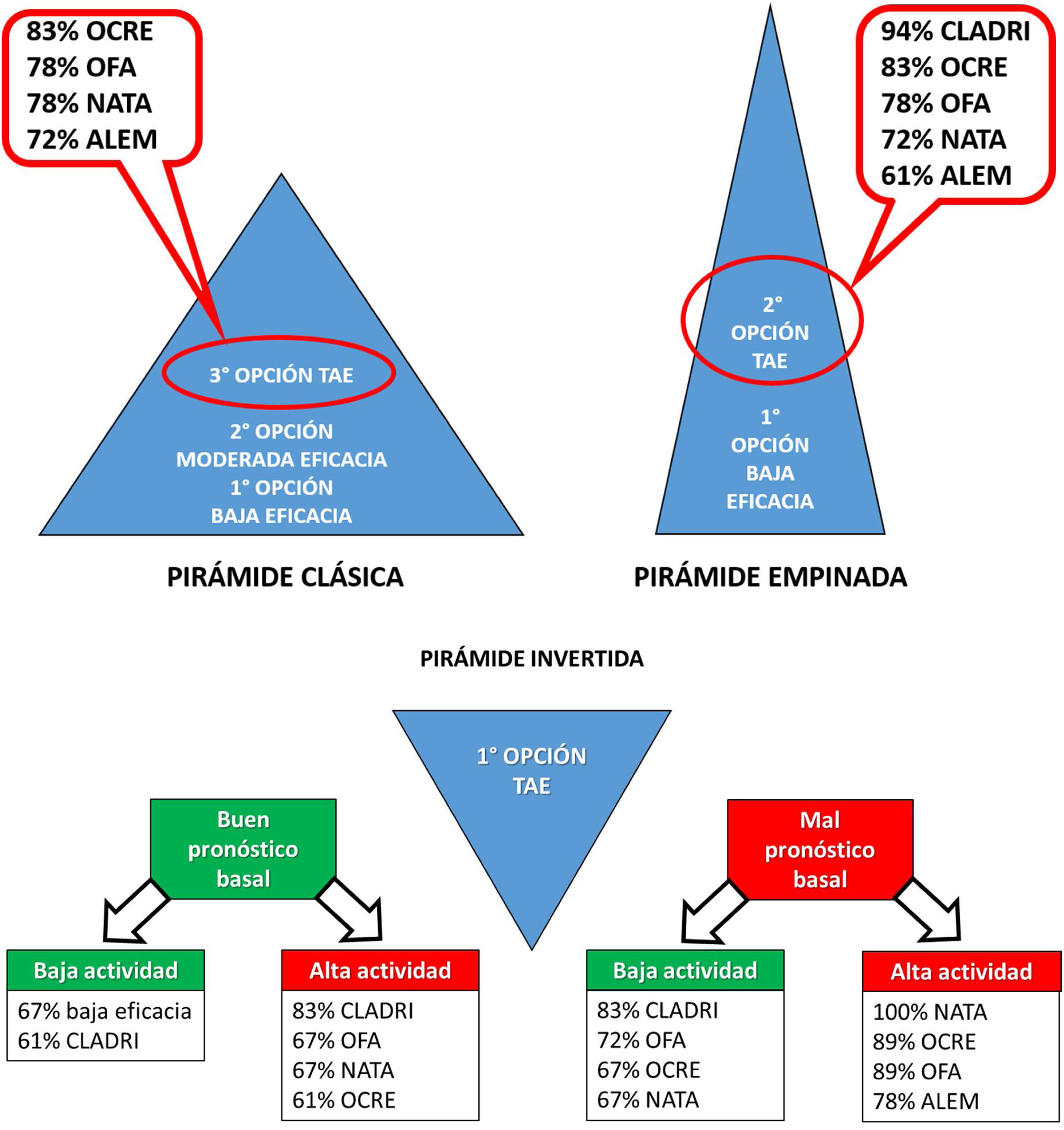
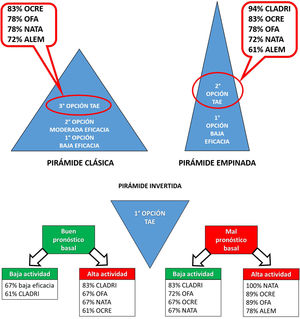
Indicaciones de TAEActualmente se plantean tres estrategias básicas de inicio de una TME: iniciar con una terapia de baja eficacia, si existe falla terapéutica escalar a una de mayor eficacia, y si persiste en falla volver a escalar a una TAE (pirámide clásica); otra es iniciar con una terapia de baja eficacia, y si existe falla indicar directamente una TAE (pirámide empinada); la tercera opción es iniciar directamente con una TAE (pirámide invertida). Para la adopción de esta última alternativa (en pacientes naive), se recomienda valorar previamente si el paciente tiene o no factores de mal pronóstico basales y si el debut es con alta o baja actividad17. Cabe mencionar que estudios recientes sugieren que el beneficio de la TAE se pierde cuando es utilizada como tercera opción en la pirámide clásica18. Las opciones que considerarían los especialistas del foro se muestran en la figura 1.
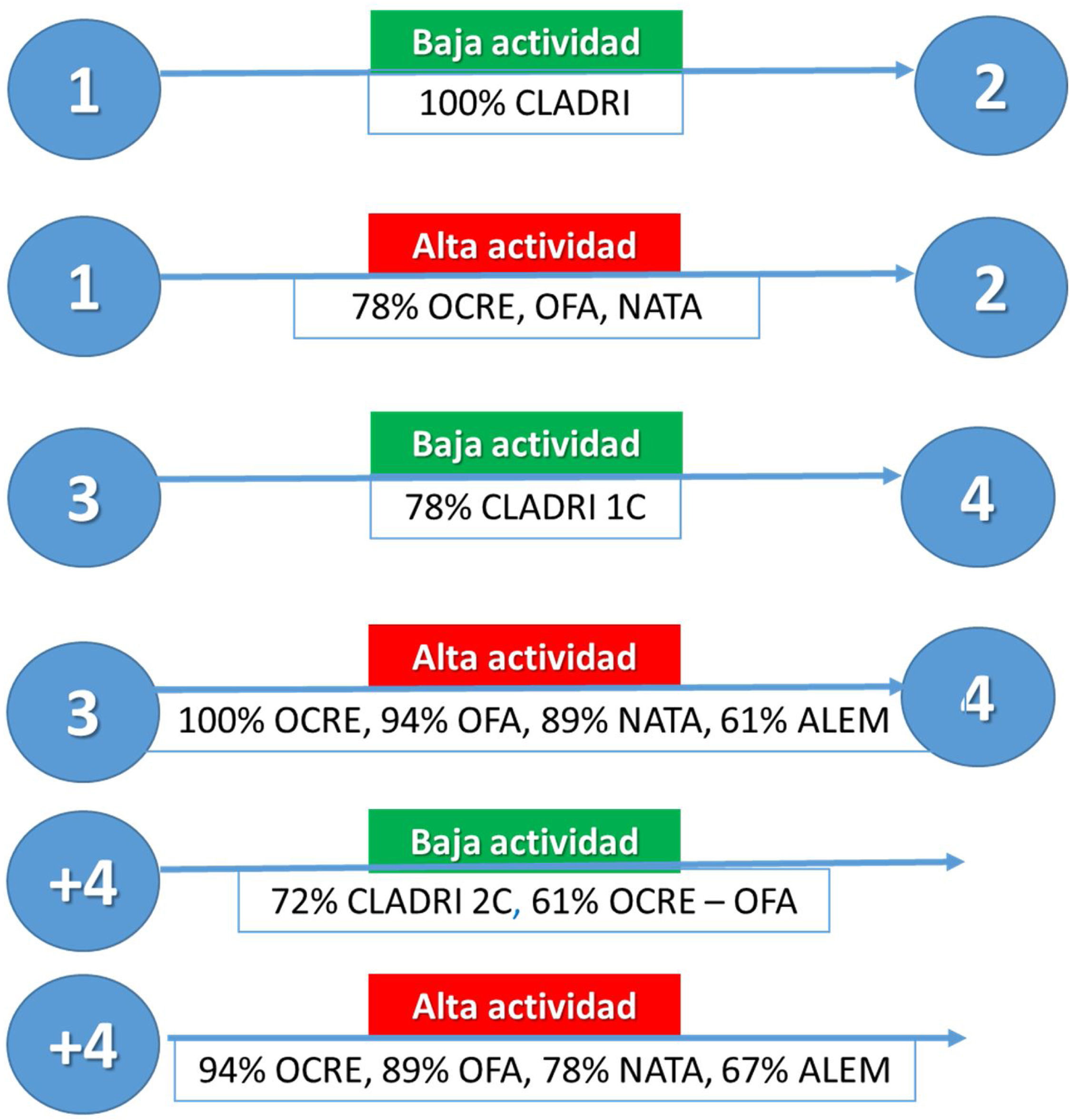
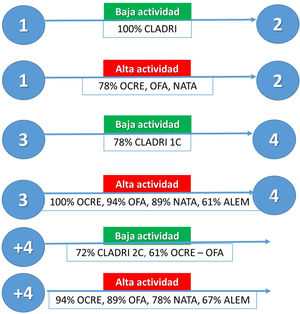
Estrategias en uso de cladribineLa dosis acumulada recomendada es de 3,5 mg/kg de peso corporal a lo largo de dos años, administrados en forma de un curso de tratamiento de 1,75 mg/kg por año. Cada curso de tratamiento consiste en dos semanas de tratamiento, una al inicio del primer mes y otra al inicio del segundo mes del año de tratamiento respectivo19. Se ha demostrado un beneficio sostenido hasta cuatro años del inicio del tratamiento, por lo que en ausencia de actividad no se considera el uso de otra terapia durante este periodo19. Sin embargo, existe la posibilidad de que el paciente presente actividad entre los ciclos 1 y 2, entre los años 3 y 4 postratamiento, y luego de los cuatro años. Se preguntó cuáles serían las opciones terapéuticas en caso de presentar actividad menor/igual (baja actividad) o mayor a la actividad pretratamiento (alta actividad). En la figura 2 se muestran las alternativas consideradas como válidas por los miembros del foro.
Alternativas de tratamiento en pacientes con actividad de la enfermedad durante y después del tratamiento.
Los círculos azules muestran el año de tratamiento. Se muestran las opciones que considerarían los miembros del foro que caso de aparecer actividad en los periodos correspondientes.
CLADRI: cladribina; OFA: ofatumumab; OCRE: ocrelizumab; NATA: natalizumab; ALEM: alemtuzumab. 1C: un ciclo. 2C: dos ciclos.
En el caso de que el paciente presente una infección oportunista severa luego de recibir el primer ciclo, 67% consideró el cambio de terapia a natalizumab como mejor alternativa. En el caso que el paciente presente progresión de la discapacidad sin actividad luego de recibir dos ciclos de cladribine, 72% consideró válido el inicio de tratamiento con ocrelizumab. Cabe aclarar que para esta última indicación no hay ensayos clínicos o estudios de vida real que demuestren su eficacia, y debería considerarse como una indicación off label. El criterio de validez discutido por los autores tuvo relación con la eficacia demostrada de ocrelizumab sobre progresión de la discapacidad en pacientes con EM primaria progresiva (EMPP).
Estrategias en uso de terapias anti-CD20Las dos alternativas aprobadas para EM son ocrelizumab y ofatumumab. Ocrelizumab se administra en forma endovenosa cada seis meses y ofatumumab en forma subcutánea en forma mensual20,21. Al tratarse de un anticuerpo monoclonal humano, ofatumumab se asocia a menor tasa de reacciones adversas durante su administración22.
Rituximab no está aprobado por ningún ente regulatorio (Administración Nacional de Medicamentos, Alimentos y Tecnología Médica [ANMAT], Agencia Europea de Medicamentos [EMA] y la Administración de Alimentos y Medicamentos [FDA]) para tratar EM, y los ensayos clínicos fase III tanto en esclerosis múltiple recaídas remisiones como en EMPP no cumplieron con los objetivos propuestos23,24. Sin embargo, diversos estudios prospectivos poblacionales en vida real y ensayos abiertos mostraron cierto beneficio clínico en ambos fenotipos25–27. El uso de rixutimab podría considerarse excepcionalmente en EM altamente activa, con factores de mal pronóstico, o falla a terapias de eficacia baja o moderada, solamente cuando no se dispone de otras alternativas de alta eficacia, o mientras se espera la provisión de otra TAE. Ochenta y tres por ciento (83%) consideró que podría utilizarse esta terapia en la misma situación en pacientes con EMPP.
En la tabla 2 se pueden comparar las opciones consideradas como válidas en diferentes escenarios para ocrelizumab y ofatumumab.
Comparación en estrategias consideradas como válidas en diferentes escenarios para terapias anti-CD20 aprobadas
| Ocrelizumab | Ofatumumab | |
|---|---|---|
| Actividad menor o similar a pretratamiento | 67% mantener ocrelizumab | 61% mantener ofatumumab |
| Actividad mayor a pretratamiento | 95% cambiar a alemtuzumab78% cambiar a natalizumab | 83% cambiar a alemtuzumab83% cambiar a natalizumab |
| Infección oportunista severa | 67% cambiar a natalizumab | 61% cambiar a natalizumab |
| Progresión de la EDSS sin actividad | 72% mantener ocrelizumab(61% solo si la EDSS es menor a 7) | 89% suspender ofatumumab |
| No evidencia de actividad de la enfermedad por más de dos años | 83% mantener ocrelizumab | 78% mantener ofatumumab |
| Reacciones severas de infusión | 83% cambiar a cladribine61% cambiar a ofatumumab | - |
Los porcentajes expresan la proporción de miembros del foro que consideraría válida cada alternativa (solo se incluyen los valores mayores a 60%).
EDSS: escala de discapacidad expandida.
Natalizumab es una terapia que limita el paso del linfocito a través de la barrera hematoencefálica, que se administra por prospecto en forma mensual27. Un efecto adverso a considerar especialmente es el desarrollo de leucoencefalopatía multifocal progresiva (LMP), razón por la cual existen protocolos de reducción de riesgos28. Recientes estudios muestran que luego de cierto periodo podría considerarse el uso de intervalo de dosis extendida cada seis semanas para mitigar este riesgo, sin comprometer la eficacia29.
En pacientes que están bajo tratamiento con natalizumab y presentan actividad similar a o menor a la del pretratamiento, 78% consideraría válido el cambio a ocrelizumab. En esta situación, menos de 60% de los autores consideró válido mantener natalizumab; la razón argumentada es que la presencia de cualquier actividad en un paciente que recibe adecuadamente natalizumab podría ser considerado como falla. En caso de presentar una actividad mayor a la del pretratamiento, la opción más considerada es alemtuzumab (78%), seguida de ocrelizumab (72%) y ofatumumab (61%). Ochenta y tres por ciento (83%) consideraría cambiar de terapia si el riesgo de LMP es mayor a 1/1.000, y entre las opciones la más elegida fue ofatumumab (89%), seguida de ocrelizumab (83%) y cladribine (73%); 61% pasaría a intervalo de dosis extendida si el paciente se encuentra en no evidencia de actividad de la enfermedad por más de 12 meses. Si el paciente presenta una progresión sostenida de la EDSS sin actividad, 67% consideraría el cambio a ocrelizumab. En este caso, cabe el mismo comentario que en el apartado de cladribine: no hay ensayos clínicos o estudios de vida real que demuestren la eficacia de ocrelizumab en este contexto, y debería considerarse como una indicación off label.
Estrategias de manejo de alemtuzumabAlemtuzumab es un anticuerpo anti-CD52, que se administra en dos ciclos separados por un año. El prospecto contempla la posibilidad de repetir un tercer y cuarto ciclo en caso de ser necesario30. En 2019, la EMA recomendó restringir su uso para EM tras haber recibido informes de efectos adversos raros pero graves, incluidas muertes. Asimismo, se recomendó que se tomaran nuevas medidas para identificar y gestionar los efectos adversos graves31. Esta recomendación condicionó la selección actual de pacientes para 56% de los miembros del foro.
En pacientes que recibieron el primer ciclo y persisten con actividad, 94% continuaría con el segundo ciclo si es similar o menor a la del pretratamiento, y 67% si es mayor. Si el paciente presenta actividad luego del segundo ciclo, 83% haría un tercer ciclo si la actividad es similar o menor a la presentada antes de iniciar el tratamiento, mientras que se cambiaría a ocrelizumab (72%) o natalizumab (61%) si la actividad es mayor.
Si el paciente presentó una infección oportunista severa luego del primer ciclo, 94% repetiría el segundo luego de hacer una consulta con especialista en infectología para organizar una estrategia de reducción de riesgos de infección, 61% consideraría también como válido rotar a natalizumab. En pacientes que presentaron reacciones severas de infusión (reacción por liberación de citocinas, reacciones anafilácticas), 72% consideró rotar a ocrelizumab u ofatumumab. No se llegó a ningún acuerdo que alcance 60% en la situación de que el paciente presente una progresión sostenida de la discapacidad sin evidencia de actividad luego de recibir el segundo ciclo.
Comentarios finalesEste trabajo pretende mostrar la complejidad del manejo de las TAE en pacientes con EM, y servir de orientación para los médicos tratantes en caso de presentar dudas de manejo, de acuerdo con lo que harían en su consultorio 18 neurólogos referentes del ámbito público y privado de distintos lugares de la Argentina. Es necesario enfatizar, más allá de las alternativas propuestas, la importancia de la terapia individualizada considerando no solo la actividad de la enfermedad, sino las características del sistema de salud, así como de las preferencias y expectativas del paciente.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflictos de interésAB ha recibido honorarios y becas por asesoramiento, capacitación e investigación de Novartis, Sanofi, Roche, Teva, Biogen, Merck, BMS, Synthon-Bagó y Gador. JC en los últimos años ha recibido compensación económica por presentaciones académicas, participación en consejos de asesoramiento, y asistencia para concurrencia a congresos de Biogen, Merck, Novartis, Roche, Bayer, Sanofi-Genzyme, Gador, Raffo, Bristol-Myers Squibb, Janssen. RA: retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Genzyme, Merck, Novartis, Scienza Uruguay, Bristol-Myers Squibb, Janssen y Roche, apoyo económico para investigación de LACTRIMS y Gobierno de la Ciudad de Buenos Aires. MB: Biogen, Novartis, Merck, Synthon-Bagó, Osmotica, Sanofi, Roche, Novartis, Teva, Gador. FC ha recibido retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y becas de viajes a congresos de Biogen, Sanofi-Genzyme, Merck-Serono, Teva, Novartis y Roche. ECC ha recibido retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes companías farmacéuticas: Biogen, Bayer, Genzyme, Merck, Novartis, Raffo (área eculizumab), Teva y Roche, apoyo económico para investigación de LACTRIMS, The Guthy-Jackson Charitable Foundation y Harvard Medical School (Clinical Research Program). EC: Merck, Biogen, Sanofi, Roche, Janssen y Novartis. JIR ha recibido honorarios en conceptos de presentaciones educativas de Biogen, Genzyme, Merck, Novartis. OG: retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes companías farmacéuticas: Teva, Biogen, Synthon-Bagó, Merck, Tuteur, Novartis, BioSidus, Raffo, Genzyme, Roche y Bristol-Myers Squibb. LP: Merck, Novartis, Sanofi-Genzyme, Roche, Biogen (viajes a congresos, conferencias, advisory board). RP: Sanofi-Genzyme, Roche, Novartis, Teva, Biogen, Merck, Synthon-Bagó, Biosidus. BS: retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Biosidus, Bristol-Myers Squibb, Genzyme, Novartis, Merck, Roche y Teva. VS ha colaborado en asesorías, recibido grants de investigación, becas de viajes a congresos y honorarios por asesoría y como disertante de parte de AstraZeneca, Bagó, Bayer, Biogen, Biosidus, Bristol-Myers Squibb, Gador, Genzyme, Merck, Novartis, Raffo, Roche, Tecnofarma/Adium, Teva y Tuteur. MCY: Merck, Biogen, Genzyme Argentina, Bayer Inc., Novartis Argentina, Roche y Teva Argentina. El resto de los autores no declara conflictos de interés.