Las demencias rápidamente progresivas (DRP) se manifiestan con deterioro cognitivo agudo/subagudo. Sin demencia, deberían denominarse como deterioro cognitivo rápidamente evolutivo (DCRE). Siendo el mismo, un cuadro multifactorial que presenta un subgrupo de etiologías potencialmente reversibles con tratamiento precoz. Son escasas las publicaciones de series de casos; esta información es necesaria a los fines de organizar los sistemas de salud.
ObjetivosCaracterizar a los pacientes con DCRE en un centro de alta complejidad, describiendo sus causas. Comparar de acuerdo con los datos obtenidos el subgrupo de pacientes con DCRE probablemente autoinmune (DCRE-AI) y los no autoinmunes (DCRE-nAI). Realizar recomendaciones para la práctica clínica basados en los resultados obtenidos.
MétodosSe realizó un estudio observacional analítico de corte transversal sobre una base de datos de consultas neurológicas realizadas por el servicio de neurología. Se seleccionó de forma retrospectiva a todos los pacientes que cumplieran los criterios para DCRE (1 de diciembre del 2009-1 de junio del 2016). Se subdividió a los pacientes en: DCRE-nAI y DCRE-AI.
ResultadosSobre 4.545 consultas, 50 pacientes cumplieron criterios de DCRE. El 72% (N = 36) eran hombres, con una edad media de 60,66 ± 18,31 años. La mediana del tiempo de inicio de los síntomas fue 8,97 (1-24,67) meses y del tiempo de diagnóstico de demencia de 7,52 (0,73-22,1) meses. Las etiologías más frecuentes fueron: neurodegenerativas y autoinmunes. Se realizó biopsia cerebral en el 20% del total de la muestra. Comparando DCRE-AI y DCRE-nAI, se vieron diferencias estadísticamente significativas en la presencia de síntomas psiquiátricos (100% vs. 67%, p = 0,004), necesidad de neurolépticos al ingreso (56% vs. 44%, p = 0,045) y la edad al diagnóstico (50,50 vs. 64,97 años, p = 0,012). No se encontraron diferencias estadísticamente significativas en otras variables.
ConclusionesEn nuestra muestra, las etiologías neurodegenerativas y autoinmunes fueron las más frecuentes. Los criterios diagnósticos para DCRE-AI fueron recientemente publicados; en nuestro estudio, la edad de presentación y los síntomas psiquiátricos ayudaron al diagnóstico diferencial.
Rapidly progressive dementia (RDP) can display acute/subacute cognitive decline. When dementia does not occur, it should be referred as rapidly progressive cognitive impairment (RPCI). Although it has multiple causes, there are potentially reversible etiologies that require prompt treatment. There are few published case series, this information is useful and necessary in order to plan and allocate healthcare resources.
ObjectivesCharacterize patients with RPCI at our center describing their etiology. According to the results obtained, compare the subgroup of patients with probable autoimmune RPCI (RPCI-AI) from those with no autoimmune etiology (RPCI-nAI). Suggest recommendations for the clinical practice.
MethodsAn analytical observational cross-sectional study was performed with the information obtained from patients referred to the neurology department. Patients with criteria for RPCI were retrospectively included during 1/12/2009-1/06/2016. Patients were divided in two groups: RPCI-AI and RPCI-nAI. We compared baseline clinical, complementary exams, MRI and serologic characteristics between groups.
Results50 patients over a total of 4545 meet the RPCI criteria. 72% (N=36) were men, mean age 60.66±18.31. The median for the time of evolution of symptoms was 8.97 (1-24.67) months and for the time of diagnosis of dementia/cognitive impairment 7.52 (0.73-22.1) months. The most frequent etiologies were: Neurodegenerative and Autoinmune. Brain biopsy was performed in 20% of the total sample. When comparing RPCI-AI and RPCI-nAI statistical significant differences were observed in the presence of psychiatric symptoms (100% vs 67%, P=.004), requirement of neuroleptics (56% vs 44%, P=.045) and age (50.50 vs 64.97, P=.012). There were no statistical differences in the other variables studied.
ConclusionsIn our study, neurodegenerative and autoimmune etiologies were more frequent. Recent publications proposed criteria for RPCI-AI, in our sample age of presentation and psyquiatric features helped in the differential diagnosis.
En las últimas décadas, con el descubrimiento de nuevas tecnologías, herramientas diagnósticas y posibilidades terapéuticas, ha aumentado la expectativa de vida de la población en general. Un estudio realizado por las Naciones Unidas revela que entre los años 1980 y 2025 la población general crecerá un 14,7%, mientras que los mayores de 60 años lo hará en un 76%1. Esto implica que patologías antes poco prevalentes tengan un impacto social, económico y sanitario de mayor relevancia. Entre ellas, debemos de mencionar las demencias.
Los datos acerca de la prevalencia de la enfermedad de Alzheimer (EA) a nivel mundial son muy variables. En nuestro país, se han registrado 37.500.000 habitantes en el último censo, de los cuales 4.700.000 son mayores de 60 años. Si se realiza una comparación entre los datos de 1970 y 2010, se observa un aumento de la población mayor de 65 años del 7 al 10,2% y de la población mayor de 85 años de un 1 a un 2,5%. En Argentina, el 23% de los pacientes mayores de 60 años presentaba deterioro cognitivo2.
En función de los datos censales, se puede estimar que aproximadamente de 480.000 a 500.000 personas en nuestro país tienen demencia. Probablemente, esta cifra no refleje con exactitud el número real de esta patología2.
El término demencia no hace referencia a una enfermedad en particular. Incluye a un sinfín de patologías que fueron definidas como aquellas que producen déficit en la memoria y 2 o más dominios cognitivos con compromiso de las actividades básicas de la vida diaria. La causa más frecuente en la actualidad es la EA3, seguida por la demencia vascular (DV) y la enfermedad por cuerpos de Lewy4.
Si bien las demencias antes mencionadas suelen tener un curso lentamente progresivo, existen otros cuadros, que presentan una evolución más rápida, con un franco deterioro a nivel cognitivo, conductual y/o psiquiátrico, que representan un verdadero desafío diagnóstico, ya que algunas de ellas pueden ser potencialmente tratables, reduciendo su morbimortalidad, impacto social y familiar5.
Se define como demencia rápidamente progresiva (DRP) a toda afección que produce un declive de las funciones cognitivas de manera aguda o subaguda, con compromiso de las actividades básicas de la vida diaria. No obstante ello, deberá considerarse que, en ocasiones, una detección precoz puede permitir el diagnóstico en estadios en los que el deterioro cognitivo no configura el diagnóstico de demencia. En este caso se deberá incluir el concepto de deterioro cognitivo rápidamente evolutivo (DCRE).
El tiempo para considerar una DRP o un DCRE como rápidamente evolutivos es variable entre los diversos autores, aceptándose en algunos casos una evolución no superior a 2 años6. Sus etiologías son múltiples, entre las que se pueden mencionar a la enfermedad priónica de Creutzfeldt-Jakob (CJD) y es sobre esta entidad que la mayoría de los artículos de DRP se encuentran basados7. Otras causas no priónicas de DRP incluyen, entre otras, causas toxicometabólicas, vasculares, neoplásicas, inflamatorias, nutricionales e infecciosas8. La etiología neurodegenerativa también fue citada dentro de las causas de DRP7.
La ausencia de datos sobre incidencia y/o prevalencia de DRP/DCRE y su multicausalidad plantean un desafío para los estudios epidemiológicos, siendo imprescindible definir la metodología adecuada para evitar la inclusión de factores confundidores, como lo serian los síndromes confusionales o pacientes críticos9.
Estos estudios constituyen el primer paso necesario para identificar las causas tratables y evitar los efectos deletéreos que causas potencialmente reversibles puede ocasionar en los individuos afectados, así como el impacto social, económico y en términos de salud pública. El conocimiento creciente de las encefalopatías autoinmunes abre el abanico de posibilidades diagnósticas y un mejor entendimiento de DRP/DCRE, anteriormente considerados como de causa indeterminada5,10.
Objetivo- 1.
Caracterizar a los pacientes con DCRE en un centro de alta complejidad de CABA, para identificar las principales causas subyacentes.
- 2.
Comparar las características clínicas y los datos obtenidos de estudios complementarios entre los pacientes con alta sospecha de DCRE de etiología probablemente autoinmune y los pacientes cuya etiología no se sospecha un origen inmunomediado.
- 3.
Realizar recomendaciones para la práctica clínica basados en los resultados obtenidos.
Se realizó un estudio observacional analítico de corte transversal sobre una base de datos de consultas neurológicas realizadas por el servicio de neurología. Se seleccionó de forma retrospectiva a todos los pacientes que cumplieran los criterios para DCRE que fueron evaluados por el servicio de neurología general entre los meses de diciembre del 2009 y junio del 2016. De un total de 4.545 pacientes que fueron internados por diversas patologías neurológicas en el periodo estudiado, un total de 50 pacientes presentaban criterios de DCRE.
La institución presenta diversas áreas de admisión de pacientes, la guardia ambulatoria, la guardia de emergencias, los consultorios externos, la demanda espontánea y las unidades cerradas que pueden recibir derivaciones de otros centros.
Se recabó información acerca de las consultas recibidas de las diversas áreas de la institución por diversos motivos neurológicos, haciendo especial hincapié en las consultas por trastornos de la memoria, trastornos psiquiátricos y/o déficits conductuales, síndrome confusional, sospecha de encefalitis, convulsiones, status convulsivo y de origen no convulsivo. Los pacientes fueron evaluados caso por caso según la práctica clínica habitual.
Definición operativa de las variables estudiadas- –
DCRE: DCRE de más de un mes y menos de 2 años de evolución7.
- –
Síndrome confusional agudo: cuadro de inicio agudo caracterizado por déficit de los procesos atencionales que presenta un carácter fluctuante y puede acompañarse de síntomas de agitación psicomotora y alucinaciones visuales. Una vez resuelta la causa que lo desencadena, suele el individuo volver a su estado habitual11.
- –
EA: se realizó el diagnóstico siguiendo los criterios propuestos por el NINCDS-ADRA3.
- –
Demencia por cuerpos de Lewy: de realizó el diagnostico según lo detallado en el International consortium on Dementia With Lewy Bodies12.
- –
DV: se consideró en los pacientes que cumplieran los criterios NINDS-AIREN13.
- –
Demencia frontotemporal (DFT): se siguieron los criterios de Lund y Manchester14.
- –
Epilepsia: se utilizó la definición actualizada propuesta por la ILAE15.
- –
Estado de mal epiléptico convulsivo (EMEC): se utilizó la definición actualizada propuesta por la ILAE16.
- –
Estado de mal epiléptico no convulsivo (EMEnC): se define como el resultado de convulsiones prolongadas que se manifiestan como cambios en el estado mental17.
- –
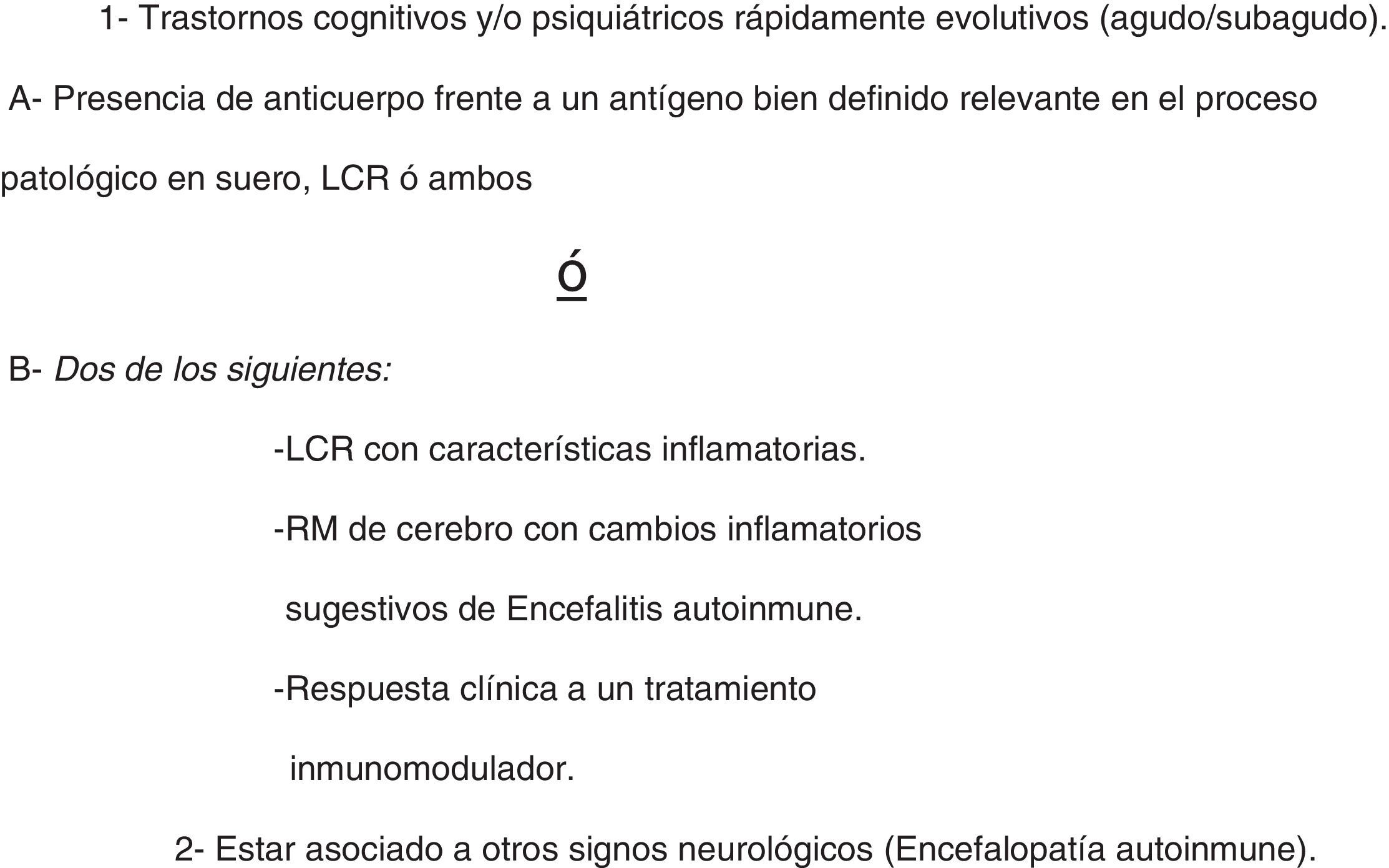
DCRE de probable origen autoinmune (DCRE PAI): trastornos cognitivos y o psiquiátricos rápidamente evolutivos (agudo/subagudo). Presencia de anticuerpos (Ac) frente a un antígeno bien definido relevante en el proceso y/o respuesta clínica a un tratamiento inmunomodulador. Estudios de neuroimágenes y/o líquido cefalorraquídeo (LCR) con características inflamatorias. Puede estar asociado a otros signos neurológicos (encefalitis autoinmune). Puede llamarse también como demencia autoinmune (fig. 1).
- –
Leucocitosis: aumento de recuento de glóbulos blancos > 12.000mm3.
- –
Pleocitosis: más de 5 leucocitos por mm3 en la muestra de LCR.
- –
Hiperproteinorraquia: aumento de la concentración de proteínas en LCR > 40mg %.
- –
Glucorraquia: concentración de glucosa en LCR expresado en mg %.
- –
Hipertensión arterial: se tomaron los criterios de la Sociedad Europea de Hipertensión Arterial18.
- –
Diabetes: se tomó como referencia la definición de la Organización Mundial de la Salud19.
- –
Tabaquismo: criterios según guía de práctica clínica nacional de tratamiento de la adicción al tabaco20.
- –
Parkinsonismo: se utilizó la clasificación clínica propuesta por Bradley4.
- –
Demencia postraumática: cuadro demencial que se considera la consecuencia fisiopatológica directa del trauma21.
- –
Múltiples causas de demencia: 2 o más causas de demencia concomitantes en el paciente.
- –
Otras causas: causas de etiología no aclarada.
- –
Demencia asociada al HIV (DHIV): según los criterios propuestos por el manual DSM-IV21.
- –
Tiempo de evolución de la enfermedad: tiempo transcurrido en meses desde el primer síntoma referido por la familia o el paciente y su consulta al hospital.
- –
Tiempo de diagnóstico de demencia/deterioro cognitivo: tiempo de evolución hasta el diagnóstico de demencia.
- –
Síntomas psiquiátricos: se consideraron los cuadros con síntomas psicóticos principalmente.
- –
Síntomas conductuales: se consideraron los síntomas de agresividad, apatía, abulia y otros trastornos del comportamiento.
- –
Panel de encefalitis autoinmune: todos los AC fueron analizados a través de un panel de Ac IgG antiantígenos neuronales asociados a encefalitis autoinmunes. El material analizado fue suero y/o LCR. El método fue inmunofluorescencia indirecta (sustrato: células transfectadas). Dicho panel incluyó Ac anti-N-metil-D-aspartato (NMDA), anti-AMPA, anti-CASPR2, anti-LGL1 y anti-GABA receptores.
Fueron incluidos en el trabajo los pacientes mayores de 18 años que cumplieran con los criterios de DCRE propuestos. Se excluyeron los síndromes confusionales, el diagnóstico previo de demencia, la ausencia de al menos un estudio por imágenes de SNC y las infecciones agudas del SNC (encefalitis virales, meningitis bacteriana).
Categorización de los pacientesCon los datos obtenidos, los pacientes se dividieron según la causa más probable del DCRE: neurodegenerativas, toxicometabólicas, DFT, DHIV, infecciones no relacionadas con el HIV, múltiples causas, DCRE-AI y otras causas. En un segundo paso, se subdividió a estos grupos en DCRE no autoinmunes (DCRE-nAI) y DCRE-AI (fig. 1).
Parámetros clínicos/investigacionesSe recabaron datos demográficos, como edad y sexo, antecedentes personales, heredofamiliares y tóxicos, medicación habitual, tiempo de inicio de los síntomas, tiempo del diagnóstico de demencia/deterioro cognitivo y tiempo de internación. Se realizó evaluación neurológica en todos los pacientes por un grupo de neurólogos, así como su seguimiento durante toda la internación. Ante estos casos, se planteó estudio con laboratorio con incluía hemograma, ionograma, calcio, fósforo, magnesio, hepatograma, urea, creatinina, TSH, Ac anti-TPO, Ac antitiroglobulina, eritrosedimentación (ERS), proteína C reactiva (PCR), vitamina B12, ácido fólico, vitamina D, HIV, VDRL como estudio de laboratorio con perfil cognitivo agregando marcadores inmunológicos sistémicos, como FAN, ANCAp, ANCAc, anti-Ro, anti-La, así como marcadores onconeuronales (Ac anti-HU, Ac anti-Yo, Ac anti-Ri). De no presentar contraindicaciones22 o por negativa de la familia, se realizó una punción lumbar (PL) con estudio de fisicoquímico, cultivos y, en algunas ocasiones, citometría de flujo y cultivo de hongos y micobacterias de acuerdo con la sospecha clínica. Estudios por imágenes del SNC. Además, se realizaron electroencefalogramas (EEG) a todo paciente con DCRE a fin de descartar EMEnC y búsqueda de neoplasia oculta. Se incluyeron datos acerca de las evaluaciones cognitivas realizadas y otros estudios complementarios previos a su ingreso (TC por emisión de positrones). Asimismo, se realizó biopsia de SNC (BSNC) en pacientes con lesión ocupante de espacio (LOE) y en aquellos en los que los exámenes complementarios realizados no permitiesen concluir un diagnóstico. Por último, se evaluó a los pacientes que recibieron tratamiento inmunomodulador.
Estudios por imágenesEn todos los casos, de no presentar contraindicación, se realizó resonancia magnética (RM) de encéfalo con gadolinio23,24. De acuerdo con el patrón imagenológico, se asignaron 2 grupos: a) pacientes con patrón característico de CJD en secuencias DWI/FLAIR25,26, y b) pacientes con ausencia de dicho patrón. Los estudios fueron interpretados por médicos especialistas en diagnóstico por imágenes.
EstadísticaSe obtuvieron las medias y las desviaciones estándar para las variables cuantitativas y la distribución de frecuencias para las cualitativas. Se realizó estadística paramétrica (test de Student) y testeos no paramétricos (Mann-Whitney), según correspondió. En aquellos datos con distribución de modo a la izquierda se realizó una transformación a logarítmica normal para la utilización de test paramétricos. El test de la chi al cuadrado, con correcciones de Fisher, fue realizado para aquellas variables dicotómicas. Se empleó el paquete estadístico SPSS considerando valores estadísticamente significativos aquellos con p < 0,05.
Este estudio fue realizado acorde con la normativa de las buenas prácticas clínicas de la ICH, última revisión de 1964 de la Declaración de Helsinki. Debido al diseño del mismo, no se ha requerido la aprobación explícita de un comité ético de investigación científica, aunque se ha respetado escrupulosamente en todo momento la confidencialidad de los datos utilizados, de manera que se garantizase el anonimato de los pacientes. Para ello, los datos se han volcado de una vez en la base de datos, sin contener identificadores directos de su correspondencia con los pacientes.
ResultadosCaracterísticas clínicas y presentaciónSobre un total de 4.545 pacientes evaluados por diversas patologías (ataque cerebrovascular, epilepsia, cefalea, entre otras) por el servicio de neurología en el periodo comprendido entre el 1 de diciembre del 2009 y el 1 de junio del 2016, se identificó a un total de 50 pacientes con criterios de DCRE. La probabilidad de aparición de DCRE fue de 1,1 en nuestra población de pacientes. De los 50 pacientes, el 72% eran hombres (N = 36) y el 28% mujeres (N = 14), con una edad media de 60,66 ± 18,31 años al ingreso. La mediana con respecto al tiempo de inicio de los síntomas fue de 8,97 (mínimo: 1-máximo: 24,67) meses. El tiempo de diagnóstico de demencia/deterioro cognitivo fue 7,52 (0,73-22,1) meses. La totalidad de días de internación fue 7 (2-346) días. El 16% de los pacientes (N= 8) fallecieron con una mediana de 34 (1-75) días. El 86% de los pacientes (N = 43) fueron ingresados por causas neurológicas, el 14% restante (N = 7) se solicitó consulta después de su internación en otras áreas del Sanatorio (véase la tabla 1). La totalidad de los pacientes se encontraban en seguimiento conjunto con clínica médica y el departamento de neurología.
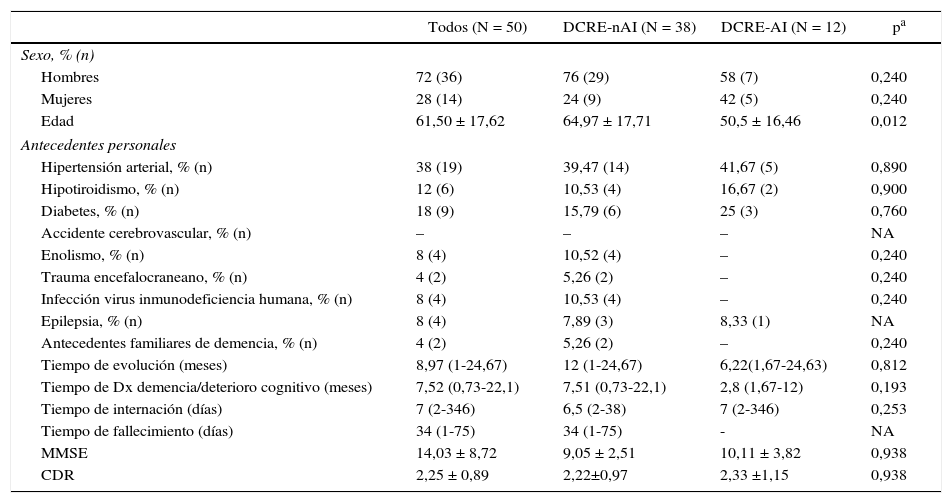
Variables demográficas, evolutivas y cognitivas en los pacientes con demencia rápidamente progresivas, DCRE no autoinmune y DCRE probablemente autoinmune
| Todos (N = 50) | DCRE-nAI (N = 38) | DCRE-AI (N = 12) | pa | |
|---|---|---|---|---|
| Sexo, % (n) | ||||
| Hombres | 72 (36) | 76 (29) | 58 (7) | 0,240 |
| Mujeres | 28 (14) | 24 (9) | 42 (5) | 0,240 |
| Edad | 61,50 ± 17,62 | 64,97 ± 17,71 | 50,5 ± 16,46 | 0,012 |
| Antecedentes personales | ||||
| Hipertensión arterial, % (n) | 38 (19) | 39,47 (14) | 41,67 (5) | 0,890 |
| Hipotiroidismo, % (n) | 12 (6) | 10,53 (4) | 16,67 (2) | 0,900 |
| Diabetes, % (n) | 18 (9) | 15,79 (6) | 25 (3) | 0,760 |
| Accidente cerebrovascular, % (n) | – | – | – | NA |
| Enolismo, % (n) | 8 (4) | 10,52 (4) | – | 0,240 |
| Trauma encefalocraneano, % (n) | 4 (2) | 5,26 (2) | – | 0,240 |
| Infección virus inmunodeficiencia humana, % (n) | 8 (4) | 10,53 (4) | – | 0,240 |
| Epilepsia, % (n) | 8 (4) | 7,89 (3) | 8,33 (1) | NA |
| Antecedentes familiares de demencia, % (n) | 4 (2) | 5,26 (2) | – | 0,240 |
| Tiempo de evolución (meses) | 8,97 (1-24,67) | 12 (1-24,67) | 6,22(1,67-24,63) | 0,812 |
| Tiempo de Dx demencia/deterioro cognitivo (meses) | 7,52 (0,73-22,1) | 7,51 (0,73-22,1) | 2,8 (1,67-12) | 0,193 |
| Tiempo de internación (días) | 7 (2-346) | 6,5 (2-38) | 7 (2-346) | 0,253 |
| Tiempo de fallecimiento (días) | 34 (1-75) | 34 (1-75) | - | NA |
| MMSE | 14,03 ± 8,72 | 9,05 ± 2,51 | 10,11 ± 3,82 | 0,938 |
| CDR | 2,25 ± 0,89 | 2,22±0,97 | 2,33 ±1,15 | 0,938 |
Datos expresados en media: n ± desviación estándar y mediana: n (mínimo-máximo).
AI: autoinmune; CDR: Clinical Dementia Rating score (0-3); DCRE: deterioro cognitivo rápidamente evolutivo; DX: diagnóstico; MMSE- Mini-mental State Examination (0-30); NA: no aplicable; nAI: no autoinmune.
En la evaluación neurológica al ingreso, el 84% de los pacientes (N = 42) presentaban hallazgos patológicos. Los más frecuentes fueron la alteración de los reflejos sacádicos y la rigidez en el 21,43% (N = 9). Se objetivaron reflejo de prehensión palmar, bradicinesia y afasia en el 16,67% de los pacientes (N = 7), paratonía y mioclonías en el 11,9% (N = 5). Mientras que la agnosia, el reflejo cutáneo plantar extensor y la hiperreflexia estaban presentes en el 9,52% de los pacientes (N = 4).
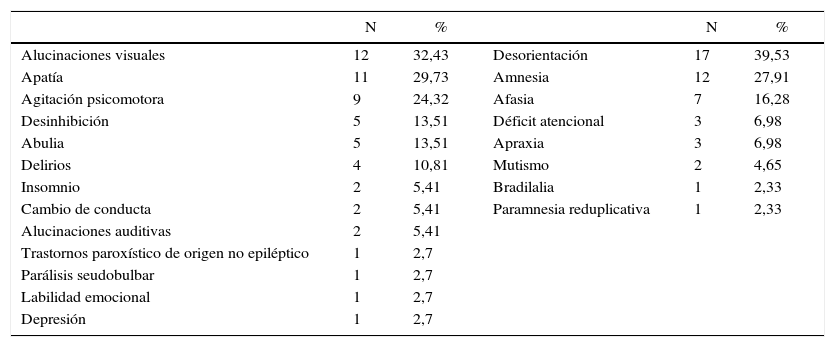
Por otro lado, el 86% (N = 43) presentaba síntomas cognitivos y el 74% (N = 37) síntomas psiquiátricos. Del total de pacientes con síntomas cognitivos, el 39,53% (N = 17) tuvo desorientación temporoespacial, el 27,91% (N = 12) evidenció fallas amnésicas, el 16,28% (N = 7) afasia, el 6,89% (N = 3) déficit atencional y apraxia, el 4,65% (N = 2) mutismo y el 2,33% (N = 1) tanto para bradilalia como un caso de paraamnesia reduplicativa.
En cuanto a los síntomas psiquiátricos, el 32,43% (N = 12) se manifestó con alucinaciones visuales, el 29,73% (N = 11) apatía, el 24,32% (N = 9) agitación psicomotora, el 13,51% (N = 5) tanto desinhibición como abulia; los delirios se evidenciaron en el 10,81% (N = 4) de los pacientes. Las alucinaciones auditivas, el insomnio y los cambios de conducta se constataron en el 5,41%(N=2) de la muestra. El 2,70% (N = 1) tuvo depresión, labilidad emocional, parálisis seudobulbar y trastorno paroxístico de origen no epiléptico (véase la tabla 2).
Síntomas psiquiátricos y cognitivos en la población total
| N | % | N | % | ||
|---|---|---|---|---|---|
| Alucinaciones visuales | 12 | 32,43 | Desorientación | 17 | 39,53 |
| Apatía | 11 | 29,73 | Amnesia | 12 | 27,91 |
| Agitación psicomotora | 9 | 24,32 | Afasia | 7 | 16,28 |
| Desinhibición | 5 | 13,51 | Déficit atencional | 3 | 6,98 |
| Abulia | 5 | 13,51 | Apraxia | 3 | 6,98 |
| Delirios | 4 | 10,81 | Mutismo | 2 | 4,65 |
| Insomnio | 2 | 5,41 | Bradilalia | 1 | 2,33 |
| Cambio de conducta | 2 | 5,41 | Paramnesia reduplicativa | 1 | 2,33 |
| Alucinaciones auditivas | 2 | 5,41 | |||
| Trastornos paroxístico de origen no epiléptico | 1 | 2,7 | |||
| Parálisis seudobulbar | 1 | 2,7 | |||
| Labilidad emocional | 1 | 2,7 | |||
| Depresión | 1 | 2,7 |
Los variables cognitivas pudieron ser analizados en el 50% de pacientes. La media del MiniMental score de Folstein (MMSE)27 fue de 14,03 ± 8,72, la valoración clínica de la demencia28 media fue de 2,25 ± 0,89.
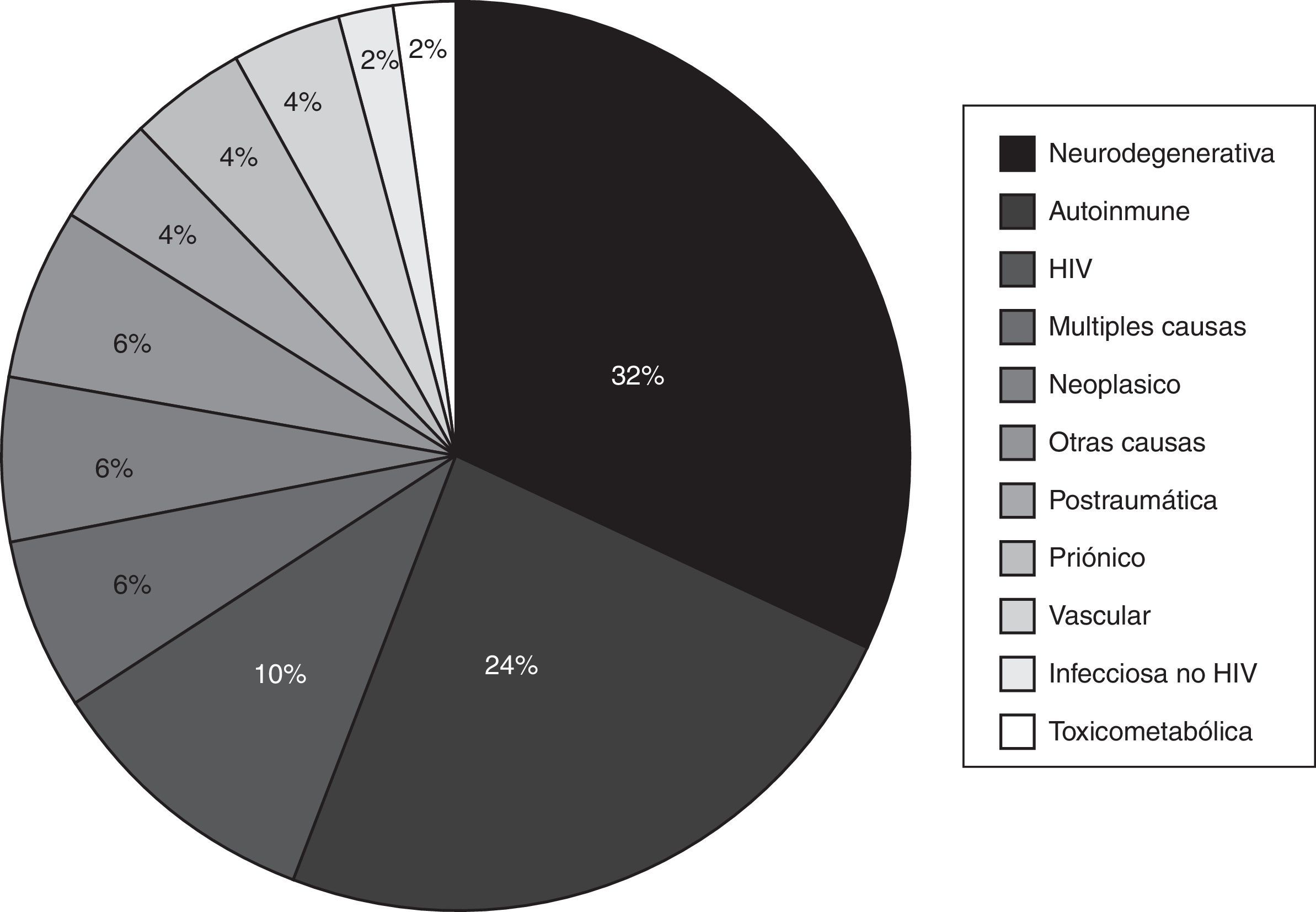
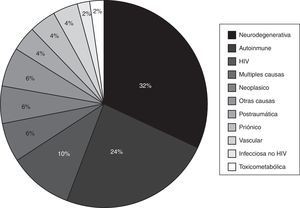
En cuanto al diagnóstico, las causas más frecuente fueron las neurodegenerativas con un 32% (N = 16), DCRE-AI con un 24% (N = 12) y las relacionadas con el HIV con un 10% (N = 5); el resto se representan en la figura 2figura 3.
Parámetros de laboratorioEn cuanto a los parámetros de laboratorio realizados en sangre, vale destacar que los marcadores sistémicos e inmunológicos fueron normales en todos los pacientes.
Punción lumbarAl 64% (N = 32) de los pacientes se les realizó PL. En cuanto a la glucorraquia, se obtuvo una media de 58,69 ± 17,27 mg%; la mediana de la celularidad fue de 3 (1-79) células por mm3; la proteinorraquia fue de 49 (16-266) mg%. En el 16% (N = 8) de los pacientes se envió material a citología, sin hallazgos patológicos en ninguno de ellos.
NeuroimágenesEl 98% (N = 49) de los pacientes tuvo como estudio complementario una RM con gadolinio. Se observó el patrón característico de CJD descripto para las secuencias DWI/FLAIR25,26 en el 4% (N = 2). Estos pacientes tuvieron diagnóstico de certeza para CJD. Se evaluaron las imágenes por RM en conjunto con médicos especialistas en imágenes; el 39% (N = 19) tenía un RM normal y el 32% (N = 16) atrofia. La atrofia se subdividió en difusa y focal (frontal, temporal, parietal, occipital), el 28% (N = 14) y el 4% (N = 2), respectivamente. En el 4% (N = 2), presentaron imágenes de restricción en DWI y el 16% (N = 8) imágenes hiperintensas en secuencias T2/FLAIR. El 6% de los pacientes (N = 3) presentó captación de contraste por vía intravenosa y 2 pacientes LOE única (véase la tabla 3).
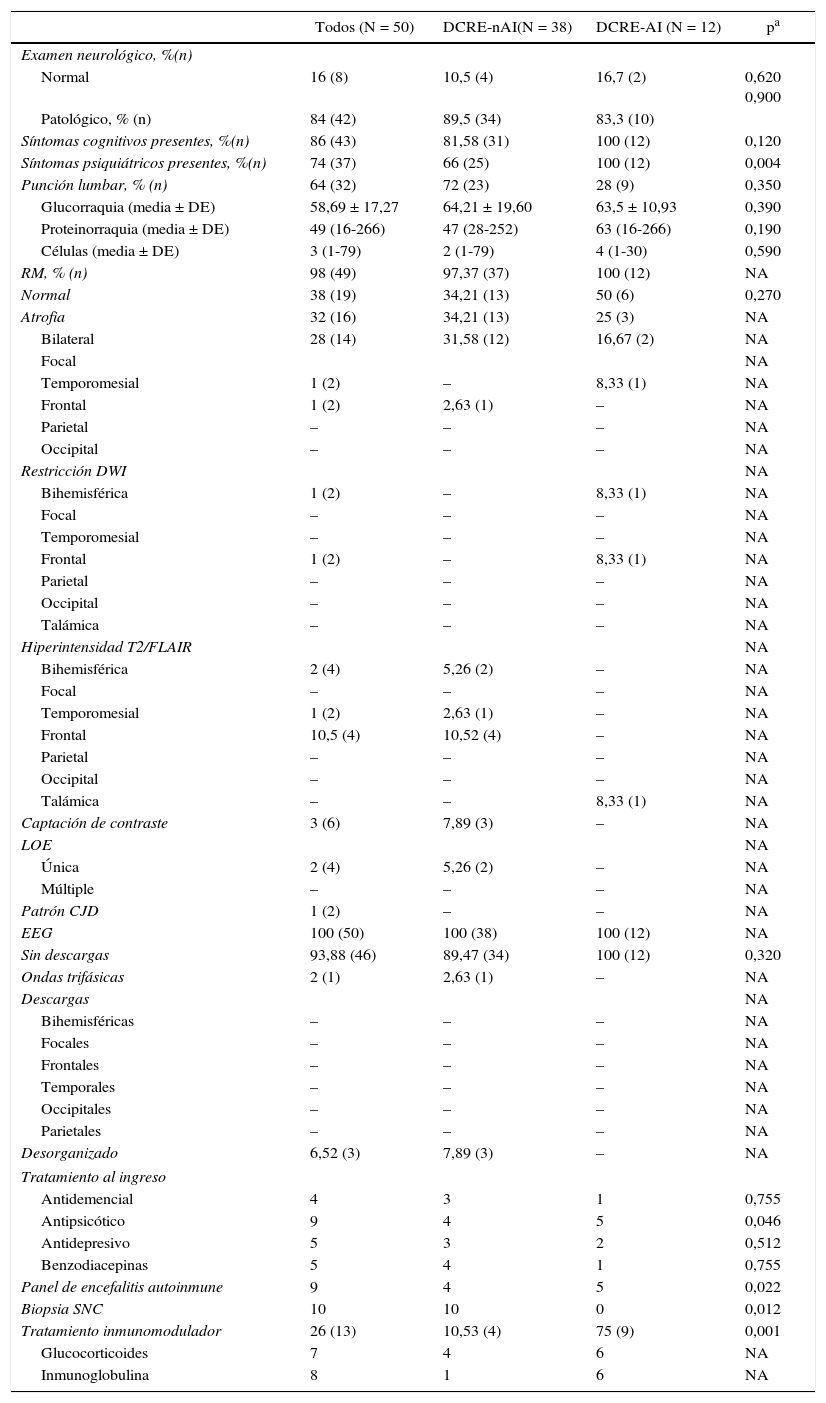
Presentación clínica, exámenes complementarios y tratamiento instaurado en los pacientes con demencia rápidamente progresivas, DCRE no autoinmune y DCRE probablemente autoinmune
| Todos (N = 50) | DCRE-nAI(N = 38) | DCRE-AI (N = 12) | pa | |
|---|---|---|---|---|
| Examen neurológico, %(n) | ||||
| Normal | 16 (8) | 10,5 (4) | 16,7 (2) | 0,620 0,900 |
| Patológico, % (n) | 84 (42) | 89,5 (34) | 83,3 (10) | |
| Síntomas cognitivos presentes, %(n) | 86 (43) | 81,58 (31) | 100 (12) | 0,120 |
| Síntomas psiquiátricos presentes, %(n) | 74 (37) | 66 (25) | 100 (12) | 0,004 |
| Punción lumbar, % (n) | 64 (32) | 72 (23) | 28 (9) | 0,350 |
| Glucorraquia (media ± DE) | 58,69 ± 17,27 | 64,21 ± 19,60 | 63,5 ± 10,93 | 0,390 |
| Proteinorraquia (media ± DE) | 49 (16-266) | 47 (28-252) | 63 (16-266) | 0,190 |
| Células (media ± DE) | 3 (1-79) | 2 (1-79) | 4 (1-30) | 0,590 |
| RM, % (n) | 98 (49) | 97,37 (37) | 100 (12) | NA |
| Normal | 38 (19) | 34,21 (13) | 50 (6) | 0,270 |
| Atrofia | 32 (16) | 34,21 (13) | 25 (3) | NA |
| Bilateral | 28 (14) | 31,58 (12) | 16,67 (2) | NA |
| Focal | NA | |||
| Temporomesial | 1 (2) | – | 8,33 (1) | NA |
| Frontal | 1 (2) | 2,63 (1) | – | NA |
| Parietal | – | – | – | NA |
| Occipital | – | – | – | NA |
| Restricción DWI | NA | |||
| Bihemisférica | 1 (2) | – | 8,33 (1) | NA |
| Focal | – | – | – | NA |
| Temporomesial | – | – | – | NA |
| Frontal | 1 (2) | – | 8,33 (1) | NA |
| Parietal | – | – | – | NA |
| Occipital | – | – | – | NA |
| Talámica | – | – | – | NA |
| Hiperintensidad T2/FLAIR | NA | |||
| Bihemisférica | 2 (4) | 5,26 (2) | – | NA |
| Focal | – | – | – | NA |
| Temporomesial | 1 (2) | 2,63 (1) | – | NA |
| Frontal | 10,5 (4) | 10,52 (4) | – | NA |
| Parietal | – | – | – | NA |
| Occipital | – | – | – | NA |
| Talámica | – | – | 8,33 (1) | NA |
| Captación de contraste | 3 (6) | 7,89 (3) | – | NA |
| LOE | NA | |||
| Única | 2 (4) | 5,26 (2) | – | NA |
| Múltiple | – | – | – | NA |
| Patrón CJD | 1 (2) | – | – | NA |
| EEG | 100 (50) | 100 (38) | 100 (12) | NA |
| Sin descargas | 93,88 (46) | 89,47 (34) | 100 (12) | 0,320 |
| Ondas trifásicas | 2 (1) | 2,63 (1) | – | NA |
| Descargas | NA | |||
| Bihemisféricas | – | – | – | NA |
| Focales | – | – | – | NA |
| Frontales | – | – | – | NA |
| Temporales | – | – | – | NA |
| Occipitales | – | – | – | NA |
| Parietales | – | – | – | NA |
| Desorganizado | 6,52 (3) | 7,89 (3) | – | NA |
| Tratamiento al ingreso | ||||
| Antidemencial | 4 | 3 | 1 | 0,755 |
| Antipsicótico | 9 | 4 | 5 | 0,046 |
| Antidepresivo | 5 | 3 | 2 | 0,512 |
| Benzodiacepinas | 5 | 4 | 1 | 0,755 |
| Panel de encefalitis autoinmune | 9 | 4 | 5 | 0,022 |
| Biopsia SNC | 10 | 10 | 0 | 0,012 |
| Tratamiento inmunomodulador | 26 (13) | 10,53 (4) | 75 (9) | 0,001 |
| Glucocorticoides | 7 | 4 | 6 | NA |
| Inmunoglobulina | 8 | 1 | 6 | NA |
Datos expresados en media: n ± desviación estándar (DE) para las variables cuantitativas.
AI: autoinmune; CJD: enfermedad de Creutzfeldt-Jakob; DCRE: deterioro cognitivo rápidamente evolutivo; EEG: electroencefalograma; LOE: lesión ocupante de espacio; NA no aplicable; nAI: no autoinmune.
El 100% (N =50) de los pacientes tuvo como estudio complementario un electroencefalograma (EEG). En el 2% (N = 1) de los pacientes de observaron ondas trifásicas como patrón predominante, teniendo como diagnóstico CJD. En ningunos de los pacientes se detectaron descargas epileptiformes ni patrón compatible con EMEC o EMEnC.
Screening paraneoplásicoEl 42% (N = 21) de los pacientes tuvo evaluación exhaustiva para neoplasia oculta. De los mismos, en el 9,56% (N = 2) se evidenció cáncer, siendo de estirpe tipo adenocarcinoma infiltrante con metástasis (sin evidencia de LOE intra o extraaxial) al diagnóstico (de riñón y vesícula).
Panel de Ac IgG antiantígenos neuronales asociados a encefalitis autoinmunesEn el 18% de los pacientes (N = 9) se solicitó panel de Ac autoinmunes dadas las características clínicas del cuadro. En 2 casos se detectaron Ac contra el canal de potasio voltaje dependiente (VGKC). En un caso positivo para LGL-1 (VGKC), el resultado se confirmó por metodología CBA en el laboratorio de la Universidad de Erasmus (Dr. Marteen Titulaer, Dr. Joseph Dalmau). En el otro caso positivo para VGKC, los resultados se negativizaron luego del tratamiento con metilprednisolona. Un caso resultó positivo para anticuerpo contra el receptor NMDA. El resto fue negativo para el panel de encefalitis autoinmune.
Biopsia del sistema nervioso centralEn el 20% (N = 10) de los pacientes se realizó una biopsia del sistema nervioso central (BSNC), de los cuales el 70% (N = 7) arribó a un diagnóstico definitivo. En 2 pacientes, la anatomía patológica (AP) fue compatible con CJD. En 6 pacientes se realizó diagnóstico de AP de las siguientes etiologías: leucoencefalopatia multifocal progresiva, EA, Chagas, melanoma amelanocítico quístico, linfoma primario del SNC y meningioma típico. Por otro lado, en 2 pacientes no se pudo determinar etiología a través de AP.
Otros estudios complementariosEl 30% (N = 15) ya tenía realizada una evaluación cognitiva previa al ingreso a nuestra institución; sin embargo, no tenía un diagnóstico definido ni un tratamiento instaurado.
TratamientoEl 26% (N = 13) recibió tratamiento inmunomodulador. El 16% (N = 8) con inmunoglobulina humana normal, mientras que al 14% (N = 7) recibió metilprednisolona.
Subestudio comparativo entre deterioro cognitivo rápidamente evolutivo de etiología no autoinmune y deterioro cognitivo rápidamente evolutivo de probable etiología autoinmuneCaracterísticas clínicas y presentaciónEl 24% (N = 12) presentaban criterios para deterioro cognitivo rápidamente evolutivo de probable etiología autoinmune (DCRE-AI). En el momento de la internación, el deterioro cognitivo rápidamente evolutivo de etiología no autoinmune (DCRE-nAI) tenía una edad media de 64,97 ± 16,71, mientras que para DCRE-AI fue de 50,50 ±16,46, con una diferencia estadísticamente significativa (p = 0,012). En cuanto al sexo, no se obtuvo un valor con significación estadística (p = 0,24). La mediana del tiempo de inicio de los síntomas de DCRE-nAI fue 12 (1-24) meses y para DCRE-AI 6,22 (1,67-24) (p = 0,812). En cuanto al tiempo del diagnóstico de demencia, la mediana para DCRE-AI fue de 2,8 (1,67-12) meses, mientras que para DCRE-AI 7,51 (0,73-22.1) meses sin alcanzar significación estadística (p = 0,193). De los pacientes con DCRE-AI, ninguno falleció durante su internación, a diferencia de DCRE-nAI (16%, N =8 de los pacientes). La mediana del tiempo de defunción para DCRE-nAI fue 34 (1-75) días. En cuanto a los días de internación, DCRE-nAI presentó una mediana de 6,5 (2-38) días y DCRE-AI 7 (2-346) días, sin una diferencia estadísticamente significativa (p = 0,253). Ninguno de los pacientes DCRE-AI tenía antecedentes familiares de DCRE o demencia, mientras que el 2,63%(N = 1) de DCRE-nAI sí (p = 0,456) (véase la tabla 3).
En cuanto al examen neurológico, en DCRE-AI el 83,33% (N = 10) tuvo una evaluación neurológica patológica y en DCRE-nAI el 88,9% (N = 32) presentó hallazgos anormales en el examen, no alcanzando esta diferencia valor estadísticamente significativo (p = 0,624). Sin embargo, al analizar la variable de síntomas psiquiátricos, el 100% (N = 12) de DCRE-AI tuvo síntomas psiquiátricos y para el grupo DCRE-nAI el 65,79% (N = 25) tuvo; esta diferencia fue estadísticamente significativa (p = 0,004). Asimismo, se observó una diferencia estadísticamente significativa si se toman en consideración los síntomas conductuales. El DCRE-AI presentó dicha sintomatología en 91,67% (N = 11), mientras que el DCRE-nAI en el 63,97% (N = 24), con un valor de p < 0,05.
La media del MMSE en los pacientes con DCRE-AI fue de 14,29 ± 10,11 y para DCRE-nAI 13,92 ± 9,05, sin diferencias estadísticamente significativas (p = 0,938).
El 41,67% (N = 5) de DCRE-AI se encontraba en tratamiento con neurolépticos al ingreso, mientras que solo el 10,53% (N = 4) de DCRE-nAI tenía esa indicación (p = 0,046). No se encontraron diferencias entre el uso de benzodiacepinas y el tratamiento antidemencial entre ambos grupos.
Punción lumbarSe realizó PL en el 75% (N = 9) de DCRE-AI y en el 60,53% (N = 23) de DCRE-nAI (p = 0,353). En cuanto a la glucorraquia, el grupo DCRE-AI tenía una media de 63,50 ± 10,93 mg% y para DCRE-nAI fue de 64,21 ± 19,60, sin alcanzar una diferencia estadísticamente significativa (p = 0,391). La mediana para la proteinorraquia en el grupo DCRE-AI fue de 63 (16-266) y 47 (28-252) para DCRE-nAI sin alcanzar, significación estadística (p = 0,197). En cuanto a la celularidad, la mediana para DCRE-nAI fue de 2 (1-79) células por mm3 y para DCRE-AI 4 (1-30) células por mm3, sin significación estadística (p = 0,599).
Resonancia magnética de encéfalo y electroencefalogramaSi se comparan ambos grupos, el DCRE-AI tenía una resonancia magnética (RM) normal en el 50% (N = 6) de los pacientes, mientras que en el 34% (N = 13) fue normal para DCRE-nAI. La atrofia se observó en el 25% (N=3) de DCRE-AI y en el 34% (N = 13) de DCRE-nAI. El 16% (N = 2) de los pacientes con DCRE-AI presentaba imágenes de restricción en la DWI sin estos hallazgos en el grupo DCRE-nAI. Por otra parte, el 7,6% (N = 3) de los pacientes de DCRE-nAI presentó captación de contraste por vía intravenosa y en el 5,2% (N = 2) de los pacientes se observó LOE única. Esto no se observó en los pacientes DCRE-AI (véase la tabla 3).
Por otro lado, en el 100% (N = 12) de los pacientes del grupo DCRE-AI no se observaron descargas ni paroxismos, mientras que el 89,4% (N = 34) de los pacientes DCRE-nAI tuvo un EEG sin descargas.
Biopsia del sistema nervioso centralNinguno de los pacientes del grupo DCRE-AI fue sometido a BSNC, mientras que el 26,32% (N = 10) de DCRE-nAI requirió BSNC como medida diagnostica (p = 0,012).
Tratamiento inmunomoduladorEl tratamiento inmunomodulador (inmunoglobulina humana normal o glucocorticoides) se indicó en el 75% (N = 9) de los pacientes DCRE-AI, mientras que solo en el 10,53% (N = 4) del grupo DCRE-nAI lo recibió, alcanzando una diferencia estadísticamente significativa (p < 0,001).
DiscusiónEl presente estudio permitió identificar las características clínicas, incluyendo manifestaciones cognitivas y psiquiátricas, etiologías y hallazgos en los diversos estudios complementarios realizados de los pacientes con criterio de DCRE. Adicionalmente, se procedió al análisis comparativo del DCRE-AI vs. DCRE provocado por otras causas, identificando sus principales diferencias. Este estudio es el primero en nuestro país que analiza las posibles etiologías del DCRE.
No solo se carecen de datos estadísticos a nivel nacional del DCRE, sino también para las demencias en general1,2,29. No obstante, esta ausencia de datos no se limita al nivel nacional, sino que se extiende a otras regiones, imposibilitándose la realización de un cálculo estadístico adecuado5,6,7. Esto puede deberse al bajo nivel de sospecha que se tiene, dado que, en general, se tiende a interpretar que la causa más frecuente de DCRE es CJD7,30, dejando de lado las causas potencialmente tratables y reversibles10.
En nuestro estudio, la edad media de DCRE fue de 60,66 y fue más frecuente en hombres, similar a lo reportado en otros estudios6,31. En cuanto al tiempo del inicio de los síntomas, nuestra serie fue 8,33 meses, el doble de tiempo de lo reportado en otro estudio5, pudiendo esta diferencia deberse a que dicho centro es referente de derivación para CJD (criterios de Consorcio RNM-CJD para la enfermedad de CJD esporádica32), que presenta una evolución más rápida y letal que otras DCRE6,7,8,30,31,33. En nuestro estudio, se constató el fallecimiento en el 16% de los pacientes (N = 8), todos ellos pertenecientes al grupo DCRE-nAI, 2 (4%) pacientes con diagnóstico de certeza para CJD.
Las estadísticas con respecto a las causas son muy variables y dependen de cada centro de referencia6,7,31, siendo en nuestro caso la causa neurodegenerativa la más frecuente, en segundo lugar el DCRE-AI y tercero la DHIV.
Resulta interesante esta observación, ya que aunque las demencias neurodegenerativas característicamente presentan un curso lento y progresivo; debe considerarse que algunas formas (EA, DLB, síndrome corticobasal y DFT) pueden tener una presentación atípica con DCRE5,6,7,30,31,33, destacándose la importancia de sospechar las causas potencialmente tratables dentro del algoritmo diagnóstico frente a un caso de DCRE para poder iniciar un tratamiento precoz5,10.
Los hallazgos clínicos en esta población fueron similares a los descriptos en la literatura6. Los síntomas psiquiátricos que se presentaron con mayor frecuencia fueron las alucinaciones visuales, la apatía y la agitación psicomotora; dichos hallazgos se discutirán más adelante en esta sección.
Se debe destacar la importancia de los estudios complementarios, principalmente en el diagnóstico por RM de CJD26, destacándose que las imágenes a nivel de los ganglios basales y el signo del ribete cortical que se vean con más aumento de señal en DWI que en técnica de FLAIR son característicos de CJD; no observándose otras causas de DCRE30. En nuestro caso, al igual que en otras series, las técnicas de EEG solo tuvieron una utilidad relativa en el diagnóstico etiológico de DCRE. Es importante recalcar que no se objetivaron patrones de EMEC o EMEnC.
La BSNC fue realizada en 10 pacientes, con diagnóstico de certeza por AP en 7 de ellos. La BSNC es un procedimiento que posee un sensibilidad diagnóstica en los casos de demencia del 20 al 67%34,35. La tasa de hemorragia sintomática posterior a la biopsia varía entre el 0,4 y el 7,2%36,37 y se puede evidenciar hemorragias intracerebrales asintomáticas en hasta en el 50% de los pacientes36,37. La BSNC se recomienda cuando los estudios por imágenes, el laboratorio y el LCR no permitan aclarar la etiología de DCRE, sabiendo que una BSNC sin lesión demostrable en la RM tiene un rédito bajo34,35,38. Por otro lado, en LOE es fundamental contar con una BSNC a fin de establecer el diagnóstico, el tratamiento y el pronóstico de acorde con los hallazgos anatomopatológicos39,40.
Cuando se compararon los grupos DCRE-AI y DCRE-nAI, pudimos observar ciertas diferencias que merecen ser mencionadas. Fue la segunda causa más frecuente de DCRE en nuestro estudio, a diferencia de lo reportado en otros estudios6,7; los «centros especializados en demencia» reciben un número importante de casos con sospecha de CJD, por lo que su prevalencia real podría estar sesgada. Nuestro estudio fue realizado en un centro polivalente de alta complejidad con internación en clínica médica y neurología general. Algunos autores reportaron una prevalencia de DCRE-AI del 20-40%9,41,42, lo que nos muestra que es más frecuente de lo que realmente se considera.
En cuanto a la edad al inicio, se observó una diferencia estadísticamente significativa, siendo más jóvenes los pacientes con DCRE-AI. El tiempo del inicio de los síntomas fue menor en el grupo DCRE-AI con respecto al grupo DCRE-nAI, aunque sin alcanzar significación estadística. Estos hallazgos demarcan la importancia que se debe de tener en la edad del paciente, así como también al tiempo de evolución en el momento de la anamnesis, ya que en pacientes jóvenes con cuadros agudos/subagudos podrían tener un origen autoinmunitario, requiriendo una terapéutica temprana y agresiva5,10,30,38.
En cuanto a los síntomas, se encontraron diferencias significativas en cuanto a la presencia de síntomas psiquiátricos (alucinaciones visuales, apatía, agitación psicomotora, entre otros) con respecto al grupo DCRE-nAI. Asimismo, el grupo DCRE-AI se encontraba en tratamiento antipsicótico al ingreso, con una diferencia significativa desde el punto de vista estadístico en comparación con el grupo DCRE-nAI. La encefalitis por Ac anti-NMDA se puede manifestar con síntomas psiquiátricos, manifestaciones hipercinéticas, disfunciones autonómicas y convulsiones; sin embargo, existen formas atenuadas de la enfermedad en donde se observan solo síntomas psiquiátricos atípicos. Una característica observada en estos casos, es el desarrollo de síntomas extrapiramidales ante bajas dosis de medicación antipsicótica como el haloperidol10,43. Por lo que un paciente joven que comience con un cuadro psicótico, DCRE, efectos adversos con dosis bajas de antipsicóticos típicos y sin otra manifestación neurológica asociada debería de tenerse en consideración dentro de los diagnósticos diferenciales un DCRE-AI.
Los hallazgos de la PL, si bien no fueron significativos, muestran un ligero aumento en la proteinorraquia en el DCRE-AI, lo cual está en relación con su característica inflamatoria.
En cuanto al tratamiento, se observó una diferencia estadísticamente significativa entre los pacientes con DCRE-AI que recibieron terapia inmunomoduladora, sea metilprednisolona o inmunoglobulina humana, y los pacientes con DCRE-nAI. Se siguieron los criterios de DCRE-AI, iniciándose tratamiento durante su internación. Si bien este estudio no fue diseñado de manera prospectiva, se reportó el caso de un paciente con encefalitis por Ac anti-VGKC que recibió terapia con metilprednisolona, inmunoglobulina humana y posteriormente rituximab, con mejoría en las evaluaciones cognitivas y las escalas motoras. El tratamiento de inicio debería ser precoz y agresivo. De no responder a la primera terapia, se pueden escalar en los tratamientos. La evaluación sistemática de dichos pacientes es importante5,10,30,38,43.
Basados en la literatura, podemos indicar que el estudio de todo paciente con DCRE debería incluir5,38:
- 1.
Una anamnesis detallada, un examen neurológico y cognitivo. Como opinión personal de los autores en un paciente de rápida evolución indicamos internar al paciente para un estudio exhaustivo y eventual tratamiento empírico.
- 2.
Rutina de laboratorio: hemograma, ionograma, urea, creatinina, calcio, fósforo, magnesio, hepatograma, amonio, TSH, Ac antiperoxidasa y Ac antitiroglobulina, ERS, PCR, FAN, ANCAp, ANCAc, factor reumatoideo, Ac anti-Hu, Ac anti-Yo, Ac anti-Ri, vitamina B12, ácido fólico, HIV, VDRL, Ac anti-Ro y Ac anti-La. En casos seleccionados, cobre y ceruloplasmina plasmáticos, cobre urinario, estudio de coagulabilidad, laboratorio para discrasias malignas sanguíneas.
- 3.
Imágenes del SNC: RM que incluya secuencias de difusión, ADC, FLAIR, T1, T2 con contraste. De presentar contraindicación para la realización de la RM, se recomienda TC de encéfalo con contraste, de ser posible. En caso de LOE intraaxial se sugiere completar estudio con espectroscopia y técnicas de perfusión.
- 4.
Examen de LCR: fisicoquímico, cultivo de gérmenes comunes, VDRL, antigenorraquia para criptococo, citología, PCR para infecciones virales (herpes simplex i y ii). En casos seleccionados, citometría de flujo (sospecha de procesos linfoproliperativos), PCR para T whipplei, PCR para Micobacterium tuberculosis, PCR para infecciones virales (herpes simplex vi, virus de Epstein-Bar, citomegalovirus, causas de encefalitis de la región estudiada).
- 5.
Screening oncológico exhaustivo: TC de cuello, tórax, abdomen y pelvis, con contraste (de no presentar contraindicaciones)44.
- 6.
EEG: En todos los pacientes a fin de descartar EMEC y EMEnc.
- 7.
Panel de Ac para encefalitis autoinmune: se recomienda cuando no pudo encontrarse por otros métodos una mejor explicación de su DCRE y se sospecha clínicamente una demencia autoinmune. Sin embargo, cabe destacar que su solicitud no debería retrasar un eventual tratamiento empírico.
Los mismos incluyen las siguientes determinaciones en suero y LCR:
- –
Ac antiantígenos neuronales asociados a encefalitis autoinmune: Ac antirreceptor de glutamato tipo NMDA, Ac antirreceptor de glutamato tipo AMPA 1 y AMPA 2, Ac antiproteína asociada a contactina (Ac anti-CASPR2), Ac antiproteína 1 de glioma inactivada rica en leucina (Ac anti-LG1) y Ac antirreceptor GABAB (B1 y B2).
- –
Panel de autoanticuerpos paraneoplásicos: Ac anti-Hu, Ac anti-Yo, Ac anti-Ri, Ac anti-Ma2, Ac anti-CV2 (CRMP 5), Ac antianfifisina, Ac antirrecoverina, Ac anti-SOX1, Ac antititina, Ac anti-Zic4, Ac anti-GAD65, Ac anti-Tr (DNER).
Las fortalezas de este trabajo incluyen un tiempo de DCRE de más de un mes y menos de 2 años con el fin de excluir los síndromes confusionales y de incluir aquellos cuadros que tal vez tengan un curso un poco menos acelerado y que puedan deteriorarse dramáticamente al pasar el primer año. La base incluye datos acerca de antecedentes heredofamiliares, de medicación al ingreso, examen neurológico completo para cada paciente con todas sus características más relevantes. Se logró estudiar con estudio de alta resolución del SNC como la RM a la mayoría de los pacientes, por lo que cuenta con un buen apoyo neuroimagenológico, siendo todas las imágenes evaluadas por especialistas y neurólogos.
Por otro lado, observamos que en un centro de alta complejidad (dedicado a la neurología general) las causas más frecuente son neurodegenerativa y autoinmunes. Esto podría explicarse por que el conocimiento actual del último grupo es cada vez mayor y por la mayor difusión que se tiene respecto de la posibilidad de realizar anticuerpos. Cabe destacar que es muy reciente la publicación de los primeros criterios para el diagnóstico de encefalitis autoinmune10. El inicio del presente trabajo es previo a la publicación de dichos criterios diagnósticos.
Además, al comparar los grupos con DCRE-AI y con DCRE-nAI, pudimos ver con más detalle las características de ambos grupos, sus semejanzas y diferencias desde el punto de vista clínico neurológico. Según nuestro conocimiento, es el primer estudio de la región que compara ambas poblaciones.
Las limitaciones son: a) baja probabilidad de aparición en nuestro centro, esto podría explicarse por el bajo nivel de sospecha de DCRE y que todos los pacientes no son referidos a nuestro servicio cuando arriban a la guardia, siendo derivados a consultorios externos para mayor estudio; b) no se incluyó a pacientes que presentaban lesiones agudas con la potencialidad de tener un DCRE; un ejemplo sería el accidente cerebrovascular isquémico en zonas estrategicas45, accidente cerebrovascular hemorrágico (ACVh), traumatismos encefalocraneanos (TEC), entre otros; de todas formas el objetivo de este estudio fue retrospectivo y utilizó una metodología de selección de casos propia no publicada, por lo que nuevos estudios de seguimiento deberían ser realizados en el futuro para poder definir la metodología adecuada de selección de las DRP/DCRE y confirmar nuestros hallazgos; no se incluyó a pacientes internados en áreas críticas, lo que podría justificar la probabilidad de aparición de DCRE encontrada, y c) dentro de los estudios complementarios, no todos los pacientes presentaron un estudio de LCR a su ingreso; algunos de los pacientes presentaban contraindicaciones formales (LOE principalmente), en otros casos los familiares negaron su consentimiento. Por último, se observó que hay una baja proporción de pacientes con evaluaciones cognitivas, sabiendo que es difícil en la internación realizar una evaluación ampliada por el ambiente en el que está el paciente. Esto podría ser importante a fin de diseñar diferentes baterías en el paciente internado.
ConclusiónEn conclusión, el DCRE es un cuadro de etiologías múltiples cuyo diagnóstico debe de ser investigado de manera exhaustiva, evitando caer en la tentativa de pensar que siempre estamos frente a un caso de una enfermedad irreversible como el CJD10,31. El paciente debería ser internado para una búsqueda ordenada y completa, ya que las causas potencialmente reversibles no son tan poco frecuentes como parece.
Es importante recalcar que ante la sospecha de DCRE-AI debería iniciarse tratamiento inmunomodulador, puesto que estas entidades tienen una buena tasa de respuesta con poca repercusión en la vida diaria, cuando son tratadas a tiempo. Asimismo, no se debería de esperar a la positividad de un anticuerpo del panel para llevar a cabo dichos tratamiento10.
Como vimos en este trabajo y en otros publicados10,43, los pacientes con DCRE-AI suelen ser más jóvenes y presentar síntomas psiquiátricos al inicio de la enfermedad. Esto último, en nuestro caso, fue corroborado por el mayor requerimiento de psicofármacos (quetiapina).
A nuestro entender, es el primer estudio de la región en un centro de alta complejidad acerca de las características de DCRE y las diversidades que existen entre los distintos grupos mencionados. Basados en esta experiencia, se realizan recomendaciones no publicadas hasta ahora respecto del manejo de las demencias autoinmunes; sin embargo, esta propuesta debe ser validada en otros estudios a mayor escala. Si bien el costo de investigar estos anticuerpos es elevado, el mismo es mucho menor que los costos que genera un paciente con demencia, en la familia y los sistemas de salud, si bien no es el foco de este estudio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflictos de interesesLos autores no declaran conflictos de interés. No se recibió ningún tipo de financiación durante el desarrollo del estudio.
Este trabajo ha sido galardonado con el “Premio 53° Congreso Argentino de Neurología”.