La hiperglucemia y la leucocitosis han sido asociadas a la severidad del accidente cerebrovascular (ACV) isquémico y a las complicaciones desarrolladas en su evolución.
ObjetivoDeterminar el valor pronóstico del índice leucoglucémico (ILG) para complicaciones mayores en pacientes con ACV isquémico.
Materiales y métodosSe realizó un estudio de cohorte prospectivo, multicéntrico, reclutando pacientes con ACV isquémico dentro de las 72horas del inicio del evento, internados en las salas de clínica médica de ambos hospitales. Se registraron los primeros valores de glucemia y recuento de leucocitos desde su llegada al hospital. Se realizó el seguimiento de los pacientes durante 14 días o hasta el alta, y se evaluaron las complicaciones mayores definidas previamente.
ResultadosSe analizaron 101 pacientes con diagnóstico de ACV isquémico. La edad media fue de 69 años (DS: 12,78), el 60% fueron hombres y la media de escala neurológica canadiense al ingreso fue de 7 (DS: 2,35). El mejor valor de corte pronóstico de ILG para el objetivo final primario fue de 1.021 (S: 90% y E: 46%). En el análisis univariado el ILG mayor a 1.021 se asoció significativamente con el desarrollo de complicaciones mayores —OR: 8,17 (IC 95%: 1,78-37,44)—. En un modelo de regresión logística multivariado el ILG>1.021 ajustado por diabetes, gravedad del evento mediante Escala neurológica canadiense, nivel de proteína C reactiva y fibrilación auricular no se asoció significativamente con el desarrollo de complicaciones —OR: 6,24 (IC 95%: 0,90-43,43)—.
ConclusiónEl ILG no demostró ser un predictor independiente de complicaciones mayores en pacientes con ACV isquémico.
Hyperglycemia and leukocytosis have been associated with the severity of the ischemic stroke and the complications developed in its evolution.
ObjectiveTo determine the prognostic value of the leuko-glycemic index (ILG) for major complications in patients with ischemic stroke.
Materials and methodsA prospective, multicenter cohort study was conducted, recruiting patients with ischemic stroke within 72hours of the start of the event, admitted to the medical clinic rooms of both hospitals. The first blood glucose and leukocyte count values were recorded since their arrival at the hospital. Patients were followed up for 14 days or until discharge and the previously defined major complications were evaluated.
Results101 patients with a diagnosis of ischemic stroke were analyzed. The mean age was 69 years (SD: 12.78), 60% were men and the average Canadian neurological scale at admission was 7 (SD: 2.35). The best ILG prognostic cutoff value for the primary primary objective was 1021 (S: 90% and E: 46%). In the univariate analysis, ILG greater than 1021 was significantly associated with the development of major complications —OR: 8.17 (95% CI: 1.78-37.44)—. In a multivariate logistic regression model, the ILG>1021 adjusted for diabetes, event severity using Canadian Neurological Scale (CNS), C-reactive protein level (CRP) and atrial fibrillation was not significantly associated with the development of complications —OR: 6.24 (95% CI 0.90-43.43—
ConclusionILG did not prove to be an independent predictor of major complications in patients with ischemic stroke.
El accidente cerebrovascular (ACV) isquémico es un problema de salud pública importante en la Argentina. Una amplia variedad de factores influye en el pronóstico del ACV, incluyendo la edad, la gravedad, el mecanismo, la localización, las comorbilidades y las complicaciones relacionadas1–3. En la fase aguda del ACV isquémico los predictores más fuertes de resultado son la severidad del accidente cerebrovascular y la edad del paciente4,5. La gravedad del evento isquémico puede objetivarse mediante escalas como National Institutes of Health Stroke Scale (NIHSS) o la Escala neurológica canadiense (CNS) cuyas puntuaciones estiman la probabilidad de muerte o de discapacidad grave6,7. Al momento de la admisión una puntuación NIHSS de 16 o más, o una puntuación CNS menor a 6,5 se asocian a mayor probabilidad de complicaciones y muerte. Entre los biomarcadores asociados al desarrollo de complicaciones se han propuesto la hiperglucemia y la leucocitosis, estando estos vinculados a un estado adrenérgico y proinflamatorio8.
El índice leucoglucémico (ILG [glucemia×glóbulos blancos/1.000]) se ha señalado como un predictor independiente de mortalidad y de complicaciones en pacientes con infarto agudo de miocardio con elevación del ST. Un ILG mayor a 1.000 se vio relacionado con mayor tasa de complicaciones, incluyendo muerte, especialmente en paciente no diabéticos9–11.
En nuestro conocimiento no existen estudios que analicen la relación entre ILG y el desarrollo de complicaciones en pacientes con ACV isquémico.
Este estudio se realizó con el objetivo de determinar si el ILG dentro de las primeras 72horas del inicio del cuadro es predictor de complicaciones mayores en pacientes con ACV isquémico.
Material y métodosSe realizó un estudio de cohorte prospectiva, multicéntrico, reclutando pacientes con ACV isquémico dentro de las 72horas del inicio del evento, internados en las salas de Clínica Médica del Hospital de Agudos Juan A. Fernández y del Hospital General de Agudos Cosme Argerich, durante los meses comprendidos entre septiembre de 2017 a julio de 2018. El muestreo fue no probabilístico consecutivo. Los criterios de inclusión fueron: pacientes mayores de 18 años que se internaron en las salas de clínica médica de ambos hospitales con diagnóstico de ACV isquémico de 72horas de evolución desde el inicio del evento, cuya confirmación se haya realizado mediante tomografía computarizada o resonancia magnética nuclear de cerebro. Los criterios de exclusión fueron: pacientes con ACV isquémico con más de 72horas de evolución desde el inicio del evento. Se registraron los primeros valores de glucemia y recuento de glóbulos blancos desde su llegada al hospital, así como también el valor de gravedad neurológica mediante CNS, también de NIHSS, y el nivel de proteína C reactiva (PCR). Aquellas complicaciones que ocurrieron en pacientes que requirieron ingreso en unidades de cuidados intensivos no fueron consideradas. Se realizó el seguimiento de los pacientes durante 14 días, hasta su derivación a la unidad de cuidados intensivos o hasta el alta, y se evaluaron las complicaciones mayores definidas a priori como requerimiento de ventilación mecánica, sepsis-shock séptico, shock cardiogénico, progresión de foco isquémico o nuevo foco neurológico, transformación hemorrágica del foco isquémico con relevancia clínica, paro cardiorrespiratorio, síndrome coronario agudo, hemorragia mayor, tromboembolismo de pulmón, hipertensión endocraneana y muerte12. También se evaluaron las complicaciones menores, definidas como ocurrencia de neumonías, disfagia, hipertensión arterial grave, trombosis venosa profunda, infección del tracto urinario, convulsiones, arritmias de importancia clínica e insuficiencia cardiaca congestiva. El ILG se calculó como el producto del primer registro de glucemia al azar (en mg/dl) y el número de leucocitos (en mm3) dividido entre 1.000. Se registraron como otras variables predictoras, identificadas según la revisión bibliográfica: género, edad, territorio vascular afectado, puntaje según SCN, antecedentes de fibrilación auricular, diabetes mellitus, enfermedad renal crónica, insuficiencia cardiaca congestiva y de infarto agudo de miocardio, niveles de PCR y anemia3–6,8,13–18. Para describir la severidad del ACV isquémico hemos utilizado la CNS, ya que su cálculo es sencillo y se correlaciona con el de NIHSS19.
Análisis estadísticoSe utilizó el test de Kolmogorov-Smirnov para evaluar la distribución de las variables continuas. Las variables continuas de distribución normal se expresaron como medias y su desvío estándar, y las de distribución no normal se expresaron como mediana y su rango intercuartílico. Se utilizaron la prueba «t» para varianza iguales o desiguales, según corresponda de acuerdo a la prueba de Levene, o la de Mann-Whitney-Wilcoxon según su tipo de distribución. Las variables categóricas se expresaron como porcentajes y se compararon con la prueba de Chi cuadrado o test exacto de Fisher según corresponda. Para el cálculo del tamaño muestral se consideró incluir en el modelo de regresión logística múltiple una variable predictora por cada 10 complicaciones mayores. En función de la bibliografía consultada se estimó una frecuencia de este evento del 40%. Para poder incluir al menos 4 variables en el modelo se calculó un tamaño muestral de 100 pacientes20. Se utilizó la curva ROC y el área bajo la curva para determinar el poder discrimatorio y el punto de corte para las variables cuantitativas. Se utilizó como medida de asociación la odds ratio (OR) con su correspondiente intervalo de confianza del 95% (IC 95%). Se realizó un análisis univariado de las variables predictoras. Aquellas variables con un valor de p menor a 0,1 se incluyeron en el modelo de regresión logística múltiple para el análisis multivariado. El ILG se incluyó en el modelo como variable dicotómica. Se consideró significativo un valor de p menor a 0,05. Se utilizó el programa SPSS versión 23 para Windows para el análisis estadístico (Chicago, IL, EE. UU.).
Consideraciones éticasEste trabajo fue aprobado por el Comité de ética del Hospital de Agudos Juan A. Fernández. Se realizó bajo las normas éticas que rigen las investigaciones en humanos respetando la Ley Nacional de Protección de Datos Personales n.° 25.326 (Ley de Habeas Data), los principios de la Declaración de Helsinki (Fortaleza 2013) y sus revisiones posteriores y las normas de buenas prácticas clínicas de la Conferencia Internacional de Armonización (GCP-ICH).
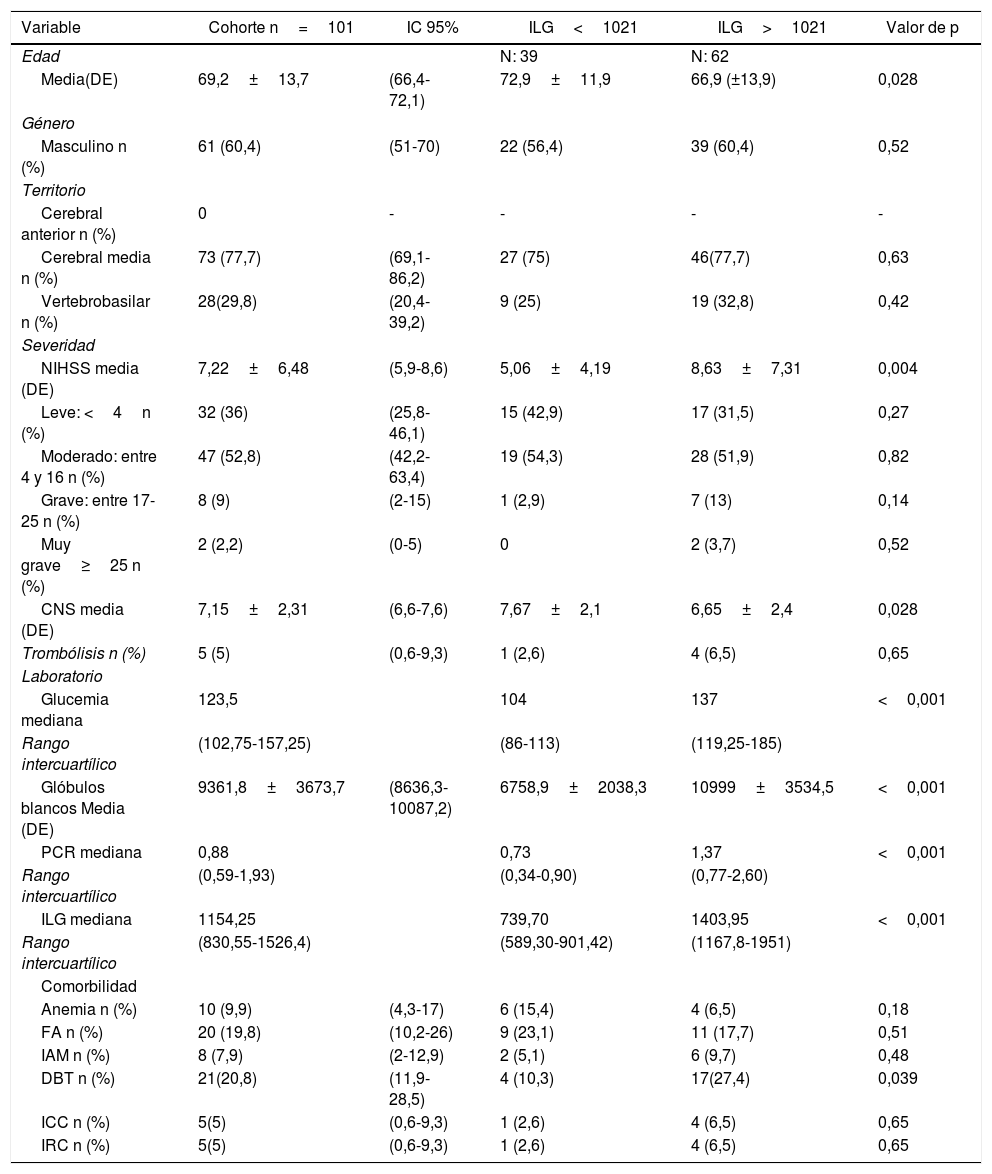
ResultadosSe analizaron 101 pacientes con diagnóstico de ACV isquémico. La media de edad fue de 69 años (DS: 12,78), el % fueron hombres y la media de CNS al ingreso fue 7 (DS: 2,31). El 21% de los pacientes eran diabéticos y el 19,8% tenía antecedente de fibrilación auricular. De los 101 pacientes 50 (49,5%) presentaron alguna complicación durante su seguimiento (tabla 1). Solo 21 pacientes (20,8%) tuvieron complicaciones mayores (tablas 1 y 2).
Característica de la muestra
| Variable | Cohorte n=101 | IC 95% | ILG<1021 | ILG>1021 | Valor de p |
|---|---|---|---|---|---|
| Edad | N: 39 | N: 62 | |||
| Media(DE) | 69,2±13,7 | (66,4-72,1) | 72,9±11,9 | 66,9 (±13,9) | 0,028 |
| Género | |||||
| Masculino n (%) | 61 (60,4) | (51-70) | 22 (56,4) | 39 (60,4) | 0,52 |
| Territorio | |||||
| Cerebral anterior n (%) | 0 | - | - | - | - |
| Cerebral media n (%) | 73 (77,7) | (69,1-86,2) | 27 (75) | 46(77,7) | 0,63 |
| Vertebrobasilar n (%) | 28(29,8) | (20,4-39,2) | 9 (25) | 19 (32,8) | 0,42 |
| Severidad | |||||
| NIHSS media (DE) | 7,22±6,48 | (5,9-8,6) | 5,06±4,19 | 8,63±7,31 | 0,004 |
| Leve: <4n (%) | 32 (36) | (25,8-46,1) | 15 (42,9) | 17 (31,5) | 0,27 |
| Moderado: entre 4 y 16 n (%) | 47 (52,8) | (42,2-63,4) | 19 (54,3) | 28 (51,9) | 0,82 |
| Grave: entre 17-25 n (%) | 8 (9) | (2-15) | 1 (2,9) | 7 (13) | 0,14 |
| Muy grave≥25 n (%) | 2 (2,2) | (0-5) | 0 | 2 (3,7) | 0,52 |
| CNS media (DE) | 7,15±2,31 | (6,6-7,6) | 7,67±2,1 | 6,65±2,4 | 0,028 |
| Trombólisis n (%) | 5 (5) | (0,6-9,3) | 1 (2,6) | 4 (6,5) | 0,65 |
| Laboratorio | |||||
| Glucemia mediana | 123,5 | 104 | 137 | <0,001 | |
| Rango intercuartílico | (102,75-157,25) | (86-113) | (119,25-185) | ||
| Glóbulos blancos Media (DE) | 9361,8±3673,7 | (8636,3-10087,2) | 6758,9±2038,3 | 10999±3534,5 | <0,001 |
| PCR mediana | 0,88 | 0,73 | 1,37 | <0,001 | |
| Rango intercuartílico | (0,59-1,93) | (0,34-0,90) | (0,77-2,60) | ||
| ILG mediana | 1154,25 | 739,70 | 1403,95 | <0,001 | |
| Rango intercuartílico | (830,55-1526,4) | (589,30-901,42) | (1167,8-1951) | ||
| Comorbilidad | |||||
| Anemia n (%) | 10 (9,9) | (4,3-17) | 6 (15,4) | 4 (6,5) | 0,18 |
| FA n (%) | 20 (19,8) | (10,2-26) | 9 (23,1) | 11 (17,7) | 0,51 |
| IAM n (%) | 8 (7,9) | (2-12,9) | 2 (5,1) | 6 (9,7) | 0,48 |
| DBT n (%) | 21(20,8) | (11,9-28,5) | 4 (10,3) | 17(27,4) | 0,039 |
| ICC n (%) | 5(5) | (0,6-9,3) | 1 (2,6) | 4 (6,5) | 0,65 |
| IRC n (%) | 5(5) | (0,6-9,3) | 1 (2,6) | 4 (6,5) | 0,65 |
La mediana de la glucemia al azar fue 123,50mg/dl (rango intercuartílico:102,75-157,25mg/dl), la media de recuento de glóbulos blancos fue de 9.361,8 (IC 95%: 8.636,3-10.087,2) y la mediana de PCR fue 0,88mg/dl (rango intercuartílico: 0,59-1,93mg/dl). La mediana del ILG global fue de 1.154,25 (rango intercuartílico: 830-1.526,4). El 36% de los pacientes presentó un ACV leve, es decir, con una puntuación de NIHSS menor de 4 el 52,8% fue moderado y en aproximadamente un 11% la puntuación de NIHSS fue mayor a 17puntos. Las características de la población se detallan en la tabla 1.
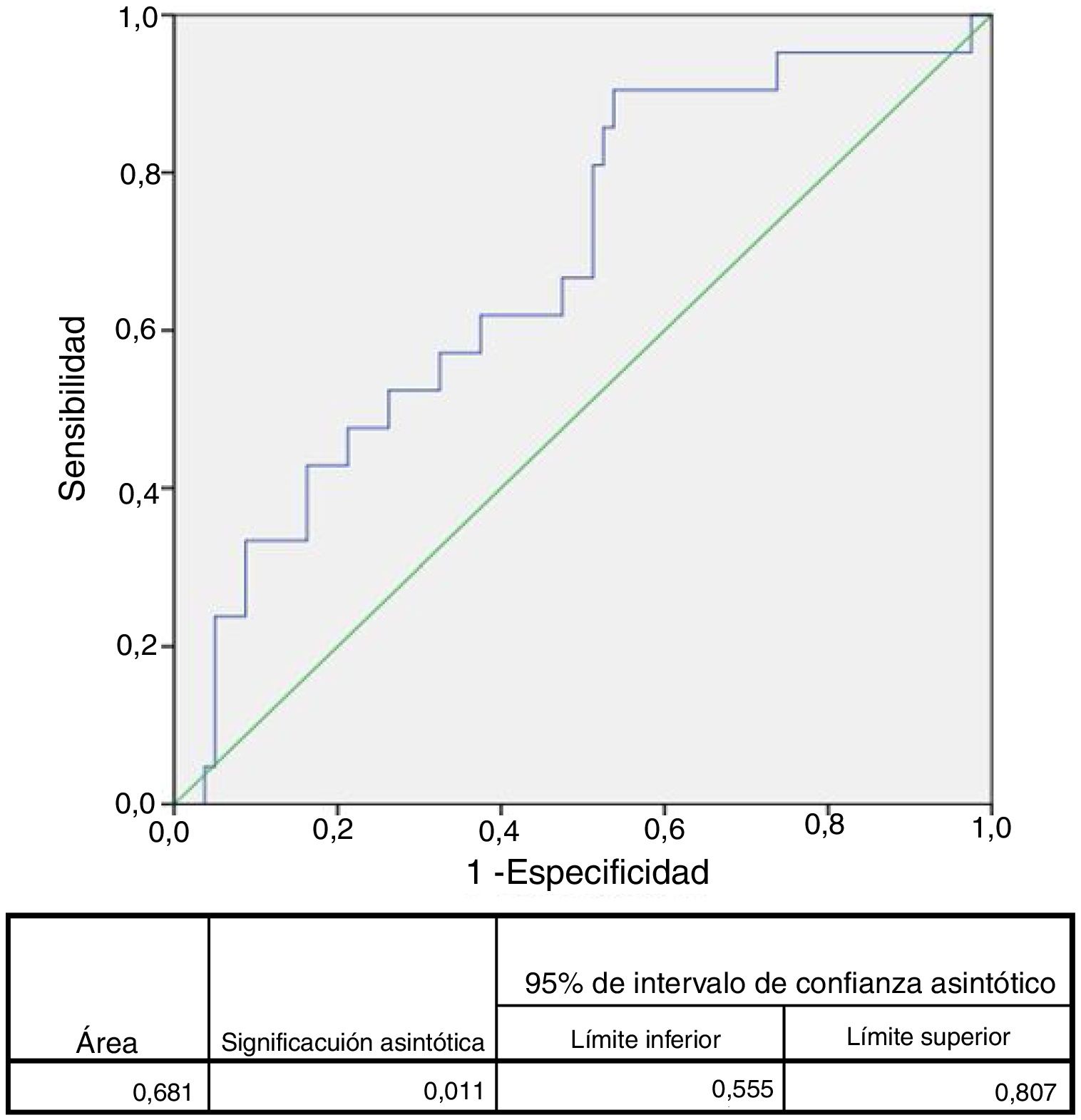
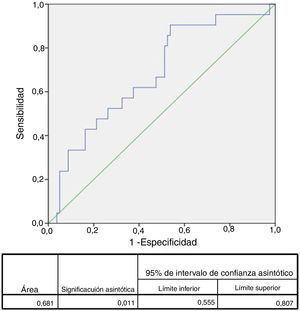
El área bajo la curva ROC para complicaciones mayores fue de 0,68 (IC 95%: 0,55-0,81) para ILG (fig. 1), 0,78 (IC 95%: 0,68-0,89) para SCN, 0,72 (IC 95%: 0,59-0,85) para PCR, 0,65 (IC 95%: 0,50-0,80) para glucemia y 0,58 (IC 95%:0,44-0,73) para edad. Se eligieron los siguientes puntos de corte para las variables continuas: ILG 1.021 (S: 90% y E: 46%), CNS: 6 (S: 67% y E: 82%), PCR: 1,50mg/dl (S: 70% y E: 77%), glucemia 129mg/dl (S: 62% y E: 65%) y edad: 70 años (S: 57% y E: 48%).
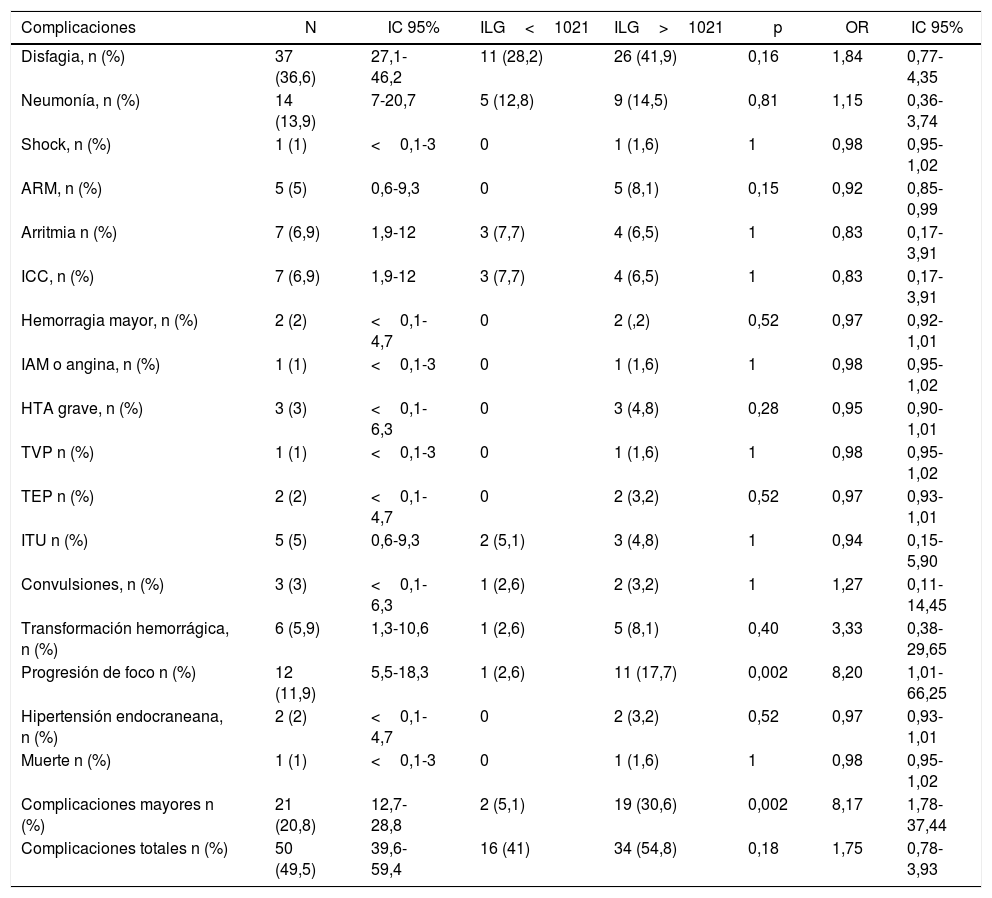
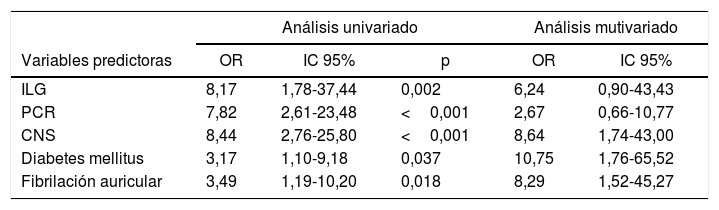
En el análisis univariado el ILG mayor a 1.021 se asoció significativamente con el desarrollo de complicaciones mayores —OR: 8,17 (IC 95%: 1,78-37,44)— (tabla 2). Las complicaciones mayores se asociaron también con severidad de ACV isquémico al ingreso (CNS<6) —OR: 8,44 (IC 95%: 2,76-25,80)—, antecedentes de diabetes —OR: 3,17 (IC 95%: 1,10-9,18)—, PCR (>1,5mg/dl) —OR: 7,82 (IC 95%: 2,61-23,48)— y antecedentes de fibrilación auricular —OR: 3,49 (IC 95%: 1,19-10,20)— (tabla 3). En un modelo de regresión logística multivariado el ILG>1.021 ajustado por diabetes, CNS, PCR y fibrilación auricular no se asoció significativamente con el desarrollo de complicaciones —OR: 6,24 (IC 95%: 0,90-43,43)— (tabla 3).
Evaluación de complicaciones según Índice leucoglucémico
| Complicaciones | N | IC 95% | ILG<1021 | ILG>1021 | p | OR | IC 95% |
|---|---|---|---|---|---|---|---|
| Disfagia, n (%) | 37 (36,6) | 27,1-46,2 | 11 (28,2) | 26 (41,9) | 0,16 | 1,84 | 0,77-4,35 |
| Neumonía, n (%) | 14 (13,9) | 7-20,7 | 5 (12,8) | 9 (14,5) | 0,81 | 1,15 | 0,36-3,74 |
| Shock, n (%) | 1 (1) | <0,1-3 | 0 | 1 (1,6) | 1 | 0,98 | 0,95-1,02 |
| ARM, n (%) | 5 (5) | 0,6-9,3 | 0 | 5 (8,1) | 0,15 | 0,92 | 0,85-0,99 |
| Arritmia n (%) | 7 (6,9) | 1,9-12 | 3 (7,7) | 4 (6,5) | 1 | 0,83 | 0,17-3,91 |
| ICC, n (%) | 7 (6,9) | 1,9-12 | 3 (7,7) | 4 (6,5) | 1 | 0,83 | 0,17-3,91 |
| Hemorragia mayor, n (%) | 2 (2) | <0,1-4,7 | 0 | 2 (,2) | 0,52 | 0,97 | 0,92-1,01 |
| IAM o angina, n (%) | 1 (1) | <0,1-3 | 0 | 1 (1,6) | 1 | 0,98 | 0,95-1,02 |
| HTA grave, n (%) | 3 (3) | <0,1-6,3 | 0 | 3 (4,8) | 0,28 | 0,95 | 0,90-1,01 |
| TVP n (%) | 1 (1) | <0,1-3 | 0 | 1 (1,6) | 1 | 0,98 | 0,95-1,02 |
| TEP n (%) | 2 (2) | <0,1-4,7 | 0 | 2 (3,2) | 0,52 | 0,97 | 0,93-1,01 |
| ITU n (%) | 5 (5) | 0,6-9,3 | 2 (5,1) | 3 (4,8) | 1 | 0,94 | 0,15-5,90 |
| Convulsiones, n (%) | 3 (3) | <0,1-6,3 | 1 (2,6) | 2 (3,2) | 1 | 1,27 | 0,11-14,45 |
| Transformación hemorrágica, n (%) | 6 (5,9) | 1,3-10,6 | 1 (2,6) | 5 (8,1) | 0,40 | 3,33 | 0,38-29,65 |
| Progresión de foco n (%) | 12 (11,9) | 5,5-18,3 | 1 (2,6) | 11 (17,7) | 0,002 | 8,20 | 1,01-66,25 |
| Hipertensión endocraneana, n (%) | 2 (2) | <0,1-4,7 | 0 | 2 (3,2) | 0,52 | 0,97 | 0,93-1,01 |
| Muerte n (%) | 1 (1) | <0,1-3 | 0 | 1 (1,6) | 1 | 0,98 | 0,95-1,02 |
| Complicaciones mayores n (%) | 21 (20,8) | 12,7-28,8 | 2 (5,1) | 19 (30,6) | 0,002 | 8,17 | 1,78-37,44 |
| Complicaciones totales n (%) | 50 (49,5) | 39,6-59,4 | 16 (41) | 34 (54,8) | 0,18 | 1,75 | 0,78-3,93 |
Análisis univariado y multivariado para las variables predictoras de complicaciones mayores
| Análisis univariado | Análisis mutivariado | ||||
|---|---|---|---|---|---|
| Variables predictoras | OR | IC 95% | p | OR | IC 95% |
| ILG | 8,17 | 1,78-37,44 | 0,002 | 6,24 | 0,90-43,43 |
| PCR | 7,82 | 2,61-23,48 | <0,001 | 2,67 | 0,66-10,77 |
| CNS | 8,44 | 2,76-25,80 | <0,001 | 8,64 | 1,74-43,00 |
| Diabetes mellitus | 3,17 | 1,10-9,18 | 0,037 | 10,75 | 1,76-65,52 |
| Fibrilación auricular | 3,49 | 1,19-10,20 | 0,018 | 8,29 | 1,52-45,27 |
La hiperglucemia es un hallazgo frecuente en pacientes con ACV isquémico independientemente del momento en el que se evalúe (en ayunas o al azar). Entre los mecanismos que pueden explicar la hiperglucemia en los pacientes con ACV se encuentran las alteraciones previas del metabolismo de la glucosa. Una proporción importante de los pacientes con ACV y sin antecedentes de diabetes mellitus que desarrollan hiperglucemia durante el ACV presentan durante el seguimiento insulinorresistencia. Por otra parte, se sabe que luego de un ACV isquémico se produce activación del eje hipotálamo hipófisis adrenal, con incremento en los niveles séricos de cortisol y una activación del sistema nervioso autónomo simpático. La afectación de la ínsula, que envía proyecciones a áreas del sistema nervioso autónomo, se ha vinculado con el desarrollo de hiperglucemia21.
Se han propuesto diversos mecanismos por los cuales la hiperglucemia puede afectar el resultado neurológico de los pacientes con ACV isquémico, entre ellos un efecto protrombótico de la hiperglucemia y antifibrinolítico mediado por hiperinsulinemia. También se ha reportado un efecto inhibidor de la vasodilatación que podría comprometer la perfusión del área de penumbra, y un incremento en la generación de especies reactivas del oxígeno en el contexto de la reperfusión. En estudios clínicos se ha observado un incremento de la mortalidad y peores resultados neurológicos asociados a hiperglucemia21,22.
La liberación de citoquinas y la inflamación del parénquima isquémico luego de un ACV se ha asociado significativamente con peores resultados neurológicos en estudios clínicos23. La magnitud de la leucocitosis predice discapacidad y mayor volumen del área isquémica, y se asocia con la severidad del mismo al ingreso24.
El índice leucoglucémico ha demostrado ser un predictor de muerte e insuficiencia cardiaca en pacientes con infarto agudo de miocardio con elevación del ST10,11. Un ILG mayor a 1.400 aumentó más de 3 veces el riesgo de complicaciones9.
Consideramos que el ILG puede ser un indicador de la respuesta inflamatoria sistémica y adrenérgica relacionada con el ACV isquémico y, por lo tanto, un predictor de las complicaciones asociadas.
Nosotros observamos una mayor incidencia de progresión del foco neurológico durante su seguimiento en los pacientes con ILG elevado (tabla 2).
Con respecto al desenlace de complicaciones mayores observamos una mayor incidencia en el grupo de pacientes con ILG elevado que fue estadísticamente significativa, aunque la asociación no se mantuvo cuando se ajustó por potenciales confundidores en el análisis multivariado (tabla 3).
Dentro de las limitaciones del estudio cabe mencionar una incidencia de eventos sustancialmente menor que la estimada (20,8% vs. 40%). Consideramos que esto se debió a que el 36% de los pacientes tuvo un NIHSS menor a 4. Esta reducción en la incidencia de complicaciones limita el análisis multivariado y la extracción de conclusiones sobre el valor del ILG como predictor independiente de complicaciones mayores.
También se debe mencionar que la muestra estuvo conformada por un grupo de pacientes internados en sala general de clínica médica, por lo que se podría considerar que están subrepresentados los pacientes con ACV más grave. Tampoco se realizó seguimiento de los pacientes durante su estancia en la unidad de cuidados críticos, por lo que se pueden haber subestimado aquellas complicaciones posteriores a la que motivó el ingreso en dicha área.
Por último, se menciona que los asesores no fueron ciegos a la exposición y por lo tanto existe riesgo de sesgo.
Hasta el momento no se encontró asociación estadísticamente significativa entre ILG y el desarrollo de complicaciones mayores en pacientes con ACV isquémico. El ILG es un método sencillo y de bajo costo, pero se necesitarán otros estudios para establecer dicha asociación.
Conflicto de interesesNinguno para declarar.