En el año 2006, el Grupo de Trabajo de Enfermedades del Sistema Nervioso Periférico de la Sociedad Neurológica Argentina publicó una Guía para la utilización de la inmunoglobulina endovenosa (IGEV) en enfermedades neuromusculares. Luego de 10 años, el grupo presenta esta actualización, en la cual se revisa sistemáticamente la literatura publicada desde 1980 hasta 2015, con un análisis uniforme, y se recomienda su utilización para cada indicación acorde con criterios internacionales. Estas recomendaciones han sido consensuadas por los miembros del grupo, a lo cual se agrega la experiencia de los autores en algunas circunstancias clínicas determinadas que se detallan explícitamente. Este trabajo no pretende ser excluyente de otras indicaciones, pero sí una guía de práctica clínica basada en la evidencia, que ayude para el neurólogo en el tratamiento de enfermedades del sistema nervioso periférico. Se han considerado 10 temas distintos vinculados al uso de la IGEV: 1) Mecanismos de acción; 2) Neuropatías agudas; 3) Neuropatías crónicas; 4) Neuropatías por paraproteinemias; 5) Enfermedades de la unión neuromuscular; 6) Enfermedades del músculo; 7) Ganglionopatías y neuropatías de fibras finas; 8) Síndrome de la persona rígida y síndrome de post-polio; 9) Dosis y regímenes de administración y, por último, 10) Eventos adversos.
In 2006 the Peripheral Nervous System Diseases’ Work Group of the Argentine Neurological Society published a «Guide for the use of Intravenous Immunoglobulin (IVIG) in Neuromuscular Diseases». After 10 years, the Group presents this update, which systematically reviews the literature published from 1980 to 2015, with a uniform analysis, and recommends its use for each indication according to international criteria. These recommendations have been agreed upon by the members of the Group, adding the experience of the authors in certain specific clinical circumstances that are explicitly detailed. This paper is not intended to exclude other indications, but an Evidence-Based Clinical Practice Guide, which could help the neurologist in the treatment of diseases of the peripheral nervous system. Ten different topics related to the use of IVIG have been considered: 1) Mechanisms of action; 2) Acute Neuropathies; 3) Chronic Neuropathies; 4) Paraproteinemic neuropathies; 5) Diseases of the Neuromuscular Junction; 6) Muscle Diseases; 7) Ganglionopathies and Small Fiber Neuropathies; 8) Stiff Person Syndrome and Post-Polio Syndrome; 9) Posology and Dosage Regimen and, finally, 10) Adverse Events.
Desde hace más de 35 años que se utiliza la inmunoglobulina endovenosa (IGEV) para el tratamiento de distintas enfermedades. Inicialmente, fue utilizada en hematología en 1981 para el tratamiento de la púrpura trombocitopénica idiopática1. Luego, en la década del 90, se inició su utilización en enfermedades neurológicas autoinmunitarias, mayormente del sistema nervioso periférico (SNP).
Su uso ha sido empírico en un gran número de síndromes y enfermedades, y en pocas patologías se ha probado su indicación fehacientemente. Gran parte de la información que los neurólogos tomamos como cierta se basa sobre experiencias realizadas en el tratamiento de enfermedades hematológicas.
En el 2006, el Grupo de Enfermedades del Sistema Nervioso Periférico de la Sociedad Neurológica Argentina (GP-SNA) publicó las Guías para la utilización de la IGEV en enfermedades del SNP2. Diez años más tarde, actualizamos las recomendaciones para el uso de IGEV en el tratamiento de distintos síndromes y enfermedades autoinmunes del SNP.
Con el objetivo de colaborar con el neurólogo en el tratamiento de enfermedades del SNP, el GP-SNA ha generado esta guía de práctica clínica basada en la evidencia realizando una revisión sistemática del material publicado entre 1980 y 2015 sobre la utilización de la IGEV en el tratamiento de las enfermedades del SNP. Los resultados de dicha búsqueda se han discutido grupalmente en reuniones mensuales periódicas de los autores, desde noviembre del 2015 hasta diciembre del 2016, categorizando la evidencia y consensuando las recomendaciones. Se han adicionado en forma explícita las experiencias clínicas de los participantes, especialmente en enfermedades o situaciones poco frecuentes sobre las que no se dispone de información de jerarquía.
Material y métodosRevisión sistemática de la literaturaSe realizó una búsqueda bibliográfica a través de las bases de datos Pubmed y Lilacs, con un límite temporal entre los años 1980 a 2015. Los términos (palabras clave) utilizados fueron: inmunoglobulina, intravenosa/endovenosa, SNP, síndrome de persona rígida (SPR), neuropatías agudas, neuropatías crónicas, miopatías, miastenia grave (MG), neuropatías por paraproteinemias, ganglionopatías, neuropatías de fibras finas (NFF), síndrome post-polio, dosis, administración y eventos adversos. Se seleccionó el material publicado con mayor nivel de evidencia y se obviaron las revisiones narrativas, las cartas, los editoriales y los estudios en modelos animales. Los resultados fueron presentados en reuniones mensuales desde noviembre del 2015 hasta diciembre del 2016 y discutidos grupalmente. Se arribó a un consenso sobre los niveles de evidencia del material publicado y sus grados de recomendación, acorde con la discusión grupal. En enfermedades o situaciones clínicas poco frecuentes, sobre las que no se ha encontrado material con validez suficiente, se ha incluido la experiencia de los autores, explicitándose en cada caso. Como guía para el ordenamiento de esta tarea se consideró la propuesta para la unificación de criterios metodológicos en la elaboración de guías de práctica clínica de la SNA de Barboza y Romano3.
Clasificación de la evidenciaPara clasificar en niveles de evidencia las investigaciones publicadas, se adoptó fundamentalmente el modelo europeo, utilizado por el grupo de SNP de la Federación Europea de Sociedades Neurológicas4, y se consideró también el de la American Academy of Neurology5, que se detallan a continuación:
Clase I: estudio clínico controlado, prospectivo, aleatorizado, doble ciego, con una medición del outcome (resultado) enmascarado, en una población representativa. Revisión sistemática de estudios controlados, prospectivos, aleatorizados, con outcome enmascarado en poblaciones representativas.
Requerimientos:
Aleatorización
Objetivo(s) primario(s) claramente definido(s).
Criterios de inclusión y exclusión claramente definidos.
Contabilidad adecuada de los abandonos para evitar potencial sesgo.
Para estudios de equivalencia de 2 fármacos (o no inferioridad) se requiere:
1. Que los autores declaren que se excluya (o no) una diferencia clínicamente significativa al definir el límite/umbral de equivalencia o de no inferioridad.
2. El tratamiento estándar en ese estudio es similar al tratamiento estándar usado en estudios previos donde se establece la eficacia para ese tratamiento.
3. Los criterios de inclusión/exclusión y los outcomes en los pacientes en tratamiento estándar son comparables con estudios previos, donde se establece la eficacia para ese tratamiento estándar.
4. La interpretación de los resultados del estudio está basado en un análisis propio de ese protocolo y que tiene en cuenta a sus propios abandonos o entrecruzamientos1i.
Clase II: estudio clínico controlado prospectivo, de cohortes comparativas (no aleatorizado), doble ciego, con medición enmascarada del objetivo, en una población representativa.
Requerimientos:
- a.
Aleatorización.
- b.
Objetivo(s) primario(s) claramente definido(s).
- c.
Criterios de inclusión y exclusión claramente definidos.
- d.
Contabilidad adecuada de los abandonos para evitar potencial sesgo.
- e.
Para estudios de equivalencia de 2 fármacos (o no inferioridad) se requiere: (véase antes).
Pero que carece uno de los requerimientos del a. al e., o estudio prospectivo:
- –
Cohortes comparativas (no aleatorizado).
- –
Población representativa.
- –
Medición del outcome (enmascarada y objetiva).
- –
Doble ciego.
Clase III: todos los otros estudios controlados en poblaciones representativas, donde la medición del outcome es independiente o es una medida objetiva.
Demás estudios:
- –
Controlados (incluidos controles históricos o pacientes que sirven como sus propios controles).
- –
Poblaciones representativas.
- –
Donde la medición del outcome es independientemente evaluada o deriva de una medición objetiva1iii.
Clase IV: estudios no controlados, serie de casos, reporte de casos, opinión de expertos.
En cuanto a los grados de recomendación, se consideraron:
- –
Grado A: efectividad, inefectividad o daño comprobados en 2 estudios de bases sólidas (consistentes) de clase I (en casos excepcionales un solo estudio clase I alcanza para grado A si la magnitud del efecto es muy grande).
- –
Grado B: efectividad, inefectividad o daño probables en un estudio clase I o 2 estudios consistentes de clase II.
- –
Grado C: efectividad, inefectividad o daño posibles en un estudio de clase II o 2 estudios consistentes de clase III.
- –
Grado U: Datos inadecuados o conflictivos. Dado el conocimiento actual dicho tratamiento no está probado.
Buena práctica: solo si hay un estudio clase IV pero el consenso lo aprueba4.
ResultadosMecanismos de acciónLa inmunoglobulina G (IgG) es la inmunoglobulina más abundante en el plasma, es monomérica y es producida en grandes cantidades por los linfocitos B durante respuestas secundarias a antígenos (Ag). Tiene una vida media de entre 2 y 3 semanas. Está compuesta por 2 cadenas polipeptídicas globulares pesadas y 2 cadenas livianas unidas entre sí por puentes disulfuro. Ambas cadenas presentan una zona constante (c) y una zona variable (v). En esta última se encuentra una zona hipervariable formada por 10 a 15 aminoácidos que conforman el receptor idiotípico (r) responsable de la unión con el epítope presente en el Ag. A su vez, tiene 2 fragmentos funcionales críticos para su actividad: uno se une al Ag (Fab) y determina la especificidad de la molécula, y otro constante o cristalizable (Fc), que es fundamental para la iniciación de respuestas efectoras, tales como la activación de la vía del complemento. La IGEV utilizada para el tratamiento es un preparado de gammaglobulinas altamente purificadas extraídas de un depósito de plasma humano obtenido de entre 3.000 a 10.000 donantes sanos que además contiene escasa cantidad de IgA, IgM, CD4, CD8, moléculas de HLA y citocinas. Se calcula que la IGEV posee anticuerpos (Ac) con aproximadamente 10 millones de especificidades diferentes6.
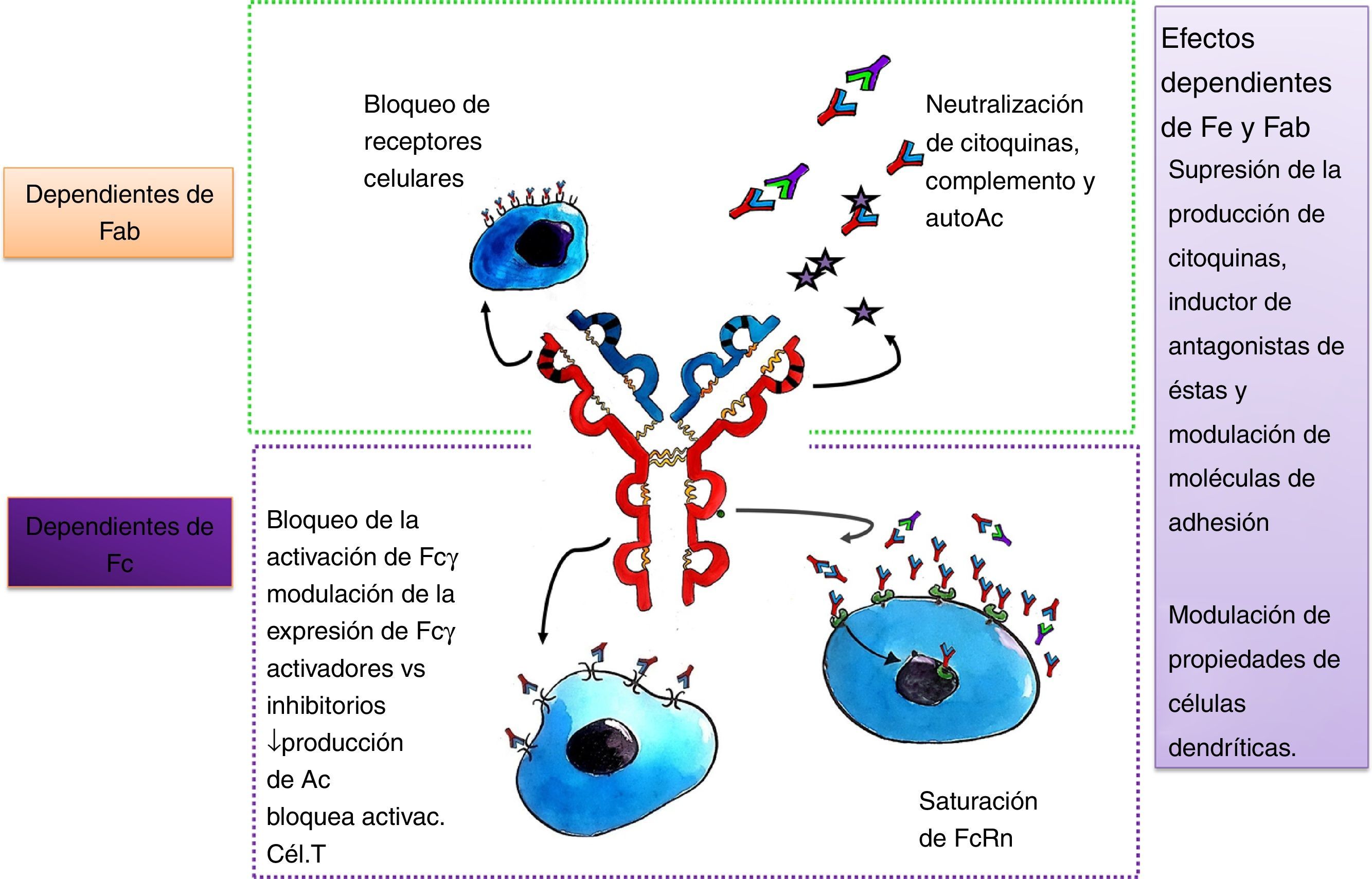
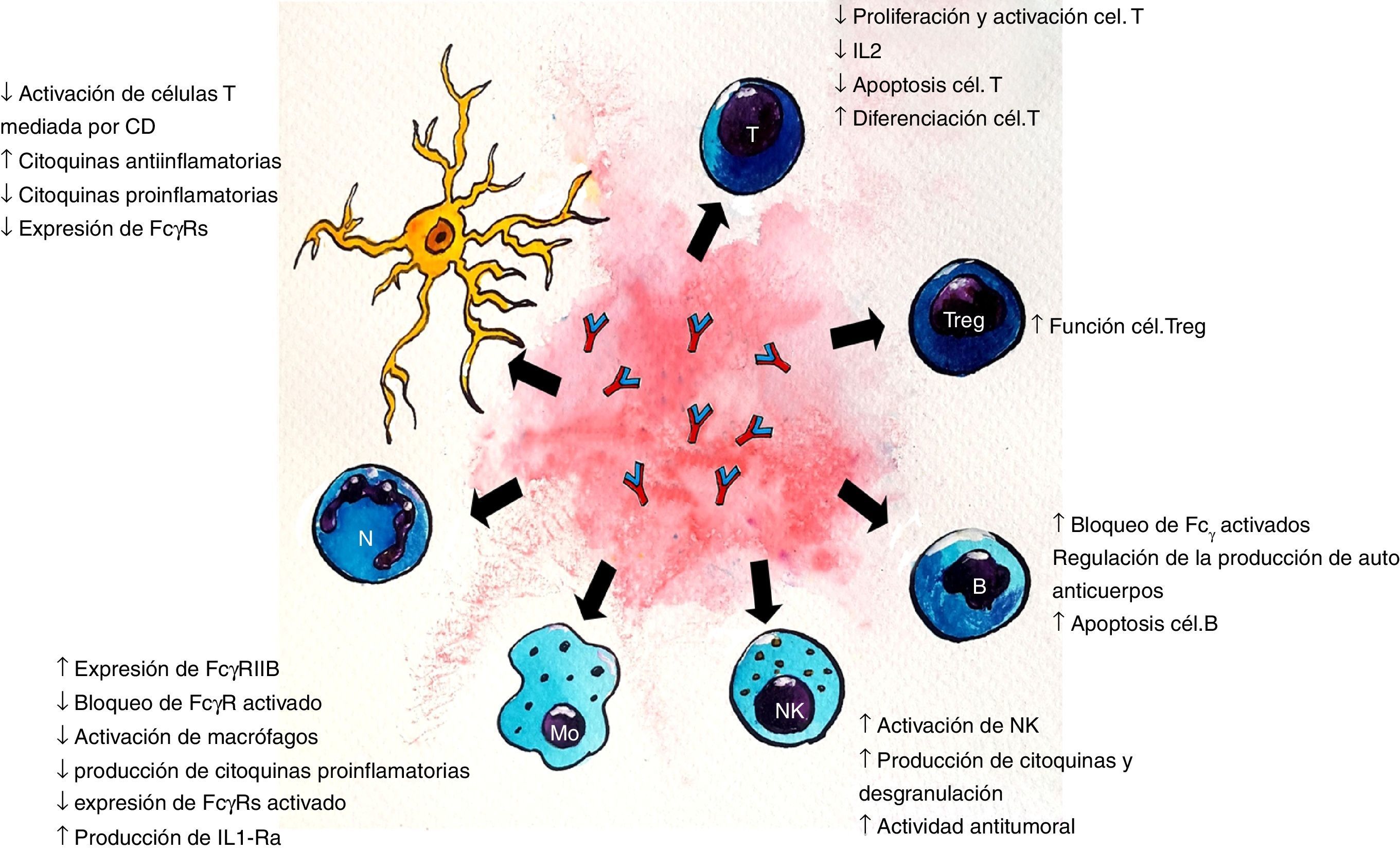
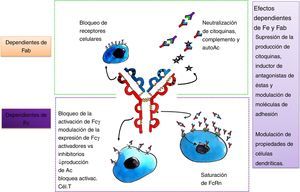
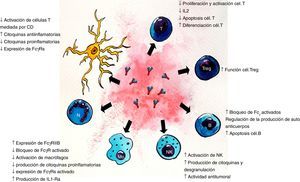
Dada la heterogeneidad de enfermedades neurológicas que responden al tratamiento con IGEV, es probable que su eficacia esté determinada por vías inmunomediadas específicas para cada enfermedad. Los diferentes mecanismos propuestos (figs. 1 y 2) no son mutuamente excluyentes y probablemente muchos de ellos contribuyan al efecto terapéutico final7. Para identificar las acciones de la IGEV que son más importantes en una enfermedad en particular, se debe entender la patogénesis de la misma, teniendo en cuenta que las enfermedades neurológicas inmunomediadas tienen diferencias fisiopatológicas importantes, por ejemplo, para enfermedades mediadas por Ac contra un determinado Ag, tales como la MG, el fragmento Fab interactúa con el receptor de acetilcolina (AChR) en la placa neuromuscular7,8. En el síndrome de Guillain-Barré (SGB) y sus variantes, se combinan mecanismos de inmunidad humoral y celular7,9. Otros mecanismos podrían derivar de los varios Ac antiidiotípicos, derivados de múltiples donantes, que están presentes en las preparaciones de IGEV. Diversos Ac autorreactivos han sido encontrados en la preparación de IGEV, tales como citocina-específicos, específicos para tipo celular y específicos antimoléculas de adhesión. Además de brindar especificidad a la IgG, la región Fab también parece intervenir en la neutralización de proteínas activadas por el complemento, incluyendo anafilotoxinas C3a y C5a5,7,8. El fragmento Fab que se une al Ag (también llamado idiotipo) puede ser reconocido por el sistema inmunitario y generar una respuesta con producción de Ac específicos dirigidos al mismo, llamados Ac antiidiotipo. Estos Ac son importantes para la regulación de linfocitos B y T, ya que pueden unirse a las IgG de superficie del linfocito B y estimular o inhibir la formación posterior de Ac. De esta misma forma, los Ac antiidiotipo se pueden ligar a los receptores de la célula T que es específica para el Ag y regular su actividad. Un Ac antiidiotipo propio puede suscitar una respuesta inmune y producir otro Ac con especificidad semejante al idiotipo que lo estimuló, y así se forman generaciones sucesivas de idiotipos y antiidiotipos. Esta red idiotípica sería crucial para la regulación de la inmunidad y también reflejaría una función inmunomoduladora de los preparados de IGEV. La IGEV puede ser un medio para proveer regulación y restauración de la red antiidiotípica a los individuos con autoanticuerpos5.
Neuropatías agudasLas neuropatías agudas inmunomediadas conforman como grupo las entidades más frecuentes dentro de las enfermedades del SNP en las cuales se ha investigado la utilidad del tratamiento con IGEV. Dentro de este grupo, el SGB es el más frecuente. Si bien los detalles clínico patológicos del SGB y sus variantes exceden el presente trabajo, debemos mencionar las distintas formas de presentación del síndrome: el SGB clásico o polirradiculoneuropatía aguda desmielinizante, el síndrome de Miller Fisher, las formas axonales como la neuropatía axonal aguda motora (AMAN) y la neuropatía axonal aguda sensitivo motora y otras variantes poco frecuentes, como la pandisautonomía aguda, el síndrome faringocervicobraquial y el SGB sensitivo puro2,10, que serán considerados como grupo con respecto a la terapéutica con IGEV.
La incidencia aproximada es de 1-2 por 100.000 habitantes por año es más frecuente en hombres y aumenta con la edad11. Generalmente, es precedida por una infección u otro estímulo inmunogénico (2 tercios de los pacientes adultos presentan síntomas de infección respiratoria o gastrointestinal dentro de las 4 semanas previas al inicio de la debilidad12).
En el SGB clásico, la respuesta autoinmune va dirigida contra la célula de Schwann, generando una desmielinización segmentaria, pero se desconoce hasta el momento el Ag implicado. En las variantes axonales la respuesta autoinmune va dirigida contra los gangliósidos de la membrana nodal2,12. La enteritis por Campylobacter jejuni esta comúnmente asociada con la variante axonal AMAN10. En estos pacientes se ha descripto la presencia de Ac anti-GM1 y suelen tener peor pronóstico2.
Se ha discutido la relación entre la vacuna contra el virus H1N1 influenza A en 2009 y SGB11,12 y actualmente la relación entre el SGB y la infección aguda por arbovirus (p. ej., zika y chinkungunya) es tema de alto interés epidemiológico. Hasta el momento, no hay información de su incidencia, se aguardan resultados de los estudios de casos y controles que se están llevando a cabo12.
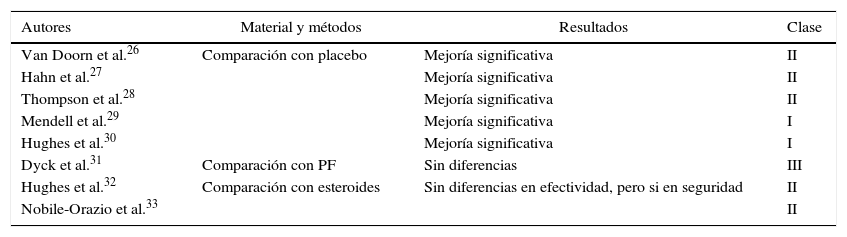
El SGB es potencialmente letal, por lo que los cuidados médicos y el tratamiento inmunológico son esenciales. Múltiples estudios aleatorizados y controlados contra placebo (del inglés randomized controlled trial [RCT]) que evaluaron el efecto de la inmunoterapia en SGB se han realizado en las últimas décadas. La plasmaféresis (PF) y la IGEV mostraron ser efectivas. Resumiremos el material publicado más significativo y los niveles de evidencia asignados en la tabla 1.
Resumen de publicaciones sobre tratamiento con IGEV en el síndrome de Guillain-Barré y los niveles de evidencia asignados
| Autores | Materiales y Métodos | Resultados | Clase |
|---|---|---|---|
| Van der Meché et al.13 | Comparación IGEV/PF | Sin diferencias significativas | I |
| Bril et al.14 | Comparación IGEV/PF | Sin diferencias significativas | III |
| Van Koningsveld et al.15 | IGEV con y sin agregado de metilprednisolona | Sin diferencias significativas | I |
| Nomura et al.16 | Comparación IGEV/PF | Sin diferencias significativas | III |
| Diener et al.17 | Comparación IGEV/PF | Sin diferencias significativas | III |
| Mori et al.18 | Comparación IGEV/PF en Miller Fisher | Sin diferencias significativas | IV |
| Charra et al.19 | Comparación IGEV/PF en ARM | IGEV mejor en ARM | III-IV |
| French GBS Group20 | IGEV (contraindicación PF) | IGEV mejor en ARM | IV |
PF: plasmaféresis.
El tratamiento con IGEV (como con PF) ha comprobado ser efectivo para el SGB (grado de recomendación: A) en dosis de 0,4 g/kg/día por 5 días en pacientes que no puedan caminar más de 10 m dentro de las 2 primeras semanas de inicio de los síntomas. No se dispone de información válida que avale el uso de IGEV o PF en forma secuencial, si hubiera fracaso de una de ellas, ni sobre la asociación con esteroides (grado de recomendación: U).
Neuropatías crónicasLa polineuropatía desmielinizante inflamatoria crónica (del inglés chronic inflammatory demyelinating polyneuropathy [CIDP]) es una entidad inmunomediada adquirida que afecta al SNP. Los mecanismos fisiopatológicos no son bien conocidos, pero intervienen tanto procesos humorales como celulares21,22. Evoluciona en forma crónica y progresiva o en recaídas; en el líquido cefalorraquídeo puede observarse disociación inmunocitológica23, en la exploración electrofisiológica se demuestra un patrón desmielinizante y en la histología de los nervios signos de desmielinización segmentaria, remielinización e infiltrados inflamatorios.
Desde 1985ha habido numerosos reportes y series de casos, estudios abiertos no comparados, considerados de clase III y IV que mostraron una mejoría de la CIDP con IGEV, que fueron detallados en la guía de la SNA de 20062 y han sido mencionados en guías y recomendaciones de otros países24,25.
Recientemente, se han publicado trabajos que consideramos clases I, II y III, comparando los efectos de IGEV con placebo, PF, metilprednisona y metilprednisolona, que resumimos en la tabla 2.
Resumen de las publicaciones sobre tratamiento con IGEV en CIDP y los niveles de evidencia asignados
| Autores | Material y métodos | Resultados | Clase |
|---|---|---|---|
| Van Doorn et al.26 | Comparación con placebo | Mejoría significativa | II |
| Hahn et al.27 | Mejoría significativa | II | |
| Thompson et al.28 | Mejoría significativa | II | |
| Mendell et al.29 | Mejoría significativa | I | |
| Hughes et al.30 | Mejoría significativa | I | |
| Dyck et al.31 | Comparación con PF | Sin diferencias | III |
| Hughes et al.32 | Comparación con esteroides | Sin diferencias en efectividad, pero si en seguridad | II |
| Nobile-Orazio et al.33 | II |
La IGEV ha comprobado ser efectiva en el tratamiento de la CIDP (grado de recomendación: A). Las dosis, la frecuencia y la duración de los tratamientos pueden tener variación de acuerdo con la evolución clínica.
Neuropatías por paraproteinemiasLas neuropatías asociadas a gammapatías monoclonales o paraproteínas forman un grupo heterogéneo que incluye predominantemente neuropatías desmielinizantes, y en menor proporción, neuropatías con un patrón mixto (axonal y desmielinizante)34. Las inmunoglobulinas involucradas pueden ser IgM, IgG o IgA. Las IgM han sido mejor caracterizadas basadas sobre el hallazgo de que la proteína monoclonal IgM reacciona contra glucoproteínas o glucolípidos. Se cree que la base patogénica es desmielinizante en estas últimas, vinculada a la presencia en suero de Ac anti-MAG, antisulfátidos, anti-GM1 y anti-GD134,35.
Desde 1991 hasta 2001, varios autores35-41 han publicado sus experiencias con IGEV37 (estudios clase III/IV) con resultados variables. Dalakas et al.38 comparan IGEV contra placebo en 11 pacientes con polineuropatía desmielinizante IgM anti-MAG (+), con enfermedad crónica y refractaria a otros tratamientos, encontrando cierta mejora. Gorson et al.39 encuentran beneficio en pocos pacientes con gammapatía IgM y en 2002 publican su experiencia en pacientes con gammapatía IgG con mejoría transitoria en menos del 50% de los pacientes40.
El primer estudio multicéntrico, aleatorizado, cruzado, controlado con placebo (clase I) fue llevado a cabo por Comi et al.41 en el 2002, en 22 pacientes con neuropatía IgM anti-MAG(+)40. Este estudio demostró a las 4 semanas una mejoría significativa de la discapacidad de los miembros, así como en la marcha, la fuerza manual y las pruebas sensitivas en los pacientes tratados con IGEV.
RecomendaciónEl tratamiento con IGEV de las neuropatías por paraproteinemias es probablemente efectivo (grado de recomendación: B). El estudio clase I favorable (paraproteinemia IgM) indica la necesidad de ensayos a largo plazo y también justifica su uso en la práctica clínica según el criterio clínico del médico tratante.
Enfermedades de la unión neuromuscularA. Miastenia graveEn la MG se deben considerar el tratamiento sintomático con inhibidores de la acetilcolinesterasa42-44 (p. ej., bromuro de piridostigmina) y el tratamiento inmunomodulador con prednisona45,46, timectomía47, azatioprina48,49, ciclosporina50, metotrexato51, micofenolato mofetilo52, rituximab53-55, tacrolimús56,57 y ciclofosfamida58,59. La IGEV60 y la PF61-64 son indicadas como tratamiento inmunomodulador durante la exacerbación de la enfermedad43,65.
En las exacerbaciones de MG, 4 estudios RCT valoran la utilidad de IGEV. Un estudio contra placebo (clase I) comparó IGEV 2 g/kg contra dextrosa 5% administrados durante 2 días, en 51 pacientes, obteniendo una mejoría significativa en la escala cuantitativa de MG (Quantitative Myasthenia Gravis Score) en el grupo con IGEV a los 14 días postinfusión, con un efecto sostenido por 28 días66.
Un estudio (clase I) comparó distintas dosis de IGEV (1 g/kg y 2 g/kg) en 168 pacientes, sin encontrar diferencias67.
Dos RCT compararon IGEV con PF, sin demostrar diferencias significativas. En uno (clase I) se comparó IGEV 2 g/kg contra PF68. En el segundo (clase III), se comparó PF con distintas dosis de IGEV (1,2 g/kg y 2 g,/kg), sin evidenciar diferencias entre los 3 grupos69.
En cuanto al tratamiento de mantenimiento o a largo plazo en MG moderada a severa, se identificaron 2 estudios RCT y 3 series de casos. El estudio de Ronager 2001 (clase III) comparó la eficacia de 2 g/kg de IGEV con PF sin encontrar diferencias significativas70. En el estudio de Wolfe 2002 (clase III) se comparó IGEV contra placebo; no evidenció diferencias71. Tres estudios prospectivos no controlados y 2 retrospectivos (clase IV) incluyeron a pacientes con MG moderada a severa o con respuesta insuficiente a inmunosupresores, tratados con IGEV 2 g/kg y luego mantenimiento con 0,4 g/kg, con frecuencia mensual durante 1-2 años. Todos ellos mostraron mejoría clínica determinada por las escalas correspondientes y disminución de los requerimientos de inmunosupresores72-76.
Para la prevención de exacerbaciones en el período perioperatorio (p. ej., pretimectomía), se identificaron estudios (clases III y IV) que no evidenciaron diferencias en la comparación de IGEV con PF77,78. Los autores recomiendan como buena práctica infusión de IGEV durante el período pre o posquirúrgico solo en pacientes seleccionados, según el contexto clínico. Se encuentra en curso un estudio prospectivo, aleatorizado, doble ciego, que compara IGEV contra placebo en pacientes con MG que van a ser sometidos a cirugía con anestesia general79.
Si bien no hay estudios que justifiquen la utilización de IGEV o PF durante el embarazo y la IGEV atraviesa la placenta luego de la semana 30-32 de gestación, algunas publicaciones y los autores de esta publicación consideran que la IGEV puede ser efectiva y segura (categoríaC de la Food and Drug Administration) cuando existe debilidad severa, que pone en riesgo a la madre y al feto80-83.
La experiencia con IGEV en MG AChRA negativo/anti-MuSK positivo consiste en reportes y series de casos (clase IV) que muestran ocasional beneficio en estos pacientes69,84,85.
Recomendación- 1.
El tratamiento con IGEV en las exacerbaciones de la MG ha comprobado ser efectivo, sin encontrarse diferencias entre IGEV y PF (grado de recomendación: A).
- 2.
El tratamiento con IGEV en el mantenimiento de la MG es posible que sea efectivo (grado de recomendación: C).
- 3.
Para la prevención de la exacerbación en el período perioperatorio: no hay evidencia suficiente (grado de recomendación: U).
- 4.
En el embarazo: si bien no hay evidencia suficiente, la opinión del GP-SNA, acorde con la experiencia de sus miembros, considera efectiva su utilización (grado de recomendación: buena práctica).
- 5.
Para el tratamiento de la MG AChRA negativo/anti-MuSK positivo: no hay evidencia suficiente (grado de recomendación: U).
La eficacia de la IGEV en SLE fue evaluada en un RCT86 (clase I) y en estudios clase IV. En el RCT se incluyó a 10 pacientes con SLE no paraneoplásico, en un diseño cruzado y controlado contra placebo. Se observó una significativa mejoría en la fuerza muscular medida por miometría en pacientes que recibieron IGEV. Otras series de casos y casos reportados87-89 también describieron respuesta clínica favorable con IGEV.
RecomendaciónEn SLE, la efectividad de la IGEV es probable (grado de recomendación: B).
C. NeuromiotoníaNo se identificaron estudios controlados que evalúen los efectos de la IGEV en el tratamiento de la neuromiotonía. En la experiencia de los autores de estas recomendaciones, la IGEV ha sido favorable en el tratamiento de esta entidad.
RecomendaciónNo hay evidencia suficiente que soporte o refute el uso de la IGEV para el tratamiento de la neuromiotonía. La opinión del GP-SNA, acorde con la experiencia de sus miembros, considera efectiva su utilización (grado de recomendación: buena práctica).
Enfermedades del músculoLas miopatías inflamatorias son un grupo grande y heterogéneo de miopatías potencialmente tratables que se clasifican desde un aspecto clínico patológico en dermatomiositis (DM), polimiositis (PM), miopatías por cuerpos de inclusión (MCI) y miositis necrosante autoinmune. Un quinto subgrupo llamado «overlap miositis» también ha sido descripto90.
Sobre los efectos terapéuticos de la IGEV en esta patología, se han publicado un ensayo controlado clase II (sobre DM)91, 3 ensayos controlados sobre MCI (2 clase I y uno clase II92-94), además de otros trabajos no controlados en miopatías inflamatorias95-99.
Los autores concluyen que contamos con evidencia de eficacia en la utilización de IGEV en DM muy severa o refractaria a corticoides. Con respecto a PM, no hay actualmente suficiente evidencia de la efectividad de IGEV. En MCI disponemos de evidencia que no avala el uso de IGEV y los reportes describen una mejoría transitoria de la disfagia en algunos pacientes.
RecomendaciónEl uso de IGEV en miopatías inflamatorias, particularmente dirigida a DM, está basado sobre evidencia escasa y antigua. Los autores del presente trabajo, sin embargo, acorde con su experiencia, consideran efectiva su utilización (grado de recomendación: buena práctica), y encuentran que es un recurso válido con posible efectividad en casos severos, en los que el tratamiento esteroideo presenta limitaciones tóxicas o inefectividad (grado de recomendación: C). En PM no disponemos de evidencia de valor significativo (grado de recomendación: U), con lo cual será necesaria mayor investigación sobre el tema para convalidar esta percepción clínica de los autores. En miopatía por cuerpos de inclusión, en cambio, el análisis de la evidencia ha demostrado claramente falta de efectividad (grado de recomendación: A de no efectividad).
Ganglionopatías y neuropatías de fibras finasA. Ganglionopatías sensitivas (GGP)Se trata de patologías que afectan a las estructuras situadas en el ganglio anexo a la raíz dorsal de la médula espinal. Se las conoce también como neuronopatías sensitivas, ganglionitis o gangliorradiculitis. Las GGP pueden ser hereditarias o adquiridas y asociarse a neoplasias, síndromes autoinmunes y múltiples alteraciones sistémicas. En el 50% de los pacientes son idiopáticas100.
No se encontraron estudios prospectivos controlados. Se encontraron 4 estudios no controlados, clase IV y reportes de casos.
En 1996, Uchuya et al.101 evaluaron de forma retrospectiva el efecto de la IGEV, encontrando escasa respuesta.
En el año 2003, Takahashi et al.102 estudiaron en forma prospectiva a pacientes con síndrome de Sjögren (SS), ataxia sensitiva severa crónica y GGP tratados alternativamente con IGEV y placebo, encontrando mejoría solo con IGEV, sugiriendo efectividad.
En 2011, Rist et al.103 evaluaron en forma retrospectiva la respuesta de 19 pacientes con neuropatía secundaria a SS, con resultados variables, y en 2016 Pereira et al.104 estudiaron en forma retrospectiva a 6 pacientes sin encontrar respuesta al tratamiento.
RecomendaciónNo se encontró evidencia de efectividad del tratamiento de las GGP con IGEV (grado de recomendación: U).
B. Neuropatías de fibras finas (NFF)Las NFF comprometen selectivamente a las fibras mielínicas de pequeño diámetro A δ y las amielínicas tipo C. Clínicamente, se caracterizan por presentar dolor neuropático y disfunción autonómica. Se asocian a diversas entidades, incluyendo diabetes, amiloidosis, enfermedad de Fabry, virus de la inmunodeficiencia humana, enfermedad celíaca y sarcoidosis. El porcentaje de pacientes con NFF idiopática varía entre un 24 y un 93% en diversos estudios105.
No se encontraron estudios prospectivos controlados sobre su tratamiento con IGEV. Se encontraron 3 estudios no controlados, además de algunos reportes de casos (clase IV). En un estudio prospectivo106 los autores trataron con IGEV a 3 pacientes con enfermedad celíaca, ataxia cerebelosa y cuadro compatible con NFF, en 2 casos confirmada por biopsia de piel, por un período variable de mantenimiento. Hubo mejoría, en un caso «dramática» y recaída al discontinuar la IGEV.
En otro trabajo del año 2011, Parambil et al.107 evaluaron en forma prospectiva a 3 pacientes con NFF y sarcoidosis (confirmados por biopsia), con cuadros de severo dolor neuropático y síntomas autonómicos, que fueron tratados con IGEV en dosis usuales, seguidas por un período variable de mantenimiento a una dosis mensual de 1g/kg. Todos los pacientes mejoraron tanto en su cuadro doloroso como en las pruebas autonómicas.
En un estudio del año 2013, Oaklander y Klein108 evaluaron en forma retrospectiva los registros de 41 pacientes jóvenes (edad de comienzo 12,3±5,7 años) con dolor generalizado inexplicado; el 98% de ellos presentaban además signos de disautonomía. Ocho de los pacientes recibieron 3 o más ciclos de IGEV. Hubo mejoría en 5 pacientes (62%), tanto en el cuadro doloroso como en los test autonómicos. Tres pacientes no mejoraron.
Existen reportes aislados de respuesta a la IGEV en otras entidades, como la NFF asociada a enfermedad de Sjögren109 o a eritromelalgia secundaria a poliartritis110.
RecomendaciónNo se encontró evidencia de la efectividad del tratamiento de las NFF con IGEV. Existen, en algunos cuadros específicos, reportes de mejoría de los síntomas con este tratamiento (grado de recomendación: U).
Síndrome de persona rígida y síndrome de post-polioA. Síndrome de persona rígida (SPR)Es una enfermedad autoinmune infrecuente, caracterizada por rigidez muscular y espasmos episódicos que afectan a la musculatura axial y de las extremidades111. La utilidad de la IGEV ha sido investigada en 4 trabajos y citada en 9 revisiones bibliográficas y de paneles de expertos. Los estudios con IGEV (no controlados)112 encuentran mejoría en la rigidez y en la calidad de vida. La investigación de mayor jerarquía metodológica es un estudio controlado, aleatorizado y doble ciego113 en 16 pacientes que presentaban: 1) rigidez muscular de miembros, tronco, músculos espinales, abdominales y toracolumbares, 2) cocontracción de músculos agonistas y antagonistas (estudio electromiográfico); 3) espasmos estímulo dependientes, y 4) Ac anti-GAD elevados (inmunohistoquímica, ELISA y Western Blot). Los pacientes recibieron IGEV 2g/kg dividido en 2 dosis diarias por 5 días una vez por mes, durante 3 meses consecutivos, y fueron evaluados mensualmente con escalas de rigidez y de sensibilidad a los estímulos. Los autores observaron mejoría en ambas escalas en el grupo tratado con IGEV durante los primeros 3 meses, que se mantuvo hasta el 8.° mes. El grupo placebo no mostró mejoría en las escalas empleadas durante los primeros 3 meses, por lo que a continuación fue tratado con IGEV observándose mejoría.
RecomendaciónDe acuerdo con el material publicado, se considera que IGEV es probablemente eficaz en el SPR (grado de recomendación: B), especialmente a considerar en aquellos pacientes con respuesta incompleta al tratamiento con agonistas GABA (diazepam, baclofeno), que se beneficiarían con dosis estándar mensuales durante 3 meses.
B. Síndrome de pospolio (SPP)El término SPP se aplica para describir debilidad, atrofia y fatiga muscular de aparición reciente, no explicables por otra causa médica, por lo menos 15 años luego de una poliomielitis aguda114. Sobre los efectos de la IGEV en el SPP encontramos 3 estudios controlados, prospectivos y aleatorizados.
Bertolasi et al.115 incluyeron a 50 pacientes, 24 con IGEV (0,4g/kg/día durante 5 días) y 26 con placebo, y evaluaron la respuesta con escalas de fuerza, fatiga, calidad de vida y dolor a los 2 y 4 meses luego de la infusión. El grupo tratado con IGEV no mostró mejoría salvo en dolor y fatiga.
Farbu et al.116 estudiaron a 20 pacientes, 10 con IGEV (2g/kg/día durante 5 días), 10 con placebo, y cuantificaron las respuestas con escalas de fuerza muscular, fatiga y dolor como objetivos primarios, con parámetros de LCR y nivel de citocinas como marcadores secundarios durante los meses 1, 3 y 6 postinfusión. Observaron mejoría en el dolor durante los primeros 3 meses, pero no encontraron cambios en las escalas de fatiga y fuerza muscular.
Gonzalez et al.117 estudiaron una cohorte de 142 pacientes, 63 con IGEV (90g en total durante 3 días y una segunda infusión a los 3 meses) y 69 con placebo. Evaluaron escalas de fuerza muscular, marcha, calidad de vida y dolor, a los 3 y 6 meses, y observaron mejoría del dolor y la fatiga, y de la calidad de vida y niveles de citoquinas sostenidos al año118 pero no de la fuerza muscular.
Se cuenta además con revisiones y opiniones de expertos119 con las cuales coincide nuestro análisis.
RecomendaciónLa IGEV no demostró ser eficaz en el tratamiento de la fuerza muscular del síndrome pospolio (grado de recomendación: A de no efectividad).
Dosis y regímenes de administraciónLa IGEV fue utilizada por primera vez para el tratamiento de la púrpura trombocitopénica idiopática y luego se ha extrapolado para el tratamiento de las enfermedades neurológicas1,4. Las primeras publicaciones fueron reportes de casos de pocos pacientes con MG y CIDP, en las dosis utilizadas para enfermedades hematológicas120-122.
Las comparaciones realizadas entre distintas dosis y regímenes de administración de IGEV en enfermedades del SNP123 tienen bajo nivel de evidencia, de manera que nos referiremos a dosis y regímenes de administración que si bien no tienen altos niveles de evidencia, se han ido aplicando en regímenes empíricos a los largo de varias décadas, y son considerados como buena práctica.
La dosis inicial, el intervalo entre infusiones, la dosis de mantenimiento y la duración del tratamiento con IGEV varían de acuerdo con la patología y la respuesta individual de cada paciente4. La dosis inmunomoduladora estándar de inicio es de 2 g/kg y suele fraccionarse en una infusión diaria durante 5 días consecutivos de 0,4 g/kg, aunque puede administrarse en 2 dosis consecutivas de 1 g/kg4,124,125. En los pacientes que reciben IGEV por primera vez, la infusión suele realizarse en 5 días, aunque el suministro fraccionado en 2 días no ha sido probado que se asocie a más reacciones adversas124.
Para los regímenes de tratamiento de mantenimiento a largo plazo, algunos autores sugirieron una guía empírica: si el tiempo de respuesta es inferior a 6 semanas, podría ser necesaria una infusión de 1 g/kg cada 3 semanas; si es de 6-8 semanas, de 0,5g/kg cada 3 semanas, y si es más prolongada, de 0,25g/kg cada 3 semanas. En los pacientes que reciben dosis inmunomoduladoras a largo plazo, se sugiere intentar reducir la dosis incrementando el intervalo126.
Si bien el nivel de evidencia es muy débil y limitado a escasos reportes, recientemente se ha propuesto una dosificación ajustada al peso corporal ideal en pacientes con un índice de masa corporal>30kg/m2, usando una fórmula que tenga en cuenta el exceso de tejido adiposo pobremente perfundido. Esto podría contribuir a reducir al mínimo los efectos secundarios dependientes de la dosis y a ahorrar cantidades importantes de inmunoglobulina mejorando la relación costo-beneficio123.
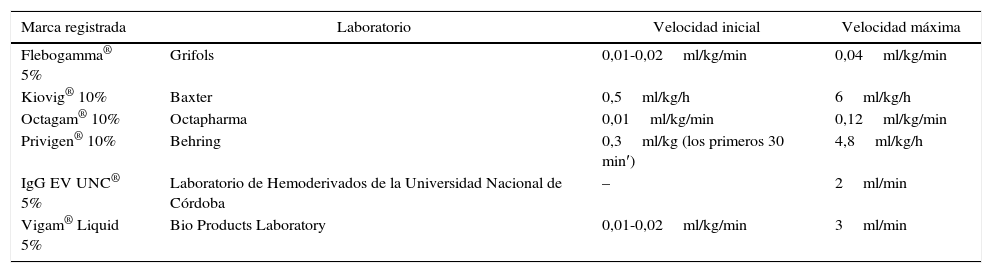
En cuanto a la velocidad de infusión, siempre debe iniciarse lentamente. Si es bien tolerada, luego de los primeros 30 min, la velocidad puede aumentarse, tal como se especifica en la ficha técnica de cada una de las inmunoglobulinas aprobadas1,127-129. La IGEV debe administrarse siguiendo la posología sugerida por cada laboratorio. En la tabla 3 se resumen los planes de administración de las IGEV aprobadas para su uso en Argentina. Algunos eventos adversos de la IGEV están directamente relacionados con la rapidez de infusión, por lo que, en ocasiones, puede ser necesario su reducción o interrupción hasta la desaparición de los síntomas y luego reiniciar al nivel tolerado por el paciente123.
Diferentes IGEV en Argentina y su velocidad de infusión
| Marca registrada | Laboratorio | Velocidad inicial | Velocidad máxima |
|---|---|---|---|
| Flebogamma® 5% | Grifols | 0,01-0,02ml/kg/min | 0,04ml/kg/min |
| Kiovig® 10% | Baxter | 0,5ml/kg/h | 6ml/kg/h |
| Octagam® 10% | Octapharma | 0,01ml/kg/min | 0,12ml/kg/min |
| Privigen® 10% | Behring | 0,3ml/kg (los primeros 30 min′) | 4,8ml/kg/h |
| IgG EV UNC® 5% | Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba | – | 2ml/min |
| Vigam® Liquid 5% | Bio Products Laboratory | 0,01-0,02ml/kg/min | 3ml/min |
Normalmente, los preparados se administran sin dilución previa pero, de ser necesario, algunas preparaciones pueden diluirse en una solución de glucosa al 5% o salina isotónica hasta obtener una concentración final de inmunoglobulina al 5%.
Aunque el principio activo en las IGEV (inmunoglobulinas purificadas) es el mismo en las distintas marcas comerciales, existen diferencias en los procesos de fabricación empleados. Si el fármaco es bien tolerado, se recomienda mantener la misma marca comercial de IGEV durante el tratamiento a largo plazo129 y en caso de efectos adversos que no puedan minimizarse con el descenso de la velocidad de infusión podría ser útil cambiar de marca de IGEV123,130.
Todos los pacientes deben recibir hidratación adecuada antes de la infusión, monitorización de la diuresis y de niveles de creatinina sérica, y debe evitarse el uso concomitante de diuréticos del asa. Se debe controlar todo el período de infusión y tras su finalización, sobre todo en las primeras infusiones, vigilando signos vitales y la eventual aparición de eventos adversos.
RecomendaciónLas dosis y los regímenes de administración de IGEV considerados estándar en enfermedades del SNP no han sido comparados con otras dosis y regímenes (grado de recomendación: buena práctica).
Eventos adversosLas reacciones adversas pueden ser:
- 1.
Locales (en el sitio de la infusión): son raras, incluyen dolor, sangrado o hematomas en el sitio de punción131. El dolor puede ser prolongado si hubo extravasación de la IGEV.
- 2.
Sistémicas: en un 20 al 40% de los pacientes en algún momento del tratamiento6,132. A su vez, pueden ser: a) inmediatas (60%), como escalofríos, fiebre, dolor de cabeza y dolores musculares2,132 durante las primeras 6 h de la infusión, y que suelen desaparecer en 6 h; son más frecuentes durante la primera infusión y dependen de factores como la velocidad de infusión, cantidad infundida, intervalo entre infusiones y pueden variar acorde a las diferentes marcas de IGEV; b) mediatas (39%), que ocurren desde las 6 h hasta la primera semana luego de la infusión, y c) tardías (< 1%), cuando ocurren luego de una semana de administrada (tabla 4)133.
Tabla 4.Eventos adversos
Efectos adversos leves Efectos adversos moderados Efectos adversos severos • Cefaleaa
• Mialgias, dolor lumbar, artralgiaa
• Fiebre, enrojecimientoa
• Ansiedad, fatigaa
• Náuseas, vómitosa
• Hipotensión, hipertensión, taquicardiaa
• Hiponatremiab
• Neutropeniab• Cefalea persistenteb
• Meningitis asépticab
• Anemia hemolíticab
• Artritisb
• Complicaciones dérmicasb
• Interferencia con la efectividad de vacunasc• Reacción anafilácticaa
• Complicaciones renalesb
• Complicaciones respiratoriasb
• Tromboembolismob
• Colitisb
• Infecciones de médula óseac
Si bien varios autores encuentran reacciones adversas sistémicas entre el 13 y el 44% de los pacientes130, solo se han encontrado pocos casos de eventos adversos serios (0,6%)134,135.
CefaleaLa cefalea es un efecto adverso frecuente inmediato o mediato, de una intensidad variable, registrado entre el 54 y el 56% de los casos (hasta con cefaleas severas y meningitis aséptica)136, más común con uso de altas dosis137,138, que suele responder a los analgésicos139. Ocasionalmente, se puede acompañar de náuseas, vómitos y dolores musculares.
Reacciones adversas poco frecuentesReacciones anafilácticas o anafilactoidesLas reacciones adversas como picazón, enrojecimiento, opresión torácica, disnea, sibilancias, ansiedad aguda y trastornos hemodinámicos son muy poco frecuentes. Son usualmente inmediatas a la infusión y obligan a suspenderla y usar medicación preventiva en caso de reiniciarla. Las reacciones adversas serias que potencialmente pueden poner en riesgo la vida del paciente remarcan la importancia de mantener una cercana monitorización durante la infusión con personal entrenado y con acceso a un departamento de urgencias en caso de ser necesario140-142.
Anafilaxia vinculada a deficiencia de IgALa determinación de la concentración de IgA previa al tratamiento con IGEV es un tema de importancia y debate en la actualidad, ya que se han encontrado casos de anafilaxia luego de infusión de IGEV en pacientes con déficit congénito de IgA (algunos prospectos de IGEV alertan sobre este riesgo). Rachid y Bonilla143 encontraron que algunos pacientes con déficit congénito de IgA poseen Ac anti-IgA que pueden reaccionar contra la IgA contenida en la IGEV. Estos Ac anti-IgA que se encuentran en más del 30% de los pacientes con déficit de IgA; también pueden estar presentes en individuos sanos (2 al 7%). Es importante señalar que también han descripto casos con déficit IgA y Ac anti-IgA que no tuvieron reacciones reacciones anafilácticas144. Con esta información controversial, la recomendación (grado U) es que podría no ser imprescindible determinar los niveles de IgA antes de la infusión de IGEV, pero hasta nueva información se recomienda como buena práctica realizarla en pacientes con déficit congénito de IgA o en aquellos que hayan presentado previamente una reacción adversa anafiláctica a IGEV y requieran repetir el tratamiento.
Meningitis aséptica/complicaciones en el sistema nervioso central (SNC)Con poca frecuencia, algunos dolores de cabeza son persistentes y severos, se acompañan de rigidez de nuca, fotofobia, fiebre y mialgias severas. El LCR puede mostrar pleocitosis, proteínas altas, sin gérmenes, indicando un cuadro de meningitis aséptica145-148. Aunque su causa es desconocida, se cree que una respuesta inflamatoria del SNC ocurre cuando pequeñas cantidades de IgG ingresan al SNC causando inflamación meníngea. Los síntomas suelen ser autolimitados y la mayoría de los pacientes se recuperan dentro de los 5 días. No se han reportado muertes por esta complicación. El tratamiento recomendado como buena práctica consiste en analgésicos, antieméticos y antipiréticos. Los corticoides podrían ser usados en los casos severos. Si es necesario que el paciente continúe recibiendo IGEV, se debe administrar en pequeñas cantidades en forma lenta y se debe aumentar muy paulatinamente. Un recurso válido puede ser cambiar de marca de IGEV149. Otras complicaciones neurológicas severas y poco frecuentes son encefalopatía, vasoespasmo y vasculitis13,150.
Complicaciones renalesLa insuficiencia renal luego de la infusión de IGEV es poco frecuente. Se observa principalmente a dosis altas151 y en casos con patología renal preexistente. Otros factores de riesgo son edad avanzada, diabetes, enfermedad vascular, paraproteinemias como mieloma múltiple o crioglobulinemias. Algunos autores encontraron cuadros de glomerulonefritis y varios grados de severidad de insuficiencia renal atribuible a los estabilizadores del azúcar en la IGEV, como sacarosa y maltosa, ya que la sacarosa no es metabolizada por el riñón, localizándose en el túbulo proximal causando edema, nefrosis osmótica e injuria del túbulo renal proximal, hasta el requerimiento de diálisis152-154. La falla renal suele ocurrir entre el quinto y séptimo día luego de la infusión y el cuadro puede complicarse con hemólisis, trombosis, hiponatremia e hipercalemia155. Se recomienda como buena práctica para la prevención y el tratamiento, monitorizar la función renal antes de la infusión con IGEV, hidratación, evitar la depleción de volumen debida al uso de diuréticos, realizar una infusión lenta, limitar la dosis a no más de 3mg/kg/min y, eventualmente, elegir un producto de IGEV libre de sacarosa.
Otros efectos adversos infrecuentesSe ha registrado infrecuentemente: leucopenia156, insuficiencia cardíaca congestiva157, hemólisis158, uveítis159, aumento de las enzimas hepáticas160 e hiperviscosidad sanguínea.
El aumento de la viscosidad sanguínea puede provocar accidente cerebrovascular161-163, infarto de miocardio164, trombosis venosa profunda165, embolia pulmonar165 o trombosis de la vena central de la retina166. Los pacientes que presentan factores de riesgo vascular, inmovilidad prolongada o antecedentes de hipercoagulabilidad, como policitemia vera, son más susceptibles a presentar esta complicación. El 80% de las trombosis cerebrales son arteriales y presentan una incidencia del 0,6%167. La mayoría ocurre dentro de las 24 h de completar la infusión y se han reportado casos de muerte168,169.
Prevención y tratamiento de los eventos adversosEl tratamiento en la mayoría de las reacciones inmediatas incluye enlentecer o detener la infusión. Algunos efectos adversos (como urticaria, picazón y enrojecimiento) se pueden minimizar con antihistamínicos orales (difenhidramina) o antiinflamatorios no esteroideos135. Antes de una infusión, también se puede premedicar con estos fármacos y corticoides orales o endovenosos, si en infusiones previas el paciente tuvo una reacción adversa. En caso de náuseas o vómitos, se puede utilizar prometazina, para espasmos musculares diazepam y para el dolor severo opioides.
RecomendaciónSi bien los eventos adversos vinculados al tratamiento con IGEV han sido ampliamente descriptos en numerosas publicaciones con altos niveles de evidencia, no sucede lo mismo con las medidas de prevención y tratamiento de estos eventos, de manera que las recomendaciones para su prevención y manejo son consideradas como de buena práctica.
ConclusionesLa IGEV es una herramienta de suma utilidad en el tratamiento de las patologías autoinmunitarias del SNP. Muchas medidas se han aplicado en forma empírica a partir de conocimientos adquiridos a través de la investigación en patologías hematológicas y, a pesar de su uso extendido, vemos que pocas patologías neurológicas han sido exhaustivamente estudiadas. Esperamos que esta revisión sea una guía de utilidad para el neurólogo general en el momento de tener que decidir por la utilización de este tratamiento, cómo realizarlo y con qué recaudos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl Dr. Ricardo Reisin ha dado conferencias para CLS Behring y recibido una beca del Laboratorio Baxter. La Dra. Maria Alejandra Figueredo y la Dra. Paz Zuberbuhler han recibidos becas del laboratorio CLS Behring. El resto de los autores declara no tener conflictos de interés para la publicación de estas Guías.
Autores del grupo de trabajo de enfermedades del sistema nervioso periférico de la Sociedad Neurológica Argentina
Roberto Rey, director de Instituto Argentino de Investigación Neurológica (IADIN), jefe de Neurología Sanatorio Finochietto, Trinidad Palermo y Sagrado Corazón.
Gisella Gargiulo-Monachelli, Hospital J.A. Fernández, CONICET-UBA.
María Piñeiro, Instituto Argentino de Investigación Neurológica (IADIN), Sanatorio Finochietto.
Gustavo Albanese, Neurología, Hospital Argerich.
Mariana Bendersky, UBA CyT, Universidad de Buenos Aires, Instituto Argentino de Investigación Neurológica (IADIN), Hospital Italiano de Buenos Aires.
Luis M. Fiorotto, Hospital Dr. Cosme Argerich.
Paula Landriscina, Hospital Dr. Cosme Argerich, INEBA.
Valeria Álvarez, Neurología, Hospital de Clínicas José de San Martin, UBA.
Eugenia Conti, Hospital de Clínicas José de San Martín, UBA.
Ricardo Reisin, jefe de Neurología, Hospital Británico de Buenos Aires.
Belén Tillard, Instituto de Investigaciones Neurológicas Raúl Carrea, FLENI.
Fabio Barroso, jefe de Sección Enfermedades Neuromusculares, Departamento de Neurología, Instituto de Investigaciones Neurológicas Raúl Carrea, FLENI.
Marianna di Egidio, Servicio Neurología, Hospital Tornú, CABA.
Pablo M. González, Hospital Austral, Hospital Municipal Larcade, San Miguel.
Luciana León Cejas, Hospital Británico de Buenos Aires.
Marcelo Chaves, Hospital San Martín, Paraná, Entre Ríos.
Gabriela Lita Vargas, Hospital Británico de Buenos Aires.
Florencia Aguirre, Neurología, Hospital J.M. Ramos Mejía.
Luciano Recchia, Consultor Hospital Central Mendoza, DAMSU, Universidad de Cuyo, Mendoza.
Valeria L. Salutto, Servicio de Neurología, Instituto de Investigaciones Médicas A. Lanari, Universidad de Buenos Aires, Centro de Asistencia, Docencia e Investigación en Miastenia (CADIMI), CABA.
María Alejandra Figueredo, Hospital San Roque, Gonnet, Hospital Español, La Plata.
María del Carmen Martínez Perea, Neurología, Neurología Infantil, Hospital B. Rivadavia.
Rugiero Marcelo, jefe de Sección Enfermedades Neuromusculares, Neurología Adultos, Hospital Italiano de Buenos Aires.
Ernesto Fulgenzi, Hospital Pirovano, Unidad César Milstein.
Alejandro Rodríguez, INEBA.
Paz Zuberbuhler, Hospital Álvarez, Sanatorio de los Arcos.
Fabio Barroso, jefe de Sección Enfermedades Neuromusculares, Departamento de Neurología, Instituto de Investigaciones Neurológicas Raúl Carrea, FLENI.
Paola Pivetta, Neurofisiología, Complejo Churruca-Visca y CEMIC.
Andrés Berardo, Instituto Conci Carpinella, Córdoba.
Agustín Jáuregui, Unidad Enfermedades Neuromusculares, Fundación Favaloro.
Laura Pirra,Prof. Fundación Favaloro, coordinadora Unidad Enfermedades Neuromusculares, Hospital D.F. Santojanni.
Cintia Marchesoni, Hospital Británico de Buenos Aires.
Gabriel E. Rodríguez, jefe de Sector Enf. Neurona Motora, Hospital J.M. Ramos Mejía.
En el anexose relacionan los nombres de los autores del grupo de trabajo.
Guía de práctica clínica basada en la evidencia del Grupo de Enfermedades del Sistema Nervioso Periférico de la Sociedad Neurológica Argentina.
Evidence-based clinical practice guideline from the Peripheral Nervous System Diseases’ Group of the Sociedad Neurológica Argentina.
Nótese que del punto 1 al 3 son requerimientos para estudios clase ii de estudios de equivalencia. Si alguno de esos 3 está faltando, la clase desciende automáticamente a clase iii.
Medición del outcome objetiva: una medida de outcome que es improbable que sea afectada por las «expectativas o sesgo» del observador.