La prevalencia de embarazos en la población con tumores gliales es desconocida.
Casos clínicosEste es un estudio descriptivo, observacional, retrospectivo sobre 140 pacientes con tumores gliales diagnosticados entre enero de 2002 y septiembre de 2011; 49 fueron mujeres, 28 en edad fértil. Solo se registraron 3 embarazos. Dos fueron primigestas. Solamente un embarazo fue planificado. Todas se encontraban en tratamiento por epilepsia secundaria. Solo una paciente presentó una crisis parcial motora durante el embarazo. Una paciente recibió temozolomida durante el primer mes de embarazo. Todos los embarazos llegaron a término. Un parto fue vaginal. Un recién nacido presentó síndrome de Down, y uno pie Bot y retraso madurativo.
ConclusionesLos resultados de esta experiencia amplían los conocimientos sobre la maternidad en pacientes neurooncológicas.
The prevalence of pregnancies in the population with primary CNS tumors is unknown.
Case reportsThis is a descriptive, observational, retrospective study of 140 patients with glial tumors diagnosed between January 2002 and September 2011; 49 were female, 28 were childbearing age. We registered and followed the pregnancy of 3 patients. Two were primiparous; only one pregnancy was planned. All patients were treated for secondary epilepsy; one patient had a partial motor seizure during pregnancy. One received temozolomide during the first month of pregnancy. All pregnancies reached term with one vaginal delivery. One infant had Down syndrome; the second child had clubfoot and developmental delay.
ConclusionUnder an open multidisciplinary consideration, we should respect the psychosocial well-being of the couple as well as childbearing wishes.
Los tumores primarios del sistema nervioso central (SNC) son una patología poco frecuente; su incidencia en Argentina es 14,6/100.000 habitantes (ajustado por edad a la población mundial)1. No se encontraron publicaciones sobre la prevalencia de embarazos en la población con tumores primarios del SNC. La Organización Mundial de la Salud (OMS) considera en edad fértil a las mujeres entre los 10-49 años de edad2.
El presente trabajo realizado en un Instituto Universitario muestra la prevalencia y nuestra experiencia en pacientes con tumores de la serie glial y maternidad.
Casos clínicosEste es un estudio descriptivo, observacional, retrospectivo sobre 140 pacientes con tumores gliales diagnosticados entre enero de 2002 y septiembre de 2011. Cuarenta y nueve fueron mujeres, 28 de ellas se encontraban en edad fértil. El seguimiento de todos los pacientes de nuestra Institución se circunscribe a los términos de la Declaración de Helsinki de la Asociación Médica Mundial, Principios Éticos para la Investigación Médica que involucra a humanos y su última enmienda de la 59 Asamblea General de la Asociación Médica Mundial Seúl, Corea, de octubre de 2008.
Todas las pacientes, por la enfermedad neurooncológica, habían recibido la recomendación de anticoncepción.
La prevalencia de embarazos en nuestra población fue del 11%.
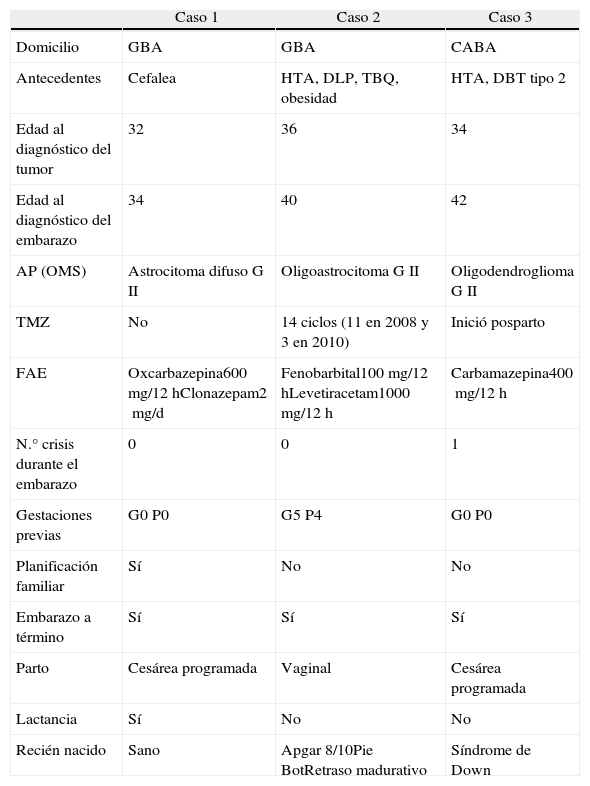
Se realizó el seguimiento de las únicas 3 pacientes de 34, 40 y 42 años de edad con diagnóstico de tumor primario de la serie glial y maternidad (C1, C2 y C3). Los tumores fueron: astrocitoma difuso, oligoastrocitoma y oligodendroglioma, todos grado ii según la clasificación de la OMS (tabla 1).
Características clínicas y demográficas de las pacientes
| Caso 1 | Caso 2 | Caso 3 | |
| Domicilio | GBA | GBA | CABA |
| Antecedentes | Cefalea | HTA, DLP, TBQ, obesidad | HTA, DBT tipo 2 |
| Edad al diagnóstico del tumor | 32 | 36 | 34 |
| Edad al diagnóstico del embarazo | 34 | 40 | 42 |
| AP (OMS) | Astrocitoma difuso G II | Oligoastrocitoma G II | Oligodendroglioma G II |
| TMZ | No | 14 ciclos (11 en 2008 y 3 en 2010) | Inició posparto |
| FAE | Oxcarbazepina600mg/12hClonazepam2mg/d | Fenobarbital100mg/12hLevetiracetam1000mg/12h | Carbamazepina400mg/12h |
| N.° crisis durante el embarazo | 0 | 0 | 1 |
| Gestaciones previas | G0 P0 | G5 P4 | G0 P0 |
| Planificación familiar | Sí | No | No |
| Embarazo a término | Sí | Sí | Sí |
| Parto | Cesárea programada | Vaginal | Cesárea programada |
| Lactancia | Sí | No | No |
| Recién nacido | Sano | Apgar 8/10Pie BotRetraso madurativo | Síndrome de Down |
AP: anatomía patológica; CABA: Ciudad Autónoma de Buenos Aires; DBT: diabetes mellitus; DLP: dislipidemia; FAE: fármacos antiepilépticos; GBA: Gran Buenos Aires; HTA: hipertensión arterial; OMS: Organización Mundial de la Salud; TBQ: tabaquismo; TMZ: temozolomida.
Las pacientes se encontraban en tratamiento por epilepsia secundaria con monoterapia y politerapia: caso 1 (C1) oxcarbazepina 600mg/12h y clonazepam 2mg/d; caso 2 (C2) fenobarbital 100mg/12h y levetiracetam 1000mg/12h; y caso 3 (C3) carbamazepina 400mg/12h. Esta última presentó una crisis parcial simple motora en la semana 26 de gestación por mala adherencia al tratamiento. El C2 optimizó su adherencia con el diagnóstico de embarazo. El C2 estuvo expuesta a la temozolomida (TMZ) durante el primer mes de gestación, habiendo recibido previamente 14 ciclos del fármaco (ciclos de 5 días cada 28 días). Además presentó plaquetopenia transitoria durante el primer trimestre (80.000/mm3), confirmada por frotis de sangre periférica, y que fuera interpretada como cambio hematológico propio de la gestación. Los valores previos y posteriores fueron 141.000/mm3 y 247.000/mm3 respectivamente. Ante el diagnóstico de embarazo, la conducta fue la suspensión de la TMZ en el C2, y postergar el tratamiento quimioterápico y radiante hasta la finalización del embarazo en el C3; en C1 la conducta fue de observación.
Solo en el C1 el embarazo fue planificado y la paciente había planteado su deseo de maternidad. Los C1 y C3 fueron primigestas. En todas las gestantes se realizaron controles para embarazo de alto riesgo. Todos los embarazos llegaron a término; un parto fue vaginal y 2 por cesárea programada; ninguno fue múltiple. Solo una paciente amamantó. En relación con los recién nacidos, dos presentaron malformaciones mayores: el C3 síndrome de Down (madre de 42 años de edad); el C2 retraso madurativo y pie Bot (paciente con oligoamnios durante el tercer trimestre y hábito tabáquico); el C3 no presentó malformaciones. El C2 optó por la ligadura de trompas vía translaparoscópica como método anticonceptivo en el posparto mediato.
Respecto a las neuroimágenes comparativas pre y posparto, C1 y C2 no presentaron cambios; en la resonancia magnética de C3 se observó un mayor refuerzo después de la administración del gadolinio, pero sin cambios en la volumetría tumoral. No se realizaron estudios por imágenes durante los embarazos.
ComentariosDurante el embarazo los tumores de la serie glial pueden aumentar su tamaño, especialmente durante el primer trimestre. Existen cambios propios del embarazo que pueden repercutir en el crecimiento tumoral por tres mecanismos: a) aceleración del crecimiento tumoral por efecto de hormonas gestacionales (estrógeno y progesterona); b) aumento del edema peritumoral especialmente entre las semanas 27 y 32 de gestación por aumento de la volemia; y c) la inmunotolerancia hacia antígenos exógenos propia del embarazo, que disminuye la respuesta inmunitaria hacia los antígenos tumorales. Uno o los 3 mecanismos pueden producir signos y síntomas de progresión tumoral, en algunos casos con potencial remisión de los mismos en el posparto2–6.
Los 3 casos que se presentan cursaban con buen control de los síntomas comiciales con los fármacos antiepilépticos (FAE) administrados previo al conocimiento del embarazo, y por esto no fueron modificados7. La ausencia de crisis durante al menos los 9 meses previos al embarazo se asocia con un 84-92% de probabilidad de permanecer libre de crisis durante la gestación (nivel de evidencia B)8. Asimismo, la monoterapia favorece la adherencia al tratamiento9. La exposición a los FAE aumenta el riesgo relativo de malformaciones mayores10–14. Se consideran malformaciones mayores a aquellas que son evidenciables durante la vida intrauterina, en el momento del nacimiento o durante las 6 semanas posteriores, y son relevantes desde el punto de vista quirúrgico, médico o estético9,12,13. Se recomienda evitar el uso de valproato y de politerapia durante el primer trimestre de embarazo para disminuir este riesgo (nivel de evidencia B)15. La tasa de malformaciones mayores en nuestro país es del 1-2%, y aumenta al 2,3-7,8% con la monoterapia y al 6,6-18,8% con la politerapia antiepiléptica11,13,16. No encontramos registros previos sobre teratogénesis en pacientes oncológicas y epilepsia secundaria.
El uso de FAE no contraindica la lactancia. Son conocidos los beneficios de la lactancia materna, pues favorece el vínculo madre-hijo y el mejor desarrollo psicomotor, emocional y social del recién nacido, así como el desarrollo de la familia como célula social17.
En la República Argentina los alumbramientos en madres mayores de 40 años representan el 2% del total de nacimientos, y de estos surge un tercio del total de los casos de síndrome Down17.
El C2 recibió TMZ, un agente alquilante, embriotóxico en especies murinas y en conejos, que a dosis inferiores a la máxima recomendada en humanos produce numerosas malformaciones en tejidos blandos internos y externos y en tejido esquelético, pero no modifica la tasa de implantación ni altera la duración de la gestación18,19. Se desconocen los efectos teratogénicos y durante la lactancia en el humano (Clase D, Food and Drug Administration, EE.UU.)20. Las malformaciones descritas en los niños de las madres C2 y C3 podrían deberse a la TMZ, los FAE, así como a la obesidad y el tabaquismo en C2, y está relacionada con la edad materna en C3. No encontramos publicaciones que muestren relación entre pie Bot y oligoamnios con FAE y/o TMZ.
Para disminuir el riesgo de malformaciones, la suplementación rutinaria de ácido fólico vía oral (0,4mg/d) debe iniciarse desde la planificación familiar o en su defecto ante la sospecha de embarazo (nivel de evidencia C)9,11,21. Se recomienda que la gestante reciba suplemento de vitamina K vía oral durante el último mes de embarazo, así como también el recién nacido vía intramuscular, para prevención de la «enfermedad hemorrágica del recién nacido»11,21. Esto se debe a que algunos de los FAE son inductores enzimáticos, que pueden disminuir los factores de coagulación K dependientes, y así aumentar el riesgo de esta enfermedad21.
El control prenatal debe ser precoz, completo y periódico (la frecuencia dependerá del nivel de riesgo), entendiendo riesgo como la posibilidad de padecer un daño desde el momento de la concepción22. En las pacientes aquí reportadas el riesgo resultó multifactorial, incluyendo la enfermedad tumoral, los efectos de los tratamientos oncológicos y sintomáticos, entre otros.
En los C1 y C3 se planificó el parto por cesárea2, mientras que C2 tuvo un parto vaginal. Respecto de la ligadura de trompas optada por el C2, el médico debe respetar los derechos personalísimos de autonomía y dignidad de la persona en la elección del método anticonceptivo22,23.
El embarazo en pacientes con diagnóstico oncológico propone un dilema, especialmente cuando se considera el bienestar de la persona por nacer6. El objetivo debe concentrarse en disminuir la morbimortalidad materna y del feto, considerando siempre las complicaciones potenciales de los tratamientos durante el embarazo. En el marco de una discusión abierta y multidisciplinaria, debe respetarse el bienestar psicosocial de la pareja y los deseos de maternidad, así como el binomio madre-hijo. El carácter multidisciplinario es responsabilidad del conductor del equipo de salud, y permitirá orientar hacia el mejor tratamiento para cada paciente22.
Toda mujer en edad fértil debe recibir información sobre planificación familiar, consejo genético y teratogenicidad de los fármacos, la adherencia a los tratamientos, los controles prenatales, el amamantamiento, etc. Los resultados de esta experiencia clínica y la investigación bibliográfica amplían los conocimientos sobre la maternidad en pacientes neurooncológicas.
La comprensión de forma adecuada por parte de la paciente de toda la información brindada por el equipo médico, le permitirá apreciar su presente situación y los potenciales conflictos entre «la madre y la persona por nacer»11,17,21,24.
AdendaGrados de recomendación25:
A = extremadamente recomendable: buena evidencia de que la medida es eficaz y los beneficios superan ampliamente a los perjuicios.
B = recomendable: al menos moderada evidencia de que la medida es eficaz y los beneficios superan a los perjuicios.
C = ni recomendable ni desaconsejable: al menos moderada evidencia de que la medida es eficaz, pero los beneficios son muy similares a los perjuicios y no puede justificarse una recomendación general.
D = desaconsejable: al menos moderada evidencia de que la medida es ineficaz o que los perjuicios superan a los beneficios.
I = evidencia insuficiente: de mala calidad o contradictoria, y el balance entre beneficios y perjuicios no puede ser determinado.
Categorías de riesgo fetal por exposición a fármacos20:
A: estudios adecuados en mujeres embarazadas no han mostrado riesgo para el feto en el primer trimestre del embarazo y no hay evidencia de riesgo en trimestres ulteriores.
B: estudios en animales no han mostrado efectos adversos sobre el feto, pero no hay estudios clínicos adecuados en mujeres embarazadas.
C: estudios en animales han mostrado un efecto adverso sobre el feto, pero no hay estudios clínicos adecuados en mujeres embarazadas. El fármaco puede ser útil en mujeres embarazadas a pesar de sus riesgos potenciales.
D: hay evidencia de riesgo para el feto humano, pero los beneficios potenciales del uso en mujeres embarazadas pueden ser aceptables a pesar de los riesgos potenciales.
X: estudios en animales o humanos muestran anormalidades fetales, o las comunicaciones de reacciones adversas indican evidencia de riesgo fetal. Los riesgos involucrados claramente sobrepasan los beneficios potenciales.
Nuestro agradecimiento a todas las pacientes, y a la Licenciada Zulema Torres por su invalorable aporte asistencial.