La enfermedad inflamatoria intestinal es un proceso inflamatorio crónico intestinal con manifestaciones digestivas y extradigestivas frecuentes; entre estas últimas se reconocen las neurológicas como accidente vascular encefálico, alteraciones de sustancia blanca, polineuropatías y radiculopatías, entre otras. Generalmente se manifiestan en el momento del diagnóstico o exacerbaciones de la misma. Presentamos el caso de una paciente portadora de una polineuropatía sensitiva de origen incierto y en quien después de 9 años de evolución se diagnostica una colitis ulcerosa. Se considera como diagnóstico etiológico y se recomienda tener en cuenta que la enfermedad inflamatoria intestinal debe ser considerada dentro del estudio de pacientes con polineuropatía de origen incierto.
Inflammatory bowel disease (IBD) is a chronic inflammatory intestinal process with frequent digestive and extra-digestive signs and symptoms; these would include neurological manifestations such as stroke, white matter alterations, polyneuropathies and radiculopathies. These neurologic involvement often develop at the moment of diagnosis, or during IBD exacerbations. This paper introduces the case of a patient with a sensitive polyneuropathy of uncertain etiology, who 6 years later was diagnosed with Ulcerative Colitis. This is considered to be an etiologic diagnosis. It is recommended to take IBD into account when studying patients with Polyneuropathy of uncertain origin.
Es bien conocido que la enfermedad inflamatoria intestinal (EII) tiene manifestaciones extradigestivas1,2, entre las que se incluyen clínica de compromiso del sistema nervioso central (SNC) y sistema nervioso periférico (SNP)3,4. Muchas de estas se han descrito durante exacerbaciones de la enfermedad o en el momento del diagnostico3, pero también previas al inicio de la EII4,5.
Por otro lado, el diagnostico etiológico de pacientes con polineuropatía (PNP) es un reto para todo médico especialista; siendo hasta un 20% de los casos de etiología incierta, pero de pronóstico benigno6, cuyo seguimiento estricto puede conllevar a un diagnóstico preciso.
Se presenta a continuación el reporte de un caso en que la paciente es portadora de una PNP de etiología incierta y quien desarrolla con el tiempo una colitis ulcerosa (CU). Igualmente, se hace una revisión de la literatura con el objetivo de definir la precocidad de la aparición de síntomas de PNP en pacientes con EII y/o CU.
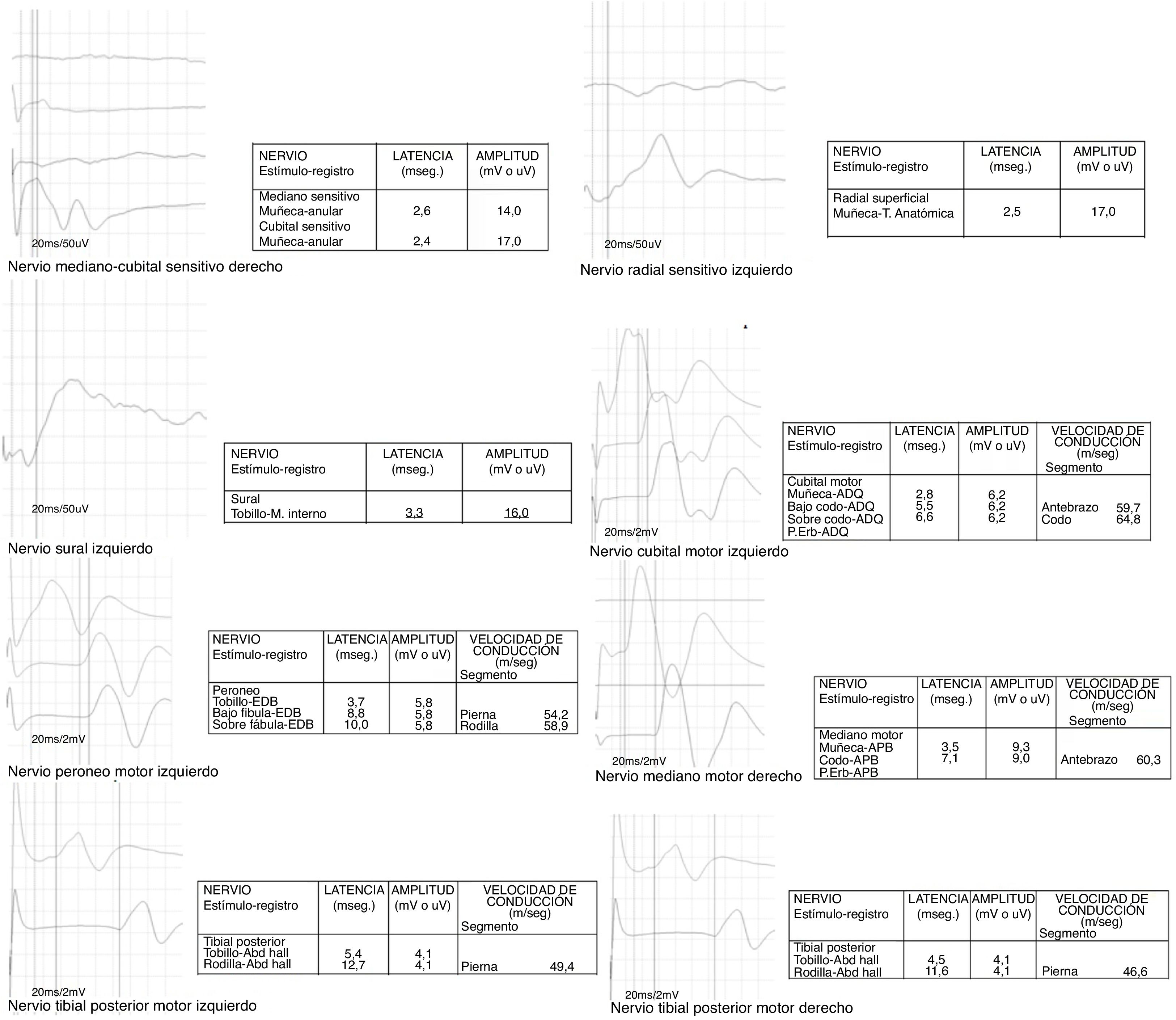
Caso clínicoPaciente de sexo femenino, de 58 años de edad, evaluada en la unidad de neurología de nuestro hospital en marzo del 2010, por historia de 2 meses de instalación de dificultad para deambular y parestesias dolorosas nocturnas en extremidades inferiores, destacando en el examen físico una ataxia de la marcha, hiporreflexia rotuliana e hipoestesia vibratoria y dolorosa en calcetín en ambas extremidades inferiores. Se evalúa con estudio electrofisiológico, descrito como PNP sensitiva axonal (fig. 1). Se complementa evaluación con hemograma completo que muestra valores de hematocrito y hemoglobina y recuento de eritrocitos en rango bajo de lo normal, perfil bioquímico, perfil tiroideo, niveles de vitamina B12 y ácido fólico normales; velocidad de eritrosedimentación elevados y factor reumatoideo en rango alto de la normalidad (tabla 1). Estudiada por reumatología, descartan patología específica reumatológica. Como parte del estudio, se realiza resonancia magnética nuclear cerebral, que muestra discreta atrofia cortical difusal, y leucoaraiosis indicativa de patología de pequeño vaso. En julio del 2013, se agrega una disfagia fluctuante, y en junio del 2016 desarrolla una crisis diverticular, a raíz de lo cual se estudia, haciéndose el diagnostico de una CU. Se inicia terapia con sulfasalazina, con mejoría parcial en las parestesias dolorosas nocturnas. En enero del 2017, la paciente presenta evento tipo sincopal, asociado a hipoestesia subjetiva táctil en el hemicuerpo izquierdo, que se estudió con tomografía computarizada, descrita con hallazgo de lesión isquémica tipo lacunar en la cabeza de caudado a izquierda.
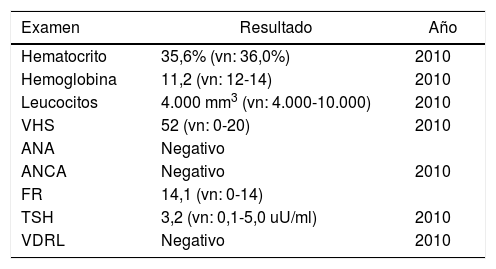
Estudios de laboratorio realizados (2008-2017)
| Examen | Resultado | Año |
|---|---|---|
| Hematocrito | 35,6% (vn: 36,0%) | 2010 |
| Hemoglobina | 11,2 (vn: 12-14) | 2010 |
| Leucocitos | 4.000 mm3 (vn: 4.000-10.000) | 2010 |
| VHS | 52 (vn: 0-20) | 2010 |
| ANA | Negativo | |
| ANCA | Negativo | 2010 |
| FR | 14,1 (vn: 0-14) | |
| TSH | 3,2 (vn: 0,1-5,0 uU/ml) | 2010 |
| VDRL | Negativo | 2010 |
Siguen siendo controvertidas la incidencia y la prevalencia de complicaciones neurológicas en pacientes con EII; variando desde un 3%3 hasta, según un autor, entre un 20-30%7, y en muchos casos, preceder al diagnóstico de la enfermedad intestinal7, especialmente en pacientes con CU, donde la incidencia es de hasta el 1,9%7.
La fisiopatología del compromiso del SNP es aún incierta. Inicialmente, se pensaba que la afectación neurológica periférica en pacientes con EII era casi exclusivamente por la malabsorción de nutrientes7, indicando un origen similar a la neuropatía del déficit de vitamina B12 y otras neuropatías carenciales. Sin embargo, ahora se ha asociado además a compromiso vasculítico y al uso de fármacos para la EII7,8, e incluso se ha considerado un proceso intrínseco a la condición9.
Los mecanismos autoinmunitarios conocidos mediante los cuales se puede producir una neuropatía periférica en pacientes con EII se relacionan con la citotoxicidad de linfocitos y depósito de inmunocomplejos7. Si bien estas últimas tienen una asociación potente con las manifestaciones neurológicas de EII, se relacionan más a manifestaciones vasculares en el SNC, de modo que no serán motivo de nuestra discusión, a pesar de que en nuestro caso se demuestra la presencia de patología de pequeño vaso y evolucionó con la aparición de un infarto lacunar. Las excepciones podrían ser la vasculitis de vaso pequeño, que afectaría la vasa nervorum de los nervios periféricos descrita en la CU7,8.
Los grupos de drogas que se asocian a manifestaciones neurológicas en EII son indicadas usualmente para tratar la condición primaria. Entre ellas se encuentran los anticuerpos monoclonales anti-TNF, asociados a lesiones desmielinizantes, o encefalomielitis producida por sulfasalazina. De manera específica en lesiones del SNP, está reconocido el uso crónico de metronidazol, tal como está descrito en pacientes con tratamientos de larga como de corta duración (estos últimos con dosis más altas)10. En nuestro caso en particular, la patogenia por fármacos se descarta, ya que la paciente tiene sintomatología y hallazgos clínicos y electrofisiológicos previos al inicio de su terapia puntual.
El compromiso de la EII en el SNP se puede manifestar de maneras muy variables, tal como proponemos (tabla 2). Entre estas se encuentran PNP desmielinizantes (como el síndrome de Guillain-Barré) y axonales, que se han descrito, respectivamente, en una proporción de 2:18. De estas últimas, se han descrito como predominantes las PNP de predominio sensitivo por sobre sensitivo-motoras y motoras puras8. Igualmente, y según varias series, hasta un 25% los pacientes portadores de CU tienen neuropatía de fibra fina, mientras se presenta en un 11% en los pacientes con enfermedad de Crohn (EC)11.
La temporalidad de la neuropatía periférica en relación con la EII varía de caso a caso. Sin embargo, se puede obtener una relación directa entre la duración en años de la EII y la probabilidad de manifestar una neuropatía periférica. En un análisis de datos se evidencia un salto en la incidencia acumulada de neuropatías entre pacientes que son portadores de EII por 4 décadas y los que lo son por 5 décadas12. A su vez, en otro estudio se describe una relación directa entre edad y neuropatía periférica, la cual es estadísticamente significativa. La odds ratio de tener una neuropatía periférica aumenta en 1,13 por cada 10 años de evolución con la condición. A la fecha, no se ha descrito de manera sistemática la temporalidad de la coexistencia de EII y PNP. Otras asociaciones descritas incluyen a pacientes de género femenino (OR de 1,71) y diabéticos (OR de 1,89)9.
En una revisión realizada en 2005 por Gondim et al. se estableció que el momento del comienzo una neuropatía periférica asociada a EII varía entre EC y CU, estableciendo que la neuropatía comienza en la EC a aproximadamente 11,8 ± 4 años después del diagnóstico, mientras que en la CU aparece en promedio 26,3 ± 5,6 después11. Esto es indicador de que las manifestaciones neuropáticas tienden a aparecer años (hasta décadas) después del diagnóstico de la EII y no antes, salvo en casos determinados.
En el estudio clásico de 1995 de Lossos et al. se observan manifestaciones neurológicas previas al diagnóstico de EII, las que incluyen: síndrome Melkersson-Rosenthal (hasta 7 años antes), miastenia gravis (hasta 9 años antes) y accidente cerebro-vascular recurrentes (hasta 10 años antes). Sin embargo, la neuropatía periférica más precoz descrita en este estudio es AIDP, pocos meses después del diagnóstico de CU3.
ConclusionesLos trastornos clasificados como EII tienen en común su origen mayoritariamente autoinmune. De esta manera, constituyen trastornos de carácter multisistémico para un porcentaje no menor de pacientes que la presentan y la clínica multisintomática así lo demuestra.
El caso clínico recién expuesto constituye un ejemplo florido de las variadas manifestaciones clínicas neurológicas asociadas a EII, específicamente la PNP sensitiva. A diferencia de la mayoría de los casos descritos, vemos una diferencia de 6 años entre la primera manifestación neurológica de la paciente y la confirmación diagnóstica de su CU como diagnostico etiológico más probable de la patología de SNP. Dentro de esta revisión literaria no se ha encontrado un reporte donde una PNP se presente con este grado de precocidad.
Se puede deducir de este reporte que la EII es un diagnóstico diferencial a tener en cuenta en el contexto de pacientes con PNP de origen incierto y, por ende, el seguimiento cercano de este tipo de pacientes es muy importante; en la paciente descrita, hubo instalación de disfagia fluctuante 3 años previos a la confirmación diagnóstica de la CU.
En nuestro caso, el tratamiento de la EII mediante inmunosupresores tuvo una respuesta clínica positiva en la sintomatología neurológica. Por tanto, un diagnóstico temprano de EII podría significar un cambio importante en la calidad de vida de los pacientes con clínica polineuropática asociada a esta condición.
Consideramos que son necesarios más reportes de casos, o realizar nuevas revisiones para tener mayor información respecto a las PNP como manifestación de la EII dada la poca cantidad de reportes. Aún queda pendiente caracterizar a la población que presenta estos trastornos y entender si estos responden a un fenotipo particular.
Por otro lado, creemos importante tener dentro de los diagnósticos posibles de PNP de origen incierto la EII. Si se logra aplicar esta aproximación, se podría obtener información muy valiosa respecto a la prevalencia de PNP en EII, las cuales están probablemente subdiagnosticadas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Conflicto de interesesLos autores niegan tener conflicto de intereses en la realización de este artículo.
Los autores agradecen a las autoridades universitarias en el apoyo para la publicación de este artículo.