La neuralgia postherpética en región facial es una situación clínica frecuente e incapacitante, que se caracteriza por la presencia de dolor neuropático presente por más de 3 meses, después de la desaparición del brote por herpes zóster. El control del dolor en ocasiones no es adecuado y los efectos adversos de las intervenciones resultan deletéreos para la salud de los pacientes, con un impacto sobre su calidad de vida. En el presente escrito, se presenta el caso de una mujer de 70 años de edad con queja de dolor de características neuropáticas secundarias a herpes zóster en región orofacial, la cual fue refractaria a tratamientos convencionales, y respondió a la aplicación de toxina botulínica tipo A. La toxina botulínica tipo A es una estrategia terapéutica utilizada en los últimos años para el manejo de la neuralgia postherpética, con adecuada respuesta según se registra en reportes de caso y 2 ensayos clínicos aleatorizados. El presente caso y los registrados en la literatura respaldan el uso de la toxina botulínica tipo A en neuralgia postherpética en región facial como una estrategia de tratamiento tolerable, segura y eficaz.
Postherpetic neuralgia in the facial region is a frequent and disabling clinical condition, characterized by the presence of neuropathic pain for more than 3 months after the outbreak of herpes zoster. Pain control is sometimes inadequate and the adverse effects of the interventions are deleterious to the health of patients, with an impact on their quality of life. In this paper we present the case of a 70-year-old woman with complaint of neuropathic pain secondary to herpes zoster in the orofacial region, who was refractory to conventional treatments and responded to the application of botulinum toxin type A. Botulinum toxin type A is a therapeutic strategy that has been used in recent years for the management of postherpetic neuralgia with adequate response, as recorded in case reports and 2 randomized clinical trials. The present case and those available in literature support the use of botulinum toxin type A in postherpetic neuralgia in the facial region, as a tolerable, safe and effective therapeutic strategy.
La neuralgia postherpética (NPH) es una condición clínica que se caracteriza por la presencia de dolor neuropático que persiste por más de 3 meses después de la desaparición del brote por herpes zóster1. Los ganglios de la raíz dorsal y nervios craneales son sitios comunes de reactivación del zóster, de donde se puede diseminar por los nervios sensitivos y sus correspondientes dermatomas2. Las zonas corporales más frecuentemente afectadas incluyen la región torácica y facial2. La vacunación para varicela zóster disminuye el desarrollo de NPH hasta en un 66,5% en personas entre los 60 y 80 años3. A pesar de esto, la incidencia de NPH aumenta con los años y el riesgo de padecerla después de un brote de herpes zóster va desde un 5% en menores de 60 años, hasta un 20% en mayores de 80 años4. Adicionalmente otros factores como el compromiso de la región facial, el compromiso de fibras gruesas sensitivas y la severidad del brote, parecen incidir sobre el riesgo de sufrir NPH5. El dolor que se produce por la enfermedad es severo en la mayoría de los casos, causando gran discapacidad y deterioro de la calidad de vida6. Su tratamiento está basado en medidas farmacológicas e intervenciones invasivas. Dentro de los medicamentos comúnmente utilizados se encuentran los antidepresivos, antiepilépticos, opioides, lidocaína y la capsaicina. Las intervenciones incluyen bloqueo de nervios periféricos con fines analgésicos, bloqueo de ganglios nerviosos (trigeminal y esfenopalatino) y procedimientos quirúrgicos7,8. Sin embargo, un porcentaje no claramente determinado de pacientes presentan una respuesta inadecuada a estas intervenciones y continúan con dolor y deterioro de la calidad de vida9. La tolerabilidad y la seguridad de los fármacos e intervenciones terapéuticas son otra preocupación en el manejo de estos pacientes, especialmente en la población susceptible a la NPH, la geriátrica9. Existe la necesidad de nuevos tratamientos con mayor efectividad, tolerancia y seguridad. En años recientes se ha venido usando la toxina botulínica tipo A para esta enfermedad como una estrategia viable que cumple los requisitos mencionados10. A continuación presentamos un caso de NPH facial refractaria, que respondió a la aplicación de toxina botulínica tipo A y revisamos la literatura existente.
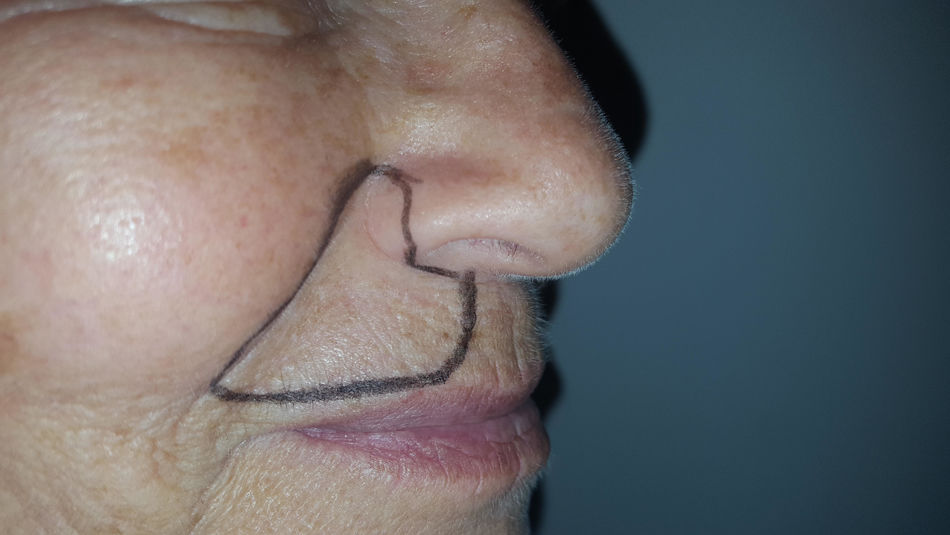
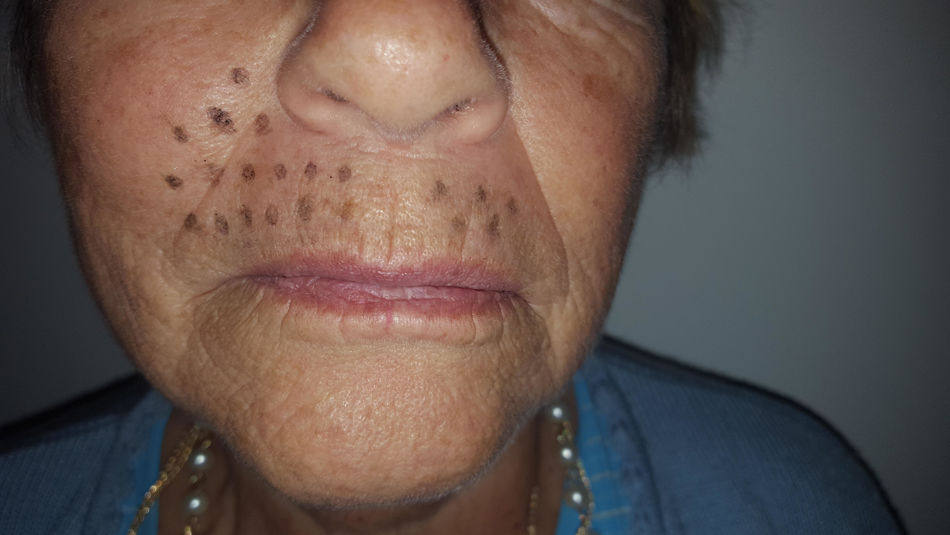
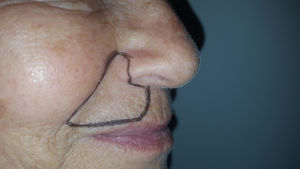
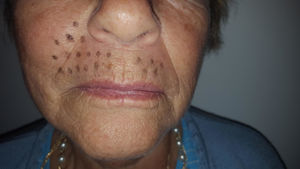
Caso clínicoSe trata de una mujer de 70 años de edad con NPH en región facial derecha (en zona de la segunda rama del trigémino) de 18 meses de evolución. La paciente se queja de dolor severo (en escala verbal numérica [EVN] de 9 sobre 10) tipo ardor y quemazón en la zona delimitada en la figura 1. El dolor es constante y ha deteriorado su calidad de vida, con limitación para comer y usar maquillaje. Como antecedentes la paciente tiene hipertensión arterial con adecuado control y en manejo farmacológico con enalapril 20mg/día. Al examen físico, como hallazgos positivos se encuentra zona de hipostesia táctil en región perilabial superior derecha y alodinia táctil estática en la zona dibujada en la figura 1. Se inicia manejo con amitriptilina hasta dosis de 50mg/día, pero por no mejoría y efectos adversos se cambia a pregabalina. Esta se administra a dosis de 450mg/día, con marcado mareo y somnolencia y sin mejoría del dolor. Por esta razón se disminuye la dosis de pregabalina a 300mg/día y se adiciona duloxetina hasta dosis de 60mg/día. Con la terapia combinada no hay mejoría del dolor y se decide realizar bloqueo de nervio infraorbitario con lidocaína al 2% sin epinefrina. El procedimiento se lleva a cabo sin complicaciones pero sin mejora del dolor. Continuando con la terapia dual farmacológica por vía oral se adiciona manejo con capsaicina al 0,025% pero la paciente no tolera la sensación de ardor inicial y la suspende. A continuación se le propone a la paciente manejo con bloqueo del ganglio esfenopalatino derecho vía nasal transmucoso con técnica de aplicador con lidocaína al 2% sin epinefrina. Este procedimiento se realiza sin complicaciones y adecuada tolerancia por el paciente pero sin mejoría del dolor. Debido a la persistencia del dolor neuropático severo (9/10 en EVN) después de las intervenciones realizadas se plantea la aplicación de toxina onabotulínica tipo A (Botox, Allergan Inc). La inyección de la toxina se realiza en la zona de dolor y puntos adicionales según esquema en figura 2. Con dilución de 50U por cc se aplica 0,1U por punto vía subcutánea (jeringa de insulina de 1cc y aguja de 13mm 30G) con separación de 0,5cm entre los puntos formando una matriz que abarca toda la zona dolorosa. Seis semanas posteriores a la aplicación la paciente presenta una mejoría marcada del dolor con un puntaje en EVN de 2/10 y sin complicaciones asociadas incluyendo no debilidad del orbicular de los labios. A las 14 semanas la paciente continúa con la mejoría del dolor con puntaje en EVN 1/10. Al examen físico en la semana 14 persiste zona de hipostesia perilabial superior derecha pero hay desaparición de la alodinia táctil estática descrita anteriormente. La paciente refiere mejoría de su calidad de vida, sin dificultad para comer y usando nuevamente maquillaje.
La NPH tiene un gran costo para el paciente y para la sociedad11. Los tratamientos comúnmente utilizados tienen limitada eficacia en el control del dolor y son asociados a efectos adversos que deterioran aun más la calidad de vida del paciente9. El uso de la toxina botulínica surge como una posibilidad más en el armamentario terapéutico para el manejo de la NPH10. Basados en este caso se realizo una búsqueda en la literatura en EMBASE, PUBMED y en la biblioteca de bases de datos de COCHRANE sobre estudios originales o de casos en humanos desde enero 1980 (primera publicación de uso de toxina botulínica en humanos)12, hasta el octubre 2016, en idioma inglés y español que incluyeran pacientes con NPH y tratamiento con toxina botulínica. Se encontraron 5 artículos, 3 sobre casos clínicos reportados con 5 pacientes y 3 estudios aleatorizados doble ciego controlados con placebo que incluyeron un total de 94 pacientes entre los 3 (Xiao et al., 60 pacientes, Apalla et al., 30 pacientes y Ranoux et al., 4 pacientes)9,13–17. El estudio de Ranoux et al.17 incluyó 29 pacientes con neuropatías focales dolorosas, 4 específicamente con NPH, los demás eran neuropatías postraumáticas o postoperatorias. En el estudio de Xiao et al.15 20 pacientes recibieron la aplicación de toxina botulínica tipo A, con duración aproximada del dolor de 12 meses, 11 eran hombres, edad promedio de 70 años y con un puntaje promedio en la escala visual análoga (VAS) para dolor de 7,6 pretratamiento. En el estudio de Apalla et al.16 15 pacientes recibieron toxina botulínica tipo A, una duración aproximada del dolor de 102 días, 8 hombres, con edad promedio 73 años y puntaje promedio del VAS de 8,8 pretratamiento. En ambos protocolos la aplicación de toxina botulínica tipo A se realizó de forma subcutánea delineando la zona dolorosa y formando una matriz con puntos espaciados entre sí de uno a 2cm, con una dosis máxima de 200UI por zona afectada. Para el estudio de Xiao et al. los comparadores utilizados en los otros 2 brazos fueron lidocaína al 0,5% y solución salina normal, mientras que en el estudio de Apalla et al. el comparador fue solución salina normal. El seguimiento se realizó hasta las primeras 12 semanas en el estudio de Xiao et al. y hasta la semana 24 en el de Apalla et al. En común para los 2 se incluyó el seguimiento de dolor con VAS y calidad de sueño pero con diferentes parámetros de medición. Adicionalmente Xiao et al. incluyen una medición de uso de opioides a los 7 días y 3 meses postratamiento. En términos de efectos adversos en la aplicación de toxina botulínica tipo A, ambos estudios demostraron que es una medicación bien tolerada y segura siendo la única molestia reportada el dolor en el momento de la aplicación. La eficacia en el control del dolor con la aplicación de toxina botulínica tipo A se demostró en ambos estudios con una reducción de al menos el 50% en el VAS versus placebo por Apalla et al. y un decremento promedio en el VAS de 4,5 por Xiao et al.; mejoría que aparece hacia la primera semana en los pacientes y persiste entre 12 y 16 semanas postratamiento. Por otro lado, los diferentes parámetros del sueño explorados en los 2 estudios mejoraron en los pacientes manejados con toxina botulínica. El porcentaje de pacientes con uso de opioides postratamiento en el grupo de toxina botulínica tipo A fue el menor (21,1%) comparado con lidocaína (52,6%) y solución salina normal (66,7%) en el estudio de Xiao et al. De los 100 pacientes comprendidos en los artículos, incluyendo nuestro reporte, solo 13 tenían NPH con compromiso craneofacial (en las tablas 1 y 2 se incluye un resumen de los estudios). El reporte de caso de Mittal et al.9 en región postauricular, solo 11 de los noventa pacientes incluidos por Xiao et al15 en región orofacial no especificada y nuestro reporte en región labial superior derecha. Los resultados compilados de los 13 casos demuestran una efectividad de la toxina botulínica tipo A en el manejo de la NPH de región facial con un excelente perfil de tolerancia y seguridad9,15.
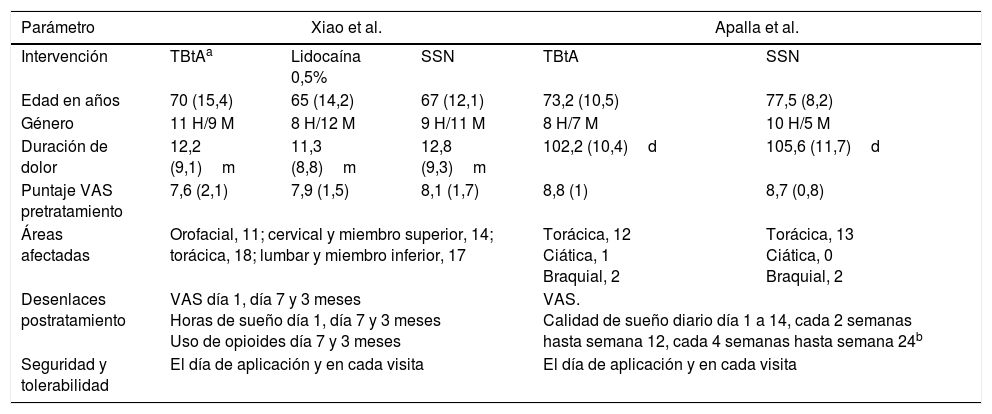
Resumen de estudios clase i en NPH y toxina botulínica tipo A
| Parámetro | Xiao et al. | Apalla et al. | |||
|---|---|---|---|---|---|
| Intervención | TBtAa | Lidocaína 0,5% | SSN | TBtA | SSN |
| Edad en años | 70 (15,4) | 65 (14,2) | 67 (12,1) | 73,2 (10,5) | 77,5 (8,2) |
| Género | 11 H/9 M | 8 H/12 M | 9 H/11 M | 8 H/7 M | 10 H/5 M |
| Duración de dolor | 12,2 (9,1)m | 11,3 (8,8)m | 12,8 (9,3)m | 102,2 (10,4)d | 105,6 (11,7)d |
| Puntaje VAS pretratamiento | 7,6 (2,1) | 7,9 (1,5) | 8,1 (1,7) | 8,8 (1) | 8,7 (0,8) |
| Áreas afectadas | Orofacial, 11; cervical y miembro superior, 14; torácica, 18; lumbar y miembro inferior, 17 | Torácica, 12 Ciática, 1 Braquial, 2 | Torácica, 13 Ciática, 0 Braquial, 2 | ||
| Desenlaces postratamiento | VAS día 1, día 7 y 3 meses Horas de sueño día 1, día 7 y 3 meses Uso de opioides día 7 y 3 meses | VAS. Calidad de sueño diario día 1 a 14, cada 2 semanas hasta semana 12, cada 4 semanas hasta semana 24b | |||
| Seguridad y tolerabilidad | El día de aplicación y en cada visita | El día de aplicación y en cada visita | |||
d: días; H: hombre; M: mujer; m: meses; NPH: neuralgia postherpética; SSN: solución salina normal; TBtA: toxina botulínica tipo A; VAS: escala visual análoga para dolor.
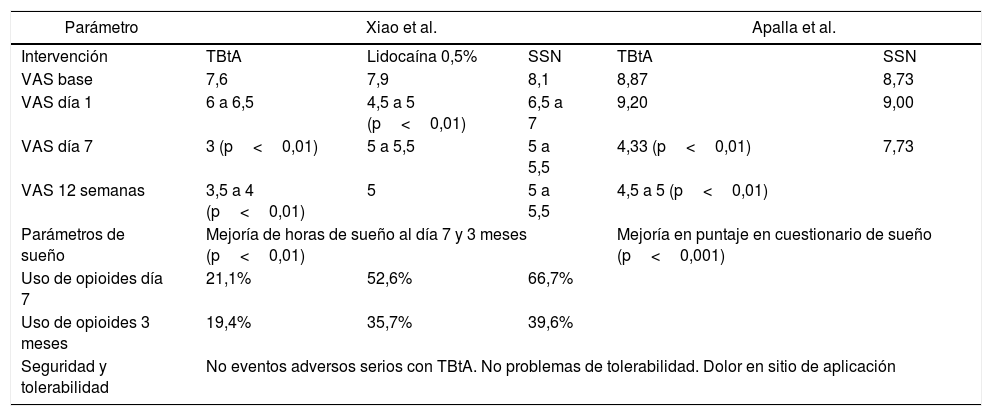
Resumen de las medidas de desenlace de estudios clase i en NPH y toxina botulínica tipo A
| Parámetro | Xiao et al. | Apalla et al. | |||
|---|---|---|---|---|---|
| Intervención | TBtA | Lidocaína 0,5% | SSN | TBtA | SSN |
| VAS base | 7,6 | 7,9 | 8,1 | 8,87 | 8,73 |
| VAS día 1 | 6 a 6,5 | 4,5 a 5 (p<0,01) | 6,5 a 7 | 9,20 | 9,00 |
| VAS día 7 | 3 (p<0,01) | 5 a 5,5 | 5 a 5,5 | 4,33 (p<0,01) | 7,73 |
| VAS 12 semanas | 3,5 a 4 (p<0,01) | 5 | 5 a 5,5 | 4,5 a 5 (p<0,01) | |
| Parámetros de sueño | Mejoría de horas de sueño al día 7 y 3 meses (p<0,01) | Mejoría en puntaje en cuestionario de sueño (p<0,001) | |||
| Uso de opioides día 7 | 21,1% | 52,6% | 66,7% | ||
| Uso de opioides 3 meses | 19,4% | 35,7% | 39,6% | ||
| Seguridad y tolerabilidad | No eventos adversos serios con TBtA. No problemas de tolerabilidad. Dolor en sitio de aplicación | ||||
NPH: neuralgia postherpética; SSN: solución salina normal; TBtA: toxina botulínica tipo A; VAS: escala visual análoga para dolor.
El efecto analgésico de la toxina botulínica tipo A no es simplemente producido por la relajación muscular a través de la inhibición de la liberación de la acetilcolina en la unión neuromuscular18. La toxina botulínica inhibe la liberación de neurotransmisores que regulan el dolor y la inflamación19. Estudios preclínicos y clínicos han demostrado su efecto antinociceptivo en diferentes modelos de dolor en ratas y enfermedades dolorosas en seres humanos10. Dentro de los neuropéptidos inflamatorios que son regulados se incluyen la sustancia P y el péptido relacionado con el gen de la calcitonina. La sustancia P y el péptido relacionado con el gen de la calcitonina son neurotransmisores producidos por neuronas del ganglio de la raíz dorsal y neuronas sensitivas primarias. La inhibición de su liberación disminuye la sensibilidad y el dolor en las aéreas afectadas donde es aplicada la toxina y a su vez contribuye a disminuir la sensibilización periférica y central20. Su mecanismo de acción antinociceptivo va mas allá de la inhibición de la liberación de sustancia P y de péptido relacionado con el gen de la calcitonina e incluye la regulación en la liberación de otros neurotransmisores, mediadores de la inflamación y el tráfico axonal de proteínas10.
La evidencia clínica respalda el uso de la toxina botulínica tipo A en el manejo del dolor neuropático21, el cual es causado por cualquier injuria o disfunción del sistema nervioso periférico o central22. Resultados de varios estudios clínicos, series de casos y reporte de casos demuestran su eficacia antinociceptiva en dolor neuropático por NPH, neuralgia trigeminal, neuralgia postraumática y posquirúrgica, neuropatía diabética y dolor por miembro fantasma10. En NPH, 2 estudios clase i (Xiao et al. y Apalla et al. expuestos con anterioridad), una serie de casos y 2 reportes de caso muestran la eficacia antinociceptiva de la toxina botulínica9,13–17. Expandiendo esta evidencia nuestro caso demuestra el beneficio de la aplicación de la toxina botulínica para el control del dolor y alodinia en la NPH y confirma su seguridad y tolerabilidad. Adicionalmente esta revisión desarrolla el tema del manejo terapéutico de la NPH con compromiso craneofacial con toxina botulínica tipo A. Sin embargo, en la actualidad no hay guías sobre el modo, dosis y frecuencia de aplicación de la toxina botulínica para el manejo del dolor neuropático. A pesar de estas limitantes consideramos que este caso y los otros 12 (Mittal et al. y Xiao et al.)9,15 de NPH con compromiso craneofacial abre la posibilidad para que se considere la toxina botulínica tipo A, como una alternativa terapéutica tolerable, segura y eficaz.
Conflicto de interesesNo hay conflictos de intereses manifestado por los autores.