La capacidad cognitiva de percibir el tiempo ha sido motivo de investigación a lo largo de la historia. Las teorías actuales refieren la dopamina como el neurotransmisor encargado del normal funcionamiento del «reloj interno». Se han descrito implicaciones en la percepción del tiempo, tanto en patologías neurológicas como psiquiátricas.
ObjetivoEvaluar alteraciones en la percepción del tiempo en pacientes con EP y DA.
Materiales y métodosSe estudió, de forma consecutiva, a pacientes con diagnóstico previo de EP o DA, ambos homologados con sus grupos controles. Se utilizó una batería cognitiva digital según el método de Bueti and Walsh (2010) con modificaciones (Bueti y Walsh, 2010; Ganzenmuller, 2012) para evaluar vías dopaminérgicas.
ResultadosEl estudio evidenció una diferencia significativa en estimación de tiempo al apreciar intervalos cortos de 3 s de duración (p=0,001); la sobrerreproducción de los tiempos mostrados fue una constante en los 4 grupos.
ConclusiónLas patologías estudiadas mostraron alteración en la percepción de tiempo. Estos datos contribuyen a las teorías que vinculan la dopamina con el funcionamiento del reloj biológico.
Cognitive ability to perceive time has been a subject of investigation throughout history and time-perception abnormalities have been described in different Neurological and Psychiatric disorders.
ObjectiveTo assess and compare time-perception in patients with PD and ADD.
Materials and methodsOutpatients with previous diagnosis of PD or ADD were studied with modified Bueti and Walsh's cognitive battery (Bueti and Walsh 2010, Ganzenmuller E 2012), to analyze time-perception.
ResultsThere was a significant difference in estimation of time between both groups, when testing short intervals (3seconds as reference. P=.001). Under-estimation of time was constant in all groups, but more prominent in patients with PD. Patients with ADD showed anticipation in most cases and learning effect was limited.
ConclusionTime-perception alterations were found in patients with PD and ADD, with more prominent under-estimation in patients with PD and anticipation in patients with ADD. More research in this subject may help to better understand the role of dopamine in the biological clock.
El tiempo ha sido motivo de investigación desde épocas antiguas. Según la astronomía, el día solar dura en promedio 24 h 3 min y 56,555 s, y el ritmo circadiano del hombre, 25 h aproximadamente. Si asociamos estos conceptos, podríamos inferir que el cuerpo humano presenta un reloj biológico vinculado a su medio ambiente1,2.
El análisis del tiempo como variable en el cuerpo humano, cronometría, presenta 2 líneas de análisis distintas en el cuerpo humano. Por un lado, las respuestas biológicas que requieren de tiempos y ciclos reglados (cronobiología) y la capacidad cognitiva de percibir el tiempo1. El proceso cognitivo de percepción y medición del tiempo puede dividirse en cronometraje controlado y automático3. Este último constituye una capacidad esencial para la vida diaria del ser humano debido a que nos permite conocer el tiempo necesario para interpretar un instrumento musical, organizar un programa motor, producción de habla y cualquier otra praxia4. El cronometraje controlado, en cambio, consiste en discriminar la duración de segmentos de tiempos y estimaciones de intervalos4.
Las alteraciones en la percepción del tiempo han sido evaluadas en patologías neurológicas y psiquiátricas, como esquizofrenia, autismo, déficit atencional (DA) y en la enfermedad de Parkinson (EP)5. Un teoría reciente establecería el papel que desempeña la dopamina como neurotransmisor para el funcionamiento de nuestro reloj interno5; correlacionando esto con lo expuesto anteriormente, tanto el DA como la EP presentan alteraciones dopaminérgicas y ambos presentan características conductuales opuestas6,7.
Si bien hay evidencia científica de los trastornos en la percepción del tiempo en pacientes con EP y DA, no hay trabajos en nuestro medio que comparen las falencias en forma unificada mediante un mismo test cognitivo con sistema de reproducción, óptimo para evaluar redes dopaminérgicas, entre ambos grupos. El objetivo de dicho estudio consiste en evaluar la función psíquica consciente de percibir el paso del tiempo en pacientes con EP y DA.
Materiales y métodosEstudio exploratorio de tipo transversal.
MuestraLa población estudiada incluyó a pacientes que concurrieron en forma espontánea al consultorio de Neurología del Sanatorio Allende con diagnóstico confirmado de Parkinson y DA del adulto. Los individuos deberán ser mayores de 18 años y no tener signos de demencias. A los participantes se les entregó un consentimiento informado aprobado por el Comité de Ética del Sanatorio Allende, explicándole su participación en dicha investigación.
El trabajo clínico estuvo sujeto a las reglas de buena práctica clínica, según la Declaración de Helsinki de la Asociación Médica Mundial8.
Todos los pacientes continuaron recibiendo su medicación habitual durante la experiencia. La medicación de los pacientes con EP fue carbidopa/levodopa 25/100mg 3 veces al día. La escala clínica de Unified Parkinson Disease Rating Scale promedio en estos últimos fue de de 35 puntos.
Los pacientes con DA permanecieron medicados con metilfenidato 10mg al día. Los individuos participantes no tenían ninguna otra enfermedad crónica y no experimentaron cambios en sus esquemas terapéuticos en los últimos 15 días.
Tanto los pacientes con EP y DA como los grupos fueron evaluados cognitivamente mediante la batería Addenbrooke Cognitive Examination para evaluar déficits que puedan sesgar el estudios.
Los grupos de control fueron armados con pacientes ambulatorios sanos que asistieron por estudios preocupacionales.
MétodoLos integrantes realizaron una batería digital que consiste en la estimación de intervalos de tiempo. Consta de 4 fases, la primera presenta el intervalo de referencia o estándar, que es un espacio vacío de tiempo cuya duración queda delimitada por 2 tonos auditivos. A continuación, se emite un sonido de inicio y el paciente deberá pulsar cuando considere que ha transcurrido el tiempo de referencia mostrado anteriormente. El ejercicio se realiza 4 veces, siempre mostrando el segmento estándar antes de la comparación con la finalidad de evaluar aprendizaje. En la segunda etapa, se continúa con la misma metodología, enseñar un intervalo estándar que luego será reproducido por el paciente pero con 5 segmentos de tiempo distintos ordenados en forma creciente. La tercera consiste en mostrar segmentos decrecientes y, por último, la cuarta, en donde los segmentos de tiempo están desorganizados.
Los periodos son prefijados y para todos los pacientes iguales (3, 5, 7, 9 y 12 s). La medición del tiempo se efectuó con la clase Stopwatch del paquete System Diagnostics, desarrollado por Microsoft, obteniendo una precisión de 1 ms.
Análisis estadísticoSe estudió a los pacientes con DA y EP, y para cada población se conformó un grupo control de acuerdo con el sexo y la edad. El análisis estadístico de los datos se adaptó a las variables en estudio (ANOVA, regresión no lineal, datos categóricos y test de comparaciones múltiples). El nivel de significación se tomará en 0,05.
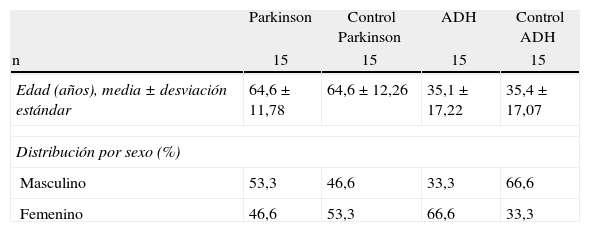
ResultadosSe reunió a 60 pacientes en total, incluyendo grupos control. Las características poblaciones pueden verse en la tabla 1.
Los datos obtenidos por medio de la batería cognitiva se muestran la tabla 2. Se obtuvo diferencia significativa al reproducir los segmentos de tiempo de 3, 7 y 12 s.
Resultados de los tiempos reproducidos por los participantes
| Tiempos ejecutados por los pacientes | Análisis estadístico | ||||
| Tiempos de referencia | Control Parkinson | Parkinson | Control ADH | ADH | ANOVA |
| 3.000 ms | 4.256,24±688,45 | 4.944,48±1.684,5 | 3.959,2±823,01 | 4.448,55±1.032,5 | p=0,001 |
| 5.000 ms | 7.214,93±3.139,3 | 7.081,22±3.020,1 | 6.771,84±2.590,8 | 6.028,93±846,21 | p=0,1284 |
| 7.000 ms | 8.606,55±1.751.1 | 8.516,86±1.153,0 | 8.825,6±1.743,9 | 7.974.6±906,73 | p=0,0389 |
| 9.000 ms | 10.668,22±1.372,4 | 11.006,17±1.062,9 | 10.983,04±1.012,2 | 10.723,11±2.412,6 | p=0,645 |
| 1.200 ms | 12.677,31±1.972,6 | 13.862±4.796,1 | 12.764,08±1.463,4 | 12.144,66±2.392,5 | p=0,047 |
En la primera columna se aprecia el valor de referencia en milisegundos dado para la posterior reproducción. En las columnas siguientes se aprecia el valor medio obtenido por grupos.° diferencia significativa. En cada grupo se muestra la media ± desviación estándar.
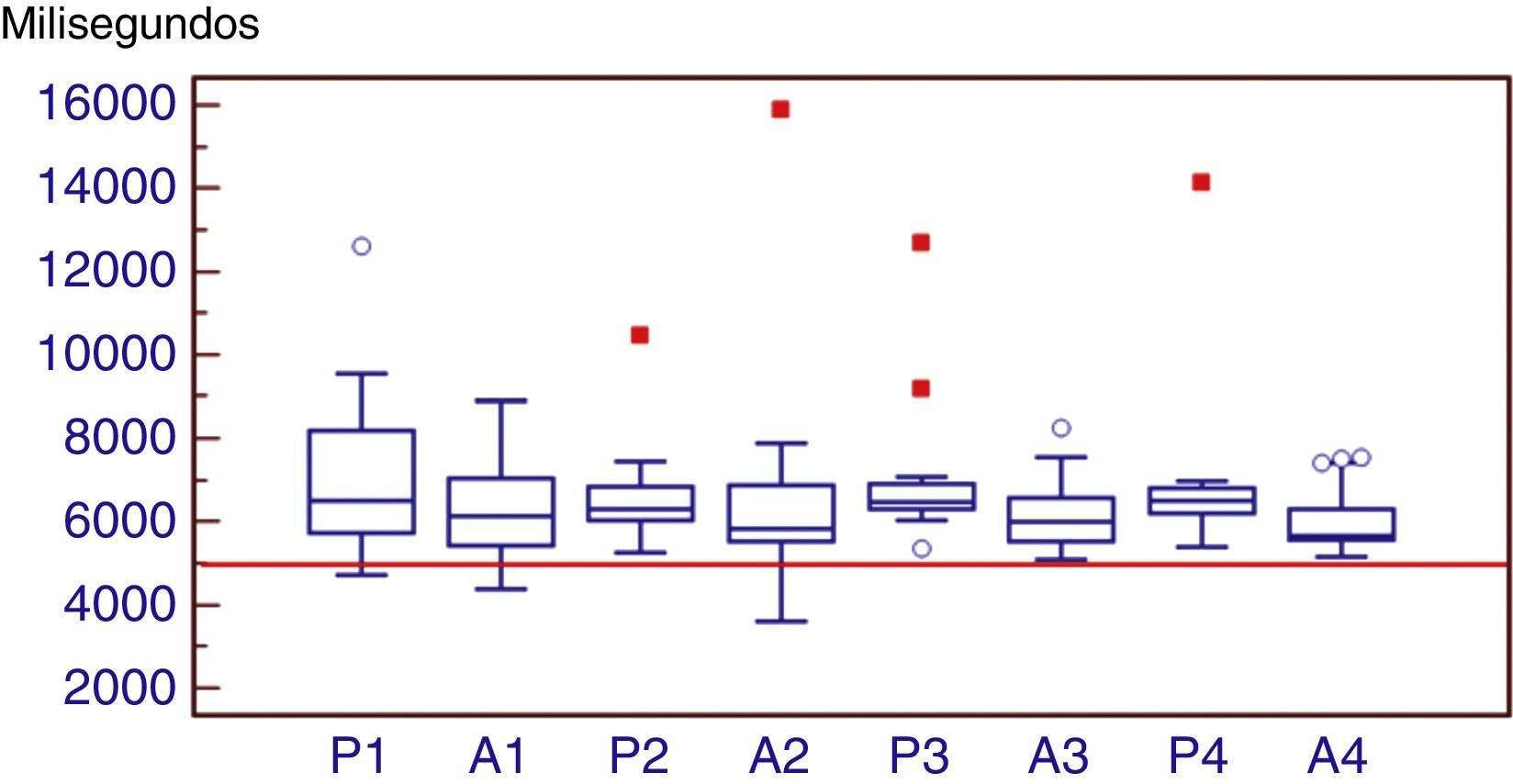
En la fase uno de la evaluación, se presentan 5 s en 4 repeticiones con la finalidad de evaluar aprendizaje. Como muestra la figura 1, no hay diferencia entre los pacientes con EP y DA para el aprendizaje al compararlos con los grupos control. Los valores de la mediana de los pacientes con DA permanecieron más cerca de los valores de referencia que los de los pacientes con EP.
Curvas de aprendizaje. El cuadro central representa los valores de los cuartiles 25 y 75. La línea central representa la mediana. Los bigotes se extienden hasta los valores máximo y mínimo de la serie o hasta 1,5 veces el rango intercuartil (RIC). Un valor atípico se define como un valor que es menor que el cuartil inferior menos 1,5 veces el rango intercuartil, o mayor que el cuartil superior más 1,5 veces el rango intercuartil (círculos). Los cuadrados representan valores que son menores que el cuartil inferior, menos 3 veces el rango intercuartil, o mayores que el cuartil superior, más de 3 veces el rango intercuartil.
La línea horizontal indica el valor de referencia evaluado (5.000 ms). Esta gráfica muestra que no hay diferencia entre los pacientes con EP y DA para el aprendizaje (p determinada con ANOVA: 0,6031). Comparando el aprendizaje entre los pacientes con EP y el grup de control (p mediante ANOVA: 0,6845) y lo mismo para los DA (p mediante ANOVA: 0,9278), la prueba no fue significativa tampoco. Es importante destacar que los pacientes con DA presentaron valores de las medianas más cercanos a los de referencia, comparado con los pacientes con EP.
A1: primer intento del grupo con DA; A2: segundo intento del grupo con DA; A3: tercer intento del grupo con DA; A4: cuarto intento del grupo con DA; P1: primer intento del grupo de EP; P2: segundo intento del grupo de EP; P3: tercer intento del grupo de EP; P4: cuarto intento del grupo de EP.
El cronometraje controlado consiste en discriminar la duración de segmentos de tiempos y estimaciones de intervalos. El ejemplo más sencillo lo constituye cuando estamos frente a un semáforo y la luz verde no aparece, ¿cómo sabemos que pasó el tiempo promedio y que el semáforo está roto? Solo es posible gracias a la medición, la comparación y la memorización de segmentos de tiempo9.
La medición consciente o inconsciente es importante para desarrollar actividades variadas10; el interrogante de múltiples investigadores es cómo se logra. Son múltiples las teorías que abordan el tema; una de ellas, llamada modelo del oscilador temporal interno (Treisman, 1963), consiste de 5 componentes: marcapasos, contador, almacén, comparador y mecanismo verbal selectivo. El oscilador temporal forma parte del marcapasos, el cual genera señales en forma rítmica a una cierta frecuencia. Los pulsos llegan hasta la unidad de calibración, que controla la tasa final de pulsos11. El modelo de cronometraje escalar (Gibbon, Church y Meck, 1984) fue desarrollado en experiencias con animales para evaluar aprendizaje; también presenta 5 componentes que se distribuyen en los 3 procesos siguientes: cronometraje (marcapasos e interruptor), almacenamiento (memoria de trabajo-acumulador y memoria de referencia) y decisión (comparador)12. Teorías posteriores agregan el concepto de la atención para esclarecer fenómenos como «el tiempo vuela cuando uno se divierte», fundamentando en que se presta menos atención al paso del tiempo por estar ocupado en otra actividad7,13.
Conociendo «cómo» posiblemente se elabora la estimación temporal, el siguiente interrogante es «dónde» se localiza el supuesto reloj interno. Si bien no hay patología que curse solamente con alteración en la percepción del tiempo, a través de pacientes con alteraciones en sitios puntuales del sistema nervioso central se pudo evaluar que los ganglios de la base, la corteza motora suplementaria, el cerebelo y la corteza prefrontal dorsolateral y parietal derecha participan del proceso de estimación temporal7,14. Diversas publicaciones han puesto énfasis en la participación de estructuras subcorticales, como los ganglios de la base15, y en los circuitos dopaminérgicos7,16. Coincidiendo con esto, los efectos secundarios de ciertos fármacos han llamado la atención de investigadores debido a las alteraciones evaluadas; se demostró la capacidad de disminuir la velocidad de reloj interno con fármacos neurolépticos, tales como haloperidol, y para aumentarla con fármacos estimulantes, tales como metanfetamina9,17. Más en detalle, los receptores D2 de la dopamina desempeñan un papel importante para la integración temporal de la percepción del tiempo9.
Las alteraciones en la percepción del tiempo han sido evaluadas en distintas patologías, entre estas se encuentra la EP y el DA5. Correlacionando esto con lo expuesto anteriormente, ambas presentan alteraciones dopaminérgicas6,18. La EP se debe al déficit de neuronas dopaminérgicas a nivel de la sustancia nigra19, mientras que en los pacientes con DA las alteraciones dopaminérgicas se presentan en distintos niveles18. Están descritas asimetrías de la cabeza del núcleo caudado20,21 y del globo pálido bilateral, aunque en mayor medida en el derecho22; también hipoperfusión de las estructuras neoestriadas y frontales, más marcada en el hemisferio derecho23 Por último, estos pacientes se benefician ampliamente al incorporar agonistas dopaminérgicos a su esquema terapéutico24.
Existen distintas baterías para evaluar alteraciones sensoperceptivas del tiempo; puntualmente pueden compararse segmentos (el intervalo 1 dura más que el segmento 2), o reproducir un tiempo luego de haber presentado antes un segmento de referencia5. Las técnicas de reproducción de intervalos dependen de un nivel óptimo de la actividad dopaminérgica en los circuitos corticoestriatales modulados por serotonina y glutamato5,7. Por esta razón, en nuestra investigación adoptamos el método de Bueti y Walsh con modificaciones10,25. Pacientes con EP presentan alteraciones documentadas en la interpretación del tiempo; Malapanini et al., mediante el uso de un diseño de doble duración, donde las 2 duraciones son probadas en bloques de prueba separados, pero dentro de la misma sesión (p. ej., 8 s y 21 s), demostraron que sobrerreproducen los 8 s de duración e infraestiman los 21 s5,6. Smith et al. compararon a pacientes con EP vs. controles mediante pruebas de estimación de segmentos temporales, encontrando una disminución de la velocidad del reloj interno26. En el DA, pueden conducir a la subestimación de las duraciones probablemente al DA per se y a su impulsividad27–30.
Por las apreciaciones globales del estudio, podemos observar que en los 4 grupos se tiende a infraestimar el paso del tiempo, ya que tienden a sobrepasarse al momento de reproducirlo. Los pacientes con DA presentaron anticipación en la mayoría de los casos y mayor precisión al estimar, probablemente debido a su componente ansioso. Estos últimos no pudieron memorizar los segmentos en la fase uno, objetivándose posiblemente debido a su DA. Los peores resultados se obtuvieron al estimar intervalos cortos de tiempo en ambos grupos, mostrando la p más significativa. De acuerdo con lo establecido por Malapanini et al., en nuestro estudio los pacientes con EP sobrerreprodujeron los tiempos, especialmente los más cortos (3 s).
ConclusiónA través de nuestro estudio pudimos establecer de forma objetiva déficits en la percepción del tiempo entre 2 grupos de pacientes con enfermedades dopaminérgicas, aun sin interrumpir la medicación. Los segmentos más cortos de tiempo lograron ser los más difíciles de reproducir. De acuerdo con nuestra investigación, y en forma conjunta con las reseñas tomadas, podemos implicar a la dopamina como participante en el reloj interno. También que este último sería un sistema y no una estructura aislada, que para poder funcionar correctamente necesita de diversos órganos y neurotransmisores que lo modulen. Como punto positivo, fue de utilidad realizar una batería, no utilizada en la práctica clínica, corta y sencilla para estimar en forma objetiva la percepción temporal, herramienta que podría ser utilizada como medidor de la eficacia de los fármacos utilizados en su terapéutica. Para esto es necesario el perfeccionamiento de la misma y el respaldo científico por otros investigadores especialistas en la temática. Conociendo en detalle el proceso cognitivo de percepción de tiempo, gracias a la creciente evidencia científica del área, podremos innovar en el tratamiento farmacología, como también en la rehabilitación de dichos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.