En los últimos años han surgido múltiples tratamientos para la esclerosis múltiple (EM), tanto inyectables como orales, los cuales están actualmente disponibles en Costa Rica. Sin embargo, en el Seguro Social los interferones son los únicos fármacos accesibles en la lista oficial de medicamentos, el resto de las terapias requieren un trámite administrativo de compra para su prescripción.
ObjetivoDescribir el tratamiento de la EM en Costa Rica.
Pacientes y métodosSe realizó un estudio longitudinal, observacional y retrospectivo de casos registrados de EM en los hospitales de la seguridad social, entre 1990 y 2017. Se analizó el tratamiento farmacológico a octubre del 2020 de los pacientes que cumplieran los criterios de McDonald del 2010.
ResultadosSe obtuvo un total de 448 casos, de los cuales 437 se encontraban en tratamiento farmacológico. Los medicamentos prescritos más frecuentes fueron interferón beta 1a intramuscular (IFN-β1a IM) (53,6%), interferón beta 1b (IFN-β1b) (21,2%) e interferón beta 1a subcutáneo (IFN-β1a SC) (7,9%). Para el 2020, 163 personas (36,4%) habían continuado con el fármaco y 274 (62,3%) necesitaron un cambio de tratamiento, siendo la falla terapéutica la principal causa y el fingolimod el medicamento de elección para el cambio. El IFN-β1a IM presentó un mayor tiempo de uso y se cambió con menor frecuencia, mientras que el fingolimod y el IFN-β1a SC tienen mayor probabilidad de requerir una modificación y en un menor periodo de tiempo.
ConclusionesEn Costa Rica los interferones son los tratamientos más utilizados en la Seguridad Social, por lo que la falla terapéutica es el principal motivo de cambio de medicación, siendo el fingolimod el fármaco de elección.
In recent years, multiple treatments for multiple sclerosis have emerged for both, injectable and oral routes of administration. Most of these medications are currently available in Costa Rica. However, interferons are still the only available treatment in the public health system. An overwhelming administrative procedure is required to justify the purchase of the rest of the options in case they are needed for any specific patient.
ObjectiveTo describe the treatment of multiple sclerosis in Costa Rica.
Patients and methodsA longitudinal, observational and retrospective study of cases with the diagnosis of multiple sclerosis in the Costa Rican public hospital system was carried out between 1990 and December 2017. Drug treatment as of October 2020 was analyzed for those patients who met the 2010 McDonald's criteria.
ResultsA total of 448 cases were obtained, of which 437 were under drug treatment. The most frequent used drugs were Interferón β1-a intramuscular (53.6%), Interferón β1-b (21.2%) and Interferón β1-a subcutaneous (7.9%). By 2020, 163 patients (36.4%) had continued with the first medication, meanwhile 274 persons (62.3%) needed a change of drug. Treatment failure was the main cause of change and fingolimod was the main alternative choice. Interferón β1-a intramuscular has a longer time of use and less change rate, while fingolimod and Interferón β1-a subcutaneous are more likely to require change in a shorter period of time.
ConclusionIn Costa Rica, interferons are the most widely used treatments for multiple sclerosis in the public health system. Therapeutic failure is the main reason for changing medication, while fingolimod is the treatment of choice in most cases.
La esclerosis múltiple (EM) es la enfermedad autoinmune más frecuente del sistema nervioso central (SNC) y la principal causa de discapacidad no traumática en la población adulta joven1.
Se estima que la EM afecta alrededor de 900.000 personas en EE. UU. y más de dos millones en todo el mundo. En América Latina se han descrito prevalencias de la enfermedad muy variables, desde uno a 10 casos por 100.000 habitantes en los países andinos y Centroamérica, hasta los 25-30 casos por 100.000 personas en la región del norte de México y la zona rioplatense1–4. En Costa Rica, la prevalencia se ha determinado en nueve casos por 100.000 habitantes, de acuerdo con las revisiones de los registros del sistema de salud pública5,6.
La EM es una enfermedad difícil de tratar, debido a la heterogeneidad de los factores ambientales y genéticos que la originan. La recuperación incompleta de los brotes y la progresión independiente de recaídas se asocian a una acumulación progresiva de la discapacidad. El tratamiento temprano permite controlar el componente inflamatorio del padecimiento y la acumulación de lesiones que se asocian a cambios neurodegenerativos. Con el inicio tardío del tratamiento, se pierde esta ventana terapéutica y se obtienen peores resultados1,7.
Costa Rica se caracteriza por ser un país en donde la atención de la salud se canaliza principalmente a través de la seguridad social. La población actual del país ronda los 5,5 millones de habitantes, de los cuales alrededor de 85% están afiliados a la seguridad social y casi la totalidad de los pacientes con EM se tratan a través de este sistema.
Un pequeño porcentaje de la población cubre sus necesidades a través de seguros privados (nacionales y extranjeros) o por medio de gasto de bolsillo. A pesar de que los centros de atención nacionales han logrado avances significativos en los últimos 10 años, principalmente en la capacidad de diagnóstico y seguimiento de los pacientes con EM, aún existen francas oportunidades de mejora. Se han logrado identificar ineficiencias en el acceso al armamento terapéutico por medio de la restricción de las opciones disponibles, trámites burocráticos excesivos en la solicitud e implementación de algunos tratamientos, inercia terapéutica en las citas de control, o bien, falla en la detección temprana de la progresión (incluida aquella independiente de recaídas). En este trabajo, se revisan las opciones terapéuticas aplicadas en los pacientes costarricenses que tienen tratamiento en la red hospitalaria de la seguridad social, con corte actualizado al final del año 2020.
Pacientes y métodosSe realizó un estudio observacional descriptivo, longitudinal-retrospectivo. Se incluyeron los pacientes de los Hospitales de la Caja Costarricense de Seguro Social (CCSS) que cumplieran los criterios de EM de McDonald8, publicados en el 2010, en el periodo comprendido entre enero de 1990 a diciembre del 2017. El estudio fue aprobado por el Comité Ético Científico Institucional con el número de protocolo de investigación R017-SABI-00144.
Se revisaron un total de 741 expedientes digitales de pacientes con el diagnóstico de EM, reportados por los servicios de estadística de los hospitales que cuentan con neurólogos de adultos de la CCSS, específicamente el Hospital San Juan de Dios, Hospital Calderón Guardia, Hospital México, Hospital Escalante Pradilla, Hospital San Rafael de Alajuela, Hospital San Vicente Paúl, Hospital de San Carlos, Hospital Max Peralta y Hospital Monseñor Sanabria. Se excluyó el Hospital Tony Facio debido a que los pacientes de esa área son valorados en el Hospital Calderón Guardia. Un total de 448 personas fueron incluidas por cumplir con los criterios de McDonald para el estudio de medicación y efectos adversos.
En el 2021 se publicó el perfil demográfico y clínico de los pacientes con EM en Costa Rica, donde se describió la terapia inicial y al 20176. Durante este estudio, se registra el tratamiento de esa misma población a octubre del 2020, recopilándose además en aquellos sujetos que tuvieron cambio de medicación, el fármaco previo y el motivo de dicho cambio para su posterior análisis.
Análisis estadísticoPreviamente definidas las variables y su codificación, se digitó la información en una base de datos de Excel versión Office 2018 para Windows versión 10, asignando a cada uno de los pacientes un código alfanumérico para mantener la confidencialidad de los datos. Una vez completa la fase de digitalización, se exportó la información al software SPSS versión 27 (IBM Corp., Armonk, NY, EE. UU.) para el procesamiento y el análisis de los datos. Por otra parte, se crearon variables de tipo numéricas que indicaran el tiempo transcurrido entre variables de fecha.
Con respecto al análisis de la información, el primer nivel se realizó a través de la estadística descriptiva de las variables según el sexo. Para las de tipo categórico se usó la distribución de frecuencia absoluta y relativa, y para las variables numéricas se empleó la distribución de medias y dispersión. El segundo nivel de análisis se aplicó calculando los intervalos de confianza (IC) fijados al 95% para los datos descriptivos.
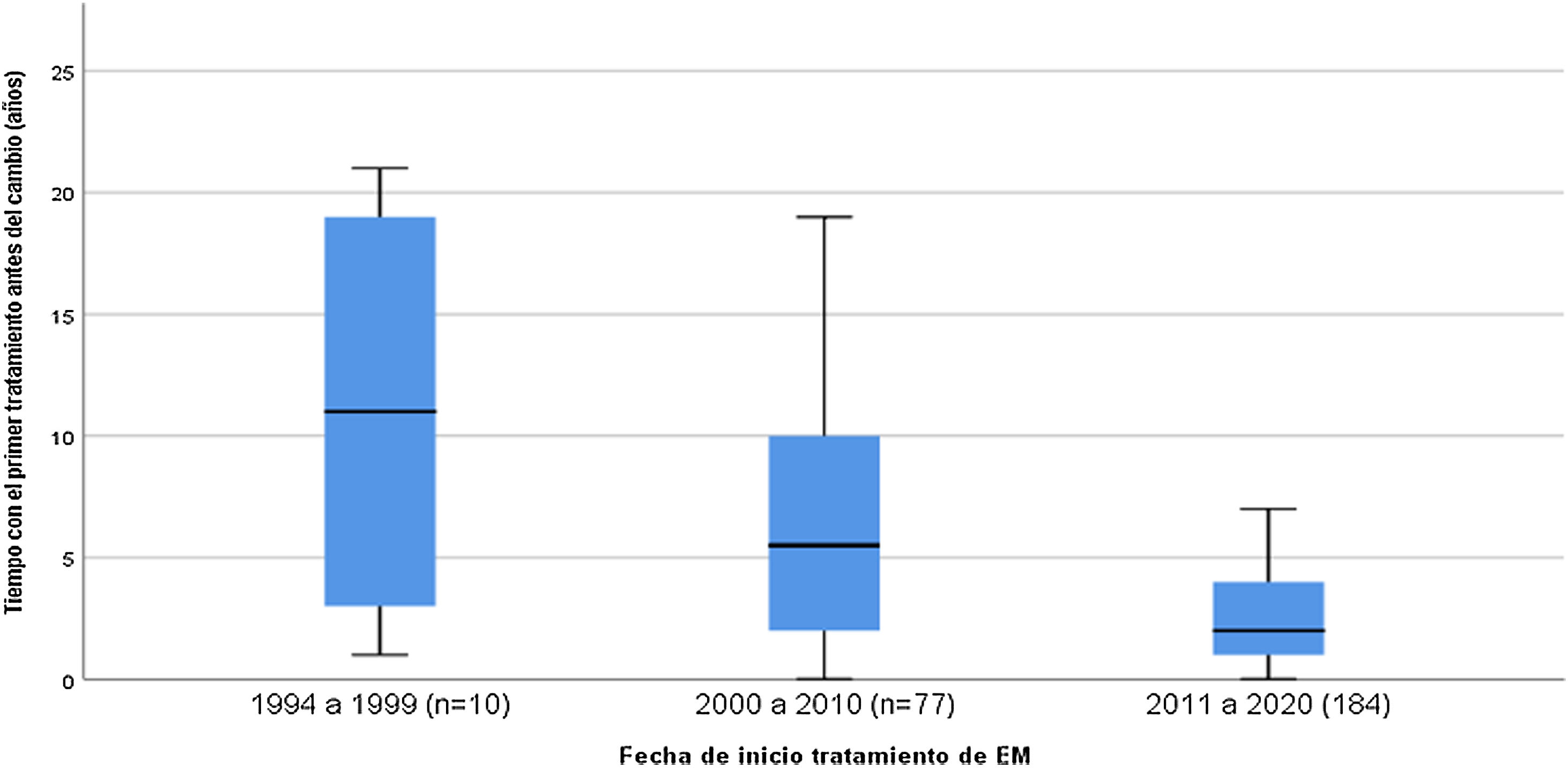
Se efectuó una descripción en el tiempo de consumo de la primera medicación en los subgrupos de pacientes diagnosticados en los intervalos de tiempo entre 1994-1999, 2000-2010 y 2011-2020.
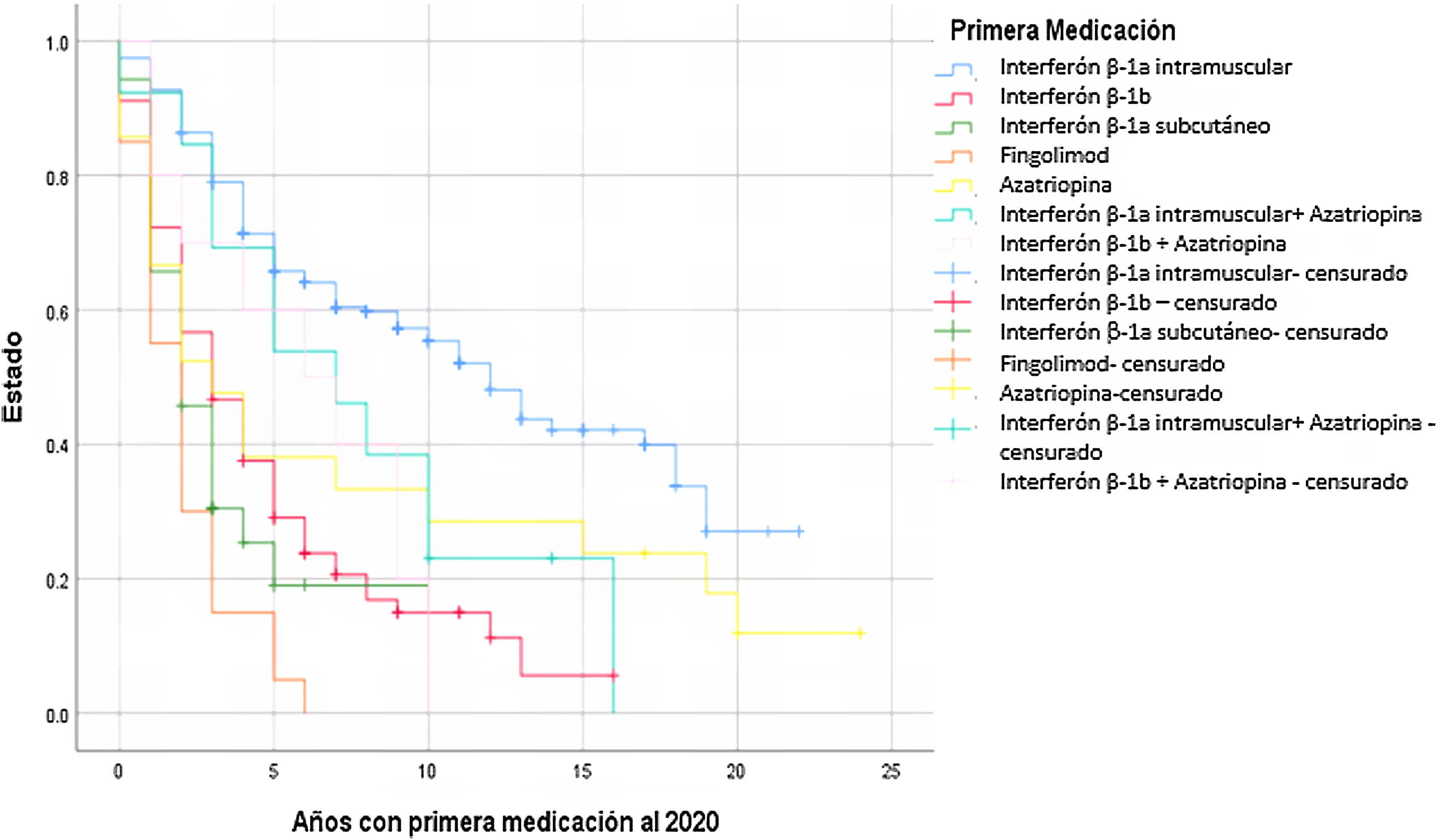
Posteriormente, se llevó a cabo un análisis de supervivencia con el método de Kaplan-Meier para la evaluación del riesgo de cambio de tratamiento en el tiempo, en donde el estado se definió como el cambio de medicación y el tiempo como los años del consumo del fármaco. Se utilizó como factor de evaluación el tratamiento que cada persona había empleado previamente para la EM, filtrado por los medicamentos de interferón beta 1a intramuscular (IFN-β1a IM), interferón beta 1b (IFN-β1b) e interferón beta 1a subcutáneo (IFN-β1a SC), fingolimod, azatioprina; y las combinaciones de IFN-β1a IM + azatioprina y IFN-β1b + azatioprina para este estudio. Se incluyeron un total de 423 personas, excluyéndose los pacientes en tratamiento con ciclofosfamida, natalizumab y acetato de glatiramer por su poca frecuencia.
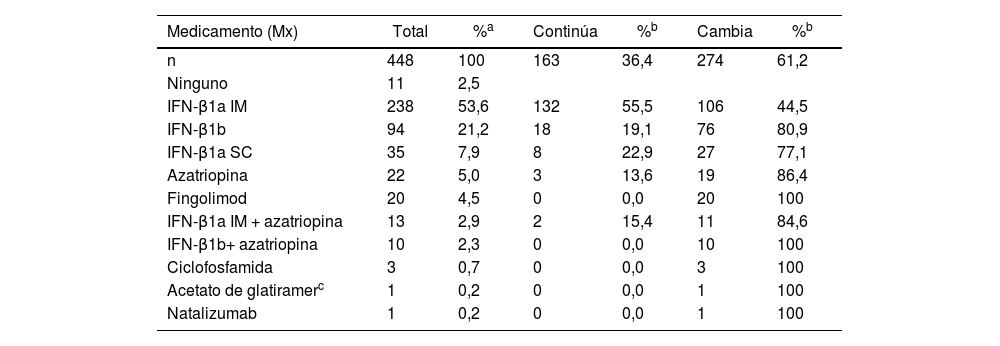
ResultadosDe los 448 pacientes incluidos, 69,2% son mujeres y 30,8% hombres. Se identificaron ocho fármacos o su combinación, dentro de las opciones más frecuentes de tratamiento para la EM, los principales (tabla 1) fueron IFN-β1a IM (53,6%), IFN-β1b (21,2%) e IFN-β1a SC (7,9%). Para el 2020, se comprobó que únicamente 163 personas (36,4%) habían continuado con el medicamento inicial y 274 (62,3%) necesitaron cambio de medicación. Asimismo, el IFN-β1a IM es el único fármaco donde la proporción de sujetos que lo continuaron es superior a la proporción de aquellos que lo modificaron.
Medicamentos suministrados a personas diagnosticadas con esclerosos múltiple, en la Caja Costarricense de Seguro Social 1994-2019
| Medicamento (Mx) | Total | %a | Continúa | %b | Cambia | %b |
|---|---|---|---|---|---|---|
| n | 448 | 100 | 163 | 36,4 | 274 | 61,2 |
| Ninguno | 11 | 2,5 | ||||
| IFN-β1a IM | 238 | 53,6 | 132 | 55,5 | 106 | 44,5 |
| IFN-β1b | 94 | 21,2 | 18 | 19,1 | 76 | 80,9 |
| IFN-β1a SC | 35 | 7,9 | 8 | 22,9 | 27 | 77,1 |
| Azatriopina | 22 | 5,0 | 3 | 13,6 | 19 | 86,4 |
| Fingolimod | 20 | 4,5 | 0 | 0,0 | 20 | 100 |
| IFN-β1a IM + azatriopina | 13 | 2,9 | 2 | 15,4 | 11 | 84,6 |
| IFN-β1b+ azatriopina | 10 | 2,3 | 0 | 0,0 | 10 | 100 |
| Ciclofosfamida | 3 | 0,7 | 0 | 0,0 | 3 | 100 |
| Acetato de glatiramerc | 1 | 0,2 | 0 | 0,0 | 1 | 100 |
| Natalizumab | 1 | 0,2 | 0 | 0,0 | 1 | 100 |
IFN-β1a IM: interferón beta 1a intramuscular; IFN-β1a SC: interferón beta 1a subcutáneo; IFN-β1b: interferón beta 1b.
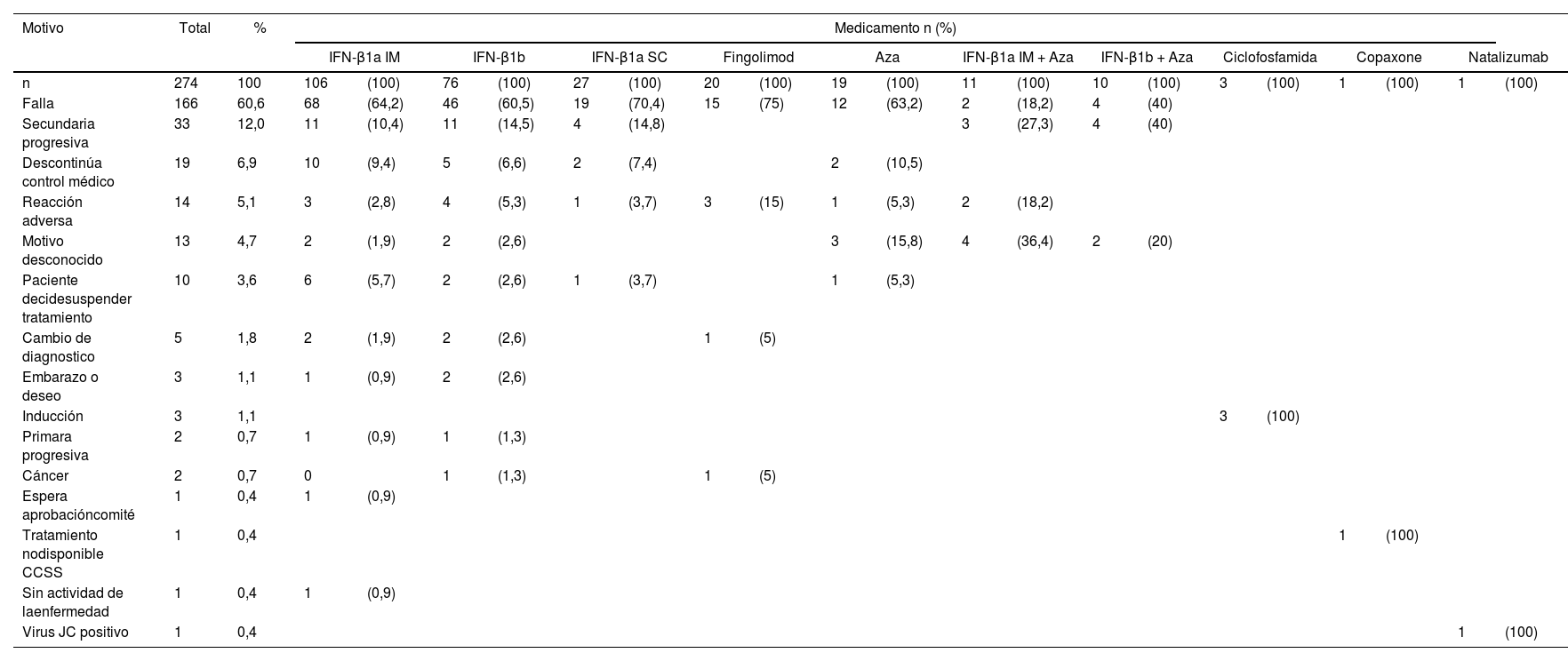
En 274 personas se identificó un motivo por el cual se realizó un cambio en el tratamiento. Según se observa en la tabla 2, la falla a la terapia fue la principal causa para IFN-β1a IM, IFN-β1b, IFN-β1a SC, fingolimod y azatioprina.
Motivo de cambio del medicamento suministrado a personas diagnosticadas por esclerosos múltiple, en la Caja Costarricense de Seguro Social 1994-2019
| Motivo | Total | % | Medicamento n (%) | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IFN-β1a IM | IFN-β1b | IFN-β1a SC | Fingolimod | Aza | IFN-β1a IM + Aza | IFN-β1b + Aza | Ciclofosfamida | Copaxone | Natalizumab | |||||||||||||
| n | 274 | 100 | 106 | (100) | 76 | (100) | 27 | (100) | 20 | (100) | 19 | (100) | 11 | (100) | 10 | (100) | 3 | (100) | 1 | (100) | 1 | (100) |
| Falla | 166 | 60,6 | 68 | (64,2) | 46 | (60,5) | 19 | (70,4) | 15 | (75) | 12 | (63,2) | 2 | (18,2) | 4 | (40) | ||||||
| Secundaria progresiva | 33 | 12,0 | 11 | (10,4) | 11 | (14,5) | 4 | (14,8) | 3 | (27,3) | 4 | (40) | ||||||||||
| Descontinúa control médico | 19 | 6,9 | 10 | (9,4) | 5 | (6,6) | 2 | (7,4) | 2 | (10,5) | ||||||||||||
| Reacción adversa | 14 | 5,1 | 3 | (2,8) | 4 | (5,3) | 1 | (3,7) | 3 | (15) | 1 | (5,3) | 2 | (18,2) | ||||||||
| Motivo desconocido | 13 | 4,7 | 2 | (1,9) | 2 | (2,6) | 3 | (15,8) | 4 | (36,4) | 2 | (20) | ||||||||||
| Paciente decidesuspender tratamiento | 10 | 3,6 | 6 | (5,7) | 2 | (2,6) | 1 | (3,7) | 1 | (5,3) | ||||||||||||
| Cambio de diagnostico | 5 | 1,8 | 2 | (1,9) | 2 | (2,6) | 1 | (5) | ||||||||||||||
| Embarazo o deseo | 3 | 1,1 | 1 | (0,9) | 2 | (2,6) | ||||||||||||||||
| Inducción | 3 | 1,1 | 3 | (100) | ||||||||||||||||||
| Primara progresiva | 2 | 0,7 | 1 | (0,9) | 1 | (1,3) | ||||||||||||||||
| Cáncer | 2 | 0,7 | 0 | 1 | (1,3) | 1 | (5) | |||||||||||||||
| Espera aprobacióncomité | 1 | 0,4 | 1 | (0,9) | ||||||||||||||||||
| Tratamiento nodisponible CCSS | 1 | 0,4 | 1 | (100) | ||||||||||||||||||
| Sin actividad de laenfermedad | 1 | 0,4 | 1 | (0,9) | ||||||||||||||||||
| Virus JC positivo | 1 | 0,4 | 1 | (100) | ||||||||||||||||||
Aza: azatriopina; CCSS: Caja Costarricense de Seguro Social; IFN-β1a IM: interferón beta 1a intramuscular; IFN-β1a SC: interferón beta 1a subcutáneo; IFN-β1b: interferón beta 1b; JC: virus John Cunningham.
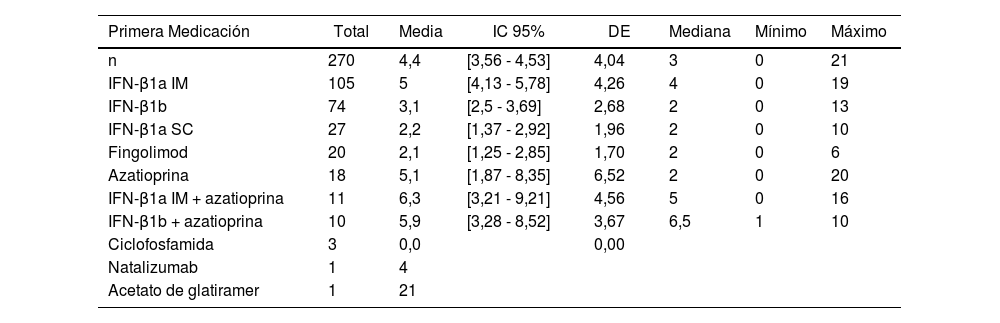
En 270 personas que cambiaron de terapia, se determinó el tiempo (en años) que la utilizaron (tabla 3), con una media de 4,4 años de uso (IC 95% 3,56 - 4,53) en general. Al analizar el tiempo de uso, el fingolimod y el IFN-β1a SC son los que han necesitado cambio en un menor tiempo, en contraparte, el medicamento empleado durante un tiempo más prolongado es el IFN-β1a IM con una media de cinco años (IC 95% 4,13 - 5,78). El acetato de glatiramer es el fármaco que se ha usado por más tiempo (21 años), sin embargo, esto corresponde a un único paciente en el estudio.
Estadística descriptiva de años de uso de la primera medicación antes del cambio
| Primera Medicación | Total | Media | IC 95% | DE | Mediana | Mínimo | Máximo |
|---|---|---|---|---|---|---|---|
| n | 270 | 4,4 | [3,56 - 4,53] | 4,04 | 3 | 0 | 21 |
| IFN-β1a IM | 105 | 5 | [4,13 - 5,78] | 4,26 | 4 | 0 | 19 |
| IFN-β1b | 74 | 3,1 | [2,5 - 3,69] | 2,68 | 2 | 0 | 13 |
| IFN-β1a SC | 27 | 2,2 | [1,37 - 2,92] | 1,96 | 2 | 0 | 10 |
| Fingolimod | 20 | 2,1 | [1,25 - 2,85] | 1,70 | 2 | 0 | 6 |
| Azatioprina | 18 | 5,1 | [1,87 - 8,35] | 6,52 | 2 | 0 | 20 |
| IFN-β1a IM + azatioprina | 11 | 6,3 | [3,21 - 9,21] | 4,56 | 5 | 0 | 16 |
| IFN-β1b + azatioprina | 10 | 5,9 | [3,28 - 8,52] | 3,67 | 6,5 | 1 | 10 |
| Ciclofosfamida | 3 | 0,0 | 0,00 | ||||
| Natalizumab | 1 | 4 | |||||
| Acetato de glatiramer | 1 | 21 |
DE: desviación estándar; IC 95%: intervalo de confianza al 95% [límite inferior - límite superior]; IFN-β1a IM: interferón beta 1a intramuscular; IFN-β1a SC: interferón beta 1a subcutáneo; IFN-β1b: interferón beta 1b.
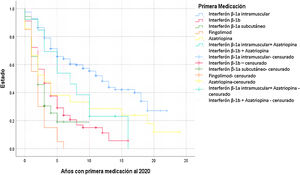
Se observó que la probabilidad de cambio de tratamiento en el tiempo es mayor con el fingolimod y el IFN-β1a SC respecto a otros fármacos, mientras que el IFN-β1a IM presenta la menor probabilidad (log-rank [Mantel-Cox], χ2 115, degree of freedom [df] 144, p<0,001) (fig. 1).
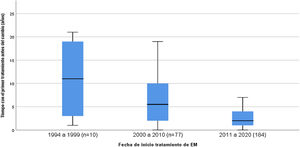
Los pacientes diagnosticados entre 1994 y 1999 tuvieron una media de uso de su primera medicación de 11,2 años (IC 95% 5,64 - 16,76), entre el 2000 al 2010 una media de 6,6 años (IC 95% 5,51 - 7,76) y entre el 2011 a 2020 una media de 2,6 años (IC 95% 2,31 - 2,85) (fig. 2).
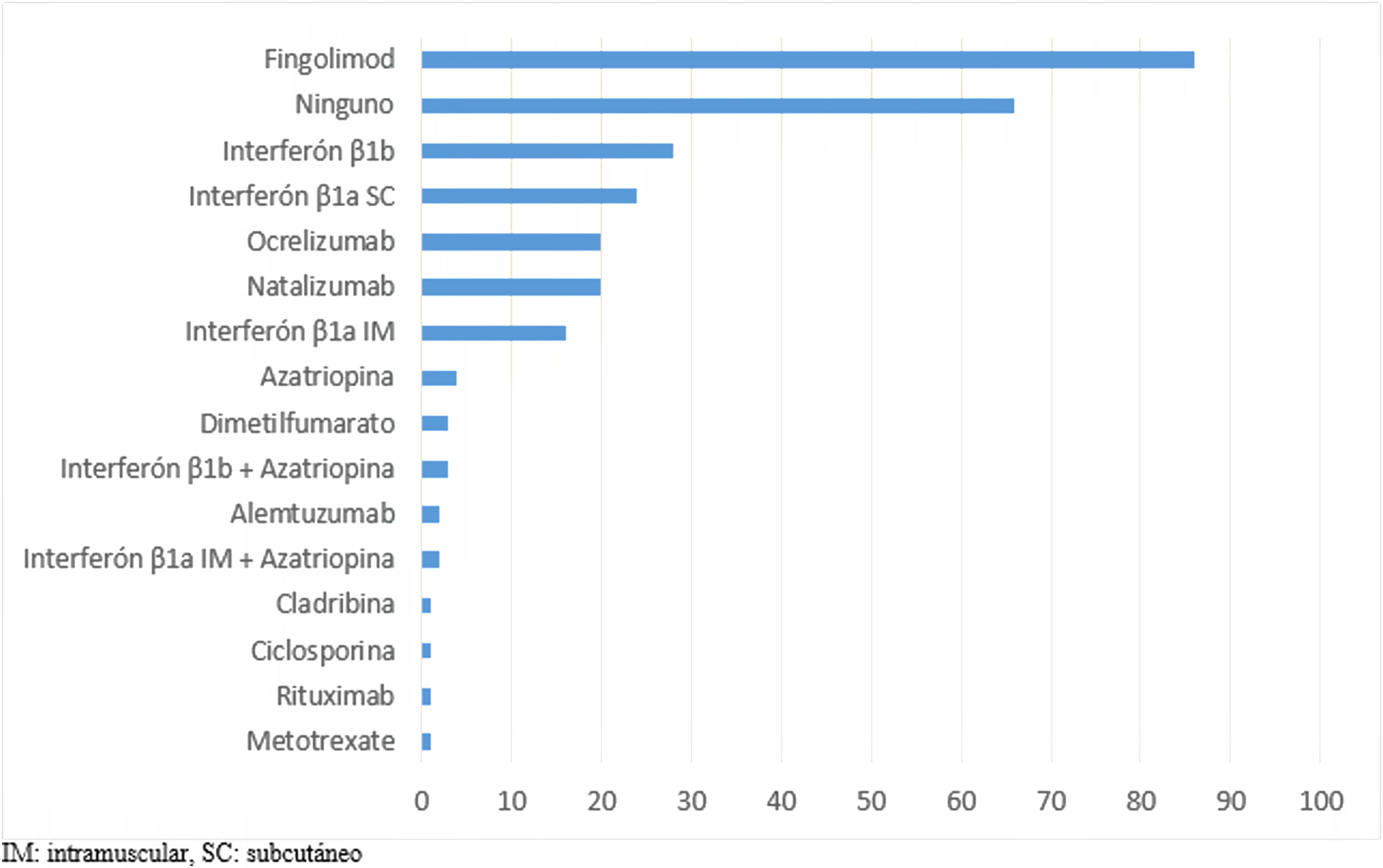
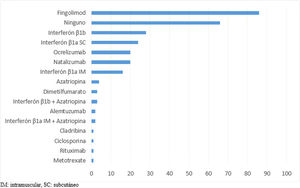
De las 274 personas que requirieron cambio de tratamiento, el medicamento de elección prescrito fue el fingolimod, seguido por optar por ningún fármaco y en tercera opción el IFN-β1b (fig. 3).
DiscusiónAl cabo de dos años, dos tercios de los pacientes con EM en tratamiento de primera línea con medicamentos modificadores de la enfermedad, sufrirán una recaída o nuevas lesiones en la resonancia magnética9. Por otro lado, la utilización de manera temprana de fármacos de alta eficacia en los sujetos con EM permite disminuir el daño irreversible que ocurre desde el inicio de la enfermedad y que condiciona una mayor discapacidad en el corto plazo, preservando, de esta manera, la funcionalidad física y cognitiva10. En la actualidad, se cuenta con suficiente evidencia que sustenta la forma en la cual se debe realizar la monitorización clínica e imagenológica para detectar la falla terapéutica de manera temprana y lograr el objetivo de preservar, en la medida de lo posible, la funcionalidad de los pacientes11,12.
En el presente estudio, el tiempo de uso de una medicación que posteriormente asoció falla terapéutica se redujo desde 11,2 años en la década de los 90 a 2,6 años entre el 2011 a 2020. Lo anterior obedece, en parte, a que, previo a disponer del fingolimod y el natalizumab en el país, solo era posible realizar cambios de medicación entre los interferones. Estos cambios explican por qué 10,1% de los pacientes reciben IFN-β1b (betaferon) como alternativa, número que empieza a crecer a partir del año 20047, cuando este producto se consideró una opción para la forma secundaria progresiva de la enfermedad13. Además, en determinado momento se consideró al IFN-β1a SC como un interferón con probabilidad de mejor respuesta, sobre todo en dosis de 44 mcg tres veces por semana14, por lo que el comité regulador de la CCSS solicitaba el uso de IFN-β1a SC antes de autorizar un medicamento en segunda o tercera línea, lo que se refleja en que fue el interferón el que menos tiempo se sostuvo como tratamiento inmunomodulador, pues se indicaba como cambio lateral en pacientes que ya habían fallado a otro fármaco de este tipo.
Esta situación cambió de manera significativa a partir del año 2006 y 2010 cuando aparecen el natalizumab y el fingolimod, respectivamente, representando un cambio del paradigma en el tratamiento de pacientes con EM con actividad y pobre respuesta a terapias de primera línea10. Sin embargo, en la institución, durante los años de estudio, el único tratamiento disponible en la lista oficial de medicamentos, exento de trámites, que pueden tardar meses, eran el interferón IFN-β1a IM y el IFN-β1b, incluso en la actualidad, el sistema carece de la posibilidad de utilizar fármacos de alta eficacia en pacientes naive con factores de mal pronóstico. El fingolimod se muestra como un medicamento de preferencia al cambio, lo anterior también a solicitud del comité regulador que lo anteponía a natalizumab y posteriormente a los otros tratamientos de alta eficacia aprobados (manejo escalonado), lo cual demuestra ser poco sostenible en el tiempo, posiblemente por usarse en personas que en su lugar requerían terapias de mayor efectividad o inducción, en lugar de un manejo escalonado.
En el estudio, el principal motivo de cambio del tratamiento fue la falla terapéutica y de mucho menor frecuencia las reacciones adversas (5-6%). Otras causas son de menor relevancia como los diagnósticos erróneos (menos de 2%) y embarazos (1%).
A octubre del 2020, 23,7% de los pacientes se encontraban sin tratamiento. Se considera que una de las principales causas de dicho resultado es la evolución de la enfermedad a secundaria progresiva y que, en el momento en que estos sujetos viraron a esa forma del padecimiento no se autorizaba aún un tratamiento para dicha condición15.
En cuanto a las limitaciones del estudio, al ser un análisis retrospectivo, la información recolectada depende del diagnóstico registrado y de las anotaciones realizadas en los expedientes, los cuales varían de forma significativa entre quienes los llevan a cabo.
ConclusionesLa seguridad social en Costa Rica, en la actualidad, dispone de la mayoría de los fármacos aprobados a nivel mundial, no obstante, al momento del estudio solo contemplaba en su lista oficial el uso de interferones, los demás medicamentos estaban disponibles y se podían prescribir bajo un trámite administrativo de compra, el cual puede demorar meses. Esta situación impide un manejo rápido, expedito y personalizado de los pacientes con EM (a excepción de los pocos que puedan financiar los tratamientos o cuenten con un sistema de seguro privado). Parece pertinente contar, en la seguridad social costarricense, con una ruta de acceso mejor definida, que reduzca la necesidad de cambiar de fármacos y permitir, en determinados casos, el uso de terapias de alta eficacia o de inducción desde el momento del diagnóstico, utilizando las recomendaciones disponibles que contemplan los factores de mal pronóstico y que de alguna manera permite la personalización del tratamiento16–18.
Para finalizar, debemos considerar que este estudio terminó la recolección de información en el 2020: desde entonces ya se han introducido nuevas terapias y esta va a ser la dinámica en farmacología por los siguientes años, situación por la cual los prestadores de servicios de salud y entes reguladores deben estar más anuentes al cambio y actualización de las recomendaciones de tratamientos, así como a la necesidad de realizar estudios que permitan una retroalimentación de forma periódica.
FinanciaciónEste trabajo no fue financiado por ningún entidad externa o institucional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.