La hipoperfusión cerebral en ratas, mediante la oclusión permanente de las arterias carótidas comunes (OPACC), induce alteraciones de la memoria y el aprendizaje. Los mecanismos moleculares han sido poco estudiados y el objetivo del trabajo consiste en caracterizar las alteraciones del metabolismo oxidativo, de la memoria y del aprendizaje.
MétodosMediante la OPACC se determinó a las 24 h y 22 días de la lesión la actividad de la superóxido dismutasa y la catalasa en el hipocampo, la corteza y el cuerpo estriado. Se realizó una tinción con hematoxilina-eosina y un marcaje con GFAP de cortes coronales. Los trastornos conductuales se exploraron mediante la prueba del laberinto acuático de Morris.
ResultadosLa lesión indujo un incremento (p<0,01) de la actividad de la catalasa en la corteza a las 24 h, mientras que la superóxido dismutasa aumentó significativamente (p<0,01) en la corteza y el hipocampo a los 22 días. Se observó una intensa vacuolización y pérdida neuronal. La respuesta glial estuvo incrementada en la corteza y el cuerpo estriado. Fue perceptible la afectación en la visión (p<0,001), y las latencias de escape al evaluar la memoria a largo y corto plazo aumentaron considerablemente (p<0,05) en ambos grupos de animales lesionados.
ConclusionesLos cambios en las actividades de las enzimas apuntan a una posible implicación del disbalance oxidativo en la patología asociada a la hipoperfusión cerebral crónica. La OPACC resulta útil para entender los mecanismos por los cuales la hipoperfusión cerebral conduce a las alteraciones de los procesos de memoria y aprendizaje.
Chronic hypoperfusion in rats produces memory and learning impairments due to permanent occlusion of commun carotid arteries (POCCA). Molecular mechanisms leading to behavioural disorders have been poorly studied. For this reason, the aim of the present study was to characterise oxidative metabolism disorders and their implications in memory and learning impairments.
MethodsSuperoxide dismutase (SOD) and catalase (CAT) activities were determined in cortex, hippocampus and striatum homogenates at 24hours and at 22 days after the lesion. Haematoxylin-eosin staining and glial fibrillary acidic protein (GFAP) immunoreactivity were performed on coronal sections. Behavioural impairments were explored using the Morris water maze (MWM). Escape latencies were determined in all behavioural studies.
ResultsThe lesion induced a significant increase (P<.01) in CAT activity in the cortex at 24hours, while SOD activity was significantly higher (P<.01) in the cortex and hippocampus at 22 days. An intense vacuolization was observed in the cortex and striatum as a result of the lesion. A neuronal loss in the striatum and hippocampus was observed. The glial reaction increased in the cortex and striatum. Visual alterations were observed in the lesion group with the lowest evolution time (P<.001). Escape latencies, corresponding to MWM schemes for long-term and short-term memory evaluation increased significantly (P<.05) in both groups of lesioned animals.
ConclusionIt was concluded that changes in SOD and CAT activities indicate a possible implication of oxidative imbalance in the pathology associated with chronic cerebral hypoperfusion. In addition, the POCCA model in rats is useful for understanding mechanisms by which cerebral hypoperfusion produces memory and learning impairments.
Es conocido que la incidencia del ictus aumenta con la edad, sin embargo, no es necesariamente mortal1. El evento isquémico se produce debido a la oclusión de una arteria principal, trayendo consigo la reducción del flujo sanguíneo2.
El cerebro presenta características particulares que lo convierten en un tejido altamente vulnerable a los efectos del estrés oxidativo3,4. Como consecuencia del evento isquémico ocurre un incremento marcado de las especies reactivas de oxígeno (ERO). Para hacer frente a las mismas, el cerebro presenta sistemas enzimáticos de defensa antioxidantes, que neutralizan estas especies de alta reactividad. Este sistema de defensa depende de la acción cooperativa de enzimas intracelulares, entre las que se encuentran la superóxido dismutasa (SOD) y la catalasa (CAT)5.
La isquemia ha sido considerada como intratable y aún hoy no existe un tratamiento que ayude a los pacientes6. La búsqueda de nuevas estrategias terapéuticas enfocadas hacia la neuroprotección o neurorrestauración del tejido dañado trae aparejado el desarrollo de modelos experimentales en animales7. El modelo de oclusión permanente de las arterias carótidas comunes (OPACC) en ratas reproducen el evento isquémico, en etapas tempranas, y la oligoemia, cuando la hipoperfusión cerebral resulta crónica7. El hipocampo es el área cerebral que ha recibido mayor atención para el estudio de las alteraciones neuropatológicas inducidas por la OPACC. La hipoperfusión cerebral ha sido asociada con alteraciones de la memoria y el aprendizaje, procesos que involucran al hipocampo7,8. Se ha sugerido que, aparte del hipocampo, el cuerpo estriado y la corteza son regiones cerebrales con alta susceptibilidad a los eventos isquémicos5.
Esta investigación tuvo como objetivo caracterizar las alteraciones del metabolismo oxidativo en la corteza, el cuerpo estriado y el hipocampo, y su repercusión en los trastornos de la memoria y el aprendizaje en un modelo de hipoperfusión cerebral en ratas.
Materiales y métodosSujetos experimentalesSe emplearon ratas machos de la línea Sprague-Dawley procedentes del Centro Nacional para la Producción de Animales de Laboratorio (Ciudad de La Habana, Cuba). Se mantuvieron en condiciones estándares de laboratorio: ciclo luz-oscuridad 12 h/12 h y libre acceso al agua y la comida, con temperatura media de 22±2°C. Durante todos los experimentos se respetaron los principios éticos establecidos para la investigación con animales9. Peso promedio de 311g±4,37 en el momento de la lesión.
Procedimiento quirúrgicoEl grupo de lesión de 42 ratas fue anestesiado por vía intraperitoneal con 350mg de hidrato de cloral por kilogramo de peso corporal. Se practicó una incisión en el cuello y se ligaron las arterias carótidas comunes con hilo de sutura de seda de 3.0, de forma permanente. Los animales controles (n=30) se sometieron al mismo procedimiento quirúrgico, excepto que no se les realizó la OPACC.
Estudio del metabolismo oxidativoObtención de muestras biológicasA las 24 h (10 lesionados y 9 controles) y 22 días (10 lesionados y 5 controles) posteriores a la cirugía, los animales fueron sedados profundamente con hidrato de cloral (700mg/kg de peso corporal, intraperitonial) y decapitados. Los cerebros fueron extraídos para la disección de las áreas cerebrales (corteza, hipocampo y cuerpo estriado) de ambos hemisferios. Los tejidos se conservaron a–70°C hasta su utilización.
Homogenización del tejidoLas áreas cerebrales fueron homogenizadas con una solución Tris 1mol/L-sucrosa 0,25mol/L a pH 7,4 en un homogenizador a 1.000rpm en baño de hielo. El resultado fue centrifugado durante 15min, a 4°C y 14.000rpm y el sobrenadante se congeló a –70°C hasta su procesamiento.
Determinación de la actividad de la superóxido dismutasaSe utilizó el método de Marklund10 basado en la capacidad de la SOD para inhibir la reacción del pirogalol. La deslipidación de las muestras fue realizada tomando una alícuota de 100μl de homogenado y añadiendo 30μl de cloroformo y 50μl de metanol. La mezcla se agitó durante 1min en vibroagitador, centrifugada a 4°C y 3.000rpm durante 20min y colectado el sobrenadante. El tampón utilizado fue Tris 50mmol/L-HCl 20mmol/L- EDTA 10mmol/L a pH 8,2. En la cubeta fueron añadidos 540μl de la solución tampón, 30μl de la muestra y 30μl de pirogalol. La mezcla fue agitada y el valor de densidad óptica (DO) se registró a 420nm a los 70s,obteniéndose por duplicado. Se consideró una unidad de actividad enzimática la cantidad de enzima necesaria para lograr una inhibición de la autooxidación del pirogalol de un 50%.
Determinación de la actividad enzimática de la catalasaLa actividad de la CAT se determinó siguiendo la descomposición del H2O2 espectrofotométricamente según Aebi11. En el ensayo se utilizó un tampón fosfato (KH2PO4 0,12mol/L-K2HPO4 0,12mol/L) a pH 7,4 y como solución sustrato, H2O2 a una concentración de 13mmol/L en tampón fosfato. En el ensayo se añadieron 375μl de tampón fosfato, 204μl de solución sustrato y 21μl de homogenado, se agitó y se midieron los valores de DO a 240nm cada 2s durante 1min en una celda con temperatura estabilizada a 37°C. Se obtuvieron valores de DO por duplicado. Se consideró una unidad de actividad enzimática como la cantidad de enzima necesaria para transformar 1 μmol de H2O2 en 1 min a 37°C.
Cuantificación de las proteínas totalesCien microlitros de agua (blanco), de patrón o de muestra fueron mezclados con 2,0mL de reactivo de Bradford (azul brillante de Coomassie 0,1mg/ml en H3PO4 al 8,5% y etanol al 4,75%). Se midió la DO a 595nm. Se realizó la calibración con albúmina sérica bovina a partir de su coeficiente de extinción a 280nm (k=0,68mLmg−1).
Evaluación del daño celularPara el estudio histológico, los animales con OPACC (n=3) y falsos lesionados (n=3) a los 7 días de la hipoperfusión cerebral se anestesiaron con hidrato de cloral, fueron perfundidos con 250ml de una solución de cloruro de sodio al 0,9% y 250ml de formol al 10%. Los cerebros fueron colocados en un procesador automático de tejidos (HISTOQUINET). Se deshidrató en soluciones de alcoholes de gradación ascendente, la desalcoholización se realizó con xilol y luego el tejido fue infiltrado en parafina. Las secciones coronales de 6μm se tiñeron con hematoxilina-eosina, y alternadamente, se sometieron al procedimiento para la detección inmunohistoquímica de la proteína fibrilar acídica de la glía (glial fibrillary acidic protein, GFAP). Los cortes se trataron con suero fetal de ternera 20%/Tritón X100 0,25% en tampón fosfato salino durante 30min y se incubaron durante toda la noche a 4°C con el antisuero policlonal anti-GFAP (1:500) y luego con el anticuerpo anti-IgG biotinilado de ratón (1:500) durante 1h a temperatura ambiente. Las secciones se sumergieron en el conjugado estreptavidina-biotina-peroxidasa (1:100) durante 1h y la reacción se visualizó con H2O2 0,02% y el cromógeno diaminobenzidina 0,05%. La reacción se detuvo con agua corriente y las láminas fueron deshidratadas con alcoholes de gradación creciente, aclaradas con xilol y observadas al microscopio óptico.
Evaluación de las alteraciones conductualesLa prueba del laberinto acuático de morris (LAM) consiste en la medición del tiempo que tardan los animales en localizar una plataforma, visible u oculta, de 11cm de diámetro y escapar del agua (latencia de escape). En la piscina circular de 1,5m de diámetro y una altura de líquido de 40cm se permitió un tiempo máximo de búsqueda de 60s a cada rata. Una cámara localizada sobre el centro del tanque permitió realizar la adquisición de los datos, para lo cual se utilizó el programa SMART, versión 2.0, Copyright Panlab, 2001.
Las pruebas conductuales se realizaron en 2 tiempos diferentes, un grupo de animales 18 días posteriores a la lesión (9 lesionados y 8 falsos lesionados) y el otro grupo después de los 33 días (10 lesionados y 5 falsos lesionados).
Evaluación del déficit sensitivomotor y motivacionalSe colocó la plataforma de forma visible a los 22 y 37 días poslesión y se realizaron 8 ensayos para cada rata, cada intento desde una posición de la periferia del tanque seleccionada aleatoriamente.
Evaluación de la memoria a largo plazo o de referencia (memoria espacial)Esta prueba se realizó en los días 18-21 y 33-36 posteriores a la lesión e incluyó la localización de la plataforma oculta en la misma posición. Constó de 29 ensayos por cada rata (8 ensayos en los 3 primeros días y 5 ensayos en el último día).
Evaluación de la memoria a corto plazo o de trabajoLa evaluación de la memoria de referencia se realizó a los 33-35 y 48-50 días poslesión. Los animales fueron evaluados durante 3 días y diariamente se varió la posición de la plataforma que se mantuvo oculta. En los 3 días se realizaron 4 ensayos variando el tiempo esperado entre un ensayo y el siguiente: 20s, 20min y 2h, respectivamente.
Procesamiento estadísticoLa información recopilada se procesó mediante el software profesional Statistica para Windows. Versión 6.0, Copyright Statsoft, Inc. 1996. Los valores fueron mostrados como la media±el error estándar de la media. Se analizó si los datos cumplían con una distribución normal mediante la prueba de Kolmogorov-Smirnov. Al no encontrarse homogeneidad de varianza al aplicar la prueba de Levene se realizó un análisis no paramétrico de los datos.
Las comparaciones correspondientes a las enzimas antioxidantes, entre los animales falsos lesionados y lesionados, se realizaron mediante la prueba U de Mann-Whitney. Esta misma prueba se aplicó para comparar los resultados de las pruebas conductuales de los animales controles y los falsos lesionados, y también entre los grupos de animales lesionados con diferentes períodos de evolución. La prueba de Wilcoxon se aplicó para comparar el desempeño conductual de un mismo grupo de animales en diferentes tiempos.
ResultadosMetabolismo oxidativoLos grupos de animales controles no mostraron diferencias significativas en la actividad de las enzimas antioxidantes, por lo que fueron considerados como un solo grupo.
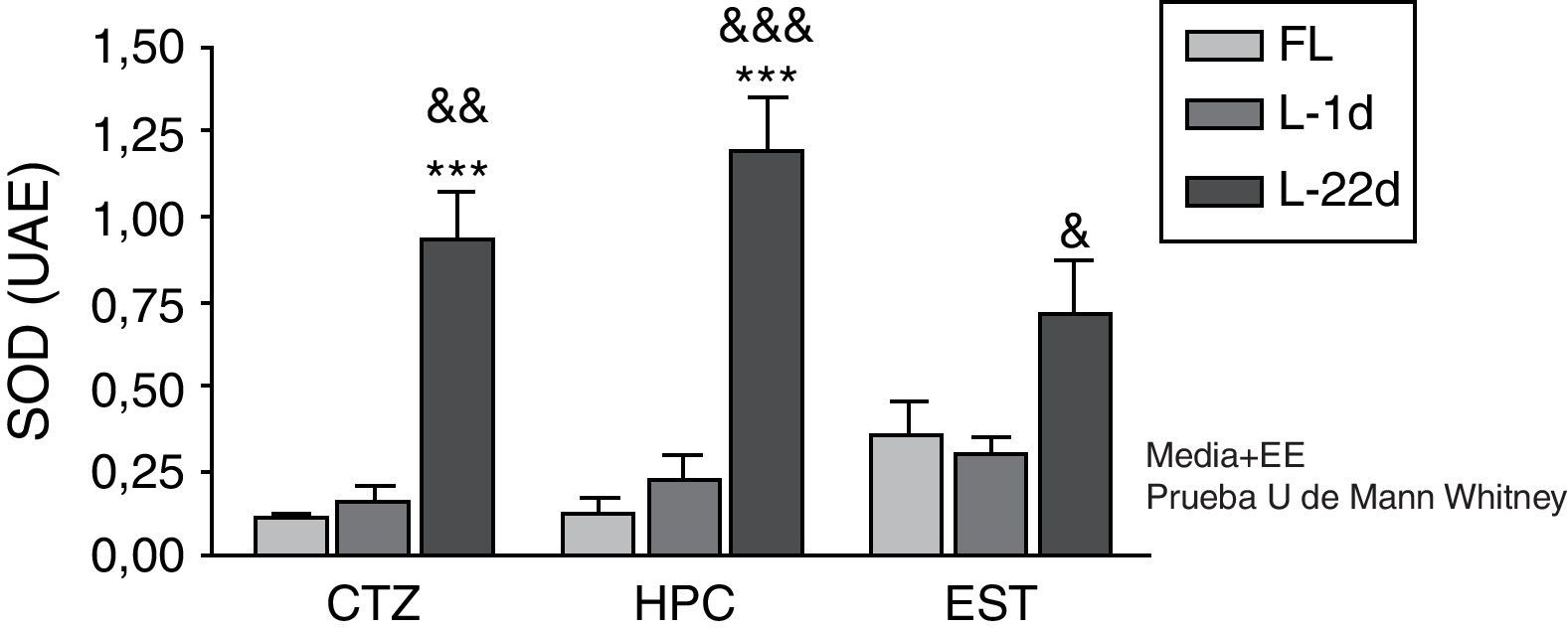
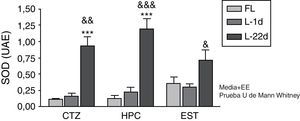
La actividad de la SOD a las 24 h después de la oclusión no mostró variación en ninguna de las áreas estudiadas (fig. 1). A los 22 días la lesión isquémica indujo un aumento significativo de la actividad de la SOD en la corteza y en el hipocampo (p<0,001). Por otro lado, los animales con una hipoperfusión cerebral de 22 días de evolución también manifestaron un aumento significativo de la actividad enzimática en las 3 áreas cerebrales estudiadas (p<0,05), en comparación con los animales sacrificados a las 24 h poslesión.
Actividad de la superóxido dismutasa en la corteza, el hipocampo y el cuerpo estriado de ratas sometidas a oclusión permanente de las arterias carótidas comunes. Se muestra la actividad enzimática de los animales lesionados con 22 días de hipoperfusión cerebral en relación con el grupo control (***p<0,001) y con el grupo de 24 h de oclusión carotídea (&p<0,05; &&p<0,01; &&&p<0,001). Las barras representan los valores medios±el error estándar de la media. CTZ: corteza; EST; cuerpo estriado; FL: grupo control; HPC: hipocampo; L-1d: grupo con 24 h de oclusión; L-22d: grupo con 22 días de oclusión; SOD: superóxido dismutasa.
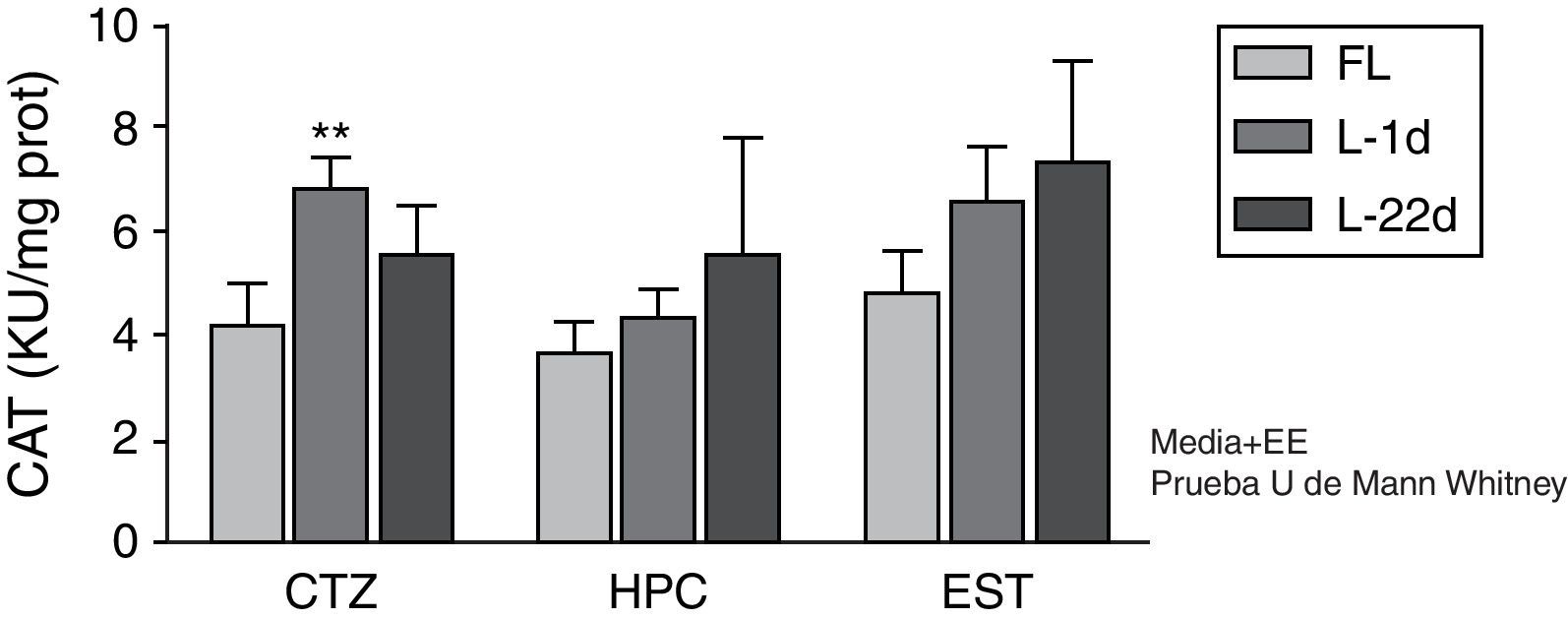
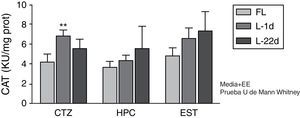
La OPACC indujo un aumento de la actividad de la CAT a las 24 h, sin embargo este incremento solo fue significativo en la corteza (p<0,01) (fig. 2). Pasados 22 días de la oclusión carotídea, este incremento no fue significativo.
Actividad de la catalasa en la corteza, el hipocampo y el cuerpo estriado de animales sometidos a oclusión permanente de las arterias carótidas comunes. Se muestra la actividad enzimática de los animales lesionados en relación con el grupo control (**p<0,01.) Las barras representan los valores medios y el error estándar de la media. CAT: catalasa; CTZ: corteza; EST; cuerpo estriado; FL: grupo control; HPC: hipocampo; L-1d: grupo con 24 horas de oclusión; L-22d: grupo de 22 días de oclusión.
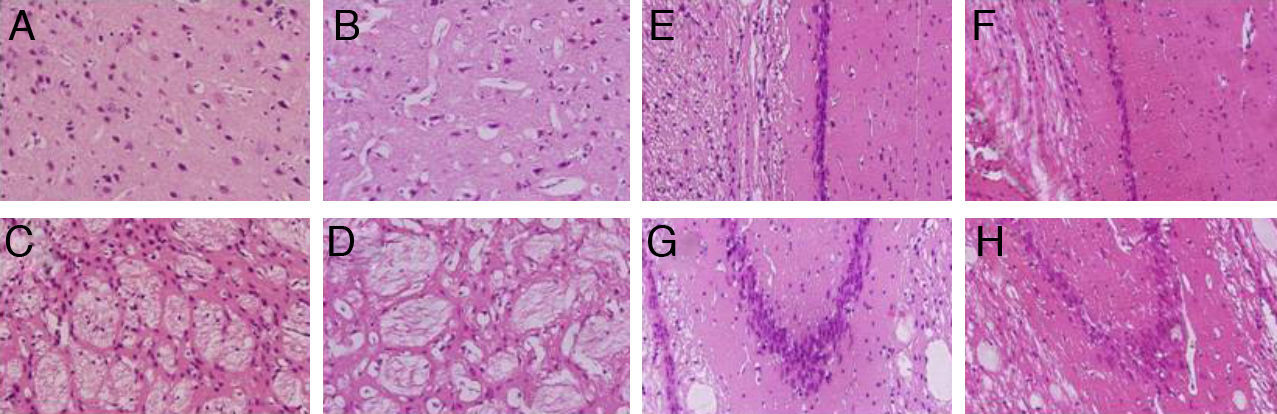
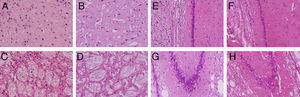
Se evidenció una marcada vacuolización en la corteza y en el cuerpo estriado, mientras que la disminución de la densidad neuronal solo se constató en el cuerpo estriado y en las poblaciones CA1 y CA3 del hipocampo (fig. 3).
Tinciones con hematoxilina-eosina de cortes coronales de la corteza (A,B), el cuerpo cuerpo estriado (C,D), CA1 (E,F) y CA3 (G,H) a 40× de magnificación. Los paneles de la izquierda muestran las secciones correspondiente a los animales controles y los de la derecha pertenecen a animales con hipoperfusión cerebral de 7 días de evolución.
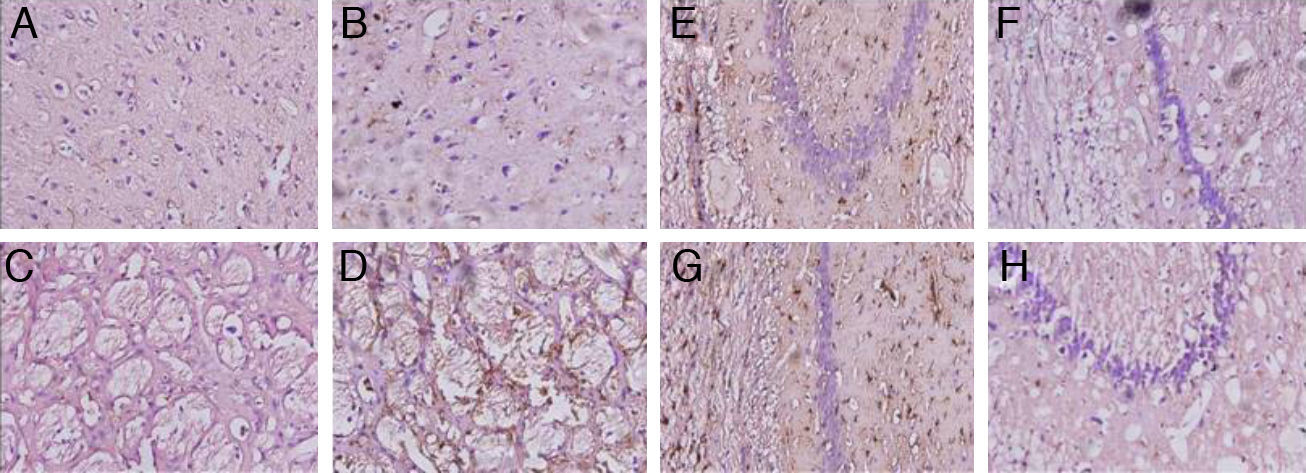
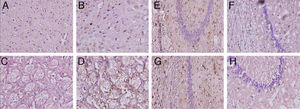
Los animales con hipoperfusión cerebral mostraron un incremento del marcador glial en las regiones de la corteza y el cuerpo estriado, y una disminución de la respuesta glial en las poblaciones CA1 y CA3, en relación con los controles (fig. 4).
Microfotografías representativas de secciones coronales de cerebros de ratas con inmunotinciones a la proteína fibrilar acídica de la glía en la corteza (A,B) el cuerpo estriado (C,D), CA1 (E,F) y CA3 (G,H) a 40× de magnificación. Los paneles de la izquierda muestran las secciones correspondiente a los animales controles y los de la derecha pertenecen a animales con hipoperfusión cerebral de 7 días de evolución.
Los animales controles correspondientes a los diferentes tiempos de evolución de la lesión no mostraron diferencias significativas en ninguna prueba conductual, por lo que fueron considerados como un solo grupo experimental.
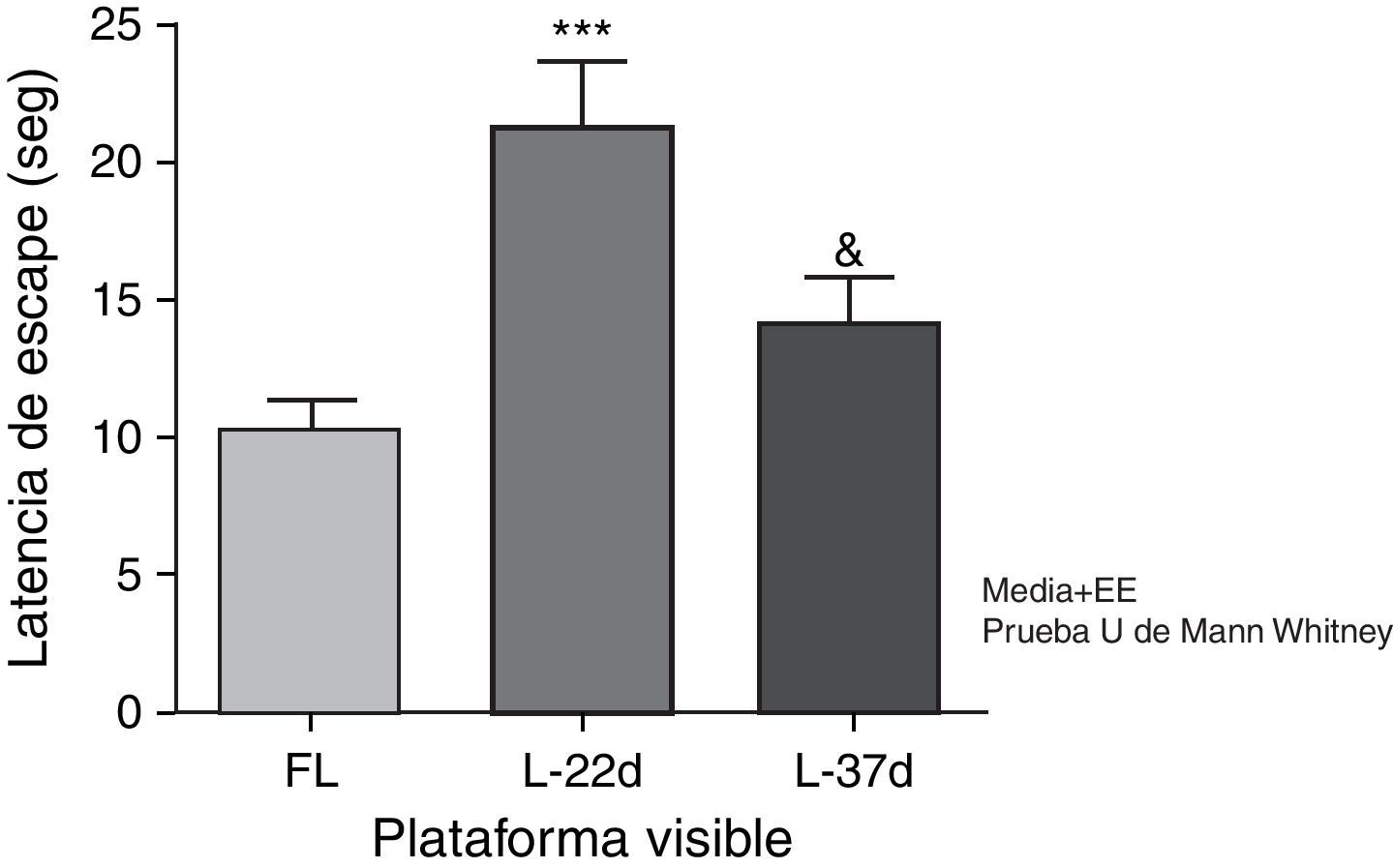
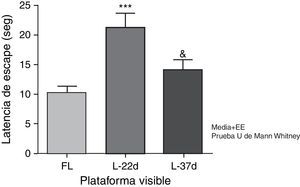
Déficit sensitivomotor y motivacionalLos animales con hipoperfusión cerebral, evaluados a los 22 días, tardaron significativamente más tiempo en encontrar la plataforma de escape que los animales controles (p<0,001). A los 37 días posteriores a la oclusión carotídea estas diferencias no fueron estadísticamente significativas. Los animales que conformaron el grupo con una lesión más tardía tardaron significativamente menos tiempo en encontrar la plataforma que los animales con un período más corto de hipoperfusión cerebral (p<0,05) (fig. 5).
Influencia de la hipoperfusión cerebral crónica sobre el déficit sensitivomotor y motivacional. En este esquema la plataforma se mantuvo visible. ***p<0,001: muestra el aumento de la latencia de escape de los animales a los 22 días de lesión en relación con los controles. &p<0,05: indica la disminución de la latencia de escape de los animales con 37 días de lesión en comparación con los de 22 días. Las barras representan los valores medios±error estándar de la media. FL: grupo control; L-22d: grupo de 22 días de lesión; L-37d: grupo de 37 días de lesión.
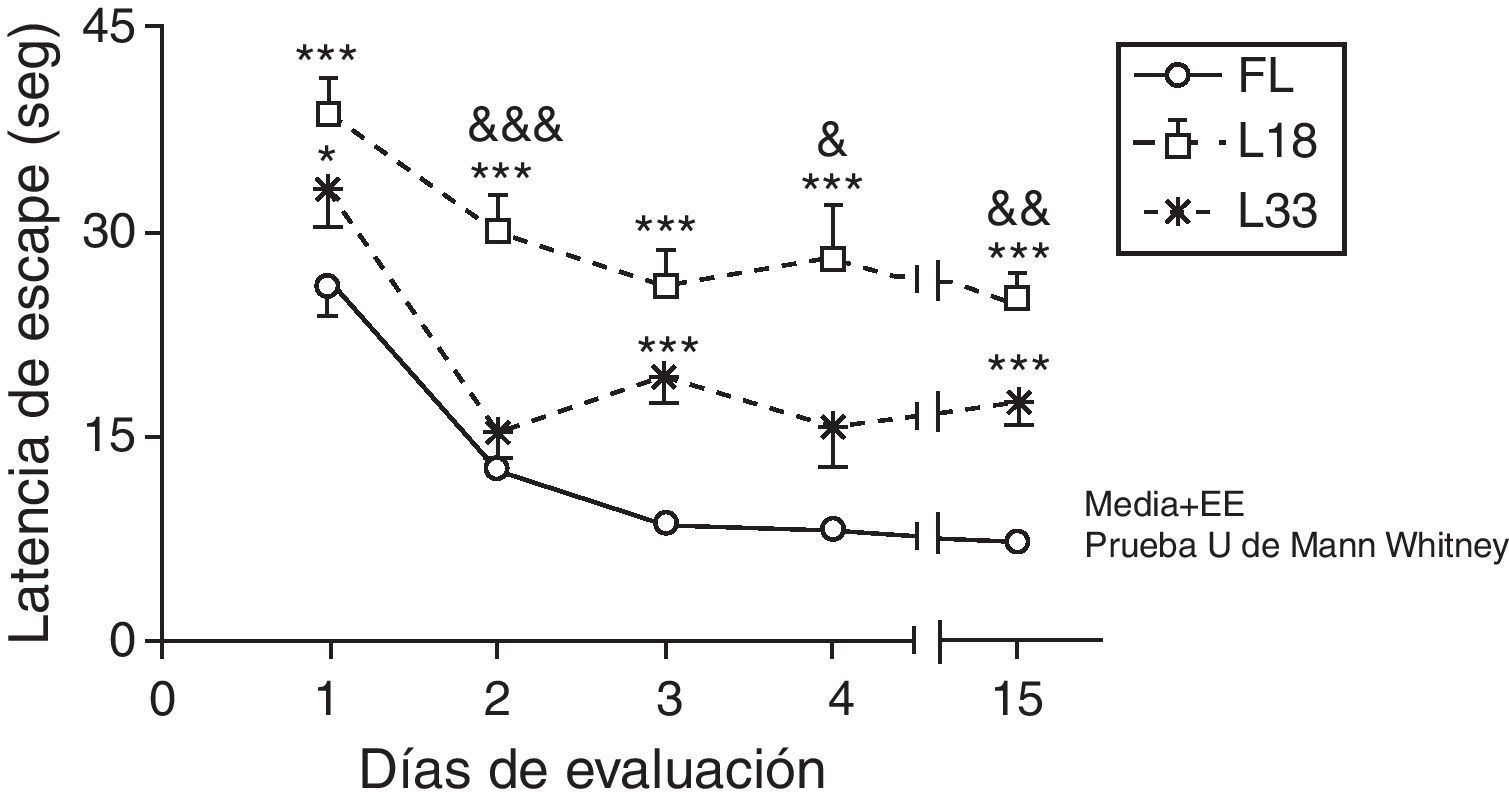
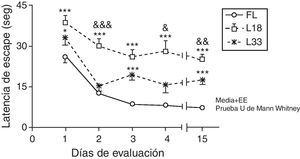
Al evaluar la memoria a largo plazo, los animales en estudio mostraron una disminución de la latencia de escape con el transcurso de los días (p<0,05). Las ratas con hipoperfusión cerebral de 18 días de evolución se diferenciaron significativamente de los animales controles en todos los días de evaluación (p<0,001). La latencia de los animales con lesión de 33 días fue superior a la de los controles, siendo las diferencias significativas en el primer, tercer y último día de la evaluación (p<0,05). Así, los animales con una hipoperfusión cerebral menos prolongada mostraron latencias de escape significativamente superiores a las de los animales con una lesión de 33 días al segundo, cuarto y último día de la evaluación (p<0,05) (fig. 6).
Evaluación de la memoria a largo plazo o de referencia. En este esquema la plataforma se mantuvo oculta y en el mismo lugar. Los valores muestran las latencias de escape medias±el error estándar de la media. *p<0,05; ***p< 0,001: latencias de los grupos lesionados en comparación con el grupo control. &p<0;05; &&p<0,01, &&&p<0,001: diferencias entre las latencias de ambos grupos de lesión. FL: grupo control; L18 y L33: animales que comenzaron a evaluarse con 18 y 33 días de evolución de la lesión.
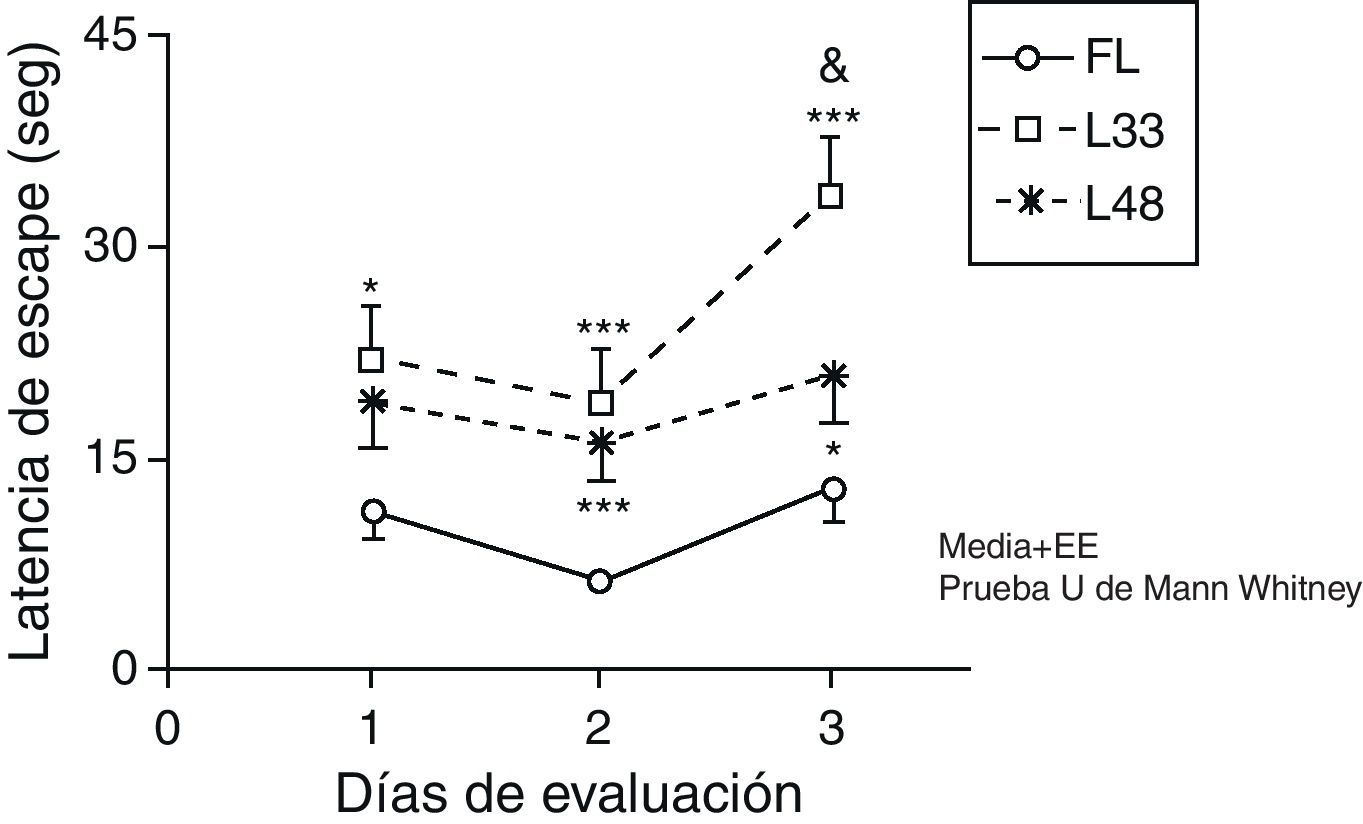
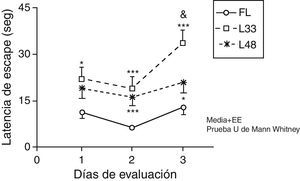
La latencia de escape de las ratas con 33 días poslesión fue significativamente superior, con relación a los animales falsos lesionados, durante los 3 días de evaluación (fig. 7) (p<0,05). Los animales evaluados a los 47 días posteriores a la oclusión mostraron diferencias significativas en los 2 últimos días de evaluación (p<0,05). Al comparar la latencia de escape entre los grupos de animales lesionados, se encontró que disminuyó en el grupo con mayor tiempo de evolución de la lesión, aunque solo fue significativamente diferente en el día 3 de la evaluación (p<0,05).
Alteraciones de la memoria a corto plazo como consecuencia de la hipoperfusión cerebral crónica. Los puntos de la curva se corresponden con los valores medios±error estándar de la media. *p<0,05; ***p<0,001: se refiere al aumento de la latencia de escape de los animales lesionados en comparación con los controles. &p<0,05: muestra las diferencias entre los grupos de animales lesionados. FL: grupo control; L33 y L48: animales que se evaluaron con 33 y 48 días después de la lesión.
En los procesos de isquemia y oligoemia, la generación de especies reactivas del oxígeno tiene lugar como consecuencia de la disminución del flujo sanguíneo cerebral12,13. Nuestros estudios muestran que la actividad de la SOD no se alteró en respuesta a la hipoperfusión cerebral aguda; sin embargo, esta enzima fue altamente sensible a la hipoperfusión cerebral crónica de 22 días de evolución. A las 24 h posteriores a la oclusión hay una reducción importante del flujo sanguíneo en las 3 regiones cerebrales estudiadas14, de manera que también disminuye bruscamente el suministro de oxígeno. Este elemento, unido a que en el modelo la reperfusión es gradual y muy lenta, conlleva que se produzca poca cantidad del radical superóxido. Por tanto, es probable que la SOD existente sea suficiente para eliminar el radical superóxido que se genere. Por el contrario, a los 22 días posteriores a la OPACC el flujo sanguíneo cerebral se ha recuperado en gran medida. Por ende, existe un mayor suministro de oxígeno y una mayor formación de radical superóxido, suficiente para inducir la actividad de la SOD.
El efecto protector de la SOD solo se logra con la participación consecutiva de otras 2 enzimas que degradan al H2O2: la CAT y la GPX15. En nuestro trabajo, el aumento de la actividad de la CAT solo fue significativo en la corteza a las 24 h posteriores a la lesión. Este aumento tuvo lugar a pesar de no haber un incremento paralelo de la actividad de la SOD, lo que normalmente ocurre como consecuencia de una reperfusión5. Este comportamiento lo atribuimos a que probablemente existe una acumulación de H2O2 que trae aparejado un aumento en la actividad de la CAT. La acumulación del H2O2 pudiera ser el reflejo de que esta molécula es estable y capaz de difundir a través de las membranas. Además al no producirse la reperfusión de forma brusca no se elimina el H2O2 circulante y se acumula.
A pesar del incremento marcado en la actividad de la SOD en las 3 regiones cerebrales en estudio, a los 22 días poslesión no encontramos un aumento significativo de la actividad de la CAT. Si bien existen estudios in vitro que demuestran que la CAT es esencial para la destoxificación del H2O2 intraneuronal16, se ha demostrado que la actividad de esta enzima es muy baja en el sistema nervioso17. Por esta razón, es probable que la GPX metabolice la mayor parte del H2O2 que se forma como producto de la acción de la SOD.
La doble tinción mediante la hematoxilina y la eosina es la más utilizada en la rutina histológica. La extensa vacuolización observada en el tejido cortical y el cuerpo estriado de los animales sacrificados una semana después de la OPACC es congruente con estudios publicados en la literatura científica18,19. Además, nosotros observamos una disminución de la densidad neuronal en el cuerpo estriado. La pérdida neuronal en las poblaciones CA1 y CA3 del hipocampo, inducida por la hipoperfusión cerebral, en nuestro estudio está de acuerdo con los resultados de otros trabajos20–22.
La astrogliosis reactiva constatada en la corteza de los animales con hipoperfusión cerebral está en coherencia con el estudio de Schmidt-Kastner et al.23. Estos autores consideran que la reducción del flujo sanguíneo en la corteza conlleva un suministro deficitario de sustratos a las neuronas, las cuales podrían inducir una respuesta astrocitaria. Por otra parte, la gliosis reactiva puede ocurrir en respuesta a la pérdida neuronal propiciando la estimulación de procesos restaurativos en el tejido cerebral, como la síntesis y liberación de factores neurotróficos24. En concondarcia con este planteamiento, nosotros encontramos un aumento considerable del número y tamaño de las células gliales en el cuerpo estriado de ratas lesionadas.
La reducción encontrada en la expresión de la GFAP asociada a las poblaciones CA1 y CA3 del hipocampo se corresponden con informes de la literatura25. Los astrocitos tienen diferente respuesta ante un evento isquémico, dependiendo de la magnitud y duración del daño26. Se ha planteado que en los períodos inciales de la isquemia los astrocitos proliferan, mientras que cuando existe una hipoperfusión mantenida se produce una degeneración progresiva de las células astrocíticas27.
El modelo de hipoperfusión cerebral en ratas ha sido asociado fundamentalmente con la neurodegeneración del hipocampo. La disminución de la latencia de las ratas lesionadas en el ensayo con la plataforma visible, a los 22 días posteriores a la oclusión, sugiere una deficiencia para ubicar las pistas visuales. Esta hipótesis es avalada por varios estudios que demuestran que la hipoperfusión cerebral produce degeneración del tracto óptico, retinopatía y pérdida del reflejo pupilar7,22,28.
Los animales con una hipoperfusión cerebral crónica de 37 días no presentaron dificultades para ubicar las pistas visuales, evidenciado por la ausencia de diferencias significativas entre las latencias de los animales lesionados y controles. Esto es indicativo de que existe una mejoría del déficit visual con el aumento del tiempo de evolución de la oligoemia. Este hallazgo podría asociarse a la ocurrencia de mecanismos adaptativos que restauran los niveles del flujo sanguíneo. Ha sido documentado que la hipoperfusión cerebral induce un aumento en el diámetro de las arterias relacionadas con el polígono de Willis, tales como: la arteria basilar, la cerebral posterior y la comunicante posterior23,29.
Al analizar el paradigma de LAM para evaluar la memoria de referencia, ambos grupos de animales fueron capaces de aprender la localización de la plataforma. Esto se corrobora en la disminución significativa de la latencia de escape a medida que pasaron los días de evaluación. Nuestros resultados muestran que la reducción crónica del flujo sanguíneo cerebral compromete los procesos de la memoria de referencia y están de acuerdo con los encontrados por otros autores25,30,31. Sin embargo, no se debe obviar el hecho de que el desempeño de los animales en el tanque de Morris depende de la localización de pistas extralaberínticas visuales, por lo que la afectación del sistema visual que se produce en este modelo agrava los resultados obtenidos en esta prueba. No obstante, en el presente estudio se observó una mejoría en la memoria de referencia de los animales lesionados con el incremento del período de evolución de la oligoemia, paralela a la observada en el paradigma del LAM con plataforma visible. Este hallazgo sugiere que, en la evaluación que se corresponde con un período mayor de la lesión, los resultados conductuales pueden ser el reflejo de las alteraciones de la memoria y el aprendizaje.
La OPACC también indujo una alteración de la memoria a corto plazo o de trabajo. Los animales evaluados con mayor tiempo de evolución de la oligoemia mostraron una mejoría en comparación con los que tenían menor tiempo de lesión. Consideramos que este comportamiento se debe a que los resultados correspondientes a la evaluación con menor tiempo de evolución de la lesión están modulados por las afectaciones visuales de los animales.
En la prueba concerniente al período de oligoemia de mayor evolución, el incremento de las latencias de escape solo fue significativo al segundo y tercer día de evaluación. Este comportamiento está asociado con el tiempo esperado entre un ensayo y otro para cada uno de los días en que se realizó el estudio conductual. En el primer día el tiempo interensayo fue de solo 15s, lo que requirió menor demanda del animal para encontrar la plataforma.
Se ha propuesto que la formación de radicales libres es uno de los mecanismos que contribuye al deterioro neuronal32. En el presente trabajo demostramos la existencia de un desequilibrio oxidativo en respuesta a una hipoperfusión cerebral crónica en el hipocampo, el cuerpo estriado y la corteza; regiones particularmente vulnerables a la generación de las ERO33. Este hallazgo sugiere que la formación de radicales libres podrían ser, en parte, responsables del daño celular persistente, característico de las regiones cerebrales estudiadas en este modelo experimental7.
Por otra parte, es conocido que las funciones cognitivas se alojan en circuitos neuronales específicos, que abarcan en algunos casos zonas extensas del cerebro. Varias zonas corticales junto con la amígdala y el estriado participan en la formación de la información. Parte de esta información es transferida al hipocampo. Las áreas CA1 y CA3 participan en la formación de la memoria a corto plazo y transfieren la información hacia la neocorteza donde se almacena durante largo tiempo34. De esta forma, es posible afirmar que los cambios neuropatólogicos asociados a la hipoperfusión cerebral en el modelo de OPACC constituyen la base del deterioro de la memoria y el aprendizaje espacial.
Los modelos animales de isquemia cerebral comenzaron a desarrollarse en la década de los años 70 del pasado siglo con el objetivo de poder estudiar el daño isquémico cerebral en condiciones fisiológicamente controladas y reproducibles35.
Los procesos fisiopatológicos de la isquemia cerebral son el resultado de la secuencia de fenómenos celulares y moleculares a corto y a largo plazo, que confluyen en 2 modalidades de muerte: la muerte necrótica y la muerte celular programada o apoptosis. La comprensión de estos mecanismos es cada vez más amplia, y es el fundamento para el uso de estrategias neuroprotectoras en la clínica. El conocimiento básico de la fisiopatología de la isquemia y de la respuesta de la microglía y de la macroglía es necesario para plantear estrategias del tipo neuroprotector, las cuales no solo deben ir dirigidas a evitar la muerte celular aguda sino también modalidades de muerte celular más tardías, o a fortalecer el tejido superviviente. Aparecen fármacos promisorios como estrategias de neuroprotección y son el sustrato para estudios en animales de experimentación y estudios clínicos en el ser humano2.
Se han planteado diferentes momentos en las estrategias neuroprotectoras, dependiendo del evento molecular sobre el que se interviene. Para esclarecer este punto se dispone de los estudios experimentales que permiten la caracterización molecular y establecen una ventana de tiempo para estas intervenciones. Las estrategias neuroprotectoras se fundamentan en el conocimiento detallado da cada una de estas etapas, y se busca reconocer eventos claves para una intervención farmacológica o física que pueda limitar el daño neuronal y facilite la recuperación2. De manera que el modelo de hipoperfusión cerebral inducido en ratas puede ser de utilidad para evaluar la eficacia de estrategias terapéuticas neurorrestaurativas, neuroprotectoras, antioxidantes y que promuevan la recuperación de las funciones cognitivas.
El objetivo fundamental de los estudios realizados en modelos experimentales de isquemia cerebral ha de ser la obtención de conocimientos básicos acerca de los procesos patobiológicos subyacentes al daño isquémico. Su empleo no debería restringirse a la mera demostración de un beneficio terapéutico como fase previa a la realización de ensayos clínicos35.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.