Nuestro objetivo es describir las características clinicoepidemiológicas y terapéuticas de los pacientes con blefarospasmo (BS) y espasmo hemifacial (EH) en tratamiento con toxina botulínica tipo A (TBA).
Pacientes y métodosSe estudió retrospectivamente a los pacientes diagnosticados de BS y EH en tratamiento con TBA en la consulta de neurología del Complejo Asistencial de Segovia, desde marzo del 1991 hasta diciembre del 2009.
ResultadosSe recogieron distintas variables de 34 pacientes con BS y 55 pacientes con EH, de los cuales el 44,1 y el 32,7%, respectivamente, llevaban más de 10 años en tratamiento con TBA. Desde el inicio de los síntomas hasta la consulta la mediana de tiempo fue de 24 meses en el grupo de BS, y de 59,7 meses en el grupo de EH, diagnosticándose en la primera visita el 76,5 y el 90,7%, respectivamente. El 34,6% de los pacientes con BS y el 77,6% de los pacientes con EH fueron derivados desde atención primaria. En ambos grupos, el preparado farmacológico de TBA más utilizado fue BOTOX®, sin hallarse resistencias primarias ni secundarias. La mediana de la dosis se incrementó progresivamente en ambas entidades, de forma significativa en los primeros años de tratamiento. La ptosis fue el efecto secundario más frecuente (el 47,1% en el BS, el 32,5% en el EH).
ConclusionesEl BS y el ES constituyen los trastornos del movimiento faciales más comunes, recogiendo en esta serie diferentes parámetros epidemiológicos, clínicos y terapéuticos, confirmándose el beneficio y la seguridad del tratamiento con TBA a largo plazo.
Our purpose is to describe the demographic, clinical and therapeutic characteristics of patients with blepharospasm (BS) and hemifacial spasm (HFS) in treatment with botulinum toxin type A (BtA).
Patients and methodsRetrospective analysis of patients diagnosed with BS or HFS and treated with BtA in the Neurology Department at Complejo Asistencial de Segovia between March 1991 and December 2009.
ResultsDifferent variables were collected from 34 patients with BS and 55 with HFS, of whom 44.1% and 32.7% respectively had been undergoing treatment with BtA for more than 10 years. Elapsed time from symptom onset to the first visit was 24 months in the BS group and 59.7 months in the HFS group. Diagnosis was given on the first visit for 76.5% of the BS patients and 90.7% of the HFS patients. Patients were referred by their primary care centres in 34.6% of the cases with BS and in 77.6% of the cases with HFS. The most commonly used BtA preparation was BOTOX® in both groups, and there were no cases of primary or secondary resistance. The median dose of BtA was raised gradually in both groups, and the increase was statistically significant during the early years of treatment. The most common side effect was ptosis (47.1% in BS, 32.5% in HFS).
ConclusionsBS and HFS are the most common facial movement disorders. The demographic and clinical characteristics and therapeutic findings from this study show that treatment with BtA is both effective and safe over the long term.
La distonía se define como una contracción muscular mantenida, involuntaria, que induce posturas anómalas o movimientos repetitivos de torsión. Según su distribución, se clasifica en generalizada, segmentaria, hemidistonía, multifocal y focal. A este último grupo pertenece el blefarospasmo (BS), que se caracteriza por contracciones espasmódicas de los orbiculares de los ojos y músculos adyacentes. Si se acompaña de contracción de otros músculos faciales, da lugar al síndrome de Meige. El espasmo hemifacial (EH) no se considera una forma de distonía, sino un trastorno del movimiento de origen periférico, idiopático generalmente, caracterizado por contracciones involuntarias irregulares, tónicas y/o clónicas de los músculos inervados por el nervio facial1,2. Las opciones de tratamiento, tanto en el BS como en el EH, incluyen fármacos, intervenciones quirúrgicas y toxina botulínica (TB)3,4.
La TB se aplica mediante inyección subcutánea en los músculos afectados. Actúa bloqueando la liberación de acetilcolina en la unión neuromuscular produciendo una denervación transitoria. Existen 2 serotipos de TB disponibles comercialmente, tipo A (TBA) y tipo B, y su potencia se expresa en unidades. Los efectos secundarios son similares en el BS y el EH, e incluyen ptosis, dolor en el sitio de inyección, paresia facial, diplopía, equimosis, queratitis por exposición corneal, lagrimeo, ectropión y entropión3-5. El fracaso terapéutico se divide en primario, que ocurre desde la primera utilización de TB y podría corresponder a una resistencia biológica de la toxina, o secundario, que aparece después de que tratamientos anteriores fueran eficaces, y cuyas causas varían desde empeoramiento de la sintomatología inicial, problemas técnicos o formación de anticuerpos capaces de neutralizar la toxina3,4,6-9.
Describimos los resultados de un análisis de las características clinicoepidemiológicas y terapéuticas de un número elevado de pacientes con BS y EH durante un largo periodo de tratamiento con TBA.
Pacientes y métodosSe analizaron, de forma retrospectiva, las características epidemiológicas, clínicas y la evolución de los pacientes diagnosticados de BS y EH en tratamiento con infiltraciones de TBA en la consulta de Neurología del Complejo Asistencial de Segovia, desde marzo del 1991 hasta diciembre del 2009. Las inyecciones de TBA se hicieron con el resultado de la solución preparada con la mezcla de TBA con 2 cc de suero fisiológico al 0,9% en el caso de Botox® (5 U en 0,1 cc) y con 2,5 cc de suero fisiológico al 0,9% en el caso de Dysport® (20 U en 0,1 cc). La equivalencia Botox®:Dysport® fue 1:4. Las inyecciones se realizaron subcutáneamente y los músculos infiltrados, según la necesidad de cada paciente, eran: orbicular (preseptal o pretarsal), musculatura peribucal y platisma. En el caso de síndrome de Meige, también podían infiltrarse otros músculos craneocervicales. La dosis era calculada en función de la severidad y la localización del espasmo, teniendo en cuenta las directrices de la literatura. No se realizaron infiltraciones de TBA de refuerzo fuera de las correspondientes cada 12 semanas como mínimo. Se recogieron también las causas de los abandonos del tratamiento, detallando las debidas a pérdidas de seguimiento, fallecimientos, etc.
Los datos se analizaron con el programa estadístico SPSS v.15.0 para Windows. Se practicó un análisis descriptivo de los datos demográficos, clínicos y de tratamiento. Para la evolución de la dosis se usaron tests no paramétricos de Wilcoxon para variables apareadas. Para la comparación de grupos para variables cualitativas se utilizó la prueba de la chi cuadrado. En la comparación de grupos, se utilizó la prueba de la U de Mann-Whitney. Se consideró significativo un valor de p inferior a 0,05.
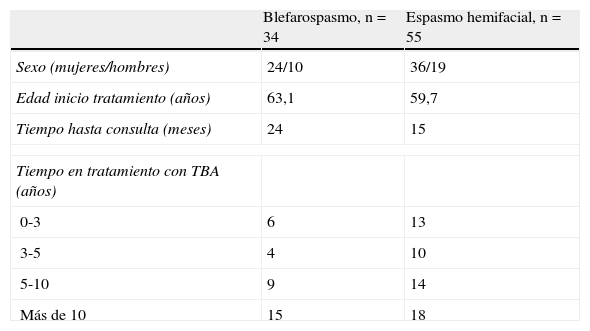
ResultadosBlefarospasmoSe recogieron 34 pacientes con BS, mayoritariamente mujeres, siendo la prevalencia de periodo de 2,2 por 100.000 pacientes/año. Otras características de los pacientes se indican en la tabla 1.
Los servicios que más frecuentemente derivan los pacientes son atención primaria (34,6%) y oftalmología (30,8%), refiriéndose como sospecha diagnóstica que motiva la consulta en neurología: BS (42,9%), tic (25%), ptosis (14,3%), miastenia (7,3%) y diplopía (3,6%).
La resonancia magnética (RM) fue la prueba diagnóstica más utilizada, empleándose el 30,8% de las veces, sin objetivarse ninguna alteración estructural. El 26,5% (9 pacientes) fueron diagnosticados al inicio de síndrome de Meige, ya que asociaban distonía oromandibular, y posteriormente, durante el seguimiento en consultas, el 11,8% (4 pacientes) lo desarrollaron, con una mediana de 36 meses.
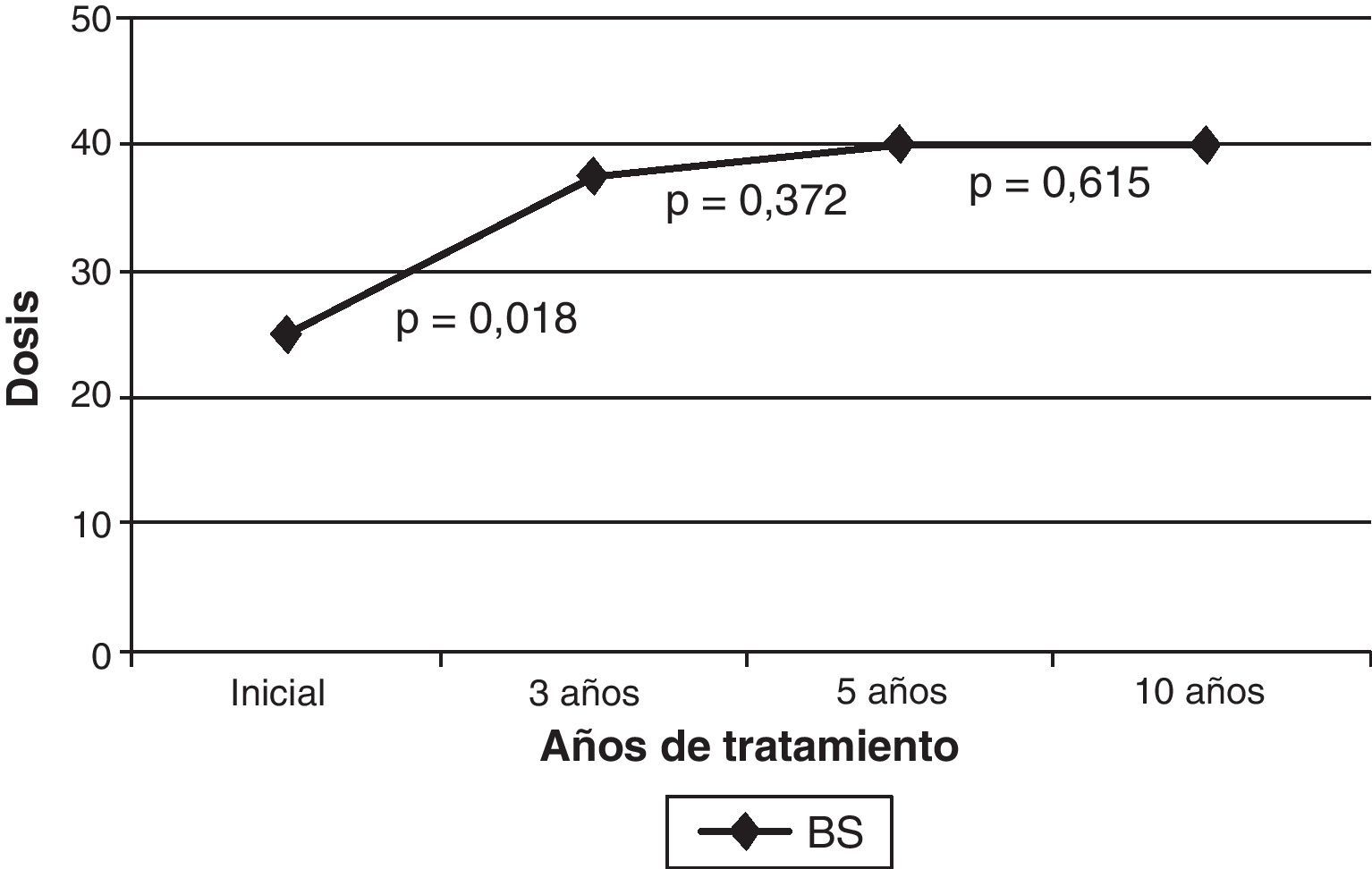
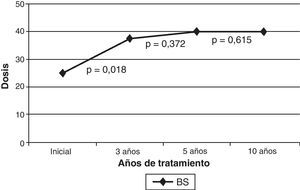
El preparado farmacológico utilizado inicialmente fue Botox®, precisando en el 5,9% (2 pacientes) cambio a Dysport®, por sospecha de resistencia secundaria, sin confirmarse en prueba de resistencia, y obteniendo similar beneficio con ambas formulaciones. Al inicio, la localización de las inyecciones a nivel orbicular fue preseptal en todos los pacientes. Se realizó una inyección pretarsal a los 3 años en el 79,4% (27 pacientes), a los 5 años en el 67,6% (23 pacientes) y a los 10 años en el 41,2% (14 pacientes). El cambio de localización de las infiltraciones de la porción preseptal a la pretarsal de los orbiculares de los ojos se realizó esperando obtener mayor eficacia, y en algún caso para evitar la ptosis como efecto secundario. La mediana de la dosis (sumando dosis de ambos orbiculares) fue de 25 U al inicio del tratamiento, 37,5 U a los 3 años, 40 U a los 5 y 10 años. La mediana de la dosis se incrementó progresivamente con el tiempo, pero esta diferencia solo fue significativa entre el inicio del tratamiento y los 3 años (fig. 1). Los pacientes que precisaron añadir tratamiento en músculos diferentes del orbicular (músculos craneales o cervicales) lo iniciaron en una mediana de 24 meses tras la primera dosis.
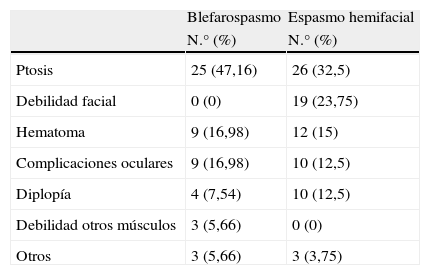
No se hallaron resistencias primarias ni secundarias. El 85,3% (29 pacientes) tuvo efectos secundarios en alguna ocasión durante el seguimiento, sin ningún efecto adverso sistémico (tabla 2). El 11,7% (4 pacientes) fueron dados de alta por mejoría en un intervalo de 1 a 4 años tras el inicio del tratamiento. Las «pérdidas de seguimiento» fueron 4 pacientes, por motivos desconocidos (tras estudio detallado de las historias clínicas no se llegó a la conclusión de por qué no acudieron a las citas). Ningún paciente abandonó el tratamiento por efectos secundarios.
Efectos secundarios al tratamiento con TBA en pacientes con BS y EH
| Blefarospasmo | Espasmo hemifacial | |
| N.° (%) | N.° (%) | |
| Ptosis | 25 (47,16) | 26 (32,5) |
| Debilidad facial | 0 (0) | 19 (23,75) |
| Hematoma | 9 (16,98) | 12 (15) |
| Complicaciones oculares | 9 (16,98) | 10 (12,5) |
| Diplopía | 4 (7,54) | 10 (12,5) |
| Debilidad otros músculos | 3 (5,66) | 0 (0) |
| Otros | 3 (5,66) | 3 (3,75) |
Se recogieron 55 pacientes con EH, mayoritariamente mujeres, con una prevalencia de periodo de 3,7 por 100.000 pacientes/año. Otras características de los pacientes se indican en la tabla 1.
El diagnóstico se realizó en la primera visita en el 90,7% de los pacientes. Los pacientes fueron derivados principalmente desde atención primaria (77,6%), seguido de oftalmología (8,2%). Las sospechas diagnósticas referidas fueron, en orden de frecuencia: tic (38,8%), EH (18,4%), parálisis facial (12,2%), ptosis (10,2%), BS (6,1%), diplopía (2%), miastenia (2%) y acúfenos (2%).
De entre los 55 pacientes con EH, 18 tuvieron antecedentes de parálisis facial (32,7%), tratándose de sincinesias posparalíticas. La localización del EH fue derecha en el 61,8% (34 pacientes) e izquierda en el 38,2% (21 pacientes). La prueba de estudio más utilizada fue la RM (se empleó el 60,9% de las veces), objetivándose una compresión vascular del nervio a nivel de la base del cráneo en 4 casos y un glioma de tronco de bajo grado en un caso.
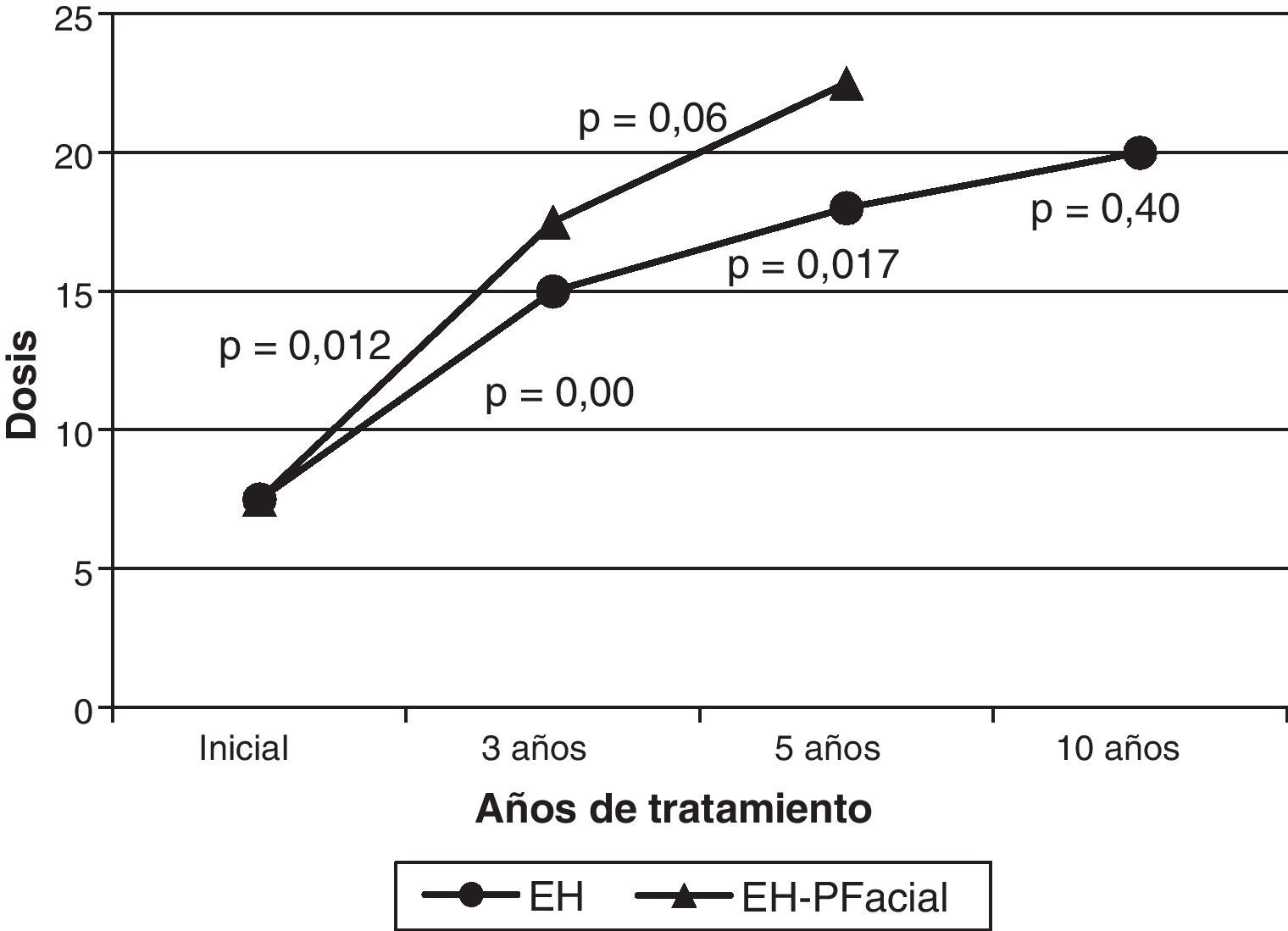
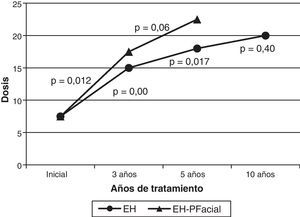
La toxina utilizada inicialmente siempre fue Botox®, precisando en el 3,6% (2 casos) cambio a Dysport®, por sospecha de reacción alérgica cutánea local en un caso y por beneficio escaso en otro, sin obtener mayor beneficio con la nueva formulación. La mediana de la dosis a nivel del orbicular de los ojos al inicio del tratamiento fue de 7,5 U, a los 3 años de 15 U, a los 5 años de 18 U y a los 10 años de 20 U. La mediana de la dosis se incrementó progresivamente con el tiempo, siendo este incremento significativo entre el inicio y los 3 años de tratamiento, y entre los 3 y los 5 años de tratamiento. El incremento de dosis no fue significativo entre los 5 y los 10 años de tratamiento. En los pacientes con antecedentes de parálisis facial (18 casos), la mediana de la dosis al inicio fue de 7,5 U, a los 3 años de 17,5 U (12 casos) y a los 5 años de 22,5 U (7 casos). Solo hay un paciente con antecedentes de parálisis facial con más de 10 años de tratamiento. Al igual que en los pacientes sin antecedentes de parálisis facial, la mediana de la dosis se incrementó progresivamente, siendo significativa la diferencia únicamente entre el inicio y los 3 años de tratamiento (fig. 2). Al comparar las medianas de las dosis del subgrupo de pacientes con antecedentes de parálisis facial con los que no tenían dicho antecedente, no se encontraron diferencias significativas en ninguno de los periodos comparados (al inicio, a los 3 años y a los 5 años). El 56% (31 pacientes) precisó inyecciones en otros músculos diferentes del orbicular, de tal forma que el 40% (22 pacientes) necesitó TBA en cigomático, el 11% (6 pacientes) en cigomático y platisma y el 5% (3 pacientes) en platisma, comenzando el tratamiento a dicho nivel con una mediana de 12 meses, no recibiendo de forma constante inyecciones a dichos niveles.
No se hallaron resistencias primarias ni secundarias. El 76,4% (42 pacientes) tuvo en alguna ocasión algún efecto secundario durante el seguimiento. No ocurrió ningún efecto adverso sistémico (tabla 2). El 9% de ellos (5 pacientes) fueron dados de alta por no precisar más inyecciones de TBA por mejoría, tras un intervalo entre 3 y 10 años desde el inicio del tratamiento. Las «pérdidas de seguimiento» fueron: efectos secundarios (2 pacientes), fallecimiento (un paciente), enfermedades concomitantes graves (2 pacientes) y desconocido (un paciente). No hubo relación significativa entre la aparición de efectos secundarios y el abandono del tratamiento (p = 0,423).
DiscusiónSe ha estudiado a un total de 89 pacientes (34 con BS, 55 con EH), valorando diferentes parámetros epidemiológicos, clínicos y terapéuticos. De todos los resultados, destacamos los más relevantes.
Epidemiológicamente, los hallazgos fueron similares a estudios previos respecto del sexo (mayor proporción de mujeres) y edad de inicio1,2.
Respecto de las pruebas realizadas para descartar causas secundarias, la RM fue la que más veces se utilizó. Sin embargo, a pesar de las recomendaciones de realizar dicho estudio en todos los casos, solo se realizó en el 50,9% de los pacientes con EH. Estos datos pueden explicarse en parte porque incluimos a pacientes que fueron diagnosticados hace años, cuando todavía la RM no estaba disponible en la mayoría de los hospitales.
Entre los estudios revisados que valoran el tratamiento con TBA a largo plazo destacamos la serie de Snir et al.10, que incluye a 27 pacientes (17 con BS y 10 con EH) durante un periodo de tratamiento de 4 a 6 años, y la serie de Cillino et al.11, con 73 pacientes con BS y 58 con EH durante un periodo de 10 años. Mejía et al.12 valoran la eficacia, la seguridad y la respuesta inmunitaria de la TBA, con una media de 12 años de evolución en diferentes distonías, pero únicamente incluye a 4 pacientes con BS, 6 con distonía craneocervical y un paciente con EH. Otras series de interés son las de Pérez Saldaña et al.13, Jitpimolmard et al.14, Defazio et al.15 y Barbosa et al.16, que estudian a pacientes con EH, o las series de Echeverría et al.17, que incluye a pacientes con BS, valorando como único parámetro la evolución de la dosis de TBA, y Mauriello et al.18, con pacientes con BS y síndrome de Meige. Todos concluyen que el tratamiento del BS y el EH con ambas formulaciones de TBA es efectivo y seguro a largo plazo. Gill et al.19 analizan la respuesta de la TBA en 18 pacientes con BS y 16 pacientes con EH, concluyendo que se trata de un tratamiento beneficioso y seguro tras más de 30 administraciones, y objetivan que en el BS el tiempo de alivio de los síntomas es menor en las últimas administraciones respecto de las primeras, con una diferencia significativa, y que dicho tiempo no se modifica en el EH.
En lo referente a la evolución de la dosis a lo largo del tiempo, los resultados varían entre estudios. Echeverría et al.17 vieron una disminución leve pero significativa de la dosis de TBA a lo largo de un periodo no lineal en pacientes con BS, y en la serie de Defazio et al.15 la dosis de TBA se mantuvo constante a lo largo del tiempo en pacientes con EH. Gill et al.19 objetivaron un aumento de la dosis no significativa en el EH. En otras series, se produce un aumento de la dosis sobre la inicial tanto en pacientes con BS como con EH10-13,16,20. En el estudio que presentamos, las dosis de TBA se incrementaron progresivamente, siendo significativas en los primeros años de tratamiento, lo que podría explicarse porque inicialmente se utilizaron dosis bajas de acuerdo con las directrices de la literatura y, posteriormente, se modifica basándose en la severidad clínica y la localización del espasmo. También podría explicarse por desarrollo de resistencia a la TBA, secundaria a la formación de anticuerpos, poco probable, ya que aunque no se practicaron mediciones de anticuerpos en laboratorio, en todos los pacientes en los que se realizó un test clínico de resistencia fue negativo, aunque podría ser debido a una resistencia parcial. Otras razones podrían ser el efecto de aprendizaje o el posible efecto placebo inicial.
Al comparar las medianas de las dosis del subgrupo de pacientes con antecedentes de parálisis facial con los que no tenían dicho antecedente, no se encontraron diferencias significativas en ninguno de los 3 periodos comparados. Kollewe et al.21 no encontraron diferencias en respuesta al tratamiento con ambas formulaciones de TBA entre los pacientes con EH y sincinesias tras una parálisis facial, de etiología tanto traumática como idiopática. En cambio, Saldaña et al.13 describieron que la sincinesia posparalítica precisa dosis inferiores, lo cual se podría poner en relación con la paresia facial residual existente, o que se tratara de un proceso más benigno con un curso más estable.
En cuanto a los efectos secundarios, de acuerdo con estudios previos5,11,13–15,21–23, el más frecuente fue el de ptosis. Otras series destacan como efecto adverso más frecuente el ojo seco, seguido de ptosis10,18,24. Todos los efectos secundarios al tratamiento fueron siempre reversibles y controlados con el ajuste de la dosis de TBA.
Se han valorado varias técnicas de infiltración para optimizar la respuesta a la TBA, en cuanto a mejor respuesta, duración mayor del efecto y menores efectos secundarios. Cakmur et al.25 realizaron un estudio retrospectivo que incluía a 25 pacientes con BS y 28 pacientes con EH, en el que comparaban la infiltración a nivel pretarsal frente a nivel preseptal, obteniendo en el grupo que recibía inyecciones a nivel pretarsal mejores tasas de respuesta con una mayor duración de los efectos, siendo el efecto secundario más común el de ptosis, pero menos frecuente que en el grupo que recibía inyecciones a nivel preseptal. Otros estudios apoyan estos hallazgos, Aramideh et al.26 concluyen que inyecciones adicionales de TBA incrementan el beneficio y disminuyen el número de fracasos terapéuticos y de ptosis, aunque hallaron un incremento significativo de visión borrosa al añadir las infiltraciones a nivel pretarsal. En esta serie, en el grupo del BS se realizaron infiltraciones a nivel pretarsal y en el grupo con EH ningún paciente recibió infiltraciones a dicho nivel. No se recogió si hubo o no beneficio, o si se modificó la frecuencia de efectos secundarios con dichas infiltraciones.
El BS y EH son patologías poco conocidas, incluso en el ámbito médico, teniendo en cuenta las sospechas diagnósticas que motivaron la consulta de los pacientes, lo cual nos hace pensar que probablemente sean infradiagnosticadas y por ello puede haber pacientes que no estén recibiendo un tratamiento adecuado.
Aunque este estudio representa un seguimiento retrospectivo de pacientes en tratamiento continuado con TBA, se trata de un estudio descriptivo y los datos deben ser interpretados cuidadosamente. Dado que se revisaron historias clínicas de años de evolución, hubo datos que no se pudieron incluir en el estudio ya que no se habían recogido, como tiempo desde la infiltración hasta respuesta al tratamiento, duración de la respuesta máxima o puntuación en escalas de evaluación de pacientes. Respecto a esto último, consideramos que el efecto de la toxina continúa siendo beneficioso y seguro tras años de tratamiento, ya que aunque no dispongamos de resultados de escalas de calidad, los pacientes solicitan continuar tratamiento por considerarlo beneficioso.
En conclusión, el BS y el EH son trastornos del movimiento de evolución progresiva, que afectan a la calidad de vida del paciente, resultando la TBA la mejor opción terapéutica, eficaz y segura a largo plazo.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Parte de los resultados de este trabajo han sido presentados en la LXII Reunión anual de la SEN como póster.