Los efectos neurotóxicos del líquido cefalorraquídeo (LCR) procedentes de pacientes con esclerosis lateral amiotrófica (ELA) han sido descritos por varios autores que han atribuido esta neurotoxicidad al efecto de glutamato del LCR-ELA.
Material y métodosSe han expuesto cultivos de neuronas embrionarias corticales de rata con un incubación de 24h y el LCR procedente de pacientes con ELA, valorando las alteraciones celulares a través de microscopía óptica en comparación con aquellas que produce con 100mM de glutamato y la inmunohistoquímica de caspasa-3, TNF y periferina a través de microscopia confocal.
ResultadosEn el cultivo expuesto a LCR-ELA se observan células con fragmentación del núcleo con escasa o nula modificación estructural de los organelos citoplasmáticos y mantenimiento de la membrana plasmática, lo que no ocurre con la exposición a glutamato. Se observa un aumento de caspasa-3 y de TNFα y un incremento de periferina que co-localiza con caspasa-3 pero no con TNFα, lo hace sugerir que puede tener un papel precoz en el desarrollo de la apoptosis.
ConclusionesLa citotoxicidad por LCR-ELA no se relaciona con el glutamato, que provoca una afectación nuclear precoz sin alteración de la membrana citoplasmática produciendo una apoptosis citoplasmática que conlleva un incremento de caspasa-3 que co-localiza con sobreexpresión anómala de periferina.
The neurotoxic effects of cerebrospinal fluid (CSF) from patients with amyotrophic lateral sclerosis (ALS) have been reported by various authors who have attributed this neurotoxicity to the glutamate in CSF-ALS.
Material and methodsCultures of rat embryonic cortical neurons were exposed to CSF from ALS patients during an incubation period of 24 hours. Optical microscopy was used to compare cellular changes to those elicited by exposure to 100μm glutamate, and confocal microscopy was used to evaluate immunohistochemistry for caspase-3, TNFα, and peripherin.
ResultsIn the culture exposed to CSF-ALS, we observed cells with nuclear fragmentation and scarce or null structural modifications to the cytoplasmic organelles or to plasma membrane maintenance. This did not occur in the culture exposed to glutamate. The culture exposed to CSF-ALS also demonstrated increases in caspase-3, TNFα, and in peripherin co-locating with caspase-3, but not with TNFα, suggesting that TNFα may play an early role in the process of apoptosis.
ConclusionsCFS-ALS cytotoxicity is not related to glutamate. It initially affects the nucleus without altering the cytoplasmic membrane. It causes cytoplasmic apoptosis that involves an increase in caspase-3 co-located with peripherin, which is also overexpressed.
El líquido cefalorraquídeo procedente de algunos pacientes con esclerosis lateral amiotrófica (LCR-ELA) tiene una característica específica que es la posibilidad de provocar una reducción de la supervivencia celular en cultivos de neuronas motoras, en lo que se ha denominado como efecto citotóxico1. Este efecto se limita al LCR2–8 y ha sido repetidamente demostrado9–13. En un estudio previo14, hemos observado efectivamente este mecanismo en cultivos de neuronas, y hemos comprobado que es independiente del glutamato a través de exponerlo a distintos antagonistas. El motivo del actual estudio es comprobar qué cambios celulares se producen en los cultivos neuronales expuestos al LCR-ELA.
Material y métodosEl LCR obtenido por punción lumbar de 3 pacientes con el diagnóstico de ELA, definida según los criterios del Escorial-Arlie Diagnostic Criteria15 obteniéndose entre 1,5-3cc, centrifugado, alicuotado y almacenado a −80° hasta el momento de exposición al cultivo. De la misma forma, se extrajo el LCR de 3 pacientes controles, cuya punción lumbar se hizo formado parte del diagnóstico de cefalea o crisis epiléptica. Todos los pacientes y controles firmaron el consentimiento informado.
La extracción y el mantenimiento de los cultivos de neuronas embrionarias motoras de rata se realizaron bajo el protocolo descrito anteriormente por Yañez et al., 201114. Los cultivos fueron expuestos inicialmente al LCR-ELA, LCR-control y a 100mM de glutamato, así como el cultivo basal incubados durante 24h y analizados mediante microscopía óptica e inmunohistoquímica.
Para la determinación de los estudios inmunohistoquímicos previa fijación de las células, se utilizaron anticuerpos anti-caspase-3 (1:200, Millipore, 04-1090), anti-TNFα (1:100, Abcam ab66579), anti-peripherin (1:500, Millipore, AB9282), FluoroPan Neuronal Marker para marcar todas las células de origen neural (1:100, Millipore MAB2300×) seguido de las incubaciones con los anticuerpos secundarios pertinentes (Alexa 488, 555 o 647, 1:500, Invitrogen), posteriormente se contrastaron los núcleos con DRAQ5 (1:3000, Abcam, ab108410). Las imágenes de contraste de fases y de inmunofluorescencia fueron adquiridas en un microscopio invertido Olympus acoplado a un sistema de microscopio confocal Olympus FV1000®. El análisis cuantitativo se efectuó a través de analysis software ImageJ (versión 1.42) (http://rsbweb.nih.gov/ij/), realizando todas las cuantificaciones bajo doble ciego. Para el análisis estadístico utilizamos el software GraphPad Prism 5, y los valores se presentan como media ± error estándar de la media (EEM).
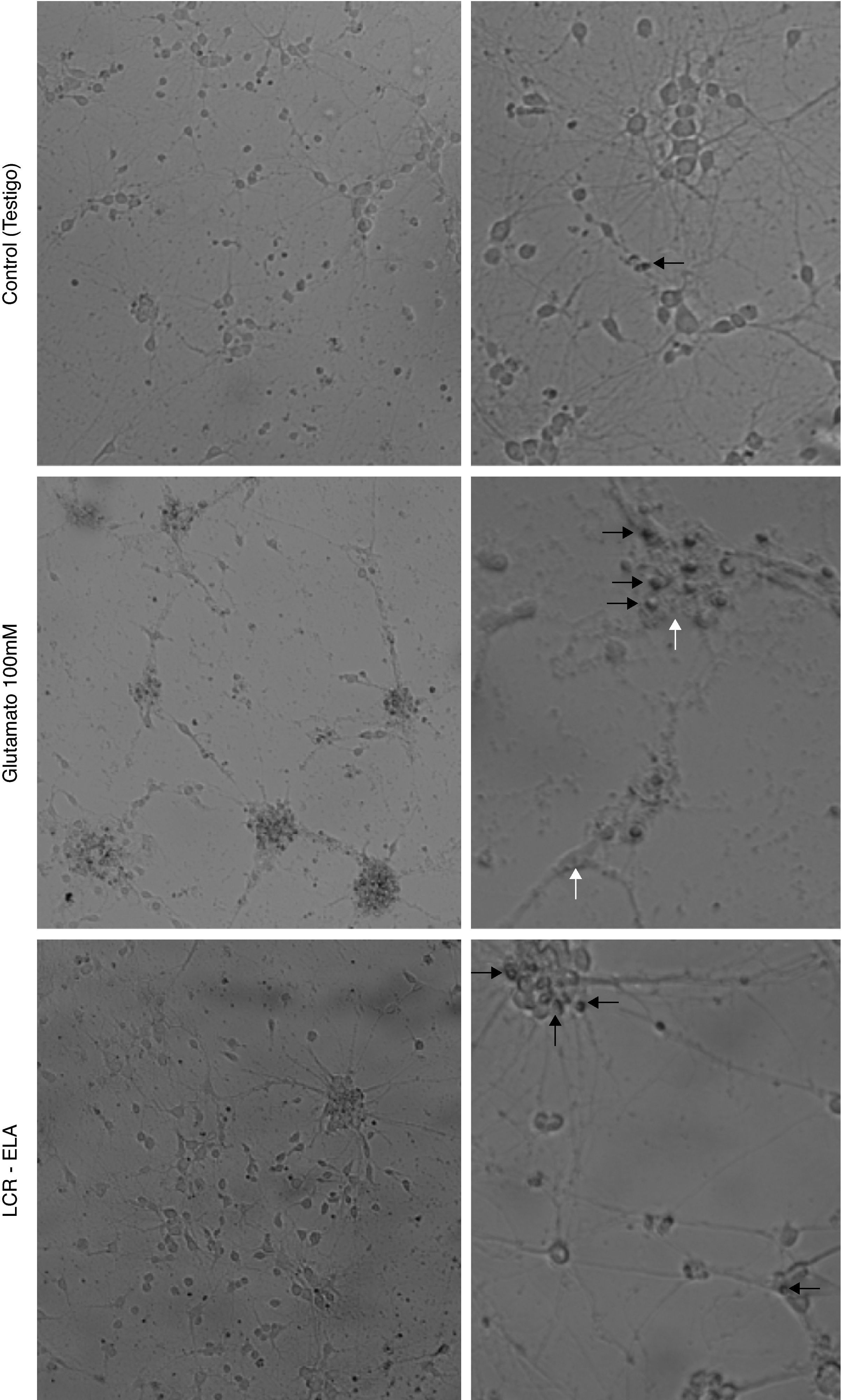
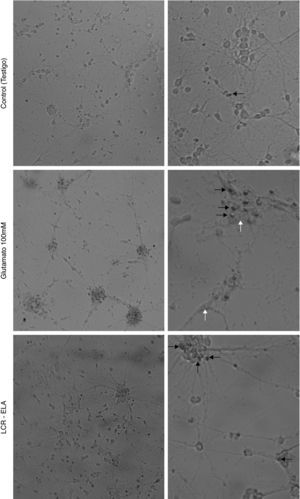
ResultadosLos cambios celulares observados por microscopia óptica que se producen en el cultivo de neuronas motoras tras la exposición con glutamato (100mM) presentan signos de degeneración autofágica, caracterizadas por vacuolización autofágica del citoplasma, degeneración granulovacuolar, además de células picnóticas y una clara condensación de la cromatina. Contrariamente, en el cultivo expuesto al LCR-ELA se observan células con retracción de las proyecciones celulares, reducción del volumen celular, fragmentación del núcleo (cariorexis), condensación de la cromatina (picnosis), con escasa o nula modificación estructural de los organelos citoplasmáticos, burbujas de membrana plasmática y mantenimiento de la membrana plasmática (fig. 1). La comparación de ambas imágenes muestran como los cambios celulares producidos por el LCR-ELA y glutamato son distintos.
Cambios celulares en el cultivo de neuronas motoras tras la exposición a control, glutamato 100mM y LCR-ELA. En el control, la flecha negra indica células picnóticas. En el cultivo expuesto a glutamato, las flechas blancas señalan vacuolas autofágicas, y en las flechas negras condensación de cromatina. En el cultivo expuesto a LCR-ELA, las flechas negras indican mantenimiento de la membrana citoplasmática.
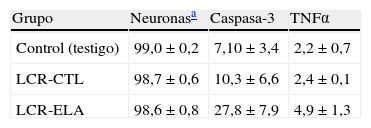
Al comparar el número de células marcadas mediante la inmunohistoquímica en los cultivos controles, basales, y aquellos expuestos al LCR controles con los expuestos al LCR-ELA, se observa un incremento significativo de caspasa-3 y de TNFα en estos últimos (tabla 1), no habiendo diferencias entre los 2 primeros. El marcaje de caspasa-3 mostró una media ±DE de 27,8±7,9 al exponer al LCR-ELA frente a 7,1±3,4 y 10,3±6,6 en los otros 2 grupos. Con relación a TNFα la media ±DE tras la exposición al LCR-ELA fue de 4,9±1,3 frente a 2,2±0,7 y 2,4±0,1, respectivamente. La comparación de los datos muestra, por lo tanto, que la exposición al LCR-ELA supone a las 24h de incubación un aumento de caspasa-3 y de TNFα.
Inmunohistoquímica de caspasa-3 y TNFα en los 3 tipos de cultivos
| Grupo | Neuronasa | Caspasa-3 | TNFα |
| Control (testigo) | 99,0±0,2 | 7,10±3,4 | 2,2±0,7 |
| LCR-CTL | 98,7±0,6 | 10,3±6,6 | 2,4±0,1 |
| LCR-ELA | 98,6±0,8 | 27,8±7,9 | 4,9±1,3 |
Media±DE. Datos expresados en porcentaje.
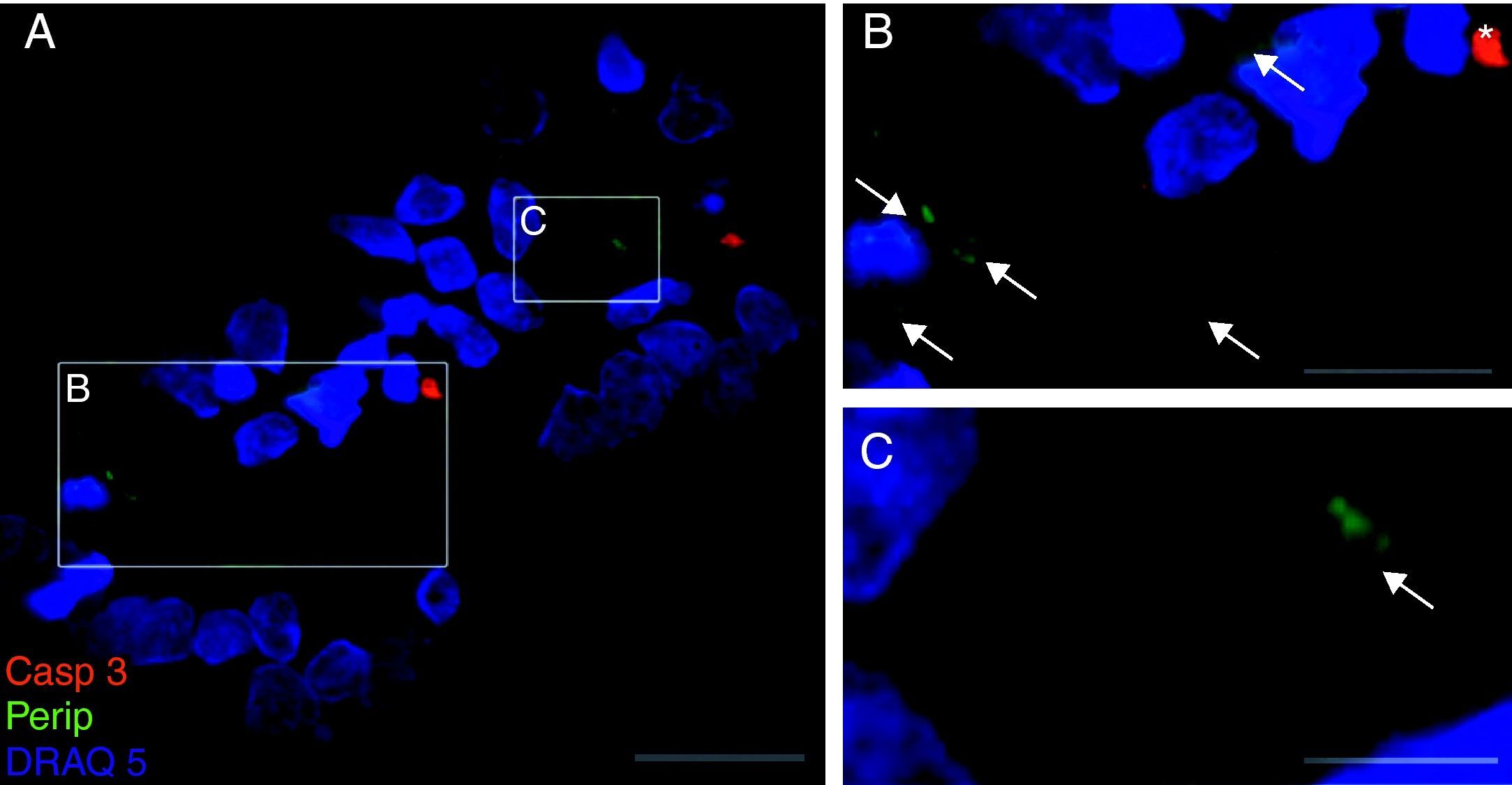
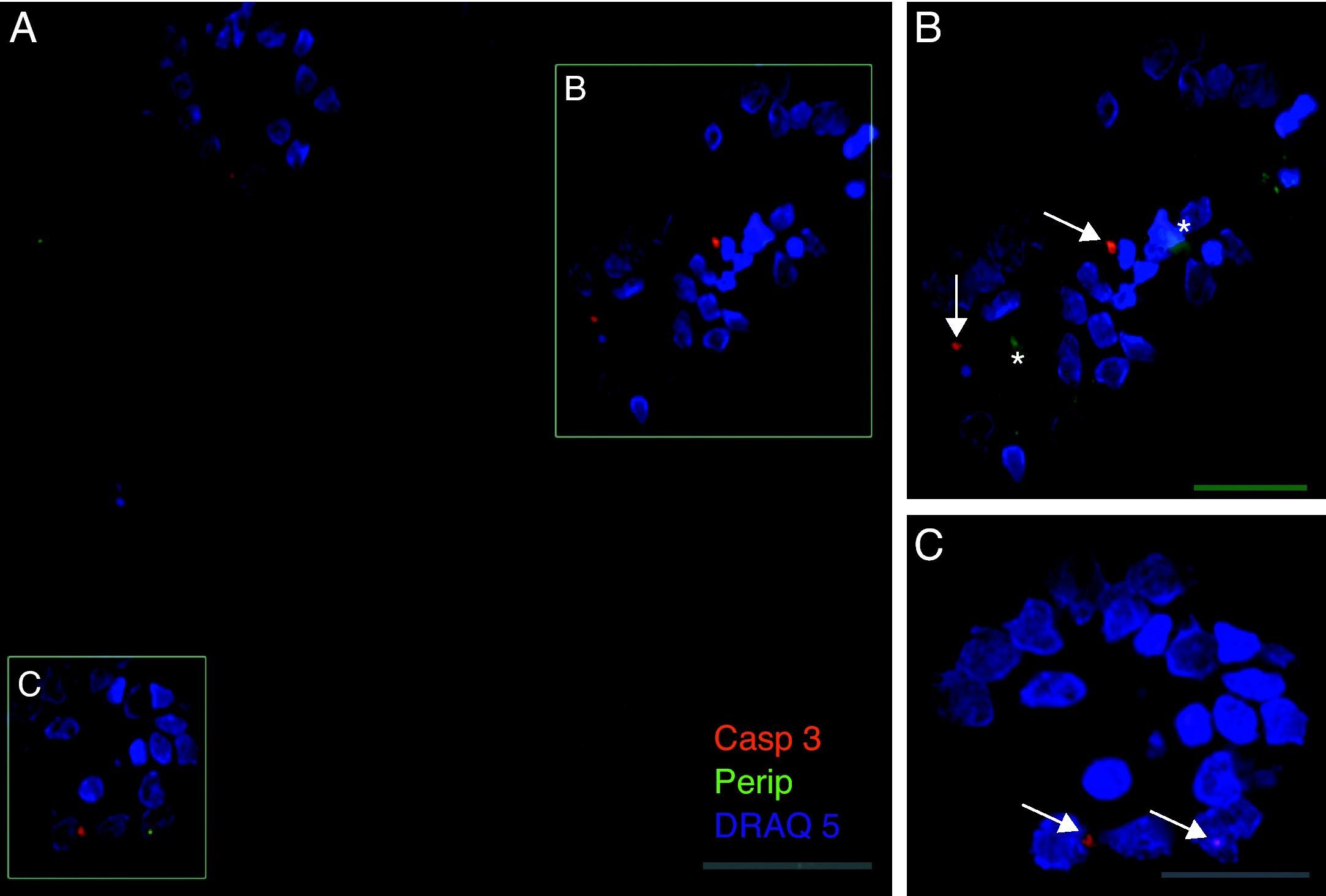
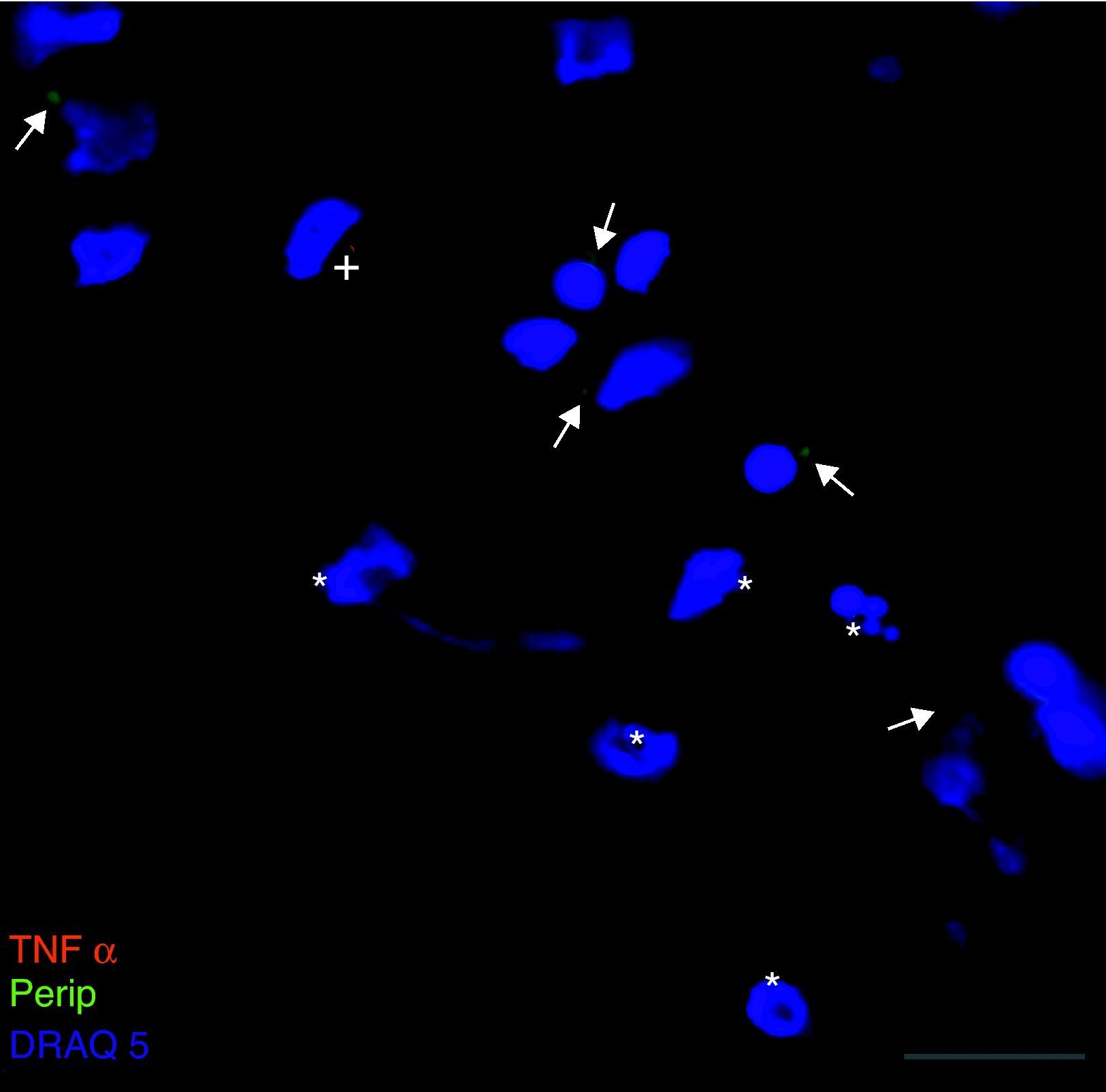
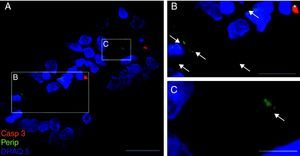
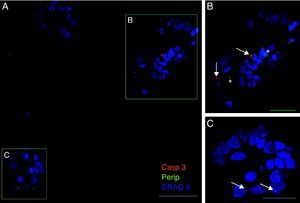
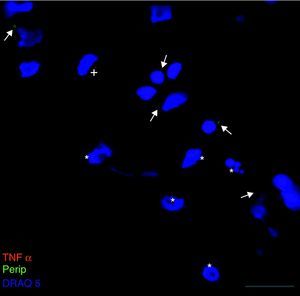
Exclusivamente en el cultivo expuesto al LCR-ELA se muestra la expresión de periferina, no apareciendo en los demás cultivos. La expresión de esta proteína se observó en el grupo de células expuestas al LCR-ELA, en forma de pequeños precipitados citoplasmáticos (fig. 2). Se observan células que expresan caspasa-3 que no co-expresan periferina, pero hay células con marcaje caspasa-3 positivas que la co-expresan (fig. 3). Existen células con expresión de periferina sin que se observe marcaje de TNFα en ellas, lo que hace postular que la expresión de periferina antecede al incremento de TNFα (fig. 4). En consecuencia, la comparación entre los cultivos nos muestra como la exposición del LCR-ELA produce una sobreexpresión de periferina que es previa al aumento de TNFα a las 24h de exposición.
Co-expresión de caspasa-3 y periferina en el cultivo de LCR-ELA (A-C). El marcaje de caspasa-3 (rojo), de periferina (verde-flechas) y de núcleos (azul) (A-C). La expresión de periferina se observó en forma de pequeños precipitados citoplasmáticos (flechas, B y C) y células caspasa-3 positivas (asterisco). Barra: A) 30 micras, B) 15 micras y C) 5 micras.
Co-expresión de caspasa-3 y periferina en el cultivo de LCR-ELA. El marcaje de caspasa-3 (rojo-asterisco), de periferina (verde-flecha) y de núcleos (azul) (A-C). En la imagen B se observan inclusiones que expresan periferina (asteriscos), mientras que la expresión de caspasa-3 está marcada con flechas (B y C). Barra: A) 60 micras, B) 40 micras y C) 20 micras.
El diagnóstico de citoxicidad por el LCR-ELA en los cultivos de neuronas motoras primarias se ha basado en distintas técnicas de laboratorio que han variado dependiendo del grupo de investigación. Así, por ejemplo, se ha utilizado la determinación de LDH intracelular16, expresión de CHAT17, viabilidad celular a través de MTT o técnica similar14,17, recuento de células vivas9,10,17, calcio intracelular14 o expresión de neurofilamentos fosforilados18. Nuestro estudio confirma que la citotoxicidad ha demostrado por la viabilidad celular mediante MTT, que se asocia al incremento de caspasa-3 y, por lo tanto, se correlaciona con el desarrollo de apoptosis.
Nuestro estudio demuestra que los cambios celulares que se observan como consecuencia de la exposición a un cultivo de neuronas motoras por el LCR-ELA son distintos a aquellos que se producen al añadir 100mM de glutamato, y que conducen a una apoptosis con incremento de TNFα. La excitoxicidad inducida por glutamato ha sido implicada como uno de los mecanismos de la ELA y de su modelo en roedor con SOD1 mutada19,20. Ello ha venido reforzado porque la neurotransmisión excitatoria de las motoneuronas medulares dependen especialmente de los receptores AMPA, lo que podría explicar la vulnerabilidad específica de estas células21 y, porqué riluzole, que es el único fármaco que ha mostrado un discreto efecto protector prolongando la vida de los pacientes unos pocos meses22,23 bloquea el efecto presináptico del glutamato, inhibe la entrada de calcio, sobrerregula los receptores de AMPA y bloquea el efecto de los receptores de NMDA y AMPA24–26.
Existe muy poca información en la literatura sobre los cambios celulares producidos por el efecto citotóxico del LCR de pacientes de la ELA, habiéndose descrito desde astrocitosis27–29, en modelos in vivo o cultivos que son mixtos con astrocitos, vacuolas30,31, signos pre o pro apoptóticos32–34, o signos de muerte celular35. Nuestros datos muestran que los cambios son distintos a lo que se observa tras la exposición de glutamato al cultivo, reforzando nuestra conclusión en un estudio previo que el mecanismo del LCR-ELA es independiente del glutamato a través de exponerlo a distintos antagonistas14.
Los cambios celulares observados sugieren que en la exposición al LCR-ELA es más precoz la afectación nuclear que la alteración de la membrana celular o de organelas citoplasmáticas. Este hecho ya ha sido observado en la enfermedad36, en el modelo transgénico de la ELA37 y en forma de la ELA familiar autosómica dominante (ALS8)38,39, que produce una proteína mutada que lleva a la formación de membranas de RE en el citoplasma donde se observa alteraciones en el envoltorio nuclear, que conduce a un bloqueo del transporte de nucleoporinas al envoltorio nuclear, quedando estas proteínas secuestradas en el citoplasma40. Nuestros hallazgos sugerirían que el mecanismo citotóxico podría penetrar inicialmente en las motoneuronas sin lesionar la membrana celular y, probablemente, por acumulo anómalo de proteínas en el citoplasma, lo que explicaría que el mecanismo de apoptosis demostrado por el incremento de caspasa-3 se asocia a un aumento de TNFα35, que probablemente aumentaría su expresión si la incubación del cultivo hubiera sido superior a 24h.
La periferina es una proteína neuronal de filamentos intermedios que predomina en el sistema nervioso periférico, aunque se ha encontrado en algunas poblaciones neuronales del sistema nervioso central, y se ha descrito su sobreexpresión en algunas enfermedades neurodegenerativas. En la ELA, mutaciones sobre su gen se asocia a formas esporádicas y su sobreexpresión conduce a una enfermedad de motoneurona en el roedor41. Mizuno et al.,42 han descrito su presencia en los cuerpos de Bunina, que son característicos de las formas no relacionadas con SOD1 de la enfermedad43. Un ratón desarrollado con una mutación de TDP-43 que presenta un cuadro clínico similar a la ELA con degeneración fronto-temporal presenta sobreexpresión de periferina44. La presencia de esta proteína en los cultivos expuestos al LCR-ELA refuerza la hipótesis de Mizuno et al.42 que la periferina podía tener un papel en el desarrollo de la ELA, y considerando que reduce el efecto de BDNF45 y que riluzole actúa sobre sus receptores, este mecanismo podría explicar cómo podría actuar este fármaco al margen del glutamato. El hecho que el incremento de periferina anteceda al aumento de TNFα hace evidenciar que puede tener un papel precoz en el desarrollo de la apoptosis, reforzado la observación de que co-localiza con caspasa-3.
En resumen, nuestro trabajo refuerza la idea que la citotoxicidad por el LCR-ELA no se relaciona con el glutamato, que provoca una afectación nuclear precoz sin alteración de la membrana citoplasmática produciendo una apoptosis citoplasmática que conlleva un incremento de caspasa-3 que co-localiza con sobreexpresión anómala de periferina.
FinanciaciónLa investigación en la que se basa este artículo está financiada por el proyecto «Vulnerabilidad selectiva de la motoneurona a los efectos neurotóxicos del líquido cefalorraquídeo de pacientes en esclerosis lateral amiotrófica (ELA)» concedido por la Fundación Mutua Madrileña 2008, 2009.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.