Actualización de la guía para el diagnóstico y tratamiento de la hemorragia subaracnoidea de la Sociedad Española de Neurología.
Material y métodosRevisión y análisis de la bibliografía existente. Se establecen recomendaciones en función del nivel de evidencia que ofrecen los estudios revisados.
ResultadosLa causa más frecuente de hemorragia subaracnoidea espontánea (HSA) es la rotura de un aneurisma cerebral. Su incidencia se sitúa en torno 9 casos por 100.000 habitantes/año y supone un 5% de todos los ictus. La hipertensión arterial y el tabaquismo son sus principales factores de riesgo. Se ha de realizar el tratamiento en centros especializados. Se debe considerar el ingreso en unidades de ictus de aquellos pacientes con HSA y buena situación clínica inicial (grados I y II en la escala de Hunt y Hess). Se recomienda la exclusión precoz de la circulación del aneurisma. El estudio diagnóstico de elección es la tomografía computarizada (TC) craneal sin contraste. Si esta es negativa y persiste la sospecha clínica se aconseja realizar una punción lumbar. Los estudios de elección para identificar la fuente de sangrado son la resonancia magnética (RM) y la angiografía. Los estudios ultrasonográficos son útiles para el diagnóstico y seguimiento del vasoespasmo. Se recomienda el nimodipino para la prevención de la isquemia cerebral diferida. La terapia hipertensiva y el intervencionismo neurovascular pueden plantearse para tratar el vasoespasmo establecido.
ConclusionesLa HSA es una enfermedad grave y compleja que debe ser atendida en centros especializados, con suficiente experiencia para abordar el proceso diagnóstico y terapéutico.
To update the Spanish Society of Neurology's guidelines for subarachnoid haemorrhage diagnosis and treatment.
Material and methodsA review and analysis of the existing literature. Recommendations are given based on the level of evidence for each study reviewed.
ResultsThe most common cause of spontaneous subarachnoid haemorrhage (SAH) is cerebral aneurysm rupture. Its estimated incidence in Spain is 9/100 000 inhabitants/year with a relative frequency of approximately 5% of all strokes. Hypertension and smoking are the main risk factors. Stroke patients require treatment in a specialised centre. Admission to a stroke unit should be considered for SAH patients whose initial clinical condition is good (Grades I or II on the Hunt and Hess scale). We recommend early exclusion of aneurysms from the circulation. The diagnostic study of choice for SAH is brain CT (computed tomography) without contrast. If the test is negative and SAH is still suspected, a lumbar puncture should then be performed. The diagnostic tests recommended in order to determine the source of the haemorrhage are MRI (magnetic resonance imaging) and angiography. Doppler ultrasonography studies are very useful for diagnosing and monitoring vasospasm. Nimodipine is recommended for preventing delayed cerebral ischaemia. Blood pressure treatment and neurovascular intervention may be considered in treating refractory vasospasm.
ConclusionsSAH is a severe and complex disease which must be managed in specialised centres by professionals with ample experience in relevant diagnostic and therapeutic processes.
La hemorragia subaracnoidea (HSA) es el subtipo de ictus menos frecuente pero es el que cualitativamente mayor morbimortalidad produce. La carga sociosanitaria que representa es aún más pesada dado que incide en un porcentaje relevante de los casos sobre personas jóvenes, previamente sanas y completamente independientes. En este trabajo se actualizan las recomendaciones en lo que se refiere a la metodología diagnóstica y el tratamiento médico del paciente con una HSA. Los grados de recomendación y las evidencias científicas que las avalan se clasifican siguiendo los criterios del Centro para la Medicina Basada en la Evidencia (Center for Evidence Based Medicine-CEBM) (tabla 1).
Niveles de evidencia y grados de recomendación
| Niveles de evidencia | Tipo de estudio en que se basa la clasificación | Grados de recomendación | |||
| 1a | Revisión sistemática de ensayos clínicos aleatorizados (con homogeneidad) | A | B (extrapolación) | D (estudios no concluyentes) | |
| 1b | Ensayo clínico aleatorizado con intervalo de confianza estrecho | A | B (extrapolación) | D (estudios no concluyentes) | |
| 2a | Revisión sistemática de estudios de cohortes (con homogeneidad) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 2b | Estudio de cohorte individual (incluyendo ensayo clínico aleatorizado de baja calidad, por ejemplo seguimiento inferior al 80%) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 3a | Revisiones sistemáticas de estudios de casos y controles (con homogeneidad) | B | C (extrapolación) | D (estudios no concluyentes) | |
| 3b | Estudio de casos y controles | B | C (extrapolación) | D (estudios no concluyentes) | |
| 4 | Series de casos o estudios de cohorte o casos y controles de baja calidad | C | D (estudios no concluyentes) | ||
| 5 | Opinión de expertos sin valoración crítica explícita o basada en la fisiología o fisiopatología. | D | |||
Adaptada del Centre for Evidence Based Medicine (CEBM). (http://www.cebm.net)
La HSA es una de las enfermedades neurológicas más temidas por su elevada mortalidad y generación de dependencia, con un impacto económico superior al doble del estimado para el ictus isquémico1. La HSA representa un 5% de los ictus2,3. Esta cifra ha experimentado un leve incremento en los últimos 30 años debido al descenso en la incidencia de los otros subtipos de ictus asociado al mejor control de los factores de riesgo vascular (FRV), pero que no repercute de la misma manera en la HSA cuya incidencia permanece invariable4 en 9 casos/100.000 habitantes-año, según el estudio European Registers of Stroke (EROS)2, similar a referida en los meta-análisis internacionales5 a excepción de Japón y Finlandia, que duplican estas cifras. En España6, la Sociedad Española de Neurocirugía (SENEC) constató un incremento en la incidencia a partir de los 50 años, siendo la proporción de mujeres ligeramente superior, y sin diferencias respecto al día de la semana, el mes o la estación del año como las descritas en Rochester7 donde se asistía a un incremento en los meses de invierno para dicha población. El estudio de Omama et al.8 mostró una relación entre la HSA y la hora de presentación, con una curva de incidencia bimodal, ya descrita previamente9 para los ictus hemorrágicos. Se postula que esta relación con el ritmo circadiano se explicaría por las variaciones de las cifras de presión arterial a lo largo del día, y con el incremento de la agregación plaquetaria descrito durante el despertar10. Hasta el 5% de los pacientes fallece antes de llegar al hospital o de obtener una prueba de imagen3. Este dato es significativamente menor a las cifras de muerte súbita del 12% para aneurismas de circulación anterior y 44% para los de la circulación posterior, planteado clásicamente11, no descartándose la posibilidad de sesgos por la complejidad de la definición de muerte súbita y la difícil adecuación a cada país y ciudad concretos. En el estudio español, hasta el 68% de los pacientes presentan una «buena situación clínica» a su llegada, definida como grados I-III de la escala de la federación mundial de neurocirujanos (Word Federation of Neurosurgeons Scale, WFNS) (tabla 2), que implica una puntuación en la escala de coma de Glasgow entre 13 y 15. Este dato es significativo de cara a la decisión de hospitalización de los casos de HSA en las unidades de ictus12. El 19% se clasificó como HSA idiopáticas tras un estudio angiográfico inicial negativo. De estas, un 40% fueron HSA perimesencefálicas y hasta en el 10% el estudio de imagen fue normal. Los pacientes con HSA perimesencefálica o con neuroimagen normal presentan recuperación completa a los 6 meses hasta en el 90%13.
En el caso de las HSA aneurismáticas, la localización más frecuente del aneurisma es la arteria comunicante anterior (36%), seguida de cerebral media (26%), comunicante posterior (18%) y carótida interna (10%). Un 9% de los casos son aneurismas de circulación posterior y aneurismas múltiples en un 20%. La incidencia de malformación arteriovenosa (MAV) asociada es inferior al 2%. En España, se realiza tratamiento reparador del aneurisma en el 85% de las HSA aneurismáticas, un dato significativamente mayor que en las series americanas publicadas14,15. Dicho tratamiento se realizó en las primeras 72 h en el 64% de los pacientes prefiriéndose el tratamiento endovascular en el 56% de los casos.
La tasa de mortalidad global, medida al alta, es del 22%, que se incrementa hasta el 26% si se consideran solo las aneurismáticas. Estos resultados son equiparables a los encontrados en los meta-análisis publicados, que muestran una mortalidad del 25-30% calculada a los 30 días de evolución en países de alta renta per cápita4,16. Existe una clara tendencia hacia el descenso en la mortalidad en los últimos 30 años, no asociado a una mayor tasa de dependencia3. Los pacientes presentan una recuperación completa (definida como una puntuación en la Glasgow Outcome Scale [GOS] de 5) en el 49% de los casos. Hasta el 64% de los pacientes alcanzan el grado de independencia (definidos como GOS 4-5, equiparable a 0-2 puntos en la escala de Rankin modificada), siendo este porcentaje de hasta el 58% en el caso de HSA aneurismática, dato que concuerda con los resultados internacionales3,16.
Factores de riesgo y prevenciónLos principales FRV modificables siguen siendo la hipertensión arterial (HTA)17, que duplica el riesgo para la presión arterial sistólica (PAS) > 130mm Hg y lo triplica para PAS > 170mm Hg18, el tabaco y el alcohol. Otros factores de riesgo como el ejercicio físico intenso se describen en series como la australiana ACROSS19. Por otro lado, la diabetes mellitus se relaciona solo con el subtipo de HSA perimesencefálica13. Los principales FRV no modificables son el antecedente familiar de primer grado, que multiplica hasta 4 veces la incidencia20, y las enfermedades del tejido conjuntivo: poliquistosis renal, síndrome de Ehlers-Danlos tipo IV, telangiectasia hemorrágica hereditaria, seudoxantoma elástico, neoplasia endocrina múltiple tipo 1 y neurofibromatosis tipo 121. La corrección de los FRV modificables es necesaria para toda la población y especialmente en los pacientes con HSA22, no solo por la relación causal previamente descrita, sino por la mayor incidencia de enfermedades vasculares presentes tras el diagnóstico de HSA, que alcanza un riesgo de casi el doble de la población normal16. El uso de anticoagulantes orales se relaciona con un aumento del resangrado23 pero el uso de la antiagregación era una incógnita que obligaba al clínico a afrontar el posible riesgo de recidiva frente al demostrado aumento de incidencia de enfermedades vasculares. Un subanálisis del estudio ISAT24 y recientes publicaciones europeas23 al respecto evidencian la posibilidad de usar la antiagregación de forma segura en estos pacientes. Con respecto al uso de ácido acetilsalicílico (AAS), un estudio reciente parece demostrar que los pacientes con aneurisma cerebral que toman regularmente AAS tienen un riesgo disminuido de rotura respecto a los que no la usan25.
Aunque existe una tendencia a la mejoría en el pronóstico de esta enfermedad en los últimos 30 años, gracias a los avances terapéuticos alcanzados, todavía genera casi un 60% de morbimortalidad en el caso de la HSA aneurismática, lo que sumado a los datos de daño cognitivo crónico16 nos debe de alentar hacia el estudio y avance en el manejo de esta enfermedad.
Manifestaciones clínicas y sistematología diagnósticaLas recomendaciones para el diagnóstico de la hemorragia subaracnoidea aneurismática se resumen en la tabla 3.
Recomendaciones para el diagnóstico de la hemorragia subaracnoidea aneurismática: niveles de evidencia y recomendaciones
| Recomendaciones | Nivel de evidencia y clase de recomendación |
| Diagnóstico de la HSA | |
| – Ante la sospecha clínica de HSA, se debe referir inmediatamente a un centro especializado y adecuadamente dotado | Nivel de evidencia 3-5. Grado de recomendación C |
| – La HSA es un proceso grave con un amplio espectro en su presentación clínica. Esto lleva a que sea con frecuencia mal diagnosticada, hasta en un 25-30% de los casos, con graves repercusiones. Por ello es preciso un buen conocimiento de sus formas de presentación y un alto nivel de sospecha clínica ante toda cefalea de inicio súbito con o sin otros síntomas | Nivel de evidencia 2. Grado de recomendación B |
| – El estudio diagnóstico de elección es la TC sin contraste, más accesible que la RM, algunas de cuyas secuencias son igualmente sensibles. La rentabilidad disminuye con el paso de los días, de forma que en los 5 primeros, la TC puede tener una alta sensibilidad, para decrecer paulatinamente | Nivel de evidencia 2. Grado de recomendación B |
| – Si la TC es negativa y la sospecha clínica persiste se aconseja la práctica de una punción lumbar, dejando transcurrir unas horas desde el inicio. La presencia de hematíes y/o de xantocromía confirma el diagnóstico. Pasadas 3 semanas tanto la neuroimagen como el LCR suelen ser ya normales | Nivel de evidencia 2. Grado de recomendación B |
| – El estudio de elección para identificar la fuente de sangrado es la RM, y la angiografía si se sospecha un aneurisma. La angio-RM y la angio-TC son muy sensibles para aneurismas de los vasos del polígono de Willis mayores de 5mm de diámetro. Si un primer estudio angiográfico es negativo se recomienda repetirlo en unas 2 semanas, salvo en la HSA perimesencefálica | Nivel de evidencia 2. Grado de recomendación B |
| – Los estudios sonográficos son útiles para el diagnóstico y seguimiento del vasoespasmo | Nivel de evidencia 2. Grado de recomendación B |
| – Se recomienda el cribado en aquellas personas con al menos 2 familiares con aneurismas, desde los 18 a los 80 años, con una angio-RM cada 7 años | Nivel de evidencia 4. Grado de recomendación C |
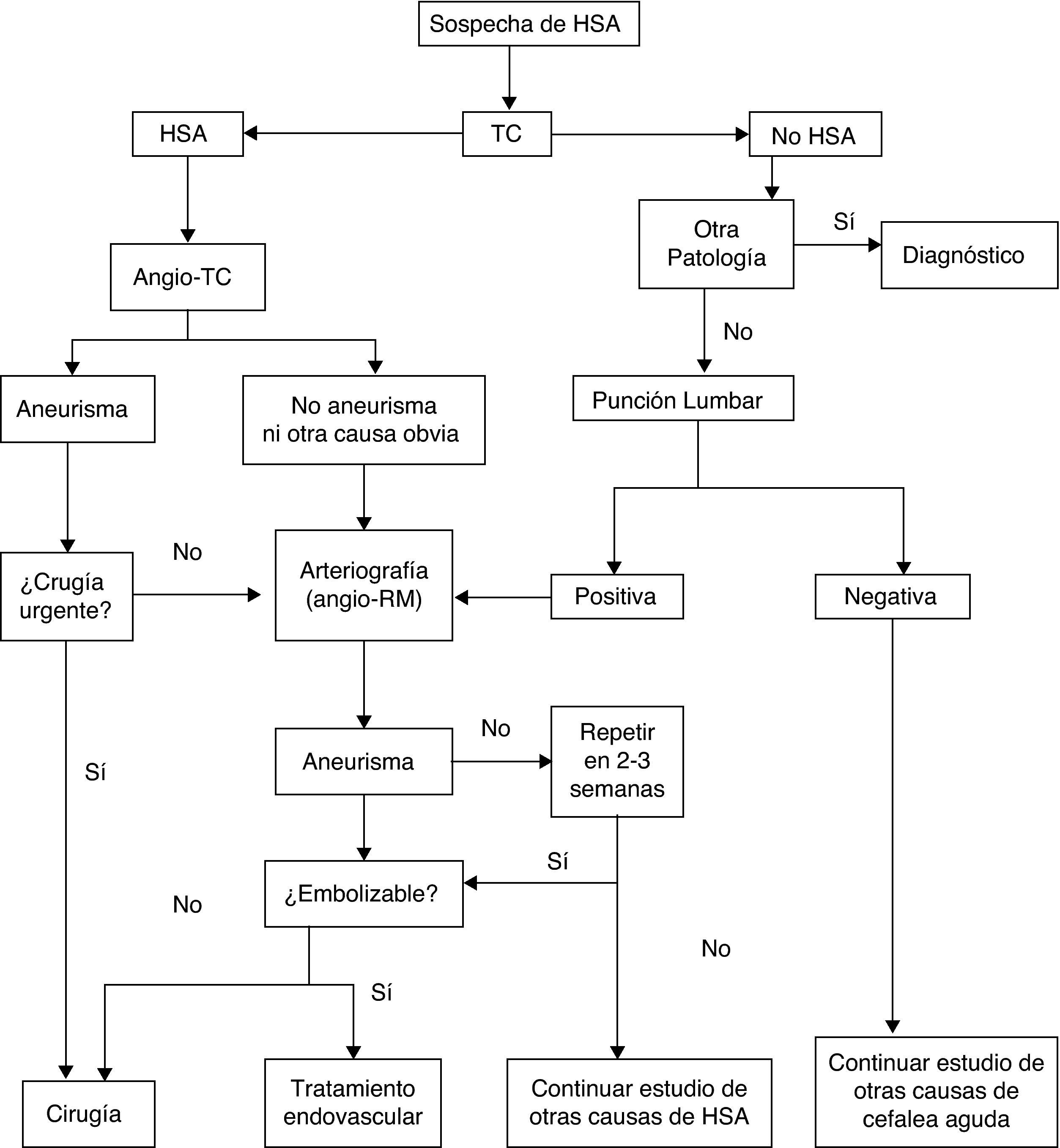
La forma más común de presentación de la HSA es la cefalea. Se trata usualmente de una cefalea intensa de comienzo súbito, que alcanza su acmé en segundos o minutos. En un tercio de los casos es la única manifestación, y son aquellos en los que el diagnóstico puede pasarse por alto. Pueden asociarse síntomas como pérdida de conciencia, que predice hemorragia aneurismática26, náuseas o vómitos, focalidad neurológica o crisis comiciales. No todas las cefaleas súbitas (cefaleas thunderclap o «en trueno») son HSA27, ni en todas las HSA la cefalea tiene las características descritas, que corresponden más específicamente a la HSA por rotura aneurismática; estas constituyen alrededor de un 85% de los casos. Algunos tipos de HSA, como las corticales puras (HSA atraumática de la convexidad28), pueden tener una presentación más indolente, con cefalea sorda, crisis o focalidad neurológica relacionada con la localización29–32. En la tabla 4 se recogen las diferentes causas de HSA. La exploración puede ser completamente normal, o presentar rigidez de nuca, ausente al principio, o en los casos leves, o cuando hay coma. Otro signo, además de los focales –de pares craneales, corticales o de vías–, presentes eventualmente, son las hemorragias subhialoideas en el fondo de ojo. El número de errores diagnósticos en la HSA es elevado, hasta de más del 30% en algunos estudios, y se deben esencialmente a no solicitar una TC por interpretar la cefalea como «benigna»; bien porque no se recoge debidamente al quedar enmascarada en un trastorno inicial de conciencia, o por la confusión del propio paciente33–36. Es importante resaltar que las HSA que estuvieron precedidas de un «aviso» (hemorragia centinela) cursan con mayor gravedad, pues en realidad constituyen un resangrado6,37–44. Los estudios complementarios pretenden por un lado confirmar el diagnóstico y, por otro, identificar el origen del sangrado. La sospecha de HSA debe llevar a la realización de una TC sin contraste. Algunas secuencias de RM pueden igualar e incluso mejorar la sensibilidad de la TC para detectar sangre en espacios subaracnoideos (especialmente ecogradiente T2 y FLAIR)45, pero su accesibilidad es menor y su realización puede estar interferida por la falta de colaboración del paciente. La rentabilidad de las técnicas de imagen va disminuyendo cuanto más tarde se llevan a cabo con respecto al inicio. Si resultan negativas, y la sospecha persiste, el segundo paso es la realización de una punción lumbar39,46,47, que conviene demorar entre 6 y 12 h desde el inicio de los síntomas para permitir que la sangre se difunda en el espacio subaracnoideo y que la lisis de los hematíes dé utilidad a la detección de xantocromía, en caso de que haya dudas de que el eventual contenido hemático sea por HSA o por punción traumática; hacia las 3 semanas de evento el líquido cefalorraquídeo (LCR) llega a ser normal48. Las escalas de Hunt-Hess (tabla 5)49 y de la WFNS (tabla 2)50 permiten cuantificar la gravedad del estado clínico; la escala de Fisher, basada en la cantidad y distribución de la hemorragia, ayuda a predecir el riesgo de vasoespasmo (tabla 6)51. Existe una versión más reciente de esta escala, la escala de Fisher modificada, que otorga un valor cualitativo a la presencia de sangre a nivel intraventricular bilateral y a nivel cisternal como indicativos de mayor riesgo de vasoespasmo52. El origen de la HSA se identifica con TC, RM o angiografía cerebral convencional de 4 vasos por sustracción digital. En caso de sospecha de fístula o MAV, se recomienda incluir el estudio de ambas carótidas externas. El patrón de sangrado permite sospechar un carácter aneurismático (los patrones cortical puro y, sobre todo, el perimesencefálico son menos indicativos de aneurisma53,54), así como evaluar el lugar del sangrado en casos de aneurismas múltiples. Con los equipos actuales la angiografía por TC o por RM se acercan cada vez más a la angiografía convencional en cuanto a sensibilidad para la detección de aneurismas, especialmente si son mayores de 5mm55,56. Los estudios de imagen permiten también identificar causas no aneurismáticas del sangrado (MAV, tumores, trombosis venosas, angeítis, angiopatía amiloide o disecciones arteriales)57,58. También permiten valorar una enfermedad asociada (hemorragia intraparenquimatosa, epidural o subdural, hidrocefalia o vasoespasmo precoz). En el caso de aneurismas, tanto la angio-TC como la angio-RM permiten su identificación y el estudio de su morfología, de forma que la angiografía convencional, no completamente exenta de riesgos, queda progresivamente reservada para un eventual tratamiento endovascular del aneurisma o MAV causantes. Si hay sospecha de aneurisma y este no se identifica en un primer estudio, se aconseja repetirlo en un plazo no inferior a 2 semanas59 para obviar el problema de los aneurismas ocultos por un vasoespasmo precoz; una excepción a esta sistematología pueden ser las HSA perimesencefálicas53,54. Se estima que la rentabilidad de una segunda angiografía detecta alrededor de un 5% de nuevos aneurismas60. Otra técnica de utilidad en el diagnóstico y manejo de la HSA es el Doppler; la mayor utilidad de los ultrasonidos está en el diagnóstico y monitorización del vasoespasmo secundario61,62. El Doppler transcraneal (DTC) es un método no invasivo y bastante útil a la hora de diagnosticar y hacer un seguimiento del vasoespasmo. La dificultad para detectar vasoespasmo en las ramas más distales y la carencia de una buena ventana ultrasónica hasta en un 10% de los pacientes son las limitaciones de esta técnica, que por otro lado tiene una buena correlación angiográfica. Hay que tener en cuenta que esta técnica debe ser realizada por una persona experimentada y que para un buen diagnóstico son necesarios varios estudios secuenciales. La angio-RM también es una técnica que puede ser de utilidad para la detección, localización, cuantificación, seguimiento y diagnóstico de repercusiones (isquemia) del vasoespasmo, sus valores de especificidad, sensibilidad y predicción de falsos positivos y negativos se sitúan como promedio entre el 92 y el 98% con respecto a la angiografía convencional. En cuanto al cribado de miembros de familias con aneurismas se ha calculado que resulta coste-eficiente en aquellos que tienen al menos 2 familiares de primer grado afectados, resultando la mejor estrategia la práctica de una angio-RM cada 7 años desde los 20 a los 80 años, seguida en su caso de angiografía63,64. En la figura 1 se muestra un algoritmo del manejo diagnóstico de la sospecha de HSA aneurismática.
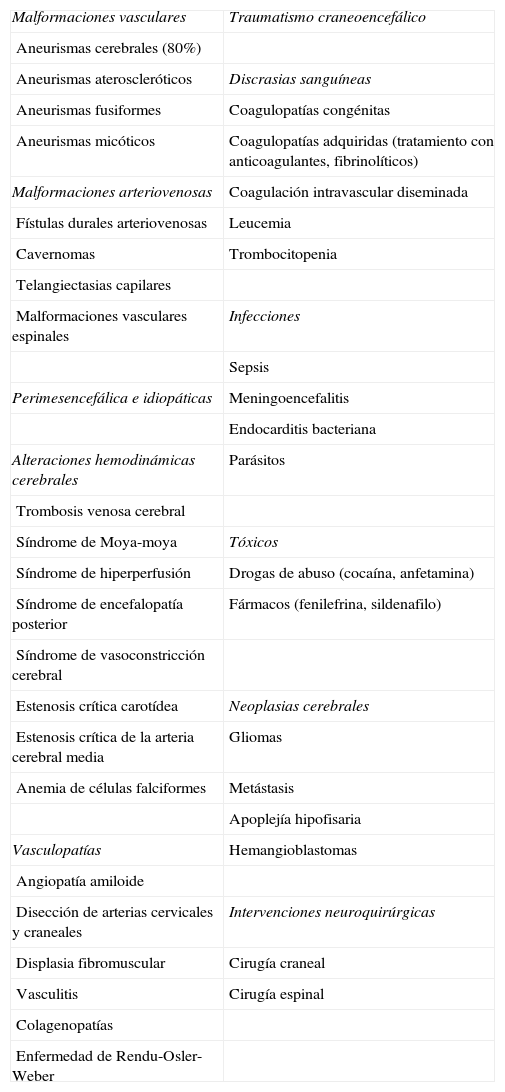
Etiología de la hemorragia subaracnoidea
| Malformaciones vasculares | Traumatismo craneoencefálico |
| Aneurismas cerebrales (80%) | |
| Aneurismas ateroscleróticos | Discrasias sanguíneas |
| Aneurismas fusiformes | Coagulopatías congénitas |
| Aneurismas micóticos | Coagulopatías adquiridas (tratamiento con anticoagulantes, fibrinolíticos) |
| Malformaciones arteriovenosas | Coagulación intravascular diseminada |
| Fístulas durales arteriovenosas | Leucemia |
| Cavernomas | Trombocitopenia |
| Telangiectasias capilares | |
| Malformaciones vasculares espinales | Infecciones |
| Sepsis | |
| Perimesencefálica e idiopáticas | Meningoencefalitis |
| Endocarditis bacteriana | |
| Alteraciones hemodinámicas cerebrales | Parásitos |
| Trombosis venosa cerebral | |
| Síndrome de Moya-moya | Tóxicos |
| Síndrome de hiperperfusión | Drogas de abuso (cocaína, anfetamina) |
| Síndrome de encefalopatía posterior | Fármacos (fenilefrina, sildenafilo) |
| Síndrome de vasoconstricción cerebral | |
| Estenosis crítica carotídea | Neoplasias cerebrales |
| Estenosis crítica de la arteria cerebral media | Gliomas |
| Anemia de células falciformes | Metástasis |
| Apoplejía hipofisaria | |
| Vasculopatías | Hemangioblastomas |
| Angiopatía amiloide | |
| Disección de arterias cervicales y craneales | Intervenciones neuroquirúrgicas |
| Displasia fibromuscular | Cirugía craneal |
| Vasculitis | Cirugía espinal |
| Colagenopatías | |
| Enfermedad de Rendu-Osler-Weber |
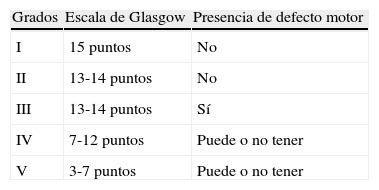
Escala de Hunt y Hess
| Grado I | Ausencia de síntomas, cefalea leve o rigidez de nuca leve |
| Grado II | Cefalea moderada a severa, rigidez de nuca, paresia de pares craneales |
| Grado III | Obnubilación, confusión, leve déficit motor |
| Grado IV | Estupor, hemiparesia moderada a severa, rigidez de descerebración temprana o trastornos neurovegetativos |
| Grado V | Coma, rigidez de descerebración |
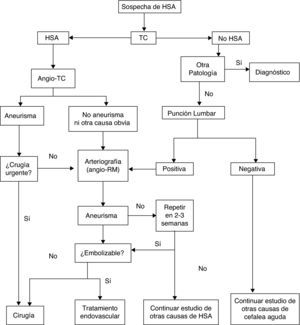
Algoritmo del manejo diagnóstico de la sospecha de HSA aneurismática. (Modificada de Guerrero et al.65)
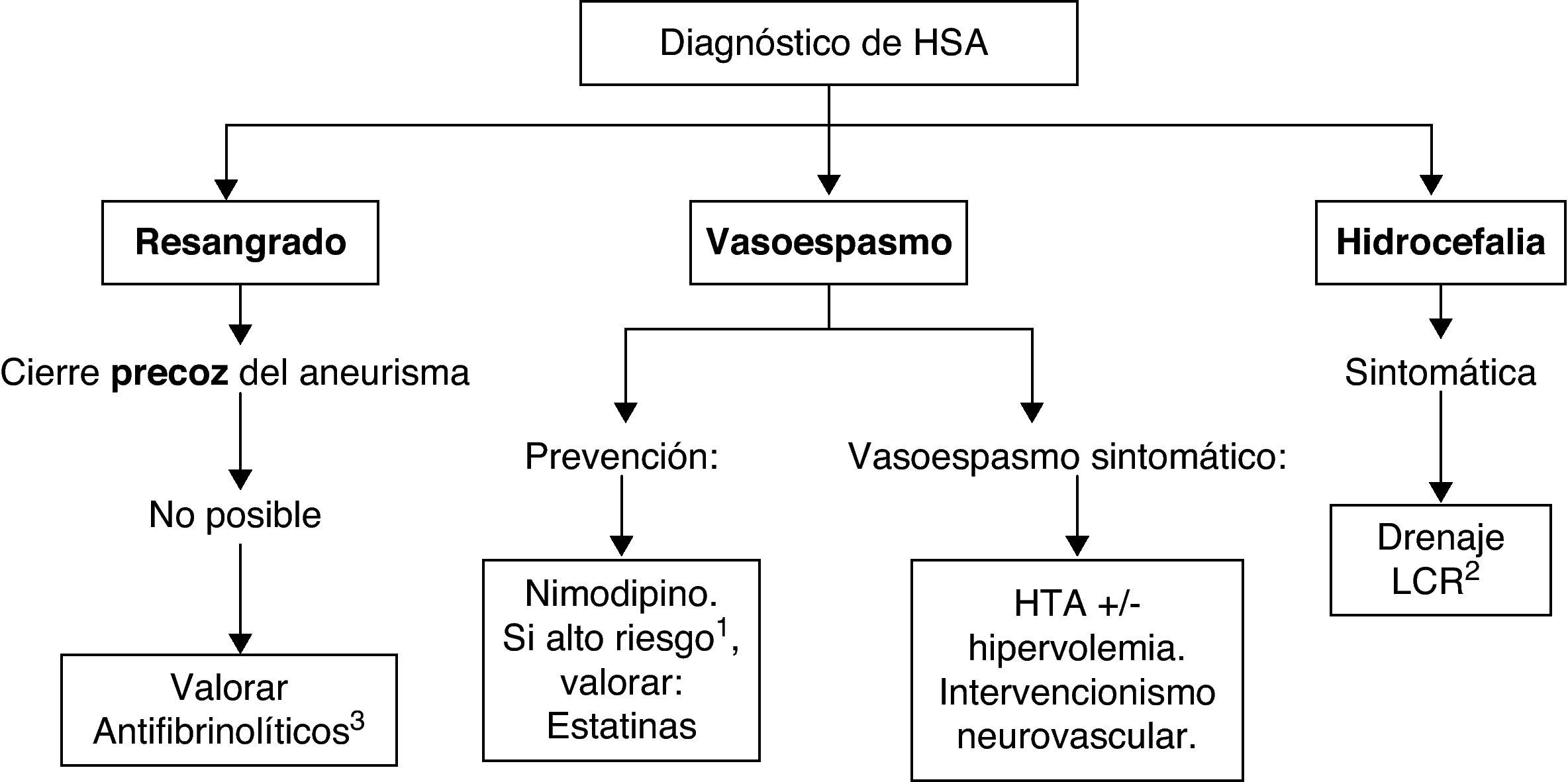
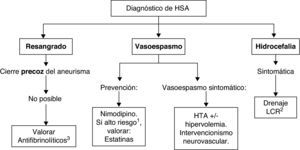
Las recomendaciones para el tratamiento médico de la hemorragia subaracnoidea aneurismática y sus complicaciones se resumen en la tabla 7. En la figura 2 se puede consultar un algoritmo de tratamiento de la HSA aneurismática.
Recomendaciones para el tratamiento de la hemorragia subaracnoidea aneurismática. Niveles de evidencia y recomendaciones
| Recomendaciones | Nivel de evidencia y clase de recomendación |
| Resangrado | |
| – Se recomienda realizar el tratamiento de exclusión del aneurisma de la circulación en la fase precoz tras su rotura | Nivel de evidencia 2b. Grado de recomendación B |
| – El reposo en cama, el tratamiento analgésico o el tratamiento antihipertensivo son útiles como medidas coadyuvantes | Nivel de evidencia 3-5. Grado de recomendación C |
| – Se debe considerar el ingreso en las unidades de ictus de aquellos pacientes con una buena situación clínica inicial (HSA con puntuaciones I-II en la escala de Hunt y Hess, caracterizados por la preservación de un buen nivel de conciencia), reservando la unidad de cuidados intensivos para puntuaciones 3-4 | Nivel de evidencia 4. Grado de recomendación C |
| – Los antifibrinolíticos, utilizados precozmente y por un período corto de tratamiento, pueden ser una opción terapéutica a tener en cuenta para prevenir el resangrado, en aquellos pacientes en los que se va a demorar el tratamiento del aneurisma y que no presenten mayor riesgo de vasoespasmo | Nivel de evidencia 1b. Grado de recomendación D |
| Prevención del vasoespasmo | |
| – Se recomienda el tratamiento con nimodipino, iniciado precozmente, indistintamente por vía oral o intravenosa, para mejorar la evolución clínica y el pronóstico de los pacientes con HSA aneurismática | Nivel de evidencia 1a. Grado de recomendación A |
| Tratamiento del vasoespasmo | |
| – En los pacientes con vasoespasmo establecido se recomienda el tratamiento precoz del aneurisma, y mantener una situación de normovolemia con el empleo de soluciones cristaloides | Nivel de evidencia 3-5. Grado de recomendación C |
| – El empleo de la terapia basada en HTA, con o sin hipervolemia, puede ser considerada una opción terapéutica alternativa en el vasoespasmo establecido, siendo potencialmente perjudicial en los pacientes con signos de sobrecarga hídrica | Nivel de evidencia 3-5. Grado de recomendación C |
| – En casos de vasoespasmo resistente, o en aquellos pacientes en los que el aumento de la volemia y de la presión arterial cause efectos secundarios sistémicos, se puede recurrir la intervencionismo neurovascular | Nivel de evidencia 2b. Grado de recomendación B |
| – En los pacientes con síndrome perdedor de sal el empleo de hidrocortisona y fludrocortisona se considera una alternativa para prevenir y corregir la hiponatremia | Nivel de evidencia 1b. Grado de recomendación B |
| Complicaciones neurológicas | |
| – En los pacientes con hidrocefalia aguda sintomática, el drenaje ventricular mediante ventriculostomía puede resultar beneficioso | Nivel de evidencia 2b. Grado de recomendación B |
| – La administración profiláctica de anticomiciales no está indicada como tratamiento generalizable a todos los pacientes con HSA. No obstante, puede ser considerada, en casos seleccionados, en el período posthemorrágico precoz | Nivel de evidencia 2b. Grado de recomendación B |
El tratamiento médico de la HSA tiene como principal objetivo situar al paciente en las mejores condiciones clínicas para que se pueda abordar la exclusión de la circulación del aneurisma roto con las máximas garantías. Así, en estos casos y en aquellos en los que no existe una etiología aneurismática, se pretende evitar la aparición de dos de sus principales complicaciones neurológicas: el resangrado y el vasoespasmo, así como combatir el propio vasoespasmo si este llega a producirse. De igual manera, se basará en estrategias para afrontar otros problemas ligados a esta enfermedad como la cefalea, el edema cerebral, la potencial aparición de crisis comiciales, y manifestaciones de índole sistémica, como las alteraciones iónicas (hiponatremia por síndrome perdedor de sal o por síndrome de secreción inadecuada de hormona antidiurética e hipernatremia por diabetes insípida), complicaciones cardíacas (arritmias, infarto agudo de miocardio o síndrome de Tako-Tsubo), gastrointestinales (hemorragia digestiva), o respiratorias (síndrome de dificultad respiratoria, edema pulmonar neurogénico o tromboembolia pulmonar).
Ante la sospecha clínica de HSA, se debe derivar inmediatamente al paciente a un centro especializado para el mejor manejo y tratamiento. Todo paciente con HSA debe ser asistido preferentemente en hospitales que dispongan de neurólogo, neurocirujano, intervencionista neurovascular, TC, RM, angiógrafo digital, unidad de ictus y unidad de cuidados intensivos. Aquellos hospitales que atienden un bajo volumen de pacientes (por ejemplo < 10 casos de HSA aneurismática por año) deben considerar la derivación precoz de los pacientes a aquellos centros que atienden un elevado volumen (por ejemplo > 35 casos de HSA aneurismática por año)66. Se recomienda la exclusión precoz de la circulación del aneurisma mediante técnica endovascular o quirúrgica para evitar el resangrado44 y el mejor manejo de las complicaciones potenciales. Un trabajo reciente preconiza realizar la exclusión del aneurisma en las primeras 24 h67. La situación clínica del paciente va a condicionar su ingreso en la unidad de ictus o en la unidad de cuidados intensivos. En un registro realizado en un hospital terciario de los pacientes hospitalizados con HSA espontánea, el 25% del total realizó el ingreso de forma exclusiva en la unidad de ictus. El perfil de estos pacientes correspondía a una buena situación clínica inicial puesta de manifiesto por la preservación del nivel de conciencia, y a grados I y II en la escala de Hunt y Hess. Fueron candidatos en su mayoría a tratamiento embolizador del aneurisma, sin necesidad en general de intervención quirúrgica. Presentaron una buena evolución funcional y bajas tasas de mortalidad12. Las medidas generales de tratamiento incluirán el reposo en cama a 30°, una habitación tranquila con pocas visitas, monitorización de constantes, dieta absoluta, antieméticos, fluidoterapia, evitando si es posible soluciones hiposmolares (caso de los sueros glucosilados), analgesia (metamizol, paracetamol y opioides), laxantes, protección gástrica y profilaxis anticonvulsiva, si se considera indicada, y de la trombosis venosa profunda.
ResangradoEs una complicación muy grave que conlleva entre un 50-70% de mortalidad, por lo que lo primordial en un paciente que se presenta con una HSA, una vez esté estabilizado, es evitar la posibilidad del resangrado del aneurisma roto. El período de mayor riesgo para el resangrado es el de las primeras 24 h tras el episodio y se produce en el 4% de los pacientes. En los 14 días siguientes el riesgo acumulado de resangrado se mantiene en torno al 15-25%, para posteriormente disminuir al 0,5%/día durante los días 15 a 30. Cuanto antes se realice el tratamiento del aneurisma, menor riesgo correrá el paciente, y el manejo del resto de las complicaciones se podrá realizar con mayor margen de confianza (como el caso del tratamiento del vasoespasmo o de la hipotensión arterial). Los factores de riesgo de resangrado son: la demora en el ingreso y en el inicio de tratamiento; la PAS > 160mm Hg (aunque está más relacionado con cambios en la presión sanguínea, que con una cifra determinada), y la mala situación neurológica al ingreso. Se recomienda una monitorización del paciente, y emplear antihipertensivos de vida media corta como el labetalol en casos de elevaciones tensionales. Se debe evitar a su vez una situación de hipotensión arterial que favorezca complicaciones de tipo isquémico, que puedan ser promovidas por la presencia de vasoespasmo44.
Exclusión del aneurisma de la circulación cerebralLa exclusión del aneurisma de la circulación cerebral se puede hacer, bien mediante tratamiento endovascular, bien mediante tratamiento quirúrgico. En el International Subarachnoid Aneurysm Trial (ISAT) se compararon los tratamientos quirúrgico y endovascular para el tratamiento del aneurisma roto68. Se observaron los siguientes datos acerca del tratamiento endovascular frente al quirúrgico: mortalidad de 8,1 frente a 10,1%, discapacidad del 15,6 frente al 21,6%, morbimortalidad del 23,5 frente al 30,9%, mayores tasas de resangrado y menores de oclusión completa en el grupo endovascular, y mayor tasa de epilepsia en el grupo quirúrgico. Actualmente se considera de primera elección la terapia endovascular siempre que el aneurisma sea abordable por esta técnica. En caso contrario, se puede optar por el clipaje del aneurisma, o el empleo de terapias combinadas. En los pacientes que han sido embolizados se realizan controles angiográficos periódicos (a los 6 meses, un año y 2 años) para volver a embolizar en aquellos casos en los que ha habido una reapertura del cuello del aneurisma. En otra guía se abordará de forma pormenorizada las técnicas de tratamiento de los aneurismas cerebrales.
Reposo en camaPara el Cooperative Aneurysm Study Group el reposo en cama por sí solo fue inferior que la cirugía para prevenir el resangrado en el análisis global y también fue inferior al tratamiento antihipertensivo, cirugía y ligadura carotídea en los grupos que completaron el tratamiento69. Aunque el reposo en cama, hoy en día, se contempla en todos los protocolos de HSA, debe ser combinado con otras medidas terapéuticas más eficaces en la prevención del resangrado. El paciente debe estar en una habitación tranquila, con pocas visitas, y con la cabecera a 30° para facilitar el drenaje venoso. Es importante evitar los esfuerzos que producen un aumento de la presión intracraneal (tratamiento sintomático de la tos, náuseas y vómitos, y del estreñimiento).
Tratamiento antihipertensivoEl tratamiento de la HTA para prevenir el resangrado constituye un tema controvertido. La hipotensión producida puede resultar perjudicial, especialmente si existe vasoespasmo o hipertensión endocraneal, pues disminuye la perfusión cerebral70. En un ensayo aleatorizado con agentes antihipertensivos y antifibrinolíticos, Nibbelink71 describió un mayor porcentaje de resangrado en los grupos tratados con antihipertensivos, aunque hay que tener en cuenta que el resangrado en estos pacientes estaba más en relación con la presencia de la HTA que con su tratamiento; además, este estudio fue realizado hace 20 años por lo que si se realizase hoy día con los nuevos antihipertensivos existentes, más seguros y eficaces, probablemente los resultados serían diferentes69. En un estudio observacional realizado por Wijdicks72 se vio que existía un mayor porcentaje de resangrado en los pacientes que no recibían tratamiento antihipertensivo, a pesar de presentar tensiones más bajas, comparados con los pacientes que sí recibieron tratamiento antihipertensivo, lo que señala que el resangrado puede estar más en relación con cambios bruscos de presión que con un valor específico de presión arterial. Se recomienda utilizar la analgesia precisa para el control adecuado de la cefalea y la agitación que pueda presentar el paciente para evitar elevaciones bruscas de la presión arterial. En principio, y si no hay contraindicación, se puede administrar metamizol ó paracetamol, oral o intravenoso, y si este no es suficiente se pueden emplear derivados opiáceos vigilando la posible aparición de hipotensión.
AntifibrinolíticosEn estudios publicados en años anteriores, los antifibrinolíticos se mostraban como una mala alternativa para la prevención del resangrado, por relacionarse con una alta tasa de efectos secundarios de tipo isquémico73. Estudios recientes, que emplean tandas cortas y precoces de medicación, han obtenido mejores resultados. En 2002, fue publicado un estudio aleatorizado en el que los pacientes que recibían 1 g intravenoso de ácido tranexámico en el momento del diagnóstico de la HSA, seguido de 1 g/6 h hasta la oclusión del aneurisma, asociaban significativamente menores tasas de resangrado y mejor evolución clínica74. En esta línea de actuación, un estudio prospectivo con ácido ¿-aminocaproico durante un máximo de 72 h tras el inicio del sangrado, ha observado que disminuye las cifras de resangrado sin que aparezcan complicaciones isquémicas mayores. Se observó una mayor tasa de trombosis venosa profunda, pero no de embolia pulmonar. La mortalidad fue similar con respecto al grupo placebo, pero el pronóstico mostró tendencia no significativa a la mejoría en el grupo tratado75.
VasoespasmoEsta complicación aparece por lo general entre los días 4 y 12, habiéndose dado casos de vasoespasmo hasta varias semanas después del sangrado inicial o de inicio más precoz a partir de las primeas 48 h. La presencia de vasoespasmo angiográfico se da hasta en el 66% de los pacientes, pero el vasoespasmo sintomático (isquemia cerebral diferida) ronda tan solo el 30%. Se considera esta complicación como la responsable del 20% de la morbimortalidad en las HSA, siendo la principal causa de morbimortalidad retardada. Su intensidad guarda una relación directa con la cantidad de sangre extravasada inicial. La presentación típica es la aparición de un deterioro neurológico, con o sin focalidad asociada, en un paciente sin hidrocefalia ni resangrado que los justifique y con una TC craneal basal sin alteraciones relevantes en sus fases precoces. Puede asociar fiebre y confusión. A nivel de la circulación proximal, en la región de las cisternas, en la que se sitúan las grandes arterias del polígono de Willis, el vasoespasmo es detectable por pruebas angiográficas y sonológicas, sin embargo esta complicación puede ser silente con este tipo de pruebas si afecta de forma exclusiva a la vasculatura distal, en la microcirculación, detectable en este caso por pruebas funcionales como la TC de perfusión o la RM de difusión/perfusión76.
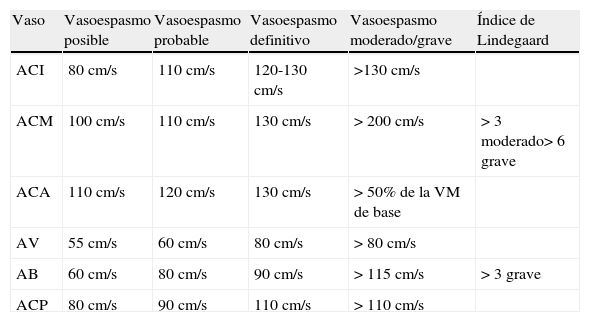
Diagnóstico del vasoespasmoDoppler transcraneal. Esta técnica no cruenta es una herramienta diagnóstica muy útil por su gran accesibilidad, teniendo en cuenta que ofrece una sensibilidad cercana a la angiografía para la detección del vasoespasmo en las grandes arterias del polígono de Willis, sobre todo para la arteria cerebral media76, siendo uso rentabilidad más limitada para la monitorización de la arteria cerebral anterior77. Se puede realizar cada 24-48h como medida de monitorización, o cuando se produzcan cambios en el estado clínico indicativos de vasoespasmo, siendo aconsejable disponer de un registro basal realizado en los primeros días. Los problemas de esta técnica son la mala ventana ecográfica que tienen hasta el 10% de los pacientes, y el hecho de que sea dependiente del explorador. La sensibilidad del Doppler transcraneal para el diagnóstico de arterias de gran calibre (vasos proximales del polígono de Willis) es elevada (en torno al 80%), el aumento de las velocidades medias permite clasificar el vasoespasmo en diferentes grados (tabla 8). Para mayor fiabilidad, se emplean los índices de Lindegaard, que comparan la velocidad de la arteria intracraneal con la de la arteria cervical, evitando diagnosticar de vasoespasmo elevaciones de la velocidad secundarias a hiperaflujo o hiperemia. Es la elevación relativa de las velocidades de las arterias intracraneales con respecto a las cervicales la que ofrece datos de vasoespasmo franco. Un índice > 3 se corresponde con la presencia de vasoespasmo angiográfico, que si asciende a 5-6, será de carácter grave.
Criterios para el diagnóstico de vasoespasmo en las diferentes arterias después de una hemorragia subaracnoidea mediante Doppler transcraneal133
| Vaso | Vasoespasmo posible | Vasoespasmo probable | Vasoespasmo definitivo | Vasoespasmo moderado/grave | Índice de Lindegaard |
| ACI | 80 cm/s | 110 cm/s | 120-130 cm/s | >130 cm/s | |
| ACM | 100 cm/s | 110 cm/s | 130 cm/s | > 200 cm/s | > 3 moderado> 6 grave |
| ACA | 110 cm/s | 120 cm/s | 130 cm/s | > 50% de la VM de base | |
| AV | 55 cm/s | 60 cm/s | 80 cm/s | > 80 cm/s | |
| AB | 60 cm/s | 80 cm/s | 90 cm/s | > 115 cm/s | > 3 grave |
| ACP | 80 cm/s | 90 cm/s | 110 cm/s | > 110 cm/s |
HSA: hemorragia subaracnoidea; AB: arteria basilar; ACA: arteria cerebral anterior; ACI: arteria carótida interna; ACM: arteria cerebral media; ACP: arteria cerebral posterior; AV: arteria vertebral.
Nota: Las cifras de velocidades de la tabla hacen referencia a la velocidad media: (VM)=[velocidad sistólica (Vs)−velocidad diastólica (Vd)] / 3+Vd.
Tomografía computarizada de perfusión. Su uso se está extendiendo de forma creciente, ya que da un diagnóstico funcional del estado circulatorio global, estimando tanto la isquemia cerebral dependiente de los grandes vasos, como la de la microcirculación. El vasoespasmo grave en esta técnica se asocia a flujos cerebrales absolutos menores de 25ml/100g/min, tiempos de tránsito medio mayores de 6,5 s o del 20% de la media, teniendo este último punto de corte un valor predictivo negativo del 98,7% en relación con la angiografía76. Otros autores identifican el retraso en el tiempo al pico como el mejor parámetro para estimar la presencia de isquemia cerebral diferida78.
Otras técnicas diagnósticas. Complementariamente a la arteriografía, que es considerada la prueba de referencia, se emplean otras técnicas diagnósticas para este cometido, como la RM multimodal con secuencias de angio-RM y de perfusión/difusión, que permitan valorar la presencia mismatch (penumbra isquémica), la saturación yugular de oxígeno y la presión tisular de oxígeno.
PrevenciónAntagonistas del calcio. El nimodipino ha demostrado mejorar el pronóstico funcional, sin que se haya observado que pueda reducir la aparición radiológica de vasoespasmo79. Este beneficio se asume que es debido a su efecto protector en la unidad neurovascular. A la inversa, el nicardipino ha demostrado reducir un 30% las cifras de vasoespasmo, sin que por contra redunde en un beneficio funcional para los pacientes80. A pesar de que en muchos centros se recurre a la administración intravenosa de nimodipino, un estudio reciente aleatorizado con 106 pacientes no ha encontrado diferencias en el pronóstico ni en las complicaciones de los pacientes, con respecto al tratamiento por vía oral. Se puede, por lo tanto, optar por la perfusión intravenosa de 0,2mg/ml a 10ml/h, o bien la terapia oral con 2 comprimidos de 30mg/4 h81. Sin embargo, un estudio piloto aleatorizado con 17 pacientes que medía las concentraciones de nimodipino en la fase aguda de pacientes con HSA, comparando la administración oral frente a la intravenosa, observó que eran más bajas en los pacientes que recibían tratamiento oral o enteral, sobre todo si presentaban una HSA grave con bajo nivel de conciencia (grado IV-V en escala de Hunt y Hess), hecho que podía interferir en la absorción adecuada del fármaco82.
Estatinas. Atendiendo a los potenciales efectos pleiotrópicos de las estatinas, que incluyen mecanismos antiinflamatorios, antiagregantes, antioxidantes y vasomotores, se han diseñado estudios para evaluar el efecto de estos agentes en la prevención del vasoespasmo y de la isquemia cerebral diferida asociados a la HSA aneurismática. El primero de ellos, que demostró resultados beneficiosos, empleó 40mg de pravastatina. Los pacientes recibieron el fármaco en una media de 1,8 días tras la instauración del sangrado y la determinación del vasoespasmo fue realizada mediante DTC. El estudio incluyó 80 pacientes y demostró que el grupo tratado presentaba una reducción significativa de la incidencia de vasoespasmo de un 32 y de un 42% en las cifras de vasoespasmo grave. Así mismo, se observó una reducción de isquemia cerebral diferida asociada al vasoespasmo del 83%, y una disminución de la mortalidad del 75%83. En trabajos posteriores sobre el mismo grupo de pacientes, se demostraron otros beneficios adicionales en los pacientes tratados con pravastatina, de tal manera que tras un análisis multivariable, presentaban menor necesidad de terapia triple-H, y mejor situación funcional al alta, hecho que se mantenía a los 6 meses84. Otros grupos de trabajo han estudiado de forma aleatorizada los efectos de 80mg de simvastatina en los pacientes con HSA aneurismática, determinando la incidencia de vasoespasmo mediante DTC y angiografía. El primero de ellos, publicado en 2005, de 39 pacientes, constataba una reducción significativa de la incidencia de vasoespasmo en el grupo tratado, así como de algunos marcadores séricos asociados a daño cerebral, como el factor de Von Willebrand, y la proteína S100β85. En el segundo ensayo, también con 39 pacientes, se demostró asimismo la seguridad de su administración, pero sin embargo, a pesar de observar una tendencia del grupo tratado a presentar menores cifras de vasoespasmo y de mortalidad, no se obtuvieron resultados estadísticamente significativos al respecto86. A pesar de la publicación de un meta-análisis en el que se recomienda el empleo de las estatinas en la HSA aneurismática87, recientemente se han dado a conocer los resultados de varios estudios que cuestionan aquellos buenos resultados. Uno de ellos es un estudio aleatorizado con 32 pacientes, empleando también una dosis diaria de 80mg de simvastatina, en el que no se han observado diferencias con respecto a placebo en cuanto a la reducción del vasoespasmo, ni de los marcadores séricos inflamatorios88. Un meta-análisis más reciente que critica la metodología del meta-análisis previo, contradice los beneficios otorgados a las estatinas89, por lo que las guías actuales están a la espera de evidencias más sólidas que apoyen su empleo generalizado. Actualmente se encuentra en marcha el estudio multicéntrico STASH con 40mg de simvastatina, que tratará de aclarar si es pertinente su indicación.
Magnesio. El magnesio también ha sido objeto de estudio como agente preventivo del vasoespasmo asociado a la HSA aneurismática en múltiples publicaciones. El preparado es a base de sulfato de magnesio, y su administración es intravenosa durante un período entre 10 y 14 días, por lo general en combinación con nimodipino. Aunque un estudio ha demostrado que su eficacia es similar a la de este último fármaco, se busca que ambos ejerzan una acción sinérgica en la prevención de la isquemia cerebral diferida90. El empleo de este fármaco se justifica en función de sus propiedades vasodilatadoras y protectoras cerebrales, las cuales residen en su efecto antagonista de los receptores de calcio, y de los receptores del N-metil-D-Aspartato (NMDA). Es necesario que los pacientes a los que se les paute permanezcan ingresados en una unidad de cuidados intensivos o intermedios, que permita monitorizar la potencial aparición de efectos adversos en forma de hipotensión e hipocalcemia91. Varios estudios aleatorizados92–94 pilotos otorgan ciertos beneficios, no corroborados posteriormente en el estudio fase III Intravenous Magnesium sulphate for Aneurysmal Subarachnoid Hemorrhage (IMASH)95. Se han comunicado muy recientemente resultados neutros del estudio MASH-II (resultados aún no publicados), cuyo objetivo es volver a evaluar si hay diferencias con la administración de magnesio intravenoso en cuanto a las cifras de discapacidad empleando la escala de Rankin modificada (eRm).
Otras sustancias estudiadas. Otros de los agentes que se están estudiando para combatir el vasoespasmo son los antagonistas del receptor de la endotelina. En el estudio Clazosentan to overcome neurological ischemia and infarction occurring after subarachnoid hemorrhage (CONSCIOUS-1), cuyo criterio principal de valoración era evaluar la eficacia del clazosentan, se demostró que este fármaco era capaz de reducir la incidencia de vasoespasmo angiográfico de forma significativa, sin que, por el contrario, se obtuvieran diferencias en la evolución funcional con respecto a placebo, que era un objetivo secundario del estudio96. Un meta-análisis sobre 3 trabajos publicados observa los mismos resultados, una capacidad de los antagonistas de la endotelina para reducir el vasoespasmo radiológico, sin que se observen diferencias en la evolución de los pacientes97. El ensayo clínico CONSCIOUS-2, realizado en pacientes con HSA sometidos a clipaje del aneurisma, las dosis de 5mg/h no han demostrado beneficios98. En el ensayo aleatorizado CONSCIOUS-3, realizado en pacientes con HSA que han recibido tratamiento embolizador, las dosis de 15mg/h de clazosentan han demostrado reducir la morbilidad asociada al vasoespasmo en la HSA, pero sin influir en el pronóstico funcional99. En cuanto a los agentes antioxidantes, numerosos antirradicales libres o scavengers han sido estudiados para evaluar sus efectos en la prevención del vasoespasmo. Entre ellos destacan el tirilazad y el nicaraven. Un par de meta-análisis que revisan los resultados obtenidos con el tirilazad, un aminoesteroide que reduce la peroxidación lipídica, determinan que es capaz de disminuir la incidencia de vasoespasmo sintomático, sin que esto mejore la evolución de los pacientes100,101. Recientemente, se ha llevado a cabo un estudio aleatorizado con edavarone, un fármaco neuroprotector disponible en otros países, en el que se observa una tendencia no significativa en la capacidad de este fármaco a disminuir la incidencia de isquemia cerebral diferida y de mal pronóstico102. La eritropoyetina es otra de las sustancias objeto de ensayo en los últimos años, dados sus potenciales efectos neuroprotectores y potenciadores de la autorregulación en la unidad neurovascular. Un estudio piloto aleatorizado fase II con 80 pacientes que habían presentado una HSA aneurismática ha demostrado que el grupo tratado con eritropoyetina intravenosa en fase aguda presentaba menores tasas de vasoespasmo grave y de isquemia cerebral diferida103. El hidrocloruro de fasudil, un vasodilatador que ejerce su acción mediante la inhibición de la proteincinasa, ha sido evaluado en un estudio aleatorizado con 72 pacientes que empleaba el nimodipino como grupo control. Sus resultados observan una similar capacidad para la prevención del vasoespasmo con respecto al antagonista del calcio, y una mayor capacidad para mejorar el déficit motor104. Se ha observado en otros trabajos que este fármaco puede ser también eficaz administrado vía intraarterial para el tratamiento del vasoespasmo establecido105. La metilprednisolona en dosis de 16mg/kg, administrada por vía intravenosa dentro de las 6 h tras el diagnóstico de rotura aneurismática, ha demostrado en un estudio aleatorizado con 96 pacientes mejorar el pronóstico funcional del grupo tratado, a pesar de no influir en la incidencia de vasoespasmo106. El ácido acetilsalicílico ha sido estudiado con el objeto de combatir los potenciales mecanismos tromboembólicos relacionados con la isquemia cerebral diferida. En algunos trabajos ofrecía resultados prometedores, como fármaco capaz de reducir la incidencia de isquemia cerebral diferida, pero el estudio aleatorizado MASH, cuyo objetivo era corroborar su eficacia, no encontró diferencias significativas en los pacientes tratados con respecto al placebo107. En una revisión Cochrane sobre el empleo de antiagregantes se llegaba a conclusiones similares108. El cilostazol, un agente con propiedades antiagregantes y vasodilatadoras, que ejerce su acción mediante la inhibición selectiva de la fosfodiesterasa III elevando los niveles de monofosfato de adenosina cíclico (AMP), ha demostrado en un ensayo prospectivo aleatorizado mejorar el pronóstico de los pacientes con HSA espontánea109. De igual manera, se han estudiado otros antitrombóticos, caso de las heparinas de bajo peso molecular. Un estudio aleatorizado con 120 pacientes ha observado resultados beneficiosos, concretamente con 20mg de enoxaparina administrados en los primeros 3 días desde el inicio del sangrado, y posteriormente durante 3 semanas. El grupo tratado tuvo menores cifras de vasoespasmo e hidrocefalia, así como un mejor pronóstico110. Otras medidas investigadas para disminuir las tasas de vasoespasmo se basan en terapias combinadas médico-quirúrgicas. La irrigación intracisternal de dosis bajas de fibrinolíticos para el depurado del sangrado en los pacientes con HSA que han recibido clipaje del aneurisma es una de las vías de tratamiento estudiadas para evitar la aparición de vasoespamo. Un estudio aleatorizado con tisocinasa, un activador tisular del plasminógeno, en 60 pacientes, ha demostrado disminuir la incidencia de vasoespasmo y mejorar el pronóstico funcional de los pacientes tratados111. Otro estudio aleatorizado a doble ciego con 32 pacientes ha comprobado que, en los pacientes con HSA grave a los que se les colocan implantes de liberación prolongada de nicardipino en la vecindad de las cisternas basales en el momento del clipaje quirúrgico, presentan una menor incidencia de vasoespasmo angiográfico (7 frente a 73% en controles) y de isquemia cerebral diferida en TC craneal (14 frente a 47%). De igual manera, se observan con esta modalidad terapéutica una mejor evolución funcional medida con la escala de Rankin modificada, mejor situación clínica en función de la escala NIHSS, y una menor mortalidad (38 frente a 6%)112. Sin embargo, a pesar esta serie de beneficios referidos, en un nuevo estudio de los mismos autores en el que se analizó la calidad de vida de los pacientes un año después de la HSA, no se apreció que esta fuera mejor en el grupo tratado, estando más relacionada con la gravedad de la propia hemorragia113.
Tratamiento del vasoespasmo establecidoPara el tratamiento del vasoespasmo establecido es esencial la exclusión de la circulación lo más precozmente posible del aneurisma, para con ello evitar el riesgo de resangrado, por si hemos de incrementar la volemia y la presión arterial del paciente. A pesar de que tradicionalmente se ha recurrido a la terapia triple «H» (hipervolemia, HTA y hemodilución) como primera línea de terapia cuando el vasoespasmo está ya instaurado y es sintomático, su eficacia no ha sido demostrada en ensayos controlados, lo que impide recomendar su empleo de forma generalizada en los pacientes con HSA. Actualmente es considerada una alternativa terapéutica razonable. El objetivo en la HSA es evitar una situación de hipovolemia, buscando un estado de normovolemia con un balance de líquidos neutro, debido a que el forzar la hipervolemia se asocia a efectos indeseables en forma de sobrecarga cardíaca o edema pulmonar, entre otros. Además, la terapia triple «H» tiene el riesgo de provocar el resangrado del aneurisma de no estar este cerrado. Para producir hipervolemia o normovolemia, se pueden emplear bolos de salino a dosis de 15ml/kg en 1 h. Las soluciones coloides sintéticas y las transfusiones sanguíneas, a diferencia de las soluciones cristaloides, se pueden asociar a peor pronóstico funcional en los pacientes con HSA114. Para inducir HTA se pueden emplear vasopresores como la dopamina y la dobutamina; la vasopresina no es recomendable, por el riesgo de desencadenar hiponatremia. La hemodilución no ha mostrado eficacia en el tratamiento del vasoespasmo115. En caso de coexistencia de otro aneurisma cerebral no roto, deberían usarse con precaución las medidas de hipertensión e hipervolemia. Si el paciente es resistente a estas medidas, o presenta algún criterio que las contraindique (edema cerebral, infarto cerebral establecido, edema pulmonar, hemoglobina < 10, hipertensión intracraneal, cardiopatía isquémica, aneurisma no excluido), se puede recurrir al intervencionismo neurovascular mediante la infusión de sustancias vasodilatadores locales como el nimodipino intraarterial o el verapamilo, o directamente con angioplastia (más efectiva y duradera, pero que conlleva un 5% de riesgo de rotura de la arteria). La papaverina, otro vasodilatador local que se aplicaba antiguamente, ha caído en desuso por los efectos secundarios que produce en forma de hipertensión intracraneal. Una de las limitaciones para que la terapia hipervolémica actúe eficazmente es que se desarrolle un síndrome perdedor de sal con la consiguiente hiponatremia. La depleción hídrica osmótica por la excesiva natriuresis es un factor de riesgo para la complicación del vasoespasmo. Un estudio aleatorizado con 72 pacientes ha observado cómo el empleo de hidrocortisona es capaz de mantener las cifras de natremia, y observa también una tendencia no significativa en cuanto a la reducción de las cifras de vasoespasmo y el pronóstico de los pacientes tratados116. También un par de estudios aleatorizados han observado que la fludrocortisona consigue prevenir la hiponatremia al disminuir la natriuresis117,118. La milrinona, un inhibidor de la fosfodiesterasa III con efecto inotrópico positivo, administrada por vía intravenosa, se perfila como un fármaco seguro para el tratamiento del vasoespasmo119,120.
HidrocefaliaEl desarrollo de hidrocefalia es una complicación precoz, que se puede instaurar desde las primeras horas. La hidrocefalia sintomática afecta al 20% de los pacientes. Se consideran factores de riesgo para su desarrollo la demora en el ingreso y el inicio de tratamiento, y la mala situación neurológica al ingreso (puntuación en la escala de Hunt y Hess: 3-5). Cuando la hidrocefalia se manifiesta clínicamente con alteración del nivel de conciencia, se puede recurrir a diversas medidas para su tratamiento como la colocación de un drenaje ventricular transitorio o una válvula de derivación ventriculoperitoneal o ventriculoauricular permanente. Este tipo de técnicas aumentan el riesgo de ventriculitis y de resangrado. Un ensayo aleatorizado con 84 pacientes ha observado menores tasas de hidrocefalia en los pacientes en los que se realiza un drenaje precoz de líquido cefalorraquídeo (LCR) en la fase aguda, en el momento que se emboliza el aneurisma121. A veces se recurre a punciones lumbares repetidas, preferiblemente con el aneurisma responsable ya tratado, para evitar también el riesgo de resangrado. Excepcionalmente, también con el aneurisma excluido de la circulación, se puede recurrir a la fibrinólisis intraventricular en hidrocefalias resistentes que presenten escaso drenaje debido a la obstrucción del catéter por material hemático122.
Crisis epilépticasA día de hoy, no hay estudios que hayan demostrado los beneficios del tratamiento anticomicial profiláctico en los pacientes con HSA aneurismática. De hecho, un trabajo ha observado que esta terapia se relaciona con peor pronóstico funcional y mayor tasa de complicaciones intrahospitalarias123. Otro estudio que comparó aleatorizadamente el empleo de fenitoína con el de leviteracetam observó que a igualdad en la capacidad para prevenir la aparición de crisis, los pacientes tratados con leviteracetam presentaban un mejor pronóstico funcional124. Otras guías recientes consideran que la administración profiláctica de anticomiciales puede ser considerada en el período posthemorrágico precoz44.
Otras complicacionesEn cuanto a la hipertensión intracraneal, el suero salino hipertónico al 7,2% con hidroxietilo ha demostrado en un estudio aleatorizado, que incluía 22 pacientes con HSA en ventilación mecánica, ser capaz de reducir las cifras de presión intracraneal y mejorar la presión de perfusión cerebral con respecto al placebo125. Esto ha sido refrendado por otros grupos de trabajo, que comparan esta solución hiperosmolar frente a soluciones de manitol al 15% y de suero salino al 10%126. Aproximadamente un cuarto de los pacientes con HSA aneurismática van a presentar una complicación en forma de infarto cerebral. La presencia de este se asocia a peor evolución clínica, y los factores de riesgo que se han relacionado con su aparición son la edad avanzada, la mala situación clínica al ingreso, la HTA, la diabetes, los aneurismas de mayor tamaño, la inducción de hipertensión profiláctica o terapéutica, la temperatura mayor de 38°C a los 8 días del sangrado y el vasoespasmo sintomático. Este último constituye el factor de riesgo más importante, potencialmente tratable127. En la HSA, como en el resto de los ictus, el estrés en el que entra el organismo con el evento vascular agudo genera una liberación de catecolaminas que fomentan un estado de hiperglucemia128. Además, la tendencia a las cifras elevadas de glucosa se prolonga durante los siguientes días, y su presencia aumenta la frecuencia del vasoespasmo, lo cual ensombrece el pronóstico del paciente129. Las modalidades de control glucémico estricto con terapia insulínica intensiva no han demostrado mejorar las cifras de vasoespasmo ni la evolución final de los enfermos. Se recomienda mantener unas cifras de normoglucemia y evitar tanto la hiperglucemia como la hipoglucemia, pues las cifras anormales de glucosa se asocian a peor curso clínico44,130. A pesar de que la utilización de heparinas de bajo peso molecular disminuye el riesgo de complicaciones tromboembólicas en pacientes con hemorragia intracerebral parenquimatosa sin incrementar el riesgo de sangrado131, en el caso de la HSA aneurismática no se han encontrado claros beneficios con el uso de heparina de bajo peso molecular para la prevención de la trombosis venosa profunda. Datos obtenidos de registros prospectivos de pacientes con HSA aneurismática señalan que las cifras elevadas de hemoglobina se asocian con un mejor pronóstico evolutivo. La transfusión de concentrados de hematíes para tratar la anemia debe pues ser considerada en aquellos pacientes con riesgo de desarrollar isquemia cerebral diferida, sin que se haya aún determinado una cifra óptima de hemoglobina66. Entre las complicaciones cardíacas que podemos encontrar en los pacientes con HSA destacan las arritmias, el infarto agudo de miocardio y el síndrome de Tako-Tsubo. La liberación de catecolaminas por el aumento del tono simpático que acontece en la HSA es susceptible de ocasionar alteraciones miocárdicas. Un meta-análisis, que incluye 25 estudios y 2.930 pacientes, concluye que la elevación de la troponina I, de la creatincinasa MB, y del péptido natriurético cerebral, junto con la presencia de taquicardia, descenso del segmento ST, alteraciones de la onda T y las alteraciones de la contractilidad se asocian significativamente a mayor mortalidad, peor evolución clínica o a mayor frecuencia de isquemia cerebral diferida132.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Comitéad hocdel Grupo de Estudio de Enfermedades Cerebrovasculares (GEECV) de la SEN para la redacción de las Guías de actuación clínica en el ictus.
Coordinador: Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid.
A.1. Comisión de Redacción
Exuperio Díez-Tejedor (Coordinador), Hospital Universitario La Paz, Madrid; Blanca Fuentes (Secretaría), Hospital Universitario La Paz, Madrid; María Alonso de Leciñana, Hospital Universitario Ramón y Cajal, Madrid; José Álvarez-Sabin, Hospital Universitario Vall d’Hebron, Barcelona; Juan Arenillas, Hospital Universitario Clínico de Valladolid; Sergio Calleja, Hospital Universitario Central de Asturias, Oviedo; Ignacio Casado, Hospital San Pedro, Cáceres; Mar Castellanos, Hospital Josep Trueta, Gerona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Antonio Dávalos, Hospital Universitario German Trias i Pujol, Badalona; Fernando Díaz-Otero, Hospital Universitario Gregorio Marañón, Madrid; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; José Antonio Egido, Hospital Clínico Universitario San Carlos, Madrid; Juan Carlos López Fernández, Hospital Universitario Dr. Negrín, Las Palmas; Mar Freijo, Hospital Universitario de Basurto, Bilbao; Blanca Fuentes, Hospital Universitario La Paz, Madrid; Jaime Gállego, Hospital General de Navarra, Pamplona; Andrés García Pastor, Hospital Universitario Gregorio Marañón, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; Francisco Gilo, Hospital Universitario La Princesa, Madrid; Pablo Irimia, Clínica Universitaria de Navarra, Pamplona; Aida Lago, Hospital Universitario La Fe, Valencia; José Maestre, Hospital Universitario Virgen de las Nieves, Granada; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Joan Martí-Fábregas, Hospital de la Santa Cruz y San Pablo, Barcelona; Patricia Martínez-Sánchez, Hospital Universitario La Paz, Madrid; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Carlos Molina, Hospital Universitario Vall d’Hebron, Barcelona; Ana Morales, Hospital Universitario Virgen de la Arrixaca, Murcia; Florentino Nombela, Hospital Universitario La Princesa, Madrid; Francisco Purroy, Hospital Universitario Arnau de Vilanova, Lérida; Marc Ribó, Hospital Universitario Vall d’Hebron, Barcelona; Manuel Rodríguez-Yáñez, Hospital Clínico Universitario, Santiago de Compostela; Jaime Roquer, Hospital del Mar, Barcelona; Francisco Rubio, Hospital Universitario de Bellvitge, Barcelona; Tomás Segura, Hospital Universitario de Albacete, Albacete; Joaquín Serena, Hospital Joseph Trueta, Gerona; Patricia Simal, Hospital Clínico Universitario San Carlos, Madrid; Javier Tejada, Hospital Universitario de León, León; José Vivancos, Hospital Universitario La Princesa, Madrid.
A.2. Comisión de Revisión o Institucional
José Álvarez-Sabín, Hospital Universitario Vall d’Hebron, Barcelona; José Castillo, Hospital Clínico Universitario, Santiago de Compostela; Exuperio Díez-Tejedor, Hospital Universitario La Paz, Madrid; Antonio Gil-Núñez, Hospital Universitario Gregorio Marañón, Madrid; José Larracoechea, Hospital de Cruces, Bilbao; Eduardo Martínez-Vila, Clínica Universitaria de Navarra, Pamplona; Jaime Masjuan, Hospital Universitario Ramón y Cajal, Madrid; Jorge Matías-Guiu, Hospital Clínico Universitario San Carlos, Madrid; Francisco Rubio, Hospital de Bellvitge, Barcelona.
A.3. Otros colaboradores
Elisa Correas Callero, Servicio de Neurología, Hospital Universitario La Paz, Madrid; Remedios Frutos, Servicio de Radiología, Hospital Universitario La Paz, Madrid; Fernando Quintana, Servicio de Radiología, Hospital Universitario Marqués de Valdecilla, Santander; José María Roda, Servicio de Neurocirugía, Hospital Universitario La Paz, Madrid; Álvaro Ximénez-Carrillo, Servicio de Neurología, Hospital Universitario La Princesa, Madrid.
Las filiaciones de los autores y la composición del Comité ad hoc del Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología se relacionan en el addendum.