El objetivo del estudio fue analizar y comparar la capacidad de la procalcitonina (PCT) y proteína C reactiva (PCR) para detectar meningitis bacteriana (MB) y para predecir la existencia de bacteriemia.
MétodosEstudio observacional, prospectivo, descriptivo y analítico de pacientes adultos (≥ 15 años) diagnosticados de meningitis aguda (MA) en un servicio de urgencias (SU) desde agosto de 2009 hasta julio de 2013.
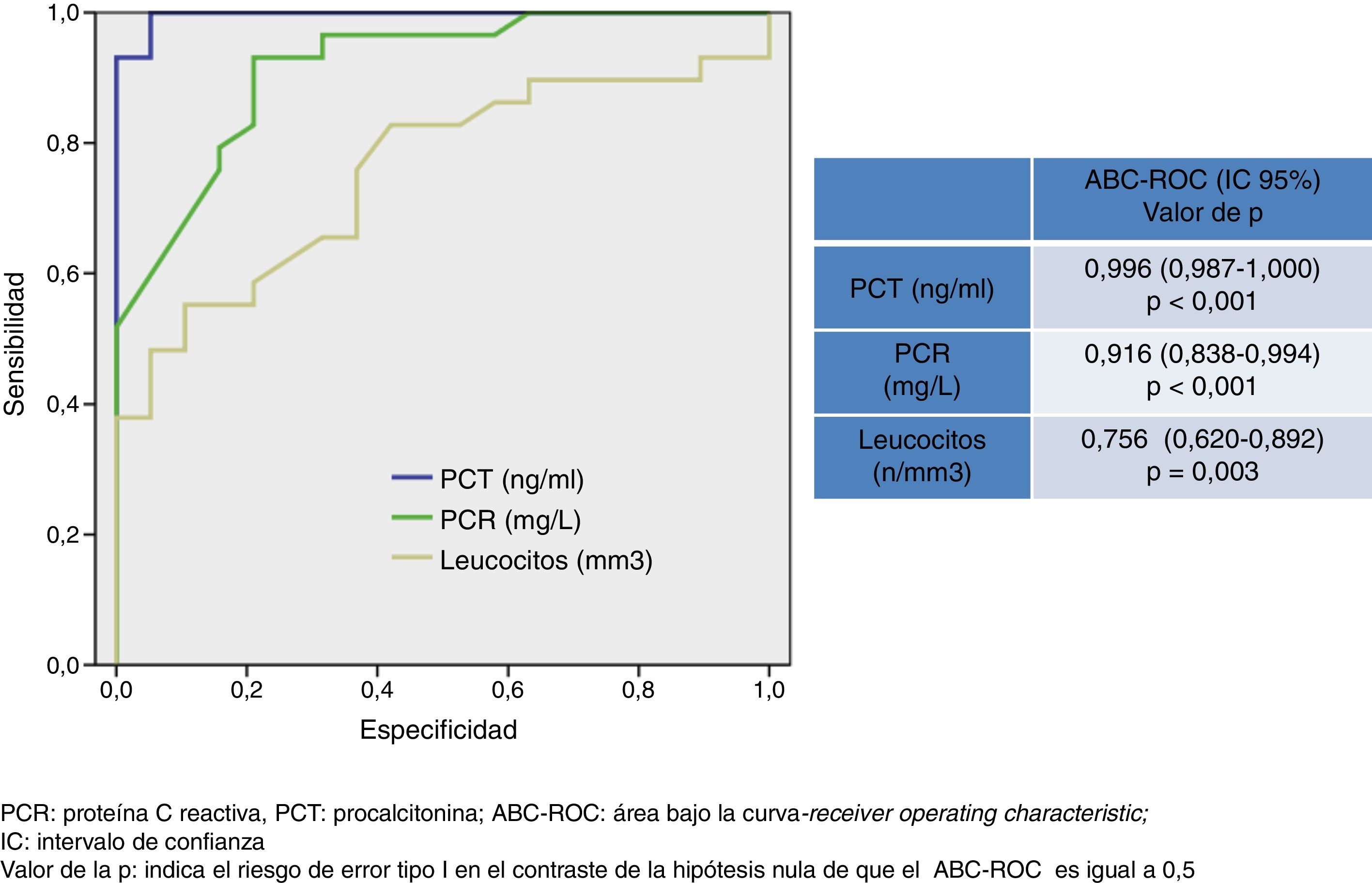
ResultadosSe incluyeron 98 casos diagnosticados de MA con una edad media de 44±21 años, el 67% varones (66). De ellos 38 fueron MB (20 con bacteriemia), 33 meningitis virales (MV), 15 probable MV y 12 posibles MA decapitadas. La PCT obtiene la mayor área bajo la curva ROC (ABC-ROC), de 0,996 (IC 95%:0,987-1, p<0,001) y con un punto de corte ≥ 0,74 ng/ml se consigue una sensibilidad del 94,7%, especificidad del 100%, un VPN de 93,9% y un VPP del 100%. Los valores medios al comparar la PCT en MB y MV fueron 11,47±7,76 vs. 0,10±0,15 ng/ml, p<0,001. La PCR consigue un ABC-ROC de 0,916 y con punto de corte ≥ 90 mg/L una sensibilidad de 67,5%, especificidad de 86,3%, VPP 89,2% y VPN: 90,4%.
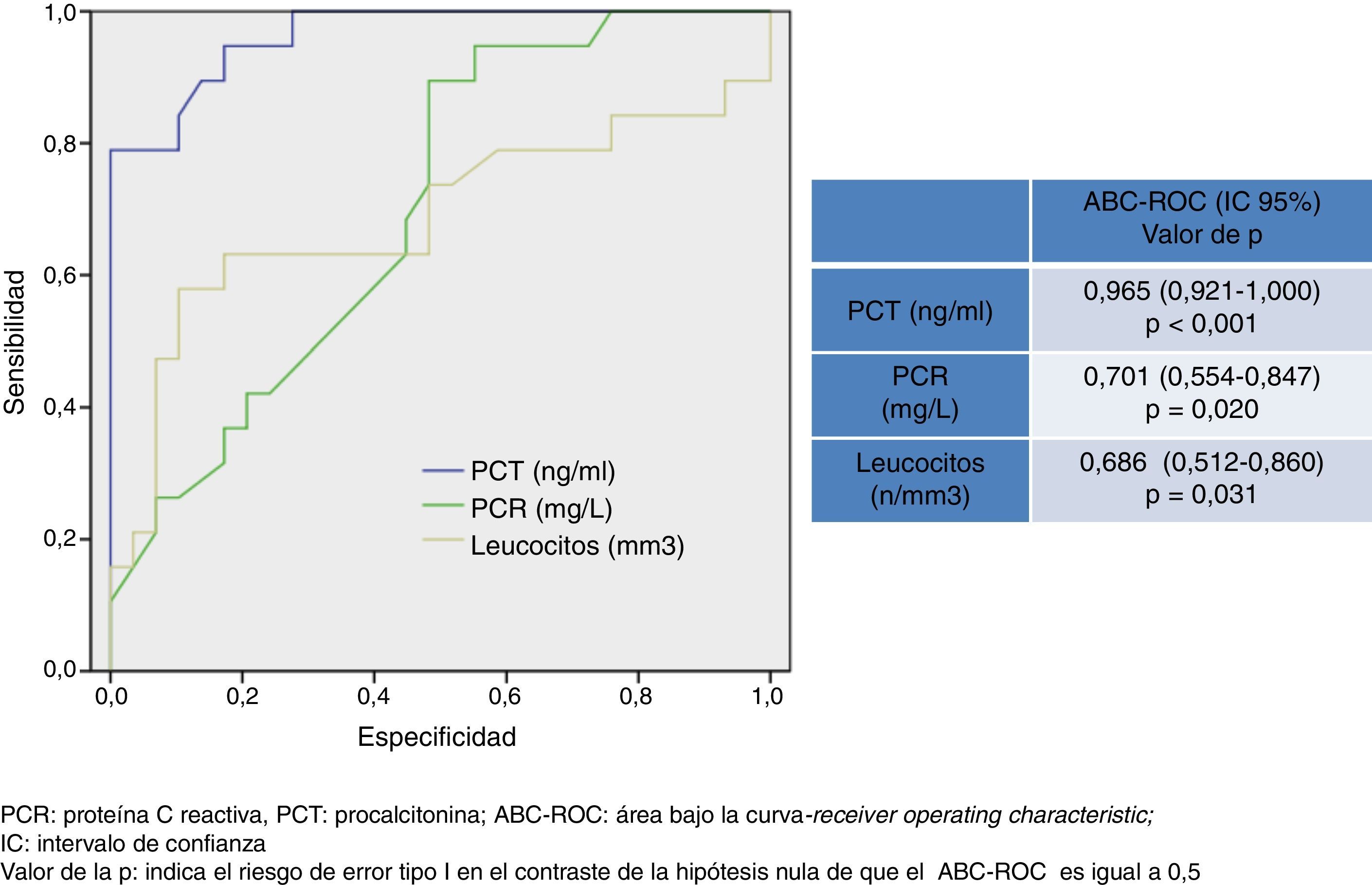
Para la predicción de bacteriemia en las MB solo la PCT consigue diferencias significativas (14,7±7,1 vs. 4,68±3,54 ng/ml, p<0,001) y con un PC de 1,1 ng/ml una sensibilidad de 94,6%, especificidad 72,4%, VPN 95,4% y VPP 69,2% y un ABC de 0,965 (IC 95%: 0,921-1, p<0,001).
ConclusionesEn los pacientes con MA en SU la PCT consigue un gran rendimiento diagnóstico para sospechar la etiología bacteriana, mayor que la PCR, y para predecir la existencia de bacteriemia en las MB.
The aim of this study was to analyse and compare procalcitonin (PCT) and C-reactive protein (CRP) as tools for detecting bacterial meningitis and predicting bacteraemia.
MethodsProspective, observational, and descriptive analytical study of 98 consecutive patients aged ≥15 years and diagnosed with acute meningitis in an emergency department between August 2009 and July 2013.
ResultsWe analysed 98 patients with AM (66 males [67%]); mean age was 44±21 years. The diagnosis was bacterial meningitis in 38 patients (20 with bacteraemia); viral meningitis in 33; probable viral meningitis in 15; and presumptively diagnosed partially treated acute meningitis in 12. PCT had the highest area under the ROC curve (AUC) (0.996; 95% CI, 0.987-1; p<0.001). With a cutoff of ≥ 0.74 ng/ml, PCT achieved 94.7% sensitivity, 100% specificity, negative predictive value (NPV) of 93.9%, and positive predictive value (PPV) of 100%. The mean levels for PCT were11.47±7.76 ng/ml in bacterial meningitis vs. 0.10±0.15 ng/ml in viral meningitis (p <0.001). The AUC for CRP was 0.916 and a cutoff of ≥ 90 mg/L achieved 67.5% sensitivity, 86.3% specificity, PPV of 89.2%, and NPV of 90.4%.
As a predictor of bacteraemia in bacterial meningitis, only PCT delivered a significant difference (14.7±7.1 ng/mL vs. 4.68±3.54 ng/mL, p<0.001). A cutoff of ≥ 1.1 ng/mL achieved 94.6% sensitivity, 72.4% specificity, NPV of 95.4%, and PPV of 69.2%; the AUC was 0.965 (95% CI, 0.921-1; p<0.001).
ConclusionsPCT has a high diagnostic power for acute meningitis in emergency department patients. PCT outperforms CRP in the detection of bacterial aetiology and is a good predictor of bacteraemia in bacterial meningitis.
La meningitis bacteriana (MB) es un proceso inflamatorio de las leptomeninges que cursa con hallazgos típicos en el líquido cefalorraquídeo (LCR): intensa pleocitosis (>500-1.000 leucocitos/mm3) con predominio de polimorfonucleares junto con aumento de proteinorraquia y disminución de glucorraquia1. La MB no representa ninguno de los diez procesos infecciosos más frecuentes atendidos en pacientes adultos en los servicios de urgencias (SU), ni siquiera entre los que precisan ingreso y administración de antimicrobianos2, ni tampoco es una de las diez causas más frecuentes de consulta desde el SU con el especialista de neurología3, pero sí supone el tipo de infección que con mayor frecuencia cumple criterios de sepsis, sepsis grave y shock séptico en los SU (reflejo de su gravedad e importancia clínica)2,4. Además sus complicaciones y la mortalidad, incluso en el propio SU o en las primeras 24 horas de estancia hospitalaria, continúan siendo importantes proporcionalmente en relación con su incidencia, aunque en números absolutos tampoco se sitúe entre las diez primeras causas de fallecimiento en el SU5. De ahí la trascendencia de la sospecha y confirmación de un posible origen bacteriano en una meningitis aguda (MA), hecho que continúa siendo un reto hasta que los cultivos y técnicas de confirmación microbiológica nos determinan su origen, viral o bacteriano6. La etiología de la MB varía con la edad. En pacientes jóvenes y adultos Streptococcus pneumoniae (S. pneumoniae) y Neisseria meningitidis (N. meningitidis) B son los patógenos más frecuentemente aislados a los que se suman a partir de los 50-65 años Listeria monocytogenes (L. monocytogenes), Haemophilus influenzae (H. influenzae) y bacilos gramnegativos1,6.
Por otro lado, las manifestaciones clínicas son más inespecíficas cuanto mayor es la edad del paciente, en inmunodeprimidos, en diabéticos y en otros enfermos especialmente susceptibles de padecer infecciones graves, en los cuales los signos y síntomas habituales no proporcionan una sensibilidad ni especificidad óptimas para distinguir una posible MB de una meningitis viral (MV)1. Por ello se justifica el interés de disponer desde el SU de herramientas útiles e inmediatas para sospechar y distinguir los casos de MB de los de MV6. En este sentido los biomarcadores de infección e inflamación (BMIeI) han demostrado su utilidad desde hace más de una década7–12. Incluso para reducir la administración inadecuada de antimicrobianos en el SU y por lo tanto los posibles efectos adversos y las consecuencias de los mismos13. En los últimos años se han publicado múltiples estudios y revisiones en relación con la utilidad de los BMIeI, sobre todo para distinguir las causas infecciosas de otros orígenes de la fiebre o para filiar la existencia de sepsis, sepsis grave o shock séptico7,9,14. Pero pocos de ellos fueron orientados específicamente para distinguir entre MB y MV en adultos. Además, la mayoría de estos analizaron una muestra limitada o utilizaron técnicas semicuantitativas para los BMIeI11,12,14–17, menos sensibles que las disponibles en la actualidad7.
La determinación de la proteína C reactiva (PCR) como respuesta a la inflamación e infección bacteriana en la MB resulta menos sensible y específica que la de procalcitonina (PCT), además su cinética es menos apropiada ya que puede tardar hasta 12-24 horas en elevarse tras la agresión bacteriana y mantener sus niveles incluso días después de la curación9. Así se considera que la PCT es el BMIeI analizado en sangre más apropiado para diferenciar MB de MV7–12,14–17.
Los objetivos del estudio fueron determinar la capacidad y el poder diagnóstico de la PCT para detectar MB, para pronosticar la existencia de bacteriemia y hallar un punto de corte (PC) seguro para descartarlas, y así poder orientar las decisiones a tomar en el SU (ingreso, administración de antibióticos, extracción de hemocultivos y otras pruebas microbiológicas)4.
Pacientes y métodosDiseñoSe elaboró un estudio observacional, prospectivo, descriptivo y analítico de pacientes diagnosticados de meningitis aguda (MA) en el SU. Se mantuvo un seguimiento de los mismos durante todo su ingreso o hasta su fallecimiento o hasta los 30 días si el alta hospitalaria tuvo lugar antes.
Sitio del estudioSe realizó en el Complejo Hospitalario de Toledo, un centro de tercer nivel de 786 camas con un área de referencia de unas 437.000 personas. Durante el periodo que duró el estudio se atendieron de media unas 435 urgencias/día.
Periodos del estudio y población estudiadaDesde agosto de 2009 hasta julio de 2013 se incluyeron de forma consecutiva los pacientes adultos (≥15 años) diagnosticados de MA en el SU a los que se les realizó punción lumbar, extrajeron hemocultivos y muestras para analítica en la que se analizaron BMIeI (PCR y PCT).
Dentro de los casos registrados se consideraron varios grupos: 1. MB ante el aislamiento del patógeno o sus antígenos capsulares en el LCR (en este caso además se comprobó la existencia concomitante o no de bacteriemia), 2. MV cuando se confirmó por amplificación de reacción en cadena de la polimerasa para virus de las familias herpes (ADN) y enterovirus (ARN) en el LCR, 3. probable MV, con cultivo bacteriano negativo tanto en el LCR como en hemocultivo, 4. posible MA decapitada cuando existió antecedente de toma de antibióticos en las 72 horas previas y los cultivos de LCR y hemocultivos fueron negativos.
No se incluyeron pacientes con sospecha de otro posible foco bacteriano primario, para evitar falsos positivos de los BMIeI9, ni a los pacientes que fueron diagnosticados de un segundo caso de MA durante el periodo del estudio o de meningitis tuberculosa o autoinmune durante el seguimiento.
El estudio cumplía las normas éticas de nuestro hospital. Todos los datos codificados se manejaron con confidencialidad y con el único conocimiento del equipo investigador. El seguimiento de todos los pacientes se realizó a través de la historia clínica informatizada hospitalaria y de atención primaria. El estudio no supuso ninguna intervención terapéutica ni tuvo ninguna implicación clínica.
Variables recogidasSe registraron variables sociodemográficas (edad, sexo) y comorbilidades (existencia de enfermedad tumoral sólida u oncohematológica, hepatopatía, cardiaca crónica, nefropatía, cerebrovascular, diabetes), infección por el virus de la inmunodeficiencia humana, estado de inmunodepresión (pacientes con trasplante de órgano sólido, esplenectomía, tratados con 10mg o más de prednisona al día o equivalentes durante más de 30 días, o tratados con otros agentes inmunosupresores en el último año). Se calculó el índice de Charlson original y el ponderado por la edad18. Se recogieron variables clínicas (fiebre ≥38°C de temperatura, hipotermia <35°C, confusión o alteración del nivel o contenido de la conciencia, cefalea, rigidez de nuca, signos de irritación meníngea –Kernig y Brudzinski–) y de gravedad incluidas en los criterios de definición de sepsis, sepsis grave y shock séptico según la conferencia internacional de expertos de sepsis de 200119. A estas variables se añadieron la toma de tratamiento antibiótico en las 72 horas previas y el tiempo desde el inicio de la sintomatología hasta la consulta en el SU, el tiempo de estancia hospitalaria y la mortalidad durante el ingreso y hasta los 30 días desde el diagnóstico. Los estudios microbiológicos realizados fueron hemocultivos, cultivo de LCR y detección por amplificación de reacción en cadena de la polimerasa de ADN (familias herpes) y ARN (familia enterovirus). Finalmente como variables analíticas además del hemograma, estudio de coagulación, y bioquímica básica se analizaron las concentraciones en suero de PCR y PCT.
Definiciones, técnicas y métodos establecidos para las muestras. Se adoptaron los valores de referencia normales de nuestro laboratorio: PCR: 0-8 mg/L y PCT<0,5 ng/ml. La PCR se determinó por inmunoanálisis enzimático cuantitativo (Slides VITROS CRP®) con una sensibilidad de 1 mg/L. Y la PCT por inmunoanálisis cuantitativo de electroquimioluminiscencia (ELECSYS BRAHMS PCT®) con una sensibilidad de 0,02 ng/ml.
Para el estudio del LCR se consideró este como normal ante la existencia de menos de 10 leucocitos/mm3, glucorraquia entre el 60-80% del valor de glucosa en suero y proteinorraquia de 15-45 mg/dl. Cuando el LCR fue patológico se definió un perfil bacteriano (con aumento de células con predominio de polimorfonucleares y de la proteinorraquia y con disminución de glucorraquia) y un perfil linfocitario (con predominio de mononucleares con glucorraquia normal o disminuida).
Análisis estadístico. Se utilizaron medias y sus desviaciones estándar, rangos, medianas y porcentajes, según procediera, para describir las características demográficas, comorbilidades, clínicas y de evolución. Además, para la estimación de los valores poblacionales se calcularon los límites de los intervalos de confianza (IC) al 95% de medias y porcentajes (binomiales exactos, en este caso).
Para la comparación de la distribución de los biomarcadores y recuento de leucocitos entre los subgrupos establecidos (MB, MV, probable MV y posible MA decapitada), según patógeno causal y para la presencia o ausencia de bacteriemia, de sepsis, sepsis grave o shock séptico, variables clínicas y de evolución se utilizaron las pruebas de ji al cuadrado o exacta de Fisher, la t de Student y la U de Mann-Whitney, según fueran aplicables. Se consideró como significativo un valor de p<0,05 y todos los contrastes fueron bilaterales. Se utilizó el programa IMB-SPSS® Statistics 19 para Windows.
La eficacia y capacidad de la PCT, PCR y recuento de leucocitos para el diagnóstico de MB y de bacteriemia se estudió mediante el análisis de las curvas Receiver Operating Characteristic (ROC). Así, para la estimación del rendimiento diagnóstico poblacional se calculó el IC 95% del área bajo la curva (ABC) de la curva ROC (ABC-ROC) de cada marcador y se comparó frente al valor neutro (0,5). Los errores estándar de las ABC se calcularon por métodos no paramétricos.
Se determinaron los puntos de corte en los valores de los BMRII con mayor capacidad diagnóstica que maximizaba la diferencia entre la tasa de verdaderos positivos y falsos positivos mediante el índice de Youden. Se halló la sensibilidad, la especificidad, el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) para los resultados estudiados así como sus IC 95% por métodos binomiales exactos.
ResultadosDurante el periodo de estudio se incluyeron 98 casos diagnosticados de MA con una edad media de 44±21 años, el 67% varones (66 casos). De ellos 38 fueron MB (18 casos por S. pneumoniae, 7 casos por N. meningitidis, 7 por L. monocytogenes, 4 por H. influenzae y 2 por Escherichia coli[E.coli]), 33 MV (30 casos por enterovirus y 3 por herpes simplex), 15 clasificados como «probable MV» con cultivos negativos y 12 «posibles MA decapitadas» (con antecedente de toma de antibióticos y cultivos negativos).
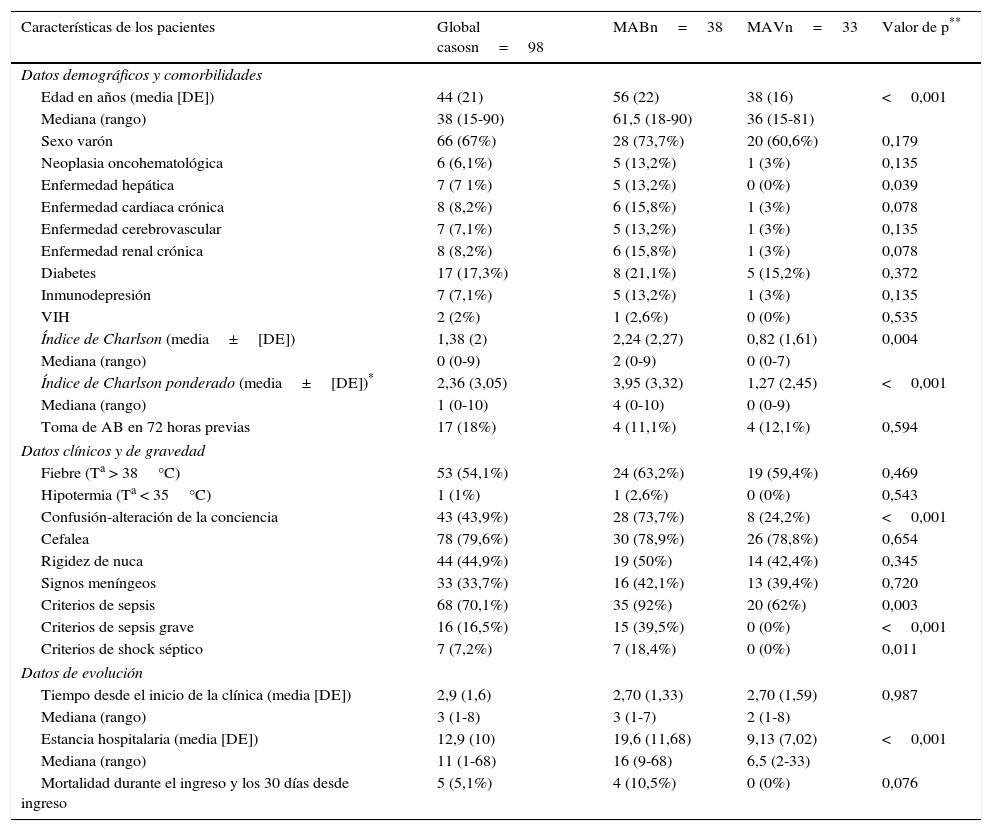
En la tabla 1 se muestran las características sociodemográficas, comorbilidades, cálculo del índice de Charlson, datos clínicos, de gravedad y de evolución de todos los pacientes y la comparación entre los subgrupos de MB y MA. Se encontraron diferencias significativas entre ambos subgrupos en la edad (56±22 vs. 38±16 años, p<0,001), la existencia de hepatopatía crónica (13,2% vs. 0%, p=0,039) y el índice de Charlson (2,2±2,2 vs. 0,8±1,6, p=0,004), que fueron mayores en las MB. En la presentación clínica hubo mayor incidencia de confusión o alteración de la conciencia en las MB (73,7% vs. 24,2%, p<0,001) pero no se obtuvieron diferencias significativas al comparar la existencia de fiebre, cefalea, rigidez de nuca o signos de irritación meníngea. Tampoco existieron diferencias en cuanto a la toma previa de antimicrobianos ni el tiempo de evolución de la sintomatología hasta acudir al SU. Por otro lado sí hubo diferencias en cuanto a la frecuencia de casos con criterios de sepsis (92 vs. 62%, p=0,003), sepsis grave (39,5 vs. 0%, p<0,001) y shock séptico (7 vs. 0%, p=0,011). También los casos de MB registraron mayor estancia media de ingreso hospitalario y mortalidad durante los 30 días posteriores al diagnóstico (tabla 1).
Características sociodemográficas y clínicas de los pacientes atendidos en el servicio de urgencias con meningitis aguda
| Características de los pacientes | Global casosn=98 | MABn=38 | MAVn=33 | Valor de p** |
|---|---|---|---|---|
| Datos demográficos y comorbilidades | ||||
| Edad en años (media [DE]) | 44 (21) | 56 (22) | 38 (16) | <0,001 |
| Mediana (rango) | 38 (15-90) | 61,5 (18-90) | 36 (15-81) | |
| Sexo varón | 66 (67%) | 28 (73,7%) | 20 (60,6%) | 0,179 |
| Neoplasia oncohematológica | 6 (6,1%) | 5 (13,2%) | 1 (3%) | 0,135 |
| Enfermedad hepática | 7 (7 1%) | 5 (13,2%) | 0 (0%) | 0,039 |
| Enfermedad cardiaca crónica | 8 (8,2%) | 6 (15,8%) | 1 (3%) | 0,078 |
| Enfermedad cerebrovascular | 7 (7,1%) | 5 (13,2%) | 1 (3%) | 0,135 |
| Enfermedad renal crónica | 8 (8,2%) | 6 (15,8%) | 1 (3%) | 0,078 |
| Diabetes | 17 (17,3%) | 8 (21,1%) | 5 (15,2%) | 0,372 |
| Inmunodepresión | 7 (7,1%) | 5 (13,2%) | 1 (3%) | 0,135 |
| VIH | 2 (2%) | 1 (2,6%) | 0 (0%) | 0,535 |
| Índice de Charlson (media±[DE]) | 1,38 (2) | 2,24 (2,27) | 0,82 (1,61) | 0,004 |
| Mediana (rango) | 0 (0-9) | 2 (0-9) | 0 (0-7) | |
| Índice de Charlson ponderado (media±[DE])* | 2,36 (3,05) | 3,95 (3,32) | 1,27 (2,45) | <0,001 |
| Mediana (rango) | 1 (0-10) | 4 (0-10) | 0 (0-9) | |
| Toma de AB en 72 horas previas | 17 (18%) | 4 (11,1%) | 4 (12,1%) | 0,594 |
| Datos clínicos y de gravedad | ||||
| Fiebre (Ta > 38°C) | 53 (54,1%) | 24 (63,2%) | 19 (59,4%) | 0,469 |
| Hipotermia (Ta < 35°C) | 1 (1%) | 1 (2,6%) | 0 (0%) | 0,543 |
| Confusión-alteración de la conciencia | 43 (43,9%) | 28 (73,7%) | 8 (24,2%) | <0,001 |
| Cefalea | 78 (79,6%) | 30 (78,9%) | 26 (78,8%) | 0,654 |
| Rigidez de nuca | 44 (44,9%) | 19 (50%) | 14 (42,4%) | 0,345 |
| Signos meníngeos | 33 (33,7%) | 16 (42,1%) | 13 (39,4%) | 0,720 |
| Criterios de sepsis | 68 (70,1%) | 35 (92%) | 20 (62%) | 0,003 |
| Criterios de sepsis grave | 16 (16,5%) | 15 (39,5%) | 0 (0%) | <0,001 |
| Criterios de shock séptico | 7 (7,2%) | 7 (18,4%) | 0 (0%) | 0,011 |
| Datos de evolución | ||||
| Tiempo desde el inicio de la clínica (media [DE]) | 2,9 (1,6) | 2,70 (1,33) | 2,70 (1,59) | 0,987 |
| Mediana (rango) | 3 (1-8) | 3 (1-7) | 2 (1-8) | |
| Estancia hospitalaria (media [DE]) | 12,9 (10) | 19,6 (11,68) | 9,13 (7,02) | <0,001 |
| Mediana (rango) | 11 (1-68) | 16 (9-68) | 6,5 (2-33) | |
| Mortalidad durante el ingreso y los 30 días desde ingreso | 5 (5,1%) | 4 (10,5%) | 0 (0%) | 0,076 |
Los porcentajes excluyen los datos perdidos si los hubiere.
AB: antibiótico; DE: desviación estándar; MAB: meningitis aguda bacteriana; MAV: meningitis aguda viral; Ta: temperatura; VIH: virus de la inmunodeficiencia humana.
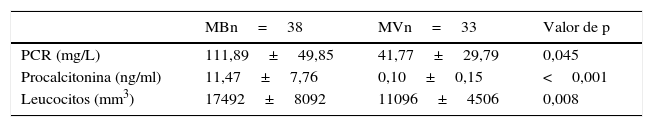
La comparación de las concentraciones medias de PCR, PCT y del recuento de leucocitos entre los casos de MB y MV se muestran en la tabla 2, donde encontramos diferencias significativas en todas ellas, aunque más marcadas en relación a la PCT (11,47±7,76 vs. 0,10±0,15 ng/ml, p<0,001).
comparación de valores medios de PCT y procalcitonina entre MB y MV
| MBn=38 | MVn=33 | Valor de p | |
|---|---|---|---|
| PCR (mg/L) | 111,89±49,85 | 41,77±29,79 | 0,045 |
| Procalcitonina (ng/ml) | 11,47±7,76 | 0,10±0,15 | <0,001 |
| Leucocitos (mm3) | 17492±8092 | 11096±4506 | 0,008 |
MB: meningitis bacteriana; MV: meningitis viral; PCR: proteína C reactiva.
Meningitis virales: casos confirmados por amplificación (reacción en cadena de la polimerasa) del ARN para enterovirus (30 casos) y ADN para virus herpes simplex (3 casos).
Meningitis bacterianas: casos confirmados por cultivo en líquido cefalorraquídeo: S. pneumoniae (18), N. meningitidis (7), L. monocytogenes (7), bacterias gramnegativas (6).
Significación estadística adoptada p<0,05.
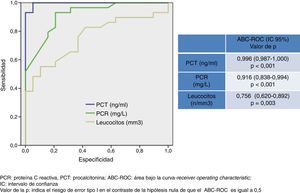
En la figura 1 se describen los valores del ABC-ROC obtenidos por la PCT, PCR y recuento de leucocitos para predecir la existencia de MB. Aunque la PCR consigue un poder diagnóstico muy elevado con un ABC-ROC de 0,916 (IC 95%: 0,838-0,994, p<0,001), superior de forma significativa sobre el obtenido por el recuento de leucocitos, es la PCT el BMIeI que ofrece la mayor ABC-ROC de 0,996 (IC 95%: 0,987-1, p<0,001) y un punto de corte ≥ 0,74 ng/ml es el encontrado con la mayor capacidad diagnóstica, con él se consigue una sensibilidad del 94,7% (IC 95%: 82,2-99,3%), una especificidad del 100% (IC 95%: 88,7-100%), un VPN de 93,9% (IC 95%: 79,7-99,2%) y un VPP del 100% (IC 95%: 90,2-100%). Por su parte, para la PCR el punto de corte ≥ 90 mg/L consigue una sensibilidad de 67,5% (IC 95%: 50,2-81,9%), una especificidad de 86,3% (IC 95%: 65-97%), un VPP 89,2% (IC 95%: 71,7-97,7%) y un VPN: 90,4% (IC 95%: 69,6-98,8%).
En la tabla 3 se muestran algunos de los resultados más relevantes al comparar los niveles de PCR y PCT entre los distintos patógenos aislados o sospechados, con/sin bacteriemia confirmada. Y en la tabla 4 se encuentran los resultados globales al comparar todos los casos de MB bacteriémica con los casos donde no se confirmó el aislamiento del microorganismo en los hemocultivos. Se comprueba que las concentraciones de PCR y PCT son significativamente distintas (todas con p<0,05) al comparar los casos de MB con MV, como se describió en la tabla 2, y que para la PCT (pero no para la PCR) al comparar los casos de MV probable (0,08±0,05 ng/ml) con la media de los casos de MB (11,47±7,76 ng/ml) por un lado (p<0,001), y con la media de los pacientes con posible MA decapitada (0,81±0,36 ng/ml) con p=0,003 por otro lado, también existen diferencias significativas.
Valores medios de proteína C reactiva y procalcitonina en meningitis agudas según etiología
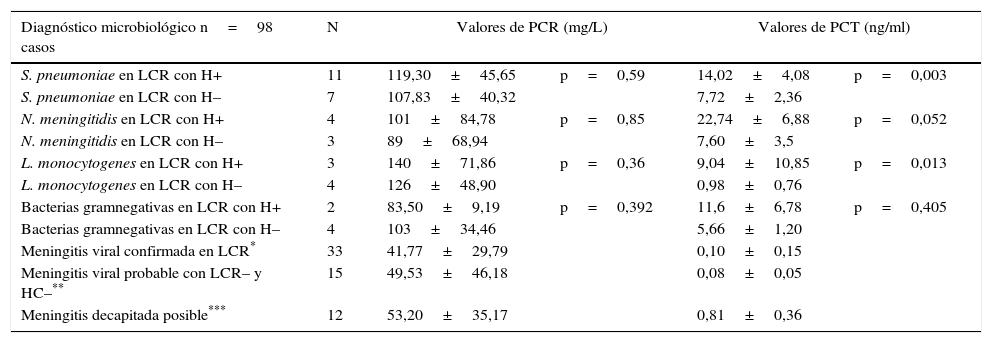
| Diagnóstico microbiológico n=98 casos | N | Valores de PCR (mg/L) | Valores de PCT (ng/ml) | ||
|---|---|---|---|---|---|
| S. pneumoniae en LCR con H+ | 11 | 119,30±45,65 | p=0,59 | 14,02±4,08 | p=0,003 |
| S. pneumoniae en LCR con H– | 7 | 107,83±40,32 | 7,72±2,36 | ||
| N. meningitidis en LCR con H+ | 4 | 101±84,78 | p=0,85 | 22,74±6,88 | p=0,052 |
| N. meningitidis en LCR con H– | 3 | 89±68,94 | 7,60±3,5 | ||
| L. monocytogenes en LCR con H+ | 3 | 140±71,86 | p=0,36 | 9,04±10,85 | p=0,013 |
| L. monocytogenes en LCR con H– | 4 | 126±48,90 | 0,98±0,76 | ||
| Bacterias gramnegativas en LCR con H+ | 2 | 83,50±9,19 | p=0,392 | 11,6±6,78 | p=0,405 |
| Bacterias gramnegativas en LCR con H– | 4 | 103±34,46 | 5,66±1,20 | ||
| Meningitis viral confirmada en LCR* | 33 | 41,77±29,79 | 0,10±0,15 | ||
| Meningitis viral probable con LCR– y HC–** | 15 | 49,53±46,18 | 0,08±0,05 | ||
| Meningitis decapitada posible*** | 12 | 53,20±35,17 | 0,81±0,36 | ||
H+: hemocultivo positivo; H–: hemocultivo negativo; LCR: líquido cefalorraquídeo; LCR+: cultivo bacteriano positivo en líquido cefalorraquídeo; LCR-: cultivo bacteriano negativo en líquido cefalorraquídeo; N:número de casos; PCR: proteína C reactiva; PCT: procalcitonina.
Bacterias gramnegativas: 2 casos de E. coli y 4 por H. influenzae.
Valores medios de proteína C reactiva y procalcitonina en meningitis agudas bacterianas con/sin bacteriemia asociada
| Menigitis bacterianasn=38 casos | Valores de PCR (mg/L) | Valores de PCT (ng/ml) | ||
|---|---|---|---|---|
| Con bacteriemia (20) | 114,9±55,5(IC 95%: 82,9-146,9) | p=0,486 | 14,7±7,1(IC 95%: 10,1-19,3) | p<0,001 |
| Sin bacteriemia (18) | 103,52±39,16(IC 95%: 71,5-135,5) | 4,68±3,54(IC 95%: 0,84-8,52) | ||
N:número de casos; PCR: proteína C reactiva; PCT: procalcitonina.
Significación estadística adoptada p<0,05.
En relación a la predicción de bacteriemia asociada a la MB no existen diferencias significativas al comparar las concentraciones de PCR en el global de los casos de MB (tabla 4), ni tampoco se obtienen en los casos independientes de S. pneumoniae, N. meningitidis, L. monocytogenes o bacterias gramnegativas (tabla 3). Pero para la PCT se comprueba que al comparar los casos de MB bacteriémica (20) con los no asociados a bacteriemia (18), sí existen diferencias (p<0,001) con medias superiores ante la existencia de bacteriemia (14,7±7,1 vs. 4,68±3,54 ng/ml). Lo mismo ocurre (tabla 3) al establecer esta comparación específica en los casos producidos por S. pneumoniae (p=0,003) y por L. monocytogenes (p=0,013), pero no se observa para N. meningitidis (p=0,052) ni con las bacterias gramnegativas (p=0,405), donde la muestra es muy reducida.
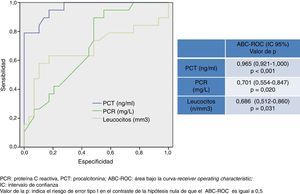
En la figura 2 se describen los valores del ABC-ROC obtenidos por la PCT, PCR y recuento de leucocitos para predecir la existencia de bacteriemia en la MB. El poder diagnóstico de la PCT para predecir bacteriemia en los casos de MB es muy elevado y superior al obtenido por la PCR y el recuento de leucocitos. Se encuentra un ABC-ROC de 0,965 (IC 95%: 0,921-1, p<0,001). El punto de corte encontrado con la mayor capacidad diagnóstica fue 1,1 ng/ml con el que se consigue una sensibilidad del 94,7% (IC 95%: 73,9-99,8%), una especificidad del 72,4% (IC 95%: 52,7-87,8%), un VPN de 95,4% (IC 95%: 77,1-99,8%) y un VPP del 69,2% (IC 95%: 48,2-85,6%).
DiscusiónLos resultados de nuestro estudio confirman, como ya habían apuntado otros autores11,12,15–17, que la PCT posee una muy elevada capacidad predictiva de MB cuando se sospecha esta al diagnosticar posibles casos de MA en el SU. Además, y dependiendo del punto de corte adoptado, también aporta un gran poder de predicción de bacteriemia en los casos de MB confirmados con aislamiento del patógeno en el cultivo del LCR7,11. En ambas situaciones su poder diagnóstico es superior de forma significativa al obtenido por la PCR y, por otra parte, se conoce que este último disminuye en relación con la mayor edad del paciente, lo que no ocurre al evaluar los resultados de la PCT9. Este hecho se debe tener en cuenta al valorar e interpretar las concentraciones de los BMIeI, entre otras cosas porque la edad de los pacientes con MB, como en nuestra muestra (56±22 años), es superior a la edad de los casos de MV (38±16 años). También las manifestaciones clínicas son más inespecíficas cuanto mayor es la edad, en inmunodeprimidos, diabéticos y en otros enfermos especialmente susceptibles de padecer infecciones graves, en los cuales los signos y síntomas habituales no proporcionan una sensibilidad ni especificidad óptimas para distinguir una posible MB de una MV1. En nuestros pacientes ni la fiebre, ni la existencia de cefalea, signos de irritación meníngea o rigidez de nuca nos orientan a un origen bacteriano, solo la existencia de confusión o alteración del nivel o contenido de la conciencia (también con frecuencia presente en los casos de meningoencefalitis viral) fue superior (73,7 vs. 24,2%) en los casos de MB. Por ello creemos justificado el disponer desde el SU de una prueba rápida (en 20-30 minutos se obtiene el resultado de una muestra de sangre) y fiable para sospechar y distinguir los casos de MB11. De esta manera se pueden orientar las decisiones que son trascendentales para el pronóstico y evolución de estos pacientes desde el primer contacto o triaje del paciente con el centro hospitalario20, al activar el «código sepsis» o «código meningitis»: extracción de cultivos y muestras para microbiología, administración precoz y adecuada de la pauta antibiótica, ingreso en el lugar apropiado, etc.
En relación con la capacidad de distinguir una MB de una MV nuestros resultados coinciden con los obtenidos por otros autores11,12,15–17 que otorgan a la PCT un mayor poder diagnóstico que a la PCR y al recuento de leucocitos. La controversia se establece al intentar establecer el punto de corte óptimo, muy variable en función del estudio (sobre todo por el tamaño muestral y la técnica utilizada para la PCT) que va de 0,2 a 5 ng/ml (con resultados de sensibilidad y especificidad mayores del 90%)11,12,15–17,21–24. Algunos señalan valores entre 0,2-0,5 ng/ml de PCT como los óptimos para el diagnóstico de sospecha de MB12,16,21,22, con especificidad y VPN del 90%. Otros, como Ray et al.22, adoptan un valor de 2,13 ng/ml de PCT para conseguir una sensibilidad del 87%, una especificidad del 100%, un VPP del 100% y un VPN del 99%. Posiblemente uno de los estudios más importantes, realizado por Viallon et al.12, sobre 254 pacientes con MA (35 Mb y 181 MV) concluyó que el mayor poder diagnóstico se obtenía con la PCT con un punto de corte ≥ 0,28 ng/ml con una sensibilidad de 95%, una especificidad del 100%, un VPP del 100% y VPN del 97% y definiendo un ABC-ROC de 0,99 (IC 95%: 0,99-1), resultados muy superponibles a los de nuestro estudio salvo que nuestro punto de corte encontrado fue superior (PCT ≥ 0,74 ng/ml) para obtener la misma especificidad y VPP. A la vista de estos resultados y para conseguir una seguridad máxima, creemos que se debería considerar una MB en los SU cuando la PCT inicial sea > 0,25 ng/ml y así obtener las pruebas microbiológicas pertinentes6 y administrar la cobertura antibiótica adecuada de forma inmediata9.
Un aspecto novedoso encontrado en nuestro estudio se refiere a las diferencias significativas al comparar los casos de MV probable (sin diagnóstico) tanto con los casos de MB confirmada (con p<0,001) como con las posibles MA decapitadas (p=0,003), respectivamente: 0,08±0,05 ng/ml, 11,47±7,76 ng/ml y 0,81±0,36 ng/ml). De manera que ante la duda diagnóstica en algunas situaciones la PCT puede proporcionar una ayuda en la orientación etiológica en las MA.
Por otra parte, tal y como demostró Viallon et al12 al combinar los resultados de la PCT en suero con las concentraciones de lactato en el LCR se incrementa aún más el poder pronóstico de ambos.
Aunque se han elaborado algunos estudios16,17,25 para valorar y comparar la utilidad de la PCT en el LCR respecto a las muestras sanguíneas, estos tienen una potencia muy pequeña y además han obtenido resultados inferiores a los obtenidos por la PCT en sangre en los mismos estudios, por lo que no se recomienda evaluar la PCT en el LCR. Pero sí sería una muy buena opción combinar los resultados con los obtenidos por el lactato en el LCR12.
Creemos que futuros estudios deberán abordar y analizar la capacidad de la PCT en sangre y el lactato en el LCR valorados conjuntamente para confirmar nuestros hallazgos para distinguir MB y posible MA decapitadas de las MV confirmadas o sospechadas.
Por otro lado, como ya se ha descrito ampliamente en los pacientes con infección grave9,10 y otros procesos infecciosos más estudiados26, la existencia de bacteriemia determina cifras superiores de PCT en nuestros casos de MB (14,7±7,1 vs. 4,68±3,54, p<0,001). La PCR no consigue diferencias significativas ni en el global de los enfermos con MB ni al analizar individualmente según el patógeno aislado. Los casos donde la PCT no muestra diferencias significativas (N. meningitidis con p=0,052 y bacterias gramnegativas con p=0,405) es posible que se deba a la muestra reducida en ambos casos. En cualquier caso el valor y las diferencias globales de valores de PCT al existir o no bacteriemia en las MB son evidentes. De nuevo el punto de corte para predecir bacteriemia varía mucho dependiendo de los estudios9,10 y puede situarse entre 0,4 y 5 ng/ml. En nuestro estudio se obtuvo un punto de corte de 1,1 ng/ml para conseguir una sensibilidad del 94,7%, especificidad del 72,4%, un VPN de 95,4% y VPP del 69,2% con un ABC-ROC de 0,965. Estos resultados son muy similares (punto de corte 0,95 a 1 ng/ml) en estudios de procesos infecciosos9,26 o de 0,4 ng/ml al combinar la PCT en un modelo predictivo elaborado por Tudela et al10 para los SU. Por todo ello ante la existencia de PCT ≥ 1 ng/ml, como sugiere una reciente revisión se debería considerar la existencia de bacteriemia y MB al valorar a los pacientes en urgencias9.
Nuestro estudio tiene distintas limitaciones, como son su carácter unicéntrico y el reducido tamaño de la muestra (no se puede excluir algún error tipo beta), que para algunas comparaciones resultó escasa y seguramente haya podido determinar que los puntos de corte y el rendimiento obtenidos hayan podido maximizarse o minimizarse. No se ha tenido en cuenta en el análisis las complicaciones (encefalitis, crisis comiciales, etc.), que hubiese podido quizás aportar más información al estudio. En este sentido el análisis conjunto con los valores de lactato en el LCR podrían también haber dado una orientación con mayor capacidad pronóstica e incluso crear una propuesta de modelo predictivo de MB más fiable. Otra limitación de nuestro estudio es que no contó con un grupo control libre de enfermedad, lo que hubiese conferido un grado de validez interna superior. A pesar de las limitaciones creemos que nuestro estudio refleja la realidad clínica ante la sospecha y confirmación de meningitis en nuestro SU y muestra el papel que puede jugar la determinación de la PCT como ayuda para predecir MB y la existencia de bacteriemia.
En conclusión, a la espera de los resultados de futuros estudios con una potencia y muestra mayores, es indudable que la PCT posee una indudable utilidad y gran rendimiento diagnóstico para predecir la MB en el SU frente a una MV así como para sospechar la existencia de bacteriemia. De esta manera, como ya se ha protocolizado y validado en otros procesos infecciosos como la neumonía grave27 o los pacientes con sepsis y shock séptico28, creemos que en un futuro próximo la PCT se incorporará en los protocolos de diagnóstico de las MB en los SU como otra herramienta de ayuda para el médico de urgencias y el especialista en neurología.
FinanciaciónEste manuscrito no ha sido presentado en ninguna reunión científica ni ha recibido ninguna financiación por parte de ningún organismo ni público ni privado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.