Natalizumab es un tratamiento que ha demostrado ser muy eficaz en los pacientes con esclerosis múltiple recurrente-remitente (EMRR) en cuanto a la reducción del número de brotes y al enlentecimiento de la progresión de la enfermedad. Sin embargo, el fármaco se ha asociado con el riesgo de desarrollar leucoencefalopatía multifocal progresiva (LMP). El objetivo de este artículo es proporcionar una posición consensuada sobre la valoración y estratificación de este riesgo y mejorar el manejo de los pacientes tratados con natalizumab.
DesarrolloEn una reunión inicial de expertos en EM (los autores de este consenso), se perfilaron los temas de interés que fueron asignados a los asistentes para su desarrollo ulterior. Los temas incluían cómo establecer el beneficio y el riesgo en general, la estratificación para el riesgo de LMP, cómo informar a los pacientes de los beneficios y riesgos, cómo realizar el seguimiento del paciente en tratamiento y tras la suspensión del fármaco. Durante la fase de redacción, se revisó toda la información disponible, publicada o presentada en reuniones internacionales. Después de varios ciclos de revisión y de reuniones, se produjo el borrador final.
ConclusionesA pesar de ser un fármaco muy eficaz, la decisión de prescribir natalizumab debe ser tomada con cuidado por los posibles efectos adversos y en particular, el riesgo de LMP. El neurólogo debe explicar al paciente en detalle los riesgos y beneficios del tratamiento, en términos comprensibles para el paciente. Antes de empezar el tratamiento, deben estar disponibles las pruebas de laboratorio y las imágenes de resonancia magnética (RM) que permitan comparaciones en el futuro, en caso de sospecha de LMP. El riesgo de LMP debe estratificarse en alto, medio y bajo de acuerdo con la presencia o ausencia de anticuerpos frente al virus JC, antecedente de tratamiento inmunosupresor y duración del tratamiento. El seguimiento clínico y la frecuencia de la RM dependerá del grupo de riesgo al que pertenece el paciente. A medida que mejore nuestra comprensión de los factores de riesgo, será posible ofrecer a los pacientes una terapia cada vez más personalizada. El presente consenso establece unas recomendaciones generales, pero los neurólogos deben aplicar su experiencia clínica para hacer un seguimiento individualizado de los pacientes.
Natalizumab is very effective at reducing relapses and delaying disease progression in patients with relapsing-remitting multiple sclerosis (RRMS). However, treatment has also been associated with a risk of progressive multifocal leukoencephalopathy (PML). The aim of this article is to provide a consensus view on the assessment and stratification of these risks, and to improve the management of natalizumab-treated patients.
DevelopmentAt an initial meeting of experts on multiple sclerosis (the authors of this consensus), the relevant topics of the consensus were determined and assigned for further elaboration. Topics included how to establish benefit and risk in general, stratification for risk of PML, informing patients of benefits/risks, and how to monitor patients during treatment and after discontinuing treatment. During the drafting phase, all available information published or presented at international meetings was reviewed. After a series of review sessions and meetings, the final draft was produced.
ConclusionsAlthough natalizumab is a very effective drug, its use needs to be considered carefully in view of possible adverse effects and the risk of PML in particular. The neurologist should carefully explain the risks and benefits of treatment in terms the patient can best understand. Before starting treatment, baseline laboratory tests and magnetic resonance imaging (MRI) should be available for future comparisons in the event of suspected PML. The risk of PML should be stratified into high, medium and low risk groups according to presence or absence of anti-JC virus antibodies, prior immunosuppressive therapy, and treatment duration. The follow-up, and frequency of MRI scans in particular, should depend on the risk group to which patient belongs. As our understanding of the risk factors for PML develops, it should be possible to offer patients increasingly individualised therapy. This is a consensus that establishes general recommendations, but neurologists must use their clinical expertise to monitor patients individually.
El natalizumab (Tysabri®) es un anticuerpo monoclonal recombinante humanizado que se une a la subunidad α4 de la integrina α4β1 (VLA-4), en la superficie de los linfocitos. Esta acción bloquea la unión con su receptor (VCAM-1), presente en el endotelio, lo que impide el paso de los linfocitos al sistema nervioso central, reduciendo de esta forma el proceso patogénico de la esclerosis múltiple (EM). En los ensayos fundamentales para el registro1, el natalizumab ha demostrado ser muy eficaz en pacientes con esclerosis múltiple recurrente-remitente (EMRR), pero se informó de dos casos de leucoencefalopatía multifocal progresiva (LMP) en el estudio SENTINEL en el que se comparaba natalizumab más interferón beta-1a frente a interferón beta-1a2.
Debido a ello, el natalizumab está indicado como agente modificador de la enfermedad en la EMRR muy activa para los siguientes grupos de pacientes: pacientes con actividad alta de enfermedad a pesar del tratamiento con interferón beta y pacientes con una EMRR grave, evolucionando rápidamente.
Los pacientes que han fracasado tras un curso completo de interferón beta deben tener al menos 1 brote en el año previo, mientras estaban en tratamiento y tener también al menos 9 lesiones hiperintensas en T2 en la RM de cráneo o al menos 1 lesión captante de gadolinio.
Los pacientes con EMRR grave que evoluciona rápidamente se definen por tener 2 o más brotes discapacitantes en un año y 1 o más lesiones captantes de gadolinio en la resonancia magnética (RM) cerebral, o un aumento significativo de la carga lesional en T2, comparada con una RM previa3,4.
Desde las primeras notificaciones de LMP, nuestros conocimientos de los riesgos y los beneficios han mejorado bastante, y siguen mejorando gracias al gran esfuerzo para entenderlos. Así, hoy en día con la nueva información disponible, el paciente y el neurólogo pueden llegar a decisiones adaptadas a la situación individual del paciente. En este documento de consenso, hemos tratado de captar el estado actual de los conocimientos existentes para servir de guía en la toma de decisiones en el tratamiento con natalizumab.
Es importante resaltar que aunque este documento sirve como una recopilación de las últimas recomendaciones generales para el manejo de pacientes en tratamiento con natalizumab, los neurólogos deben ejercer su propio juicio en el tratamiento y seguimiento de estos pacientes sobre todo por los cambios rápidos en el campo y por la tendencia a tratamientos cada vez más personalizados.
MétodosEn una reunión de expertos españoles en EM (los autores de este consenso), se definieron los temas relevantes a tratar en este documento de consenso. Los temas elegidos fueron: cómo valorar el beneficio y el riesgo en general, la estratificación del riesgo de LMP, cómo informar a los pacientes sobre los riesgos y beneficios del tratamiento, el seguimiento a efectuar durante el mismo y, en su caso, tras la discontinuación del fármaco. Cada tema se le asignó a un experto del grupo para que redactara el texto correspondiente. Los encargados de cada tema revisaron toda la bibliografía disponible, así como todas las presentaciones relevantes en congresos internacionales.
En el caso de natalizumab, los ensayos aleatorizados se llevaron a cabo en pacientes con una enfermedad menos grave que los pacientes tratados según la ficha técnica. Dada la falta de ensayos clínicos aleatorizados disponibles, con este tipo de pacientes resultó imposible construir una jerarquía de evidencia como es habitual en este tipo de documento. No obstante, debemos dejar constancia de que en el presente documento se han tenido en consideración todas las publicaciones relevantes sobre natalizumab (estudios fase II, III y observacionales), así como los datos presentados en reuniones internacionales, tanto publicados como no publicados.
En la primera reunión, se designó a un coordinador (O.F.), quien recopiló los textos y realizó un primer borrador que se revisó en una segunda reunión. Después de recibir los comentarios, se redactó una nueva versión que se sometió de nuevo al grupo de expertos. Una vez llegado al consenso sobre el contenido y la forma del texto, después de varios ciclos de revisiones y reuniones, el documento final se envió al Grupo de Enfermedades Desmielinizantes de la Sociedad Española de Neurología para su conocimiento y comentario. Una vez incorporados estos comentarios, se llegó finalmente al presente documento.
El concepto de beneficio/riesgoEn el establecimiento de la relación beneficio/riesgo, básicamente se deben tener en cuenta la información procedente de los ensayos clínicos (EECC) realizados con el fármaco, así como asumir la exposición continuada al fármaco y considerar los resultados a corto y largo plazo tanto de eficacia como de seguridad.
En la evaluación del beneficio, hay que considerar que los objetivos primarios de eficacia de los EECC son solo uno de los aspectos de los resultados percibidos por los pacientes y debe valorarse también la factibilidad del tratamiento, así como la modificación de la calidad de vida que implica su uso.
Para calcular el beneficio se utiliza el estadístico número necesario para tratar (NNT) para un determinado objetivo, tal como el número de brotes, la progresión de la discapacidad, o las variables determinadas mediante resonancia magnética - RM). NNT=1/RRA (RRA: reducción de riesgo absoluto).
La gradación del daño se hace teniendo en consideración en particular los acontecimientos adversos graves, las alteraciones de laboratorio significativas, los abandonos de tratamiento y la percepción de riesgos futuros desconocidos (ej.: posibilidad de infecciones o neoplasias en el futuro). Utilizando estas variables, de forma similar como se determina el beneficio, se puede calcular el número necesario para dañar (NND). NND=1/RDA (RDA: reducción del daño absoluto).
Una vez calculados ambos estadísticos, podríamos determinar la diferencia entre ellos, asumiendo que ambos aspectos, el beneficio y el efecto adverso, tienen significado clínico comparable, lo que debe quedar a criterio, tanto del médico como del paciente, y quizá también de las autoridades sanitarias que asignan los recursos y consideran los aspectos de utilidad pertinentes.
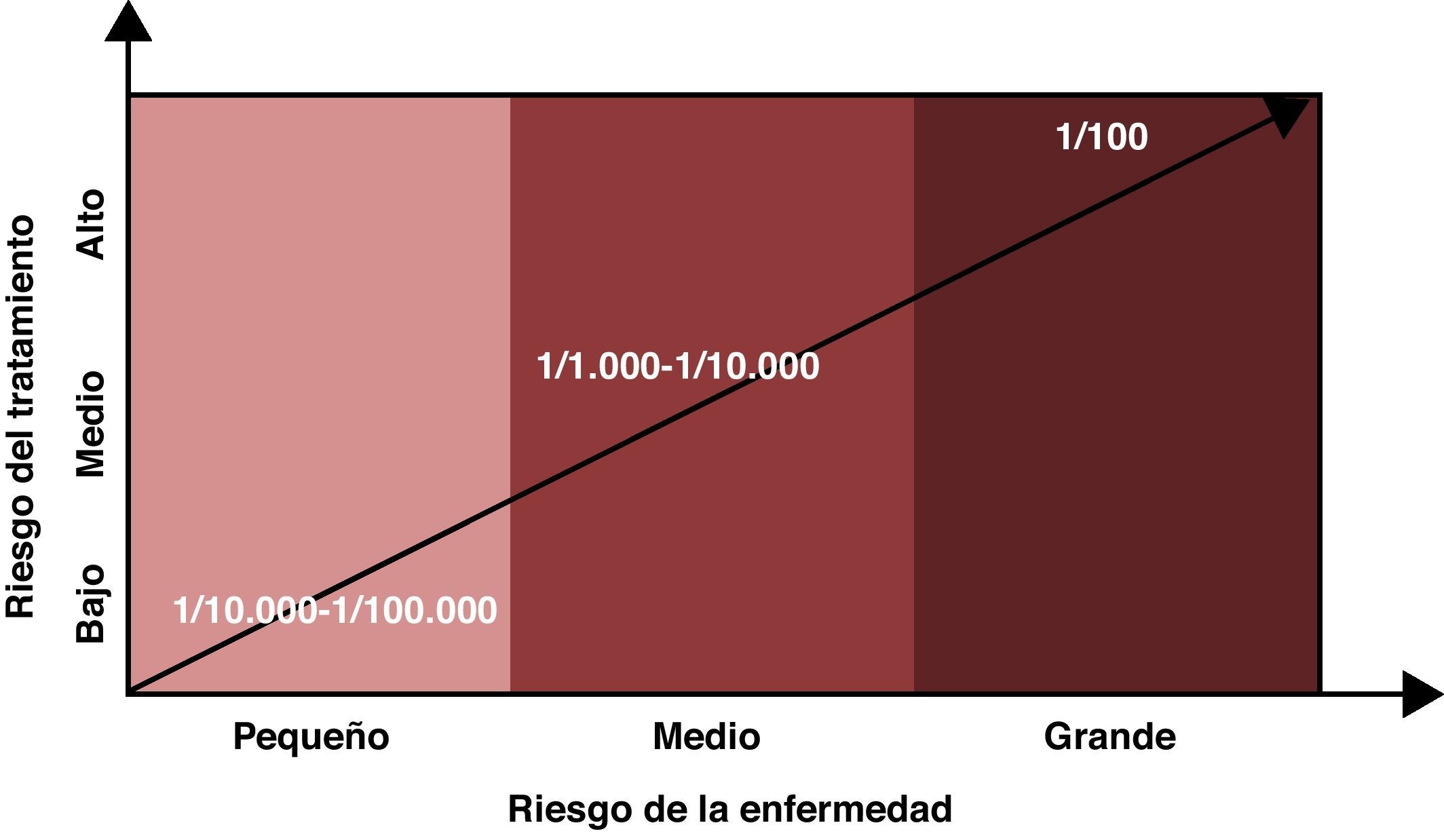
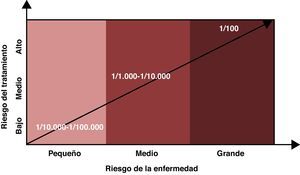
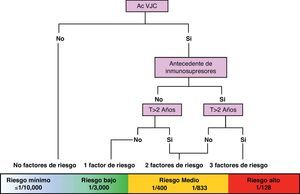
El riesgo asumible o «aceptable» debe tener en cuenta no solo el riesgo del fármaco, sino también el riesgo de la enfermedad que tratamos. Si la enfermedad no causa discapacidad o produce discapacidad menor, el riesgo asumible debe ser bajo (1/10.000 o menor); por el contrario, si ésta puede producir una discapacidad mayor, el riesgo asumible podría ser mayor (1/1.000 a 1/10.000) y finalmente si el riesgo que existe es clínicamente muy relevante, por ejemplo de muerte, el riesgo asumible para los efectos adversos podría ser aún mayor (1/100 o mayor). El paciente debe ser informado del riesgo y la decisión final tomada conjuntamente (fig. 1).
En la evaluación del beneficio/riesgo, un NNT bajo indica una buena respuesta terapéutica (se necesita tratar pocos pacientes para obtener una respuesta terapéutica), un NND alto indica un buen perfil de seguridad (se necesita tratar un gran número de pacientes para que ocurra un acontecimiento adverso). Se puede expresar como un cociente o como una diferencia, es decir, como la relación beneficio/riesgo o como la probabilidad de beneficio-riesgo.
La diferencia de riesgo o «reducción de riesgo absoluto» es la diferencia simple en la tasa de acontecimientos adversos (40–30%=10%; NNT=10). La diferencia en riesgo relativo en este caso es el 25%. Hay que tener en cuenta que si el efecto relativo del tratamiento es el mismo, la reducción del riesgo absoluto puede ser diferente a pesar de que en ambos casos la reducción del riesgo relativo sea similar.
Los cocientes a la hora de valorar el beneficio y el perjuicio o riesgo pueden ser engañosos si desconocemos el riesgo basal, por lo que es preferible utilizar los estadísticos que consideran diferencias de riesgo, motivo por el que debemos tener en cuenta siempre el beneficio o el riesgo absolutos5–8.
En la EM, las medidas de eficacia para los cálculos del NNT incluyen la evitación de un brote, el mantenimiento del paciente libre de progresión o la ausencia de variables de actividad/progresión por RM. Las medidas de NND incluyen la ocurrencia de acontecimientos adversos graves y la discontinuación de tratamiento por acontecimientos adversos graves.
La EM es una enfermedad crónica con riesgo de progresión, en la que esperamos que el tratamiento pueda beneficiar a un paciente concreto reduciendo el número de brotes, enlenteciendo o deteniendo la progresión de la discapacidad y todo ello con el menor daño posible debido a la medicación.
Aunque los pacientes tienen diferentes preferencias respecto a la trasmisión de la información, cada vez es mayor el número de ellos que desea ser informado y tomar una decisión compartida con su médico.
Para que el paciente lo comprenda podemos utilizar los NNT y analizar la ganancia en periodos libres de enfermedad. No obstante, la capacidad de comunicar eficientemente este concepto de beneficio/riesgo es aún un arte en el que debemos propiciar un buen grado de participación del paciente, evaluar sus preferencias respecto a la información, sus expectativas y preocupaciones, y su capacidad de asumir riesgos. Finalmente, debemos averiguar de qué forma la decisión que adoptamos va a influir en su estilo de vida, lo que nos permitirá tomar una decisión compartida con el paciente acerca del tratamiento y su seguimiento9. Deben siempre considerarse cuáles son las alternativas terapéuticas disponibles para un paciente en concreto.
En definitiva, la relación beneficio/riesgo depende tanto del fármaco como de la enfermedad que deseemos tratar; las cifras de NNT/NND son importantes para comunicar los beneficios y los efectos adversos demostrados en los EECC. Es preciso definir un proceso de información adecuado para cada paciente, debiendo considerarse que aunque los pacientes prefieren en general ser informados, en la mayoría de las ocasiones confían en la decisión final de su médico, que idealmente debe ser compartida por ambos.
Información sobre el beneficio asociado al tratamientoEn el estudio fundamental fase III AFFIRM1, en pacientes con EMRR el tratamiento con natalizumab redujo el riesgo de progresión mantenida de la discapacidad un 42-54% a los dos años, la tasa de brotes se redujo al año en un 68%, el número de lesiones nuevas o aumentadas en las secuencias ponderadas en T2 en RM en un 83%, y el número de lesiones captantes de gadolinio en RM en un 92%. El número de pacientes libres de brotes a los 2 años aumentó el 57%.Los NNT para estas variables son los siguientes:
- ∘
NNT para brotes (anualizado): 2.0
- ∘
NNT para estar libre de brotes (2 años): 4
- ∘
NNT para estar libre de progresión (2 años): 8
Posteriormente se han publicado series observacionales en pacientes malos respondedores al tratamiento convencional con interferón y/o acetato de glatirámero, donde se refuerza su gran efectividad10,11.
Información sobre el riesgo asociado al tratamientoEn el estudio AFFIRM, contra placebo presentaron más efectos adversos los pacientes del grupo natalizumab, esencialmente fatiga y reacciones alérgicas. Aparecieron reacciones de hipersensibilidad de cualquier tipo en el 4% de los casos, siendo serias en el 1% de los pacientes1. En el estudio SENTINEL las reacciones adversas de la terapia combinada con interferón beta 1-a IM fueron ansiedad, faringitis, congestión de senos y edema periférico. Hubo dos casos de LMP, uno de los cuales fue mortal en el grupo de natalizumab2. Además se detectó, en otro EC, otro caso de LMP en un enfermo de Crohn previamente tratado con inmunosupresores12.
La LMP es una encefalitis subaguda causada por el virus JC. Se considera una infección oportunista dado que ocurre casi exclusivamente en pacientes con trastornos graves del sistema inmunológico, sea por infección del VIH, inmunosupresión, distintos tipos de cáncer o en algunas enfermedades autoinmunes.
Tras la comercialización de este medicamento y su uso en monoterapia, ha seguido apareciendo esta complicación en un número reducido de pacientes, aunque creciente a medida que ha ido aumentando el número de pacientes tratados. Distintos análisis han mostrado que el riesgo global de desarrollar LMP se estima en cerca de 1 por cada 1.000 casos tratados, y además han revelado que el riesgo aumenta a partir del año de tratamiento, siendo el efecto más evidente a partir de los 2 años, y es mayor aún en los pacientes que han sido tratados previamente con inmunosupresores (IS). Los NND para estas variables son los siguientes:
- ∘
NND para retirada de tratamiento por efectos adversos: 50
- ∘
NND para aparición de LMP (tratamiento «de novo» y no IS previa y menos de 2 años): 1/3.000.
La duración del tratamiento es uno de los principales factores que conforman el riesgo de LMP. Los datos provenientes de los pacientes que desarrollaron LMP revelan que su aparición es muy rara antes de 1 año de tratamiento y que la media de la aparición de la mayoría de los casos es en torno a los 2 años, en pacientes tratados hasta 4 años. Más allá de este tiempo no se sabe si el riesgo sigue aumentando o se estabiliza, dado que el número de enfermos en tratamiento es aún reducido.
La inmunosupresión previa ha sido otro de los factores fundamentales en el riesgo de LMP, ya que casi la mitad de los casos que desarrollaron esta complicación habían recibido antes IS. El tipo de IS registrado ha sido muy variado sin patrones específicos de fármacos o de pautas de uso de los mismos.
Datos derivados del estudio TYGRIS sugieren que de acuerdo a esos dos factores el riesgo más bajo sería para pacientes sin tratamiento IS previo con menos de 2 años de tratamiento y el mayor (en torno a 4 veces más) para enfermos que recibieron previamente IS y se trataron más de 2 años con natalizumab13.
Estratificación del riesgo e inicio del tratamientoEn el momento actual no se cuenta con ninguna herramienta que pueda predecir el riesgo individual de LMP de un paciente con EM que comience el tratamiento con natalizumab. La adecuada selección de los pacientes y un seguimiento adecuado harán posible que el balance riesgo/beneficio se incline a favor de su uso en el tratamiento de los pacientes en los que esté indicado14–16.
Para seleccionar a los pacientes, deben tenerse en cuenta elementos de la historia clínica de cada candidato, como el diagnóstico confirmado de EM, la actividad de la enfermedad, la presencia de comorbilidades, la historia del tratamiento previo con IS y cuáles son los valores basales de los parámetros de laboratorio. Ser VIH-positivo o presentar una historia de inmunodeficiencia o enfermedad linfoproliferativa son contraindicaciones para el uso de natalizumab. Aunque en la ficha técnica no figuran como una contraindicación el embarazo, la intención de embarazo y la lactancia, hay consensos de expertos que lo desaconsejan en estas situaciones17. Antes de instaurar el tratamiento, se debe realizar una RM, que se repetirá periódicamente. La frecuencia dependerá del grupo de riesgo al que pertenezca el paciente14–16, pero oscila entre los 6 y 12 meses. El natalizumab deberá ser siempre empleado en monoterapia18.
Se debe informar al paciente del riesgo que asume con el tratamiento. Es aconsejable la determinación de anticuerpos antinatalizumab a los 6 meses ya que estos anticuerpos, cuando aparecen, lo hacen prácticamente en el 100% de los casos en este periodo. Si la determinación de anticuerpos es positiva, debe repetirse la prueba al cabo de cuatro semanas, y si persisten, debe retirarse el tratamiento, por cuanto se ha demostrado su asociación con la pérdida de eficacia del fármaco. Ésto permite evitar la exposición innecesaria al fármaco y reducir el riesgo19.
Recientemente, la puesta a punto de un método de ELISA de 2 pasos con alta sensibilidad y especificidad para la detección de anticuerpos frente al virus JC ha planteado la posibilidad de poder estratificar dicho riesgo. A nivel europeo, existe un programa para el análisis de muestras procedentes de pacientes con EM en un laboratorio central (Unilabs, Dinamarca). Para poder acceder al programa, cada centro tiene que darse de alta. Este test con alto valor predictivo negativo confirma la exposición previa al virus o infección primaria, que estaría presente en el 53,6% de los pacientes con EM; su negatividad descartaría dicha exposición. Además en los 25 casos estudiados de LMP confirmada se detectaron anticuerpos en las muestras obtenidas previamente20–22.
Si los estudios en marcha, específicamente el STRATIFY-1 (clinicaltrials.gov identifier: NCT01070823) y el STRATIFY-2 (clinicaltrials.gov identifier: NCT01070836), confirman la predicción de que la negatividad de los anticuerpos JC descarta contacto previo con el virus JC, esta detección combinada con los 2 factores antes mencionados inmunosupresión previa y duración de tratamiento pueden servir para estratificar claramente el riesgo de LMP. Además, sería recomendable realizar el estudio serológico anualmente debido a un 2% de seroconversión anual que acontece en estos pacientes con anticuerpos negativos23.
Si todos estos datos se confirman definitivamente, se habrá dado un paso fundamental en el tratamiento personalizado con natalizumab en la EM.
Los neurólogos deben informar al paciente antes de iniciar el tratamiento acerca de los beneficios y riesgos del tratamiento con natalizumab, estableciendo un balance lo más claro que sea posible para un paciente concreto. Debe hacerse constar en la historia clínica la información que se ha trasmitido, especialmente en lo referente a la LMP. Debe igualmente informarse y registrarse la existencia de riesgos derivados de la supresión del fármaco.
Se tiene que entregar al paciente una tarjeta de alerta y se considera útil, aunque no es obligatorio, firmar un consentimiento informado previo al inicio de tratamiento.
Durante todo el tratamiento se debe continuar asesorando al paciente sobre los beneficios y los riesgos de las complicaciones del fármaco, especialmente la aparición de LMP, de forma individual.
Es aconsejable que se realice un estudio analítico y de RM, y donde sea posible, un estudio neuropsicológico previos al tratamiento. Ésto permitirá realizar las comparaciones oportunas en caso de sospecha de LMP en el futuro.
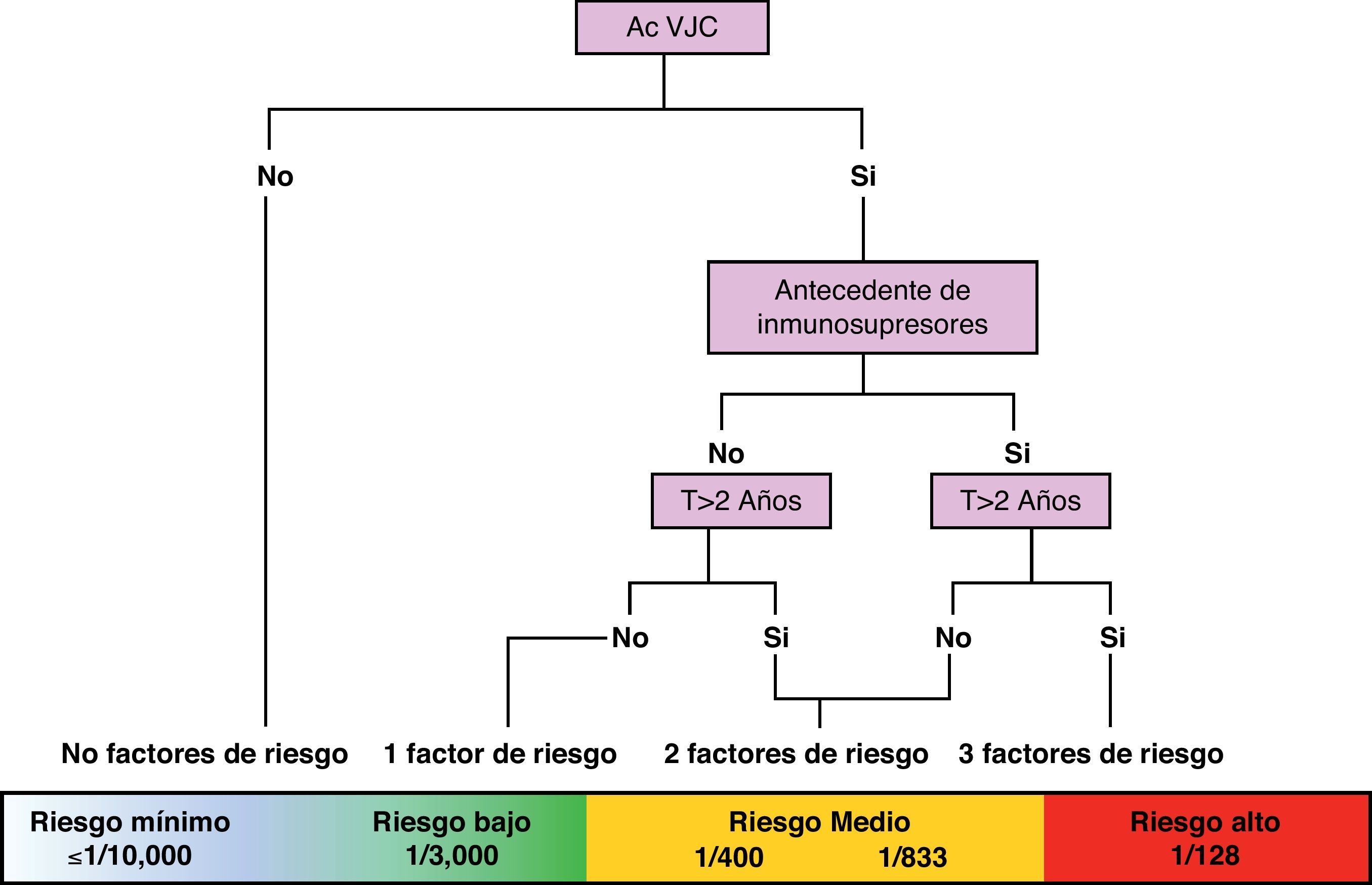
De forma práctica, en el momento actual podemos intentar estratificar el riesgo de LMP teniendo en consideración tres variables: presencia/ausencia de anticuerpos contra el virus JC, presencia/ausencia de tratamiento inmunosupresor previo y duración en meses del tratamiento (mayor o menor de 24 meses). Con ello podemos configurar un algoritmo de beneficio/riesgo que nos permite estratificar el riesgo en tres grupos, Riesgo mínimo-bajo≤1/10.000 - 1/3.000, medio 1/833–1/400 y alto 1/128. Ésto nos permite informar con más precisión a los pacientes respecto al balance entre el beneficio y el riesgo. Estos datos se están precisando todavía, pero son la aproximación numérica más adecuada de la que se dispone en la actualidad (fig. 2)24.
Estratificación del riesgo aproximado de LMP según el número de factores de riesgo conocidos en la actualidad (AcVJC: anticuerpos contra el virus JC; T: tratamiento)24.
El seguimiento de los pacientes tratados asegura un diagnóstico precoz de las posibles complicaciones y una actuación rápida para minimizar las consecuencias, todo ésto se lleva a cabo mediante la vigilancia clínica y el uso de la RM y las pruebas de laboratorio.
El neurólogo y sus habilidades clínicas constituyen la mejor forma de monitorizar a los pacientes y así reconocer lo antes posible el desarrollo de la LMP; éste debe tener en cuenta el inicio, desarrollo y tipo de síntomas que presenta el paciente para distinguirla de un brote de EM.
También el paciente y sus familiares deben ser educados en este sentido y participar en la detección de los síntomas y signos nuevos14–16.
Si no basta con los datos clínicos, se realizará un estudio con RM para visualizar las lesiones y tratar de distinguirlas de las típicas de EM, basándonos en características como la localización, los bordes y el patrón del cambio producido; es una técnica muy sensible, pero poco específica sobre todo en las lesiones iniciales de LMP25,26.
Aunque el análisis del LCR para la detección de ADN del virus JC sea muy específico para el diagnóstico de la LMP, en estadios tempranos de la enfermedad es a menudo negativo26,27. Por ello, resulta poco útil para el cribado de los pacientes, así que su uso se limita a pacientes que ya presentan una clínica o RM sospechosas de la enfermedad.
La determinación de la viremia y la viruria no presenta evidencia científica suficiente que avale su utilidad; en algún estudio se describe un aumento de las copias de virus JC en plasma y orina en pacientes tratados, lo que podría suponer una ayuda para la monitorización de los pacientes con más riesgo de desarrollar LMP28,29, pero ésto no se ha podido observar en otras cohortes mayores, probablemente por diferencias en la metodología empleada30–32.
La respuesta inmune frente al virus JC también ha sido objeto de estudio. Algunos investigadores no encuentran alteración en la respuesta inmune, otros demuestran una reducción en la actividad de las células T durante el tratamiento con el fármaco, y otros comunican un aumento de dicha actividad32.
Finalmente, y con el objetivo de estudiar la función inmunológica y la actividad de la enfermedad durante los periodos de interrupción de tratamiento con el fármaco, se está desarrollando un estudio llamado RESTORE que analiza los objetivos tras la suspensión de natalizumab durante 6 meses en tres brazos, sin tratamiento, con tratamiento con corticoides a altas dosis mensuales, con interferón beta o con acetato de glatirámero (clinicaltrials.gov identifier: NCT01071083).
Consejos prácticos en la monitorización del tratamiento14,33–36Monitorización clínicaEl equipo médico y de enfermería debe conocer bien al paciente y estar altamente capacitado y entrenado en el empleo de natalizumab y el reconocimiento de las posibles complicaciones del tratamiento con este fármaco.
Se debe monitorizar en cada perfusión por personal de enfermería y/o médico la posible aparición de reacciones de la perfusión (cansancio, mareo, cefalea, astenia, náuseas, etc.), distinguiéndolas de las reacciones alérgicas o de hipersensibilidad (urticaria con o sin repercusión sistémica).
Es recomendable que en todas las perfusiones (cada 4 semanas) personal médico o de enfermería especializada tenga contacto con el paciente para un mayor control de la actividad clínica o la detección precoz de posibles complicaciones relacionadas con la medicación, en particular la LMP.
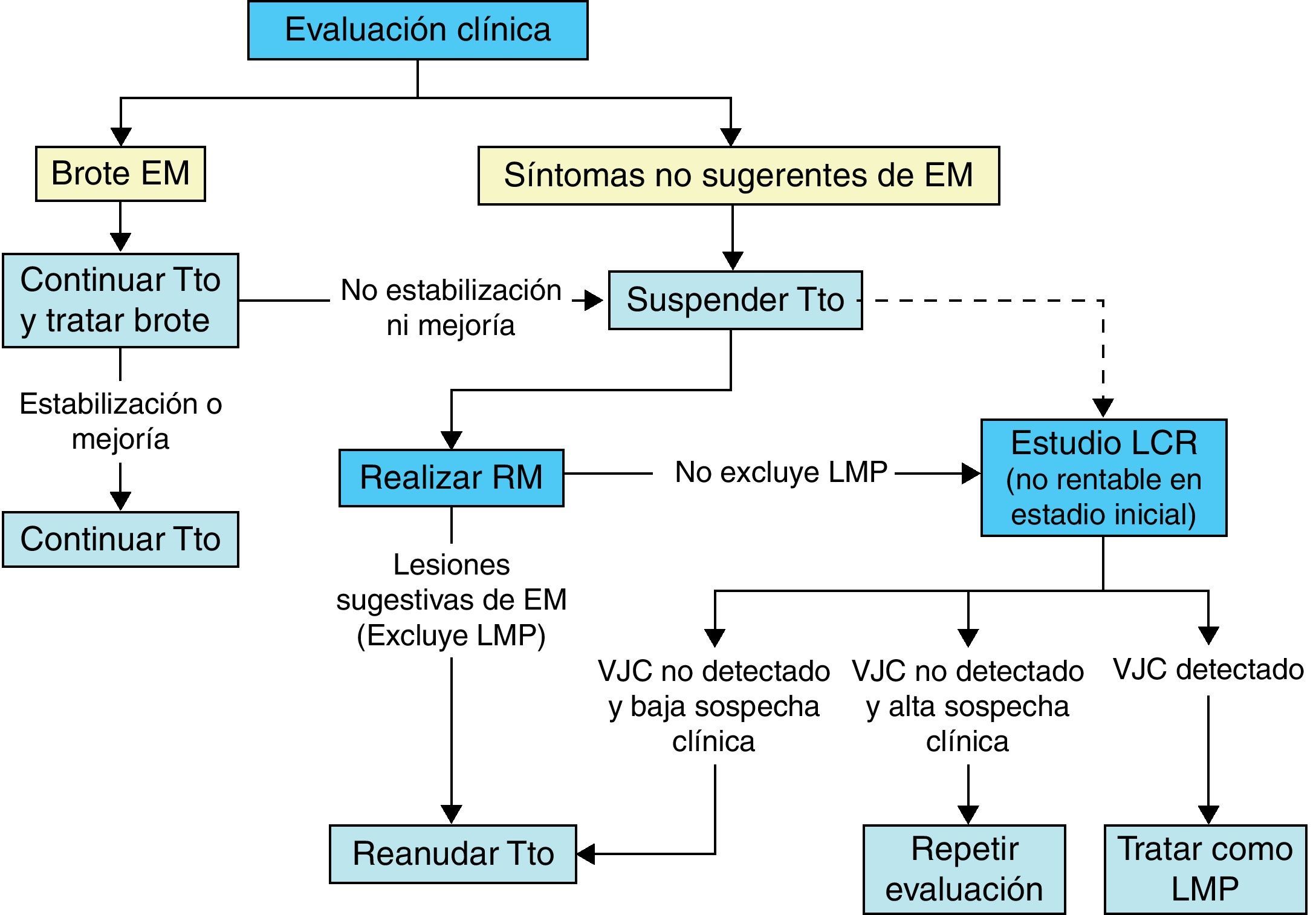
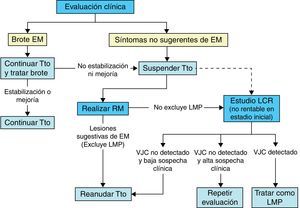
Durante el tratamiento con natalizumab se debe monitorizar el curso clínico con revisiones clínicas neurológicas periódicas cada 3-6 meses, en particular si aparecen nuevos síntomas, intentando descartar especialmente la LMP (fig. 3).
Algoritmo aconsejable de actuación en caso de aparición de síntomas en el curso clínico de los pacientes tratados con natalizumab (EM: esclerosis múltiple; Tto: tratamiento; RM: resonancia magnética; LMP: leucoencefalopatía multifocal progresiva; LCR: líquido cefalorraquídeo; VJC: virus JC).
Se debe realizar una RM cerebral previa al inicio de tratamiento con natalizumab (en los tres meses previos). Posteriormente (aunque no existen evidencias que demuestren la efectividad de la RM en la detección de una LMP en una fase subclínica, por lo que no pueden establecerse recomendaciones sobre la utilización de esta técnica para el diagnóstico precoz - fase preclínica -de esta complicación), y probablemente debido a una falta de experiencia en el manejo de pacientes con EM en tratamiento con natalizumab, se ha propuesto el realizar RM cerebrales de control para la detección precoz de una posible LMP y cuya frecuencia dependerá del grupo de riesgo al que pertenezca el paciente, cada 6 meses en pacientes con alto riesgo de desarrollar una LMP y cada 12 meses en pacientes con un riesgo medio o bajo.
Se debe realizar una RM cerebral urgente ante cualquier síntoma o signo neurológico que nos haga sospechar o dudar entre un brote o sintomatología relacionada con la aparición de LMP.
La RM se debe realizar en servicios de radiología con personal entrenado en EM y en las complicaciones de su tratamiento. Es recomendable que en los sucesivos estudios del paciente se utilicen máquinas similares (a ser posible la misma) y utilizando protocolos estandarizados, que deben incluir secuencias FLAIR ponderadas en T2 y secuencias ponderadas en T1 sin y con contraste.
Monitorización de laboratorioSe debe realizar un estudio analítico con un hemograma y una bioquímica básica (incluida función hepática) al inicio y al menos cada 3 meses. Aunque las alteraciones hepáticas son infrecuentes, se sugiere la suspensión temporal del fármaco hasta normalización de las enzimas hepáticas previo a la reintroducción del tratamiento. Al inicio del tratamiento, si hay alguna sospecha de inmunosupresión, se deben determinar neutrófilos, CD4, CD8 y cociente CD4/CD8. En zonas donde la incidencia de la infección de VIH es alta, se recomienda realizar serología de VIH previa al inicio de tratamiento. Si existe riesgo de tuberculosis se recomienda radiografía de tórax y test tuberculínico.
Determinación de anticuerpos neutralizantes antinatalizumabLos pacientes en tratamiento con natalizumab presentan anticuerpos neutralizantes en el suero persistentes en alrededor del 9%, apareciendo en los 6 primeros meses. La mayoría de estos anticuerpos neutralizantes se asocian con reacciones alérgicas o de hipersensibilidad, especialmente en la segunda infusión. Es aconsejable realizar anticuerpos neutralizantes antinatalizumab probablemente en todos los pacientes, pero debe ser obligatorio en los siguientes casos:
- ∘
Pacientes con reacciones alérgicas o de hipersensibilidad al fármaco.
- ∘
Brote clínico o datos en resonancia de actividad radiológica.
Si un paciente tiene en una muestra presencia de anticuerpos neutralizantes, se debe repetir dicho análisis al cabo de 4 semanas. Si el resultado fuera de nuevo positivo (anticuerpos persistentes) se recomienda la suspensión del tratamiento, por cuanto su presencia se relaciona con pérdida de la eficacia clínica de natalizumab y un aumento de la incidencia de reacciones de hipersensibilidad1,13.
Información para el pacienteA los 24 meses de tratamiento a todos los pacientes se les debe informar de nuevo sobre el beneficio y riesgo que se conozca en esos momentos en el empleo de natalizumab y el paciente tiene de nuevo que consentir la continuidad del tratamiento, debiéndose dejar constancia escrita en la historia clínica de la información trasmitida al paciente. Esta información debe renovarse anualmente y cada vez que se produzca algún conocimiento nuevo relativo al riesgo del tratamiento (fig. 4).
Retirada del tratamiento y seguimientoLa retirada de natalizumab se ha asociado con la reaparición de actividad de la enfermedad, durando los efectos clínicos del fármaco unos 3 meses (aunque el efecto biológico se prolonga durante 6-12 meses)37. Por ello, tras la retirada de natalizumab se aconseja iniciar tratamiento inmediato con un inmunomodulador (interferón beta o acetato de glatirámero) o corticosteroides38. Es preciso advertir, de acuerdo con la ficha técnica, que el natalizumab permanece en la sangre durante aproximadamente 12 semanas después de la última dosis, por lo que el comienzo de otros tratamientos durante este intervalo dará lugar a una exposición concomitante de ambos fármacos y se deben extremar las medidas de seguridad.
Si el paciente comenzó a recibir natalizumab por falta de eficacia de uno de los inmunomoduladores, lo razonable es utilizar aquel frente al cual no ha estado expuesto con anterioridad. Se desconoce el papel que pueden jugar los fármacos orales próximos a aparecer en el mercado a este respecto.
La aparición de LMP es una grave complicación, puesto que implica una alta tasa de mortalidad (20%) y de morbilidad. El mejor tratamiento es la prevención, pero ésta es compleja al no existir determinaciones diagnósticas sencillas y fiables que puedan anticipar el desarrollo de LMP. Por ello, se recomienda un alto grado de vigilancia y actuar según las recomendaciones actualmente disponibles4,12–16. La sospecha diagnóstica se basa en datos clínicos y de RM y la confirmación pasa por la detección del virus JC en el LCR.
El tratamiento de la LMP asociada al tratamiento con natalizumab busca la eliminación rápida del medicamento en la sangre, combatir el virus y evitar el daño neurológico producido por el síndrome inflamatorio por reconstitución inmune (SIRI). Dado que la LMP se atribuye al bloqueo de acceso de células linfoides al interior del SNC como consecuencia del mecanismo de acción de natalizumab, el objetivo prioritario es cancelar su acción. Para ello, se han utilizado plasmaféresis o inmunoadsorción en diversas pautas39.
Se han ensayado diversos tratamientos antivirales, inmunomoduladores o los antagonistas del receptor 5HT2a, entre ellos psicofármacos (mirtazapina), sin resultados claros; la utilidad del antipalúdico mefloquina no está clara y ha sido empleado en varios casos de LMP.
El SIRI, que aparece varias semanas después de la plasmaféresis o de la inmunoadsorción, puede causar daño neurológico muy grave o la muerte, y se caracteriza por la aparición de deterioro neurológico junto a signos inflamatorios evidentes en la neuroimagen. Aunque no hay consenso sobre la prevención y el tratamiento del SIRI, hay abundantes evidencias clínicas, fundamentalmente derivadas de la experiencia de pacientes con VIH, que sugieren la utilidad del uso de corticosteroides a altas dosis por vía intravenosa en ambas situaciones.
Por último, no existe ninguna evidencia de cuál puede ser el tiempo más adecuado de «lavado» tras natalizumab previo al inicio con otros fármacos de perfil inmunosupresor; puede hipotetizarse que entre 3-6 meses sería un tiempo suficiente, pero este hecho debe confirmarse. Igualmente, se desconoce cuál es el riesgo de la implementación secuencial de otro inmunosupresor, en particular para la aparición de LMP, por lo que estos aspectos deberán ser muy controlados en el futuro, en particular tras la aparición de los fármacos orales.
ConclusionesEn resumen, en el momento actual se está dando un paso muy importante en el tratamiento de la esclerosis múltiple con natalizumab, dirigido a una medicina personalizada. Se dispone de datos suficientes sobre el beneficio y se conoce mucho mejor el riesgo asociado al tratamiento, al haberse tratado un número muy grande de pacientes a nivel global.
Ésto permite establecer con una aproximación cuantitativa bastante certera la relación beneficio/riesgo y estratificar e informar a los pacientes del riesgo al que se someten en cada momento del tratamiento, sea al comienzo o durante el seguimiento, teniéndose en cuenta tres variables (anticuerpos anti virus JC, antecedente de inmunosupresión y duración del tratamiento).
Se empieza a disponer de recomendaciones para la monitorización del tratamiento.
Se conocen cada vez mejor las consecuencias de la retirada del tratamiento y cuáles son las medidas a tomar en este caso, lo que permite evitar la reagudización de la enfermedad y en su caso la aparición del temido SIRI.
Todo ello permite tratar con mucha mayor confianza la EM con natalizumab, aportando los beneficios notables de este fármaco, al tiempo que se reducen al máximo los riesgos asociados a su empleo.
Conflicto de interesesOscar Fernández ha recibido honorarios como asesor en comités, como moderador o ponente en congresos y reuniones científicas, ha participado en ensayos clínicos y en otros proyectos de investigación promovidos por Biogen-Idec, Bayer-Schering; Merck-Serono, Teva y Novartis.
Xavier Montalban ha recibido honorarios como ponente y gastos de viaje a reuniones científicas, ha sido miembro de comités directivos de ensayos clínicos y ha participado en comités como asesor de ensayos clínicos en los últimos años con Bayer Schering Pharma, Biogen Idec, EMD Merck Serono, Genentech, Genzyme, Novartis, Sanofi-Aventis, Teva Pharmaceuticals y Almirall.
Agradecemos los valiosos comentarios de A. Miralles, C.de Andrés, A. Rovira, L. Landete, F.J. Hernández, J. Meca, B. Casanova, C. Arnal y V. Pérez de Colosía y a G. Morley su contribución en la elaboración del texto.