La encefalopatía de Wernicke (EW) es la principal complicación neurológica provocada por el déficit de tiamina, cofactor de enzimas clave en el metabolismo energético, el magnesio también está implicado como cofactor de tiamina1. Puede ser alcohólica o no alcohólica2 (por desnutrición o incremento en la pérdida de vitaminas hidrosolubles, como en la diálisis renal). La prevalencia de lesiones de la EW en la autopsia fue del 12,5% en alcohólicos3 y del 30-60% de las muertes relacionadas con el alcohol4,5. Es poco reconocida y subdiagnosticada. Aunque el varón supera el número de casos, el género femenino es más susceptible6,7. El diagnóstico es clínico y el tratamiento precoz es fundamental para evitar el estado de coma y muerte.
Presentamos el caso de una mujer de 81 años, de 1,58cm de altura y un peso de 58kg (IMC: 23,2), previamente autónoma.
Entre los antecedentes destacamos, 10.° año de escolaridad, sin hábitos etílicos, hipertensa, una hernia de hiato esofágico hace 18 años, operada de reflujo gastroesofágico hace 15 años, colecistectomizada y una pancreatitis aguda biliar antigua. Medicada con pantoprazol, domperidona, ácido ursodesoxicólico, candesartán, mexazolam, mirtazapina y brotizolam.
Después de un proceso gripal se instala en 2-3 semanas un cuadro de anorexia, deshidratación, confusión mental, alteraciones del ciclo sueño-vigilia, de la visión y de la marcha.
Al examen físico presentaba somnolencia reactiva, orientada en el espacio, no en el tiempo, discurso incoherente, estrabismo, nistagmo inagotable horizonto-rotatorio en la mirada horizontal, disfagia a líquidos e hipotonía. Hemodinámicamente estable. ACP: normal y ECG: ritmo sinusal. Análisis: sin anemia, sin leucocitosis y PCR normal. Benzodiazepinas en orina 2 veces aumentado el valor normal. El resultado de la TAC craneal fue normal y 24h después describe un dudoso infarto lacunar de la lámina cuadrigémina derecha (fig. 1A), para caracterizar mejor por RM cerebral. El ecocardiograma transtorácico no reveló fuente cardioembólica y la punción lumbar fue normal.
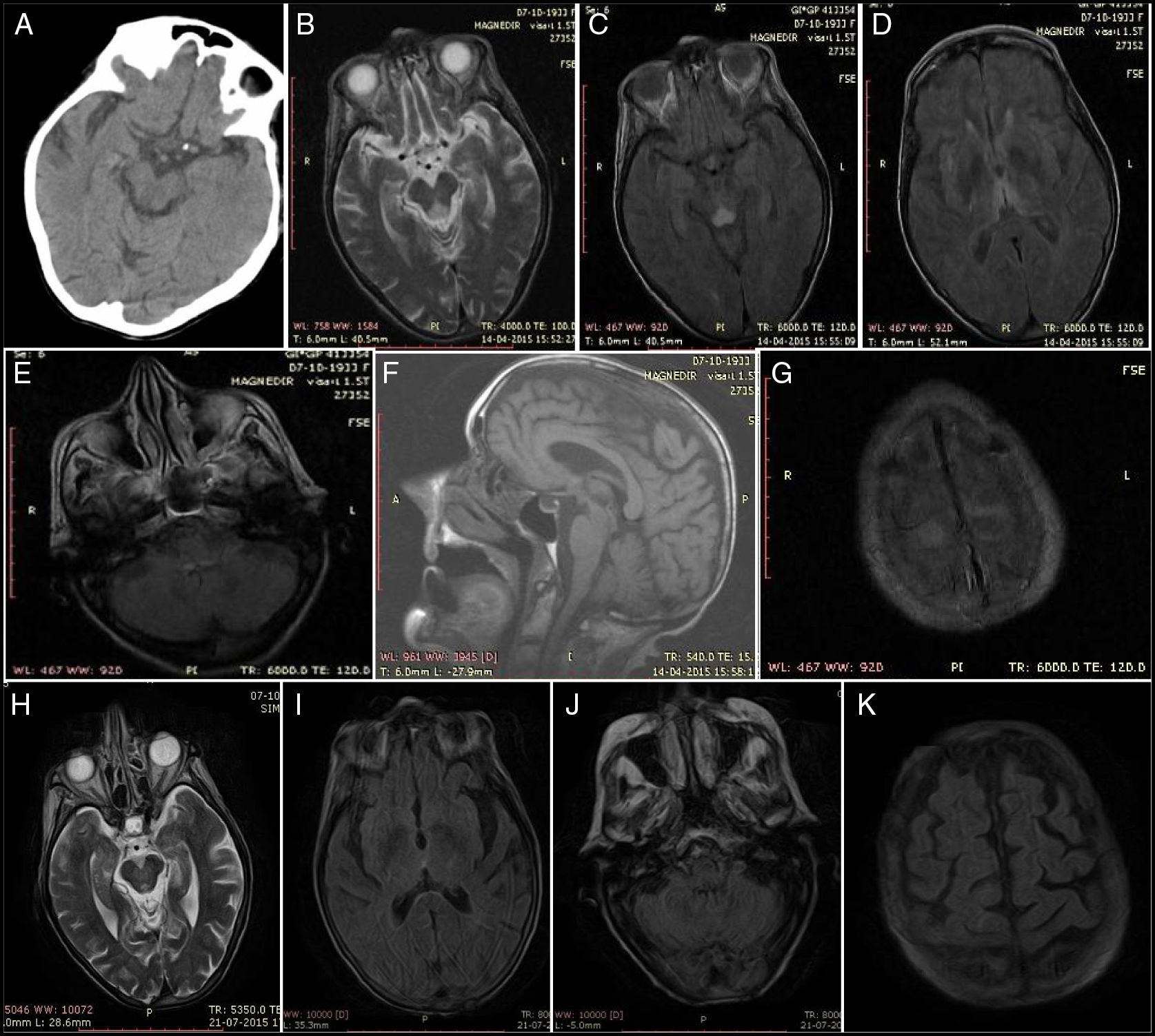
Hallazgos iniciales: A) TC craneal a las 24h: hipodensidad de la lámina cuadrigémina derecha. B) T2 axial. C) FLAIR axial: lesión en región periacueductal mesencefálica. D) FLAIR axial: lesión talámica bilateral. E) FLAIR axial: lesión en el techo bulbar. F) T1 sagital: sin alteraciones. G) FLAIR axial: lesión cortico-pial frontal superior. Hallazgos de resolución: H) T2 axial: lesión periacueductal en regresión. I) FLAIR axial: sin lesión talámica. J) FLAIR axial: sin lesión bulbar. K) FLAIR axial: sin lesión cortico-pial.
Inició tratamiento con tiamina en altas dosis con 500mg iv/8h/2 días, 500mg iv/24h/5 días y 100mg iv/8h los restantes días del ingreso en combinación con suero multivitamínico (vitaminas A, B, H y F —biotina—) y suplemento proteico-calórico.
Inicialmente fue ingresada en la unidad de ictus para excluir infarto del tronco cerebral. Se observa una mejoría clínica significativa con menor intensidad del nistagmo, una mejor expresión verbal y corrección del patrón de sueño. La RM cerebral (figs. 1 B-G) al 5.° día de evolución describe una hiperintensidad difusa de las siguientes estructuras: placa tectum del mesencéfalo, región periacueductal, tálamos mediales, cuerpos mamilares, regiones adyacentes del diencéfalo y del córtex de la convexidad con atrofia encefálica, imagen que traduce una EW.
Al 6.° día del ingreso se deriva la paciente al servicio de neurología. Se encontraba despierta, sin respuesta verbal espontanea, estrabismo —exotropía del ojo derecho—, pupilas isocóricas y reactivas (reflejo fotomotor y consensual conservados), nistagmo leve horizonto-rotatorio en la mirada horizontal. Sin déficits motores, sin colaboración en la restante exploración. Mantenía la sonda nasogástrica de alimentación con un peso de 39kg (IMC: 15,6).
En la investigación realizada fueron detectados los siguientes déficits: hemoglobina 7,8g/dl; hematocrito 24% (36-46); vitamina B1 27ng/ml (28-85); vitamina B12 158pg/ml (187-883); vitamina D 17ng/ml (30-100); magnesio 1,37mg/dl (1,6-2,6); sodio 135mg/dl (136-145); proteínas 5,3g/dl (6,4-8,3) y albúmina 2,9g/dl (3,2-4,6). El resultado de otros análisis fue normal: VCM y HCM (glóbulos rojos); ácido fólico, amonio, función tiroidea y metabolismo fosfocálcico. El anticuerpo factor intrínseco y la serología de sífilis fueron negativas.
Realizó una transfusión de 1U de glóbulos rojos; mantuvo tiamina 100mg iv/8h, fue retirado pantoprazol e inició ranitidina 150mg al acostar, hizo tratamiento vía oral con vitamina B12 con dosis de 5mg/día, colecalciferol 667UI/día, magnesio 10ml/12h, carbonato calcio 500mg/12h y suero salino al 0,9%.
En las 2 primeras semanas de la evolución presentó mejoría del discurso, emitía frases y el nistagmo aparecía únicamente en la mirada extrema, posteriormente fue detectada una ataxia de la marcha y comenzó rehabilitación.
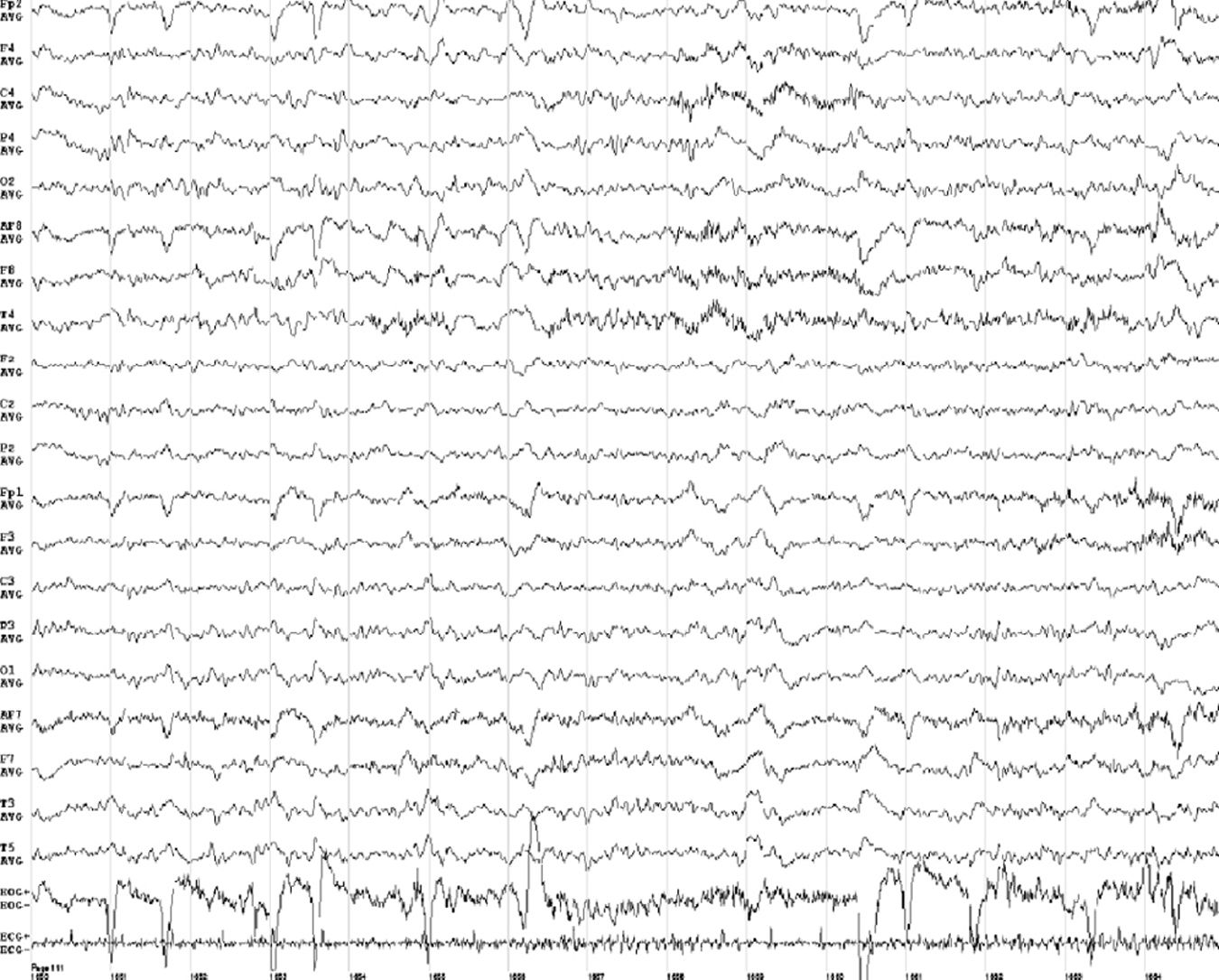
Al 1.° mes de la evolución, se realizó un EEG (fig. 2) de vigilia que mostró una actividad de base lenta indicando alteración cerebral difusa (grados 2-3). Los niveles de vitamina B1 fueron de 193ng/ml. La paciente es trasladada a una institución para convalecencia con SNG de alimentación.
A partir del 2.° mes de la evolución siguiendo el protocolo terapéutico vigente, nuestra paciente presentaba un buen aspecto general, discurso fluido y coherente, el MMSE era de 23 (orientación 4, fijación 3, atención y cálculo 4, recuerdo diferido 3, lenguaje y construcción 9), tenía autocrítica, interaccionaba con la familia y la marcha era únicamente posible con apoyo. Necesitaba auxilio para la alimentación e higiene personal. Participaba en trabajos manuales y realizaba regularmente rehabilitación.
Al 3.° mes de la evolución se observa una mejoría significativa del estado de nutrición, camina con andador y la RM cerebral revela remisión completa de las lesiones cerebrales (figs. 1 H-K).
En la evaluación neuropsicológica la memoria autobiográfica estaba preservada. En la escala de inteligencia de Wechsler para adultos (WAIS-III) solo se consiguieron aplicar 3 subtest: matrices, semejanzas y memoria de dígitos con la siguiente interpretación: nivel superior, nivel medio y nivel medio, respectivamente. No fueron identificadas áreas deficitarias.
La EW debe ser considerada en el diagnóstico diferencial de todo paciente con delirio8 o ataxia aguda. Además, enfermedades estructurales en el tálamo medial, hipocampo o región medial inferior del lóbulo temporal deberían ser consideradas por la sobreposición neuroanatómica con la EW. Estas incluyen ictus del top de la basilar, encefalopatía hipóxico-isquémica post-parada cardíaca, encefalitis del virus herpes simple y tumor del III ventrículo9,10.
En nuestro caso la edad de presentación no es la habitual (8.ª década de la vida), cumple la tríada clásica (encefalopatía, disfunción oculomotora y ataxia), aunque no fue evidenciada a la admisión. El tipo clínico de EW fue severa y la causa un inadecuado aporte de nutrientes11. Hubo una pérdida del 33% de peso con un IMC 15,6 (menor de 16, correspondiente a una delgadez III/severa según la OMS 1995, 2000).
La malnutrición proteico-calórica no siempre está presente, en una revisión de 625 casos descritos en la literatura, el ayuno o desnutrición como causa de EW fue del 10,2%12.
La neuroimagen (RM encefálica) fue característica, aunque esta prueba es más sensible para detectar lesiones de EW en pacientes no alcohólicos que en alcohólicos13 y la evolución clínica fue espectacular con el régimen vitamínico.
En relación con la fisiopatología de este cuadro, hubo extenuación de las reservas de tiamina en 2-3 semanas por restricción calórica, en ese momento la función de los sistemas enzimáticos dependientes de tiamina se deteriora así como la concentración de tiamina que circula en el torrente sanguíneo disminuye. Este daño es iniciado a los 4 días del déficit de tiamina y progresa conduciendo eventualmente a la muerte celular programada. A los 14 días del déficit vitamínico, las lesiones se desarrollan en el cerebro11. Probablemente, algunas personas que genéticamente presentan una menor actividad transcetolasa tienen un requerimiento mayor de tiamina y por ello tienen mayor predisposición a tener EW en situaciones de mayor demanda o menor absorción13. El bajo nivel de magnesio (cofactor de tiamina) contribuyó en la génesis de esta entidad. Otros factores asociados fueron los déficits de vitamina B12 (la toma crónica de pantoprazol, suprime la producción de ácido gástrico pudiendo conducir a una malabsorción de vitamina B1214), vitamina D y albumina.
La originalidad de este caso es que siendo el perfil de nuestra paciente de varias semanas de evolución con alteración del estado mental, visión y marcha, la primera hipótesis diagnóstica fue un ictus vertebrobasilar, a su vez en un contexto de una desnutrición severa no alcohólica fue diagnosticada la EW con clínica y neuroimagen más típicas de un paciente alcohólico.
Proponemos que en los pacientes de edad avanzada con alteración de conciencia de causa desconocida, la EW debe ser tomada en consideración, incluso en los pacientes no alcohólicos, y la infusión de tiamina se debe comenzar de inmediato cuando se sospecha esta enfermedad, incluso cuando se carece de síntomas típicos.
Con este caso queremos alertar para la necesidad de reconocer esta entidad de alta mortalidad, prevenible y tratable.