El glioblastoma (GB) es el tumor maligno primario más frecuente del sistema nervioso central1. El GB afecta generalmente a la sustancia blanca subcortical de los hemisferios cerebrales y su presentación infratentorial es rara siendo su localización en el cerebelo excepcional (<1%)2. Se presenta el reto en el diagnóstico de un caso de GB multifocal con una afectación llamativa del cerebelo y su evolución con el tratamiento.
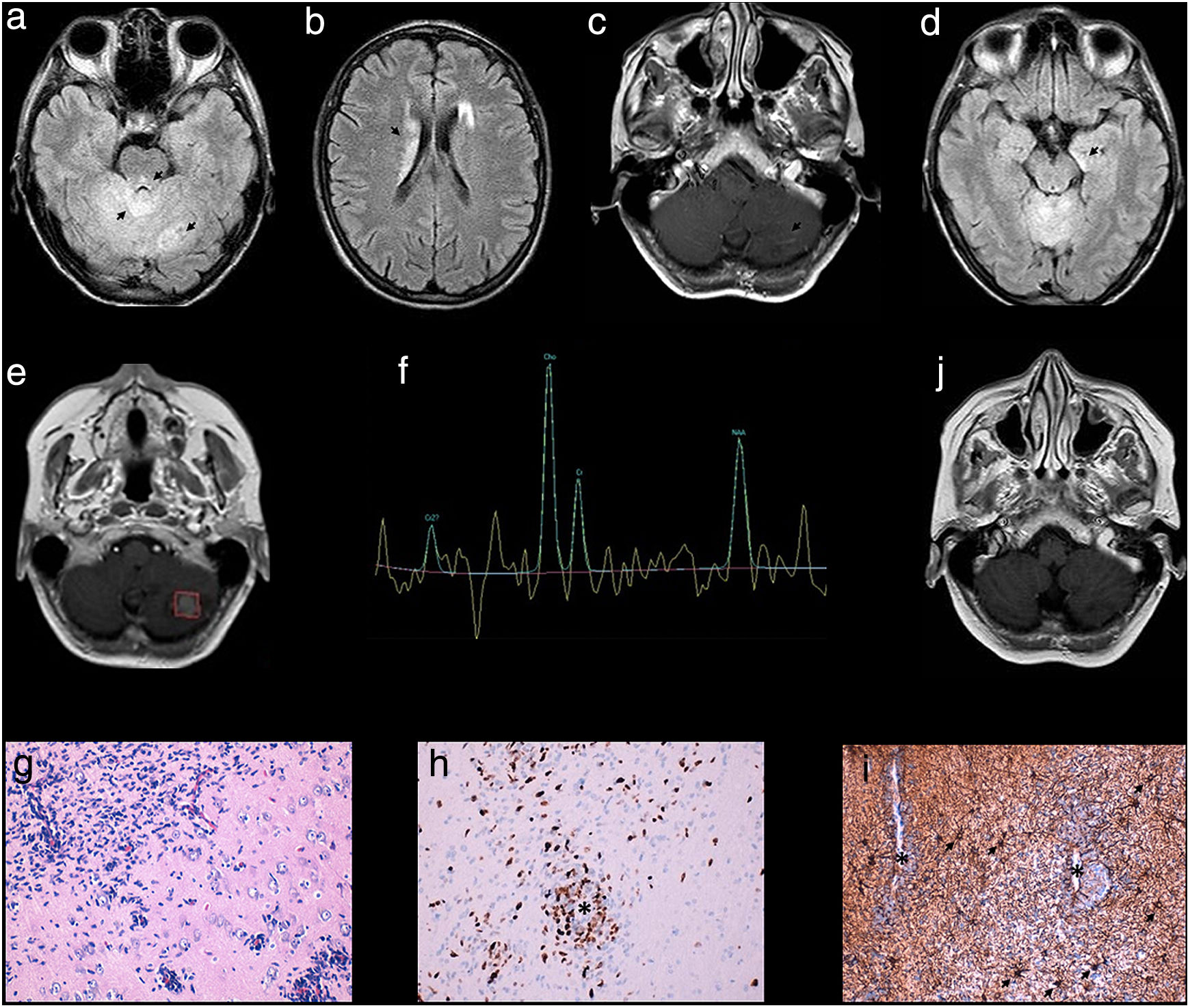
Mujer de 49 años estudiada a finales del 2014 por inestabilidad y vómitos frecuentes de 2 años de evolución con una marcada pérdida de peso. En la exploración se objetivó una marcha atáxica sin otras alteraciones. Los análisis incluyendo hormonas, vitaminas, anticuerpos y serologías fueron normales. La RM cerebral (1,5 teslas) mostró un aspecto tumefactivo del cerebelo con una afectación difusa del vermis y varias lesiones en ambos hemisferios cerebelosos hiperintensas en T2, así como a nivel periacueductal mesencefálico y supratentorial en núcleos caudados (figs. 1a y b). Tras la administración de contraste se objetivó un realce de aspecto lineal en las lesiones cerebelosas (fig. 1c). Estos hallazgos sugirieron inicialmente un proceso de tipo granulomatoso, inflamatorio. El estudio del LCR fue normal salvo los niveles del enzima convertidora de la angiotensina (94U/l, rango normal: 8-53U/l). Un TC-body, PET/TC con flúor-18-desoxiglucosa (18F-FDG PET/TC) y SPECT/TC con galio-67 (67Ga-SPECT/TC) fueron normales. Se instauró tratamiento empírico para una posible neurosarcoidosis con prednisona y metotrexato manteniéndose a los 6 meses clínicamente sin cambios. Sin embargo, el control de RM (en este caso, de 3T) objetivó, además de las lesiones ya conocidas y estables, una alteración de señal a nivel temporal mesial izquierda (fig. 1d). La biopsia estereotáxica del lóbulo anterior temporal izquierdo fue negativa. Durante los primeros meses la paciente se mantuvo clínica y radiológicamente sin cambios, objetivándose a los 12 meses una progresión de la lesión de mayor tamaño a nivel hemisférico cerebeloso izquierdo (fig. 1e). La espectroscopia mostró un aumento del pico de creatina y mioinositol con un ratio colina/N-acetil aspartato (Cho/NAA) normal, salvo a nivel de la lesión cerebelosa izquierda (ratio Cho/NAA>2) (fig. 1f). El estudio anatomopatológico de una segunda biopsia a nivel del hipocampo izquierdo reveló una infiltración por una proliferación celular neoplásica de alto grado, constituida por núcleos hipercrómicos e irregulares y pequeños focos de necrosis. Los hallazgos histológicos junto con el análisis inmunohistoquímico y de fluorescencia por hibridación in situ (FISH) resultó compatible con el diagnóstico de GB (figs. 1g e i).
Hallazgos en RM: alteración de señal afectando al cerebelo, mesencéfalo y caudados (a y b: 1,5 T, FLAIR). Realce de aspecto lineal de las lesiones cerebelosas (c: T1 con gadolinio). A los 6 meses, alteración de señal a nivel temporal mesial izquierda (d: 3 T, FLAIR). A los 12 meses, captación seudonodular de contraste de la lesión de mayor tamaño cerebelosa izquierda (e: T1 con gadolinio) que muestra en la espectroscopia un ratio Cho/NAA> de 2 (f). A las 6 semanas tras radioterapia y TMZ, disminución de la alteración de señal que afectaba al cerebelo (j: FLAIR). Estudio histológico: infiltración por células gliales astrocitarias que forman manguitos perivasculares (g: sección de hipocampo, tinción H&E ×400). Inmunohistoquímica que muestra el índice proliferativo elevado de las células tumorales y su localización perivascular (*) (1h: MIB-1 [Ki-67] ×200) y astrocitos reactivos (flechas) uniformemente distribuidos en contraposición con la agregación celular densa perivascular de células tumorales que tienen una expresión variable para la proteína glial fibrilar ácida (*) (i: PGFA ×200).
La paciente fue tratada con radioterapia (60Gy) y temozolamida (TMZ) concomitante mostrando una mejoría radiológica a las 6 semanas del tratamiento (fig. 1j). Se continuó con TMZ 160mg/m2/cada 4 semanas/durante 6 ciclos sustituyéndose por progresión de la enfermedad por tratamiento con irinotecán (CPT-11, 150mg/m2) y bevacizumab (BVZ, 10mg/kg) cada 4 semanas. La paciente falleció a los 14 meses desde el inicio de la terapia antitumoral.
La presentación multicéntrica de los gliomas es poco frecuente y la mayor parte se localizan a nivel supratentorial3. En este caso, la afectación supra e infratentorial, especialmente llamativa del cerebelo, y el larvado curso clínico, crearon dudas respecto a su patogenia. Como se muestra en el mismo, la mayor resolución de la resonancia puede poner de manifiesto lesiones menos visibles y, también, la inclusión de la espectroscopia puede ser clave para orientar su origen hacia un proceso tumoral4.
El tratamiento estándar del GB se basa en la cirugía, cuando es posible, y en la radioterapia y quimioterapia con TMZ5,6. El CPT-11, inhibidor de la topoisomerasa I, y el BVZ, anticuerpo monoclonal inhibidor del factor de crecimiento del endotelio vascular (VEGF), se utilizan como segunda línea de tratamiento basándose en la alta vascularización de estos tumores7. La presentación multifocal y la localización cerebelosa se han descrito como factores independientes de peor pronóstico8,9. En este caso, la supervivencia tras el diagnóstico fue similar al promedio general de los GB, que es de aproximadamente 12 meses10.
En conclusión, la presentación multifocal de un GB supone un reto diagnóstico obligando a diferenciarlo de otros procesos como pueden ser las lesiones inflamatorias o granulomatosas. En este sentido, la espectroscopia es una herramienta que puede resultar muy útil para orientar el proceso. Finalmente, se debe considerar la posibilidad de esta entidad, a pesar de su baja frecuencia, en las lesiones del cerebelo.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.





![Hallazgos en RM: alteración de señal afectando al cerebelo, mesencéfalo y caudados (a y b: 1,5 T, FLAIR). Realce de aspecto lineal de las lesiones cerebelosas (c: T1 con gadolinio). A los 6 meses, alteración de señal a nivel temporal mesial izquierda (d: 3 T, FLAIR). A los 12 meses, captación seudonodular de contraste de la lesión de mayor tamaño cerebelosa izquierda (e: T1 con gadolinio) que muestra en la espectroscopia un ratio Cho/NAA> de 2 (f). A las 6 semanas tras radioterapia y TMZ, disminución de la alteración de señal que afectaba al cerebelo (j: FLAIR). Estudio histológico: infiltración por células gliales astrocitarias que forman manguitos perivasculares (g: sección de hipocampo, tinción H&E ×400). Inmunohistoquímica que muestra el índice proliferativo elevado de las células tumorales y su localización perivascular (*) (1h: MIB-1 [Ki-67] ×200) y astrocitos reactivos (flechas) uniformemente distribuidos en contraposición con la agregación celular densa perivascular de células tumorales que tienen una expresión variable para la proteína glial fibrilar ácida (*) (i: PGFA ×200). Hallazgos en RM: alteración de señal afectando al cerebelo, mesencéfalo y caudados (a y b: 1,5 T, FLAIR). Realce de aspecto lineal de las lesiones cerebelosas (c: T1 con gadolinio). A los 6 meses, alteración de señal a nivel temporal mesial izquierda (d: 3 T, FLAIR). A los 12 meses, captación seudonodular de contraste de la lesión de mayor tamaño cerebelosa izquierda (e: T1 con gadolinio) que muestra en la espectroscopia un ratio Cho/NAA> de 2 (f). A las 6 semanas tras radioterapia y TMZ, disminución de la alteración de señal que afectaba al cerebelo (j: FLAIR). Estudio histológico: infiltración por células gliales astrocitarias que forman manguitos perivasculares (g: sección de hipocampo, tinción H&E ×400). Inmunohistoquímica que muestra el índice proliferativo elevado de las células tumorales y su localización perivascular (*) (1h: MIB-1 [Ki-67] ×200) y astrocitos reactivos (flechas) uniformemente distribuidos en contraposición con la agregación celular densa perivascular de células tumorales que tienen una expresión variable para la proteína glial fibrilar ácida (*) (i: PGFA ×200).](https://static.elsevier.es/multimedia/02134853/0000003600000003/v1_202103200928/S0213485320300943/v1_202103200928/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

