El drenaje lumbar externo de líquido cefalorraquídeo es una medida promisoria para la prevención de las complicaciones de la isquemia cerebral tardía asociada a la hemorragia subaracnoidea espontánea de origen aneurismático.
MétodosSe incluyeron los estudios controlados que evaluaran los efectos del drenaje lumbar externo en pacientes con hemorragia subaracnoidea aneurismática. Los desenlaces primarios fueron: nuevos infartos cerebrales y discapacidad grave. Los desenlaces secundarios fueron: deterioro clínico causado por isquemia cerebral tardía, mortalidad y necesidad de derivación ventricular definitiva. Los resultados se presentaron en riesgos relativos combinados, con un intervalo de confianza del 95% (IC 95%).
ResultadosFueron incluidos un total de 6 estudios controlados. Los riesgos relativos combinados fueron: nuevos infartos cerebrales, 0,48 (IC 95%: 0,32-0,72); discapacidad grave, 0,5 (IC 95%: 0,29-0,85); deterioro clínico causado por isquemia cerebral tardía, 0,46 (IC 95%: 0,34-0,63); mortalidad, 0,71 (IC 95%: 0,24-2,06) y necesidad de derivación ventricular definitiva, 0,80 (IC 95%: 0,51-1,24). La evaluación de la heterogeneidad demostró índices estadísticamente significativos únicamente en el análisis de discapacidad grave (I2=70% y p=0,01).
ConclusiónEl drenaje lumbar externo se asoció con una reducción estadísticamente significativa del riesgo de complicaciones causadas por la isquemia cerebral tardía (infartos cerebrales y deterioro clínico), así como del riesgo de discapacidad grave; sin embargo, esto no se tradujo en una menor mortalidad. No obstante, no es prudente emitir recomendaciones definitivas debido a la heterogeneidad cualitativa y cuantitativa entre los estudios. Son necesarios más ensayos clínicos con definiciones homogéneas de sus desenlaces para aclarar sus efectos en los pacientes con hemorragia subaracnoidea aneurismática.
External lumbar drainage is a promising measure for the prevention of delayed aneurysmal subarachnoid hemorrhage-related ischemic complications.
MethodsControlled studies evaluating the effects of external lumbar drainage in patients with aneurysmal subarachnoid hemorrhage were included. Primary outcomes were: new cerebral infarctions and severe disability. Secondary outcomes were: clinical deterioration due to delayed cerebral ischemia, mortality, and the need of definitive ventricular shunting. Results were presented as pooled relative risks, with their 95% confidence intervals (95% CI).
ResultsA total of 6 controlled studies were included. Pooled relative risks were: new cerebral infarctions, 0.48 (95% CI: 0.32-0.72); severe disability, 0.5 (95% CI: 0.29-0.85); delayed cerebral ischemia-related clinical deterioration, 0.46 (95% CI: 0.34-0.63); mortality, 0.71 (95% CI: 0.24-2.06), and need of definitive ventricular shunting, 0.80 (95% CI: 0.51-1.24). Assessment of heterogeneity only revealed statistically significant indexes for the analysis of severe disability (I2=70% and P=.01).
ConclusionExternal lumbar drainage was associated with a statistically significant decrease in the risk of delayed cerebral ischemia-related complications (cerebral infarctions and clinical deterioration), as well as the risk of severe disability; however, it was not translated in a lower mortality. Nevertheless, it is not prudent to provide definitive recommendations at this time because of the qualitative and quantitative heterogeneity among included studies. More randomized controlled trials with more homogeneous outcomes and definitions are needed to clarify its impact in patients with aneurysmal subarachnoid hemorrhage.
El vasoespasmo cerebral y la isquemia cerebral tardía (ICT) son las complicaciones más frecuentes y graves de la hemorragia subaracnoidea aneurismática (HSA), presentándose en el 20 al 50% de los casos1–3. El vasoespasmo se caracteriza por la reducción progresiva del diámetro de las arterias que conforman el polígono de Willis, y se observa usualmente entre los días 4 y 14 posteriores al inicio de los síntomas4–6. Por su parte, la ICT se manifiesta clínicamente por deterioro neurológico que no se explica por otras condiciones, tales como hiponatremia, hipoxemia, infecciones, edema pulmonar, toxicidad por drogas, hidrocefalia o resangrado7. La lesión inducida por la ICT puede llegar a ocasionar infartos cerebrales, independientemente del desarrollo de vasoespasmo cerebral8,9.
Gran parte de los recursos diagnósticos y terapéuticos que demandan los pacientes con HSA están dirigidos a la identificación, prevención o tratamiento del vasoespasmo y la ICT. Diversos estudios han explorado la utilidad de glucocorticoides, antagonistas del receptor de la endotelina, estatinas, sulfato de magnesio, ácido acetilsalicílico, hipotermia, nitroglicerina transdérmica, ebselen y trombolíticos; sin embargo, ninguno de estos tratamientos ha demostrado su aplicabilidad en la práctica clínica1,10–12. Otras alternativas, como la administración oral de nimodipino, la terapia hemodinámica, los vasodilatadores intraarteriales y la angioplastia endovascular sí han demostrado beneficios en la prevención y el tratamiento de los déficits isquémicos relacionados con el vasoespasmo; sin embargo, su efectividad es limitada13.
Aunque los mecanismos fisiopatológicos involucrados en la patogénesis del vasoespasmo no han sido completamente esclarecidos, actualmente se reconoce el papel preponderante de los productos de degradación de la hemoglobina como desencadenantes del proceso14,15. Se ha demostrado que la incidencia de vasoespasmo e ICT se relaciona estrechamente con el volumen, la densidad y la persistencia de los coágulos dentro del espacio subaracnoideo y las cavidades ventriculares4,14. De acuerdo con este concepto, se ha postulado que la extracción quirúrgica temprana de estas sustancias podría disminuir su frecuencia y severidad16. Una revisión sistemática realizada por Komotar et al. evaluó la utilidad del lavado cisternal con fenestración de la lamina terminalis en los pacientes tratados mediante microcirugía, sin embargo, los autores no observaron los supuestos beneficios de esta medida17.
Los drenajes ventriculares externos también favorecen la eliminación del líquido cefalorraquídeo (LCR) impregnado de los productos de degradación de la hemoglobina, sin embargo, su efectividad clínica tampoco ha podido ser comprobada y, en cambio, se han asociado con mayor riesgo de hidrocefalia poshemorrágica18–21.
Los drenajes lumbares externos (DLE) son otra alternativa para la extracción del LCR, con menor tasa de complicaciones hemorrágicas, obstructivas e infecciosas, en comparación con los drenajes ventriculares22. El principio teórico de su uso en pacientes con HSA se fundamenta en los estudios realizados por MaCdonald22 y por Hänggi et al.23, quienes notaron que al propiciar el aclaramiento del LCR podría reducirse la incidencia de vasoespasmo y sus potenciales consecuencias.
Algunos trabajos han revelado que la concentración de componentes hemáticos en el LCR obtenido de pacientes con HSA es mayor cuando se recolecta través de un DLE que cuando se obtiene mediante sistemas de derivación ventricular externa, demostrando así que estas sustancias se acumulan de forma predominante en las cisternas basales y la cisterna lumbar24,25. Estos hallazgos indican que el drenaje a través de la cisterna lumbar permitiría una remoción más eficiente de los productos de degradación de la hemoglobina y, por tanto, podría hacer más evidentes sus potenciales beneficios clínicos.
Existen estudios preliminares que han explorado la utilidad del DLE en los pacientes con HSA, los cuales han planteado la posible reducción del riesgo de morbimortalidad y complicaciones isquémicas relacionadas con el vasoespasmo26; sin embargo, estos aún no han sido evaluados en forma de metaanálisis.
MétodosSe realizó una revisión sistemática de la literatura siguiendo las recomendaciones consignadas en la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses –PRISMA–27.
Búsqueda de la literaturaLa búsqueda electrónica se llevó a cabo durante el mes de julio de 2013, utilizando los siguientes motores de búsqueda: MEDLINE/PubMed, EMBASE, Google Scholar, Cochrane Library, CINAHL, EBSCO, HINARI, SciELO y Google Académico. No se aplicaron restricciones de idioma o fecha de publicación.
Los términos utilizados fueron: «subarachnoid hemorrhage», «hydrocephalus», «lumbar drain», «external ventricular drain», «cerebral infarction», «stroke», «vasospasm» y «delayed ischemic neurologic deficit».
Criterios de selecciónCriterios de inclusiónTipo de estudios:
- 1.
Estudios observacionales o ensayos clínicos controlados.
- 2.
Recuperación de los datos prospectiva o retrospectivamente.
Tipo de participantes:
- 1.
Estudios que solo incluyan pacientes adultos (mayores de 18 años) con HSA.
- 2.
Estudios que incluyan pacientes cuyo aneurisma fue ocluido por microcirugía o mediante terapia endovascular.
Tipo de intervención:
- 1.
Implantación del DLE durante la fase aguda de la rotura aneurismática (primeros 7 días del sangrado).
- 2.
DLE implantado durante por lo menos 3 días consecutivos.
Tipo de evaluación de desenlaces. Se incluyeron los estudios que evaluaran alguno de los siguientes parámetros:
- 1.
Nuevos infartos cerebrales relacionados con ICT.
- 2.
Discapacidad: evaluada mediante la escala de Rankin modificada o la puntuación en la Glasgow Outcome Scale (GOS)28–30.
- 1.
Utilización concomitante de trombolíticos u otro medicamento intratecal, en asociación con el DLE.
- 2.
Estudios que incluyeran menos de 10 pacientes.
- 3.
Estudios sin grupo control.
- 4.
Hemorragia subaracnoidea de causa diferente a la rotura de un aneurisma intracraneal (trauma, cirugía, vasculitis, malformaciones arteriovenosas, malformaciones cavernosas, angiomas venosos, telangiectasias capilares, etc.).
- 5.
Estudios referentes a aneurismas de origen traumático o infeccioso.
- 1.
Nuevos infartos cerebrales relacionados con ICT.
- 2.
Discapacidad grave.
- 1.
Deterioro clínico causado por ICT.
- 2.
Mortalidad.
- 3.
Necesidad de derivación ventricular definitiva.
- -
Nuevos infartos cerebrales relacionados con ICT: identificación de infartos cerebrales en la tomografía computarizada o en la resonancia magnética realizada en las primeras 6 semanas posteriores a la HSA, o mediante estudios patológicos en autopsias. Adicionalmente, no debían estar relacionados con procedimientos quirúrgicos o endovasculares (reparación microquirúrgica, endovascular y/o posicionamiento de catéteres ventriculares).
- -
Discapacidad grave: definida como una puntuación en la escala de Rankin modificada de 0, 1 o 2 puntos; o de 4 o 5 puntos en la GOS.
- -
Deterioro clínico causado por ICT: deterioro neurológico focal (tales como hemiparesia, afasia, apraxia, hemianopsia, o negligencia), o reducción de al menos 2 puntos en la GOS, al descartar otras causas de deterioro clínico (alteraciones metabólicas, hidroelectrolíticas, hidrocefalia, resangrado, complicaciones durante la reparación del aneurisma, etc.).
- -
Mortalidad: fallecimiento del sujeto durante el periodo de observación del estudio (independientemente de la causa).
- -
Derivación ventricular definitiva: requerimiento del implante de catéteres definitivos de derivación ventricular de LCR para el tratamiento de hidrocefalia poshemorrágica.
Los títulos de los artículos fueron evaluados por 2 revisores de forma independiente, quienes identificaron los estudios potencialmente relevantes en base a los respectivos resúmenes. Posteriormente, se obtuvieron los textos completos de los artículos potencialmente relevantes, a los cuales se les aplicaron los criterios de inclusión y exclusión preestablecidos. Los mismos revisores también se encargaron de la extracción de los datos y la evaluación de la calidad metodológica. Las discrepancias entre los revisores fueron resueltas mediante consenso.
Extracción de los datosSe recuperó la información referente al diseño del estudio, el tamaño de la muestra, el método de reparación del aneurisma causante de la HSA, momento de la colocación del DLE, duración del DLE, velocidad de drenaje de LCR a través del DLE, las definiciones de cada uno de los desenlaces primarios y secundarios, y el tiempo transcurrido desde el momento de la presentación de los síntomas hasta la evaluación de los desenlaces.
Para la evaluación de la discapacidad, los desenlaces se clasificaron de forma dicotómica y se registró el número de casos en el grupo tratado con DLE y en el grupo control. Para ello, se aplicó la correspondencia entre la escala de Rankin modificada y la GOS utilizada por Wong et al.31, en la cual, se considera un resultado favorable cuando la puntuación en la escala de Rankin modificada es de 0, 1 o 2 puntos, o de 4 o 5 puntos en la GOS. Esta equivalencia se utiliza rutinariamente en los metaanálisis que evalúan la efectividad de intervenciones farmacológicas en pacientes con HSA, demostrando buena concordancia entre ambas escalas7,31–33.
En caso de que los datos requeridos para la evaluación de la calidad y las estimaciones no estuviesen registrados explícitamente en el texto completo, se contactaron los autores principales mediante correo electrónico para solicitar la información requerida. Fue necesario contactar al autor principal de uno de los estudios para la obtención de los datos necesarios para incluir en las estimaciones correspondientes34.
Evaluación de la calidad metodológicaPara los estudios observacionales se usó la escala Newcastle-Ottawa, recomendada por el Grupo de Trabajo Cochrane de Metodología de Estudios no-Aleatorizados (Cochrane Non-Randomised Studies Methods Group)35, mientras que para los estudios aleatorizados se empleó la escala de Jadad, también conocida como sistema de puntuación de calidad de Oxford36,37.
Síntesis, análisis de los datos y evaluación de la heterogeneidadEl análisis del efecto terapéutico se realizó a través de la estimación del riesgo relativo (RR) combinado con el método de efectos aleatorios, con su respectivo intervalo de confianza del 95% (IC 95%) para todos los análisis dicotómicos9,33.
La heterogeneidad estadística fue evaluada mediante el estadístico I2 y la prueba Chi2. Para la interpretación de los resultados, se consideró estadísticamente significativa cuando los resultados de la estimación del estadístico I2 era>50%, y con respecto a la prueba Chi2, cuando p<0,138.
Todos los análisis estadísticos fueron realizados con el software estadístico Review Manager versión 5 (Cochrane Collaboration, Oxford, Reino Unido).
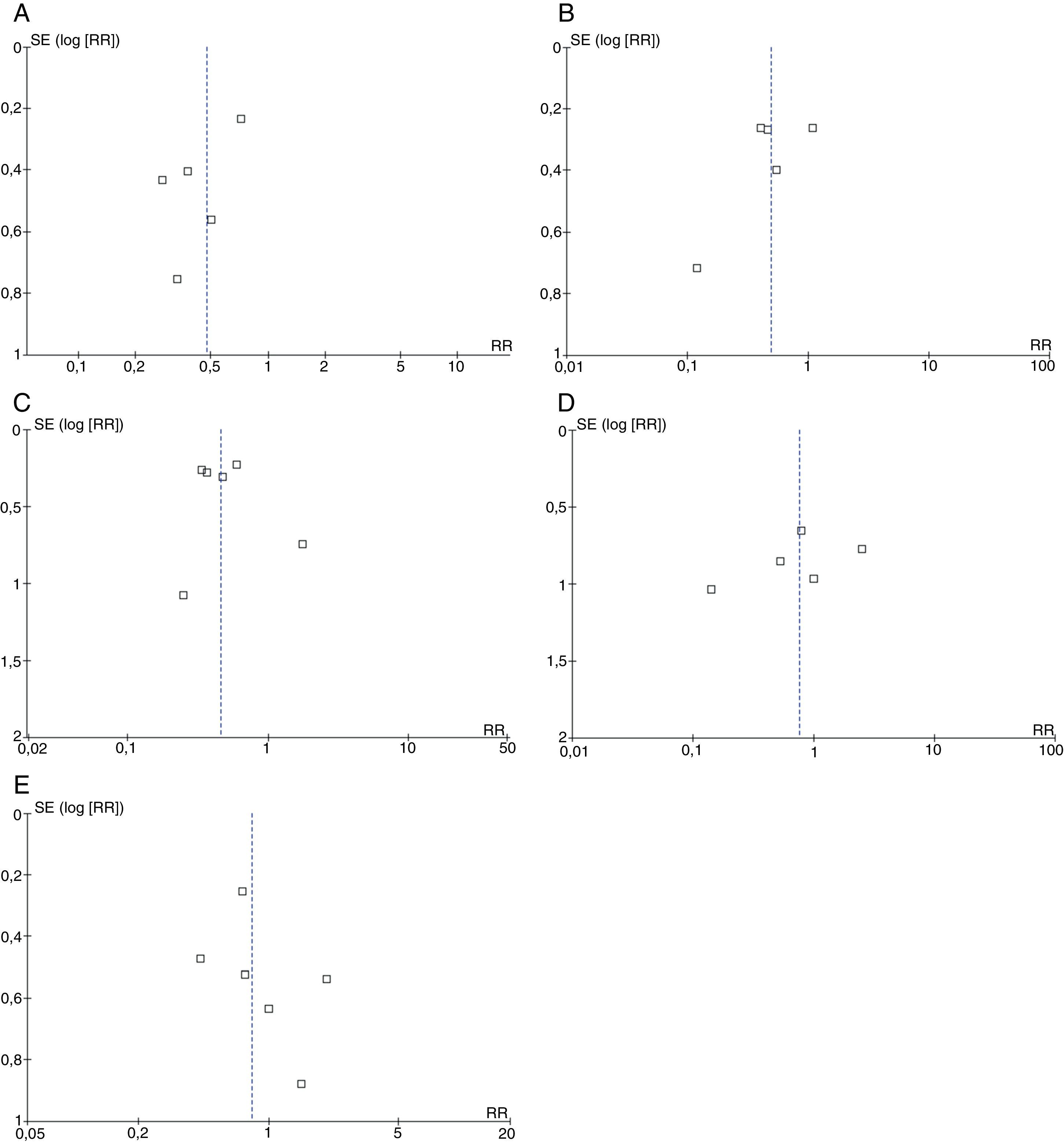
Se planificó la detección de potenciales sesgos de publicación mediante el análisis de gráficos en embudo o «funnel plots».
Adicionalmente, se realizó un análisis de subgrupos para determinar la magnitud del efecto terapéutico de acuerdo con la metodología de los estudios (observacionales controlados y ensayos clínicos).
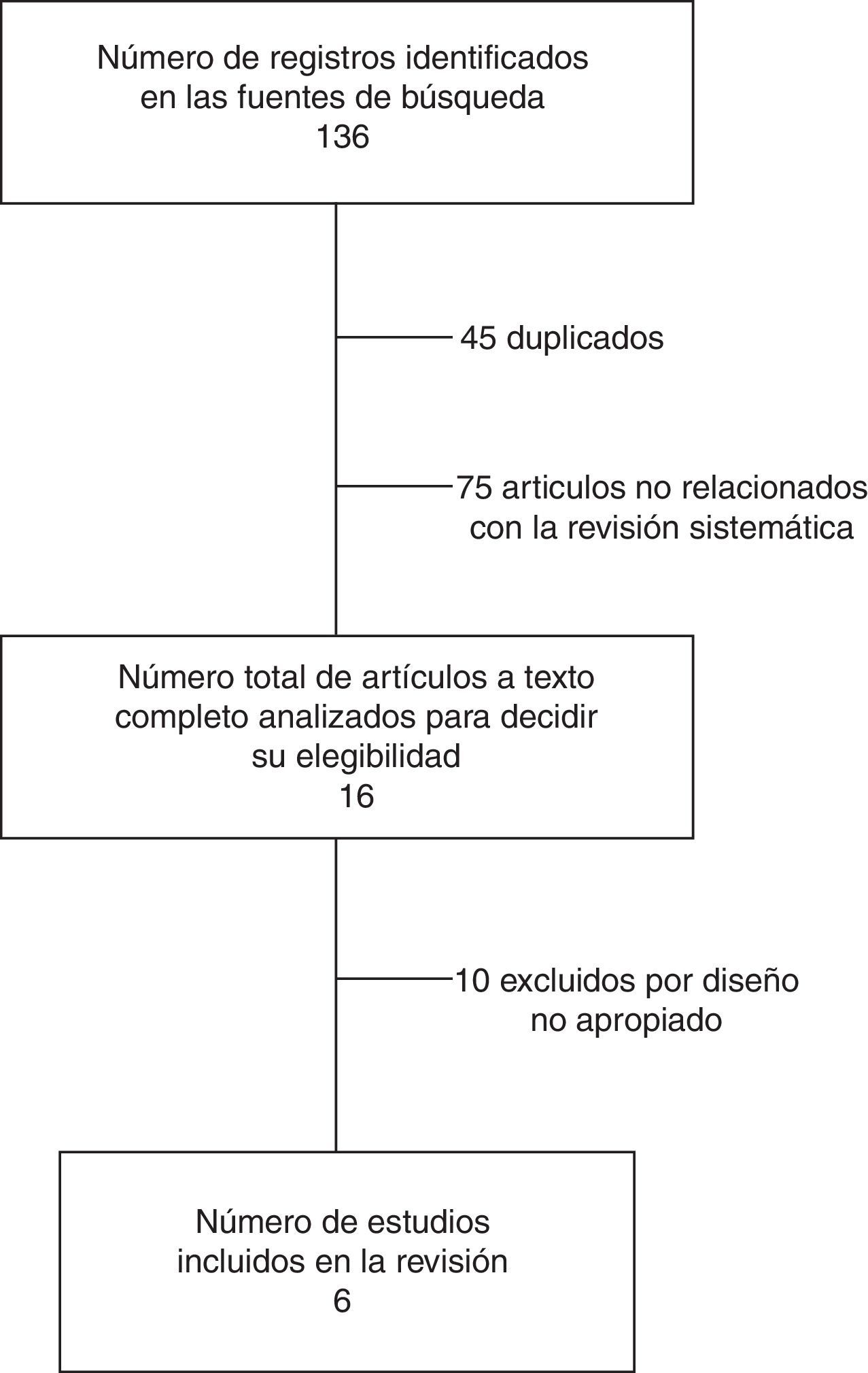
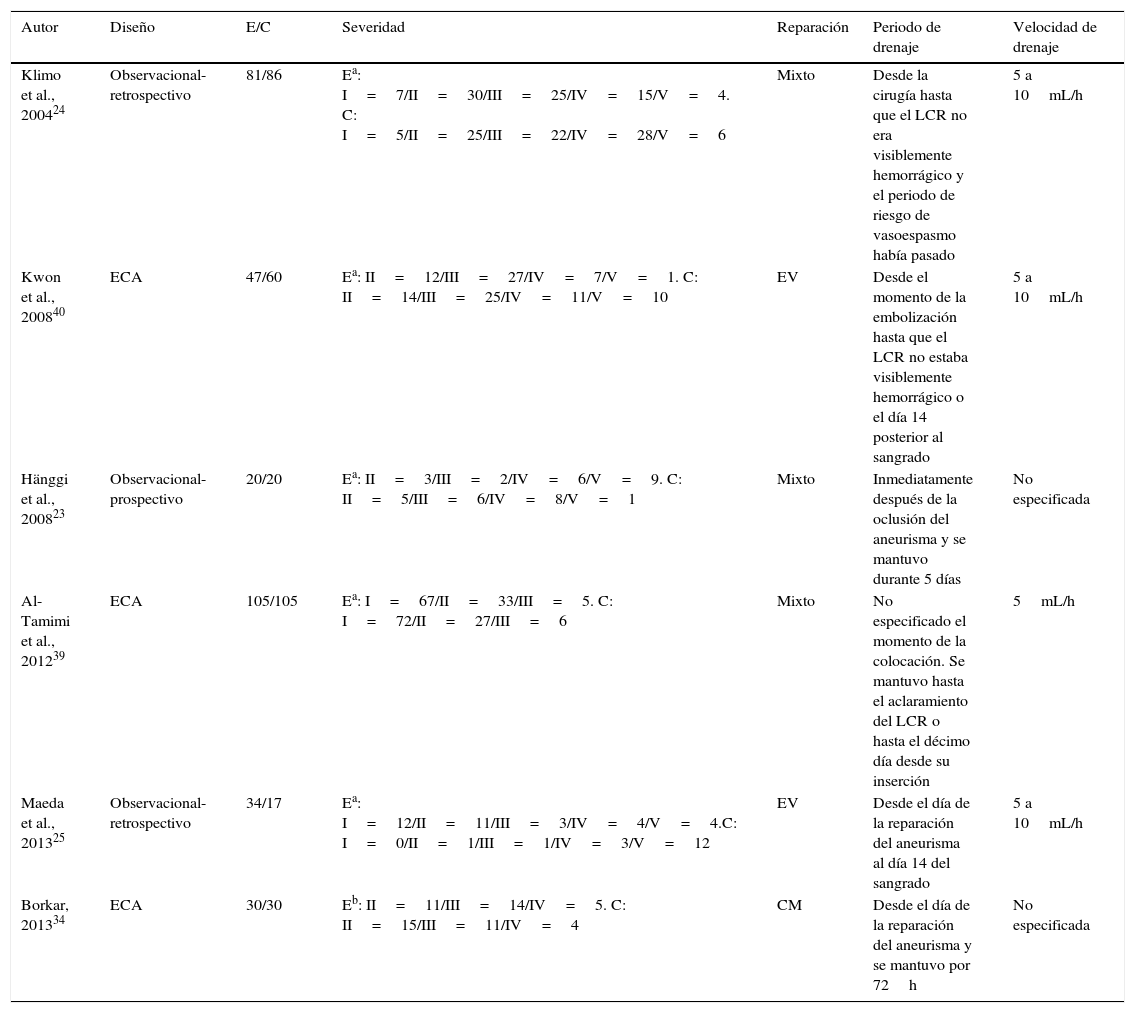
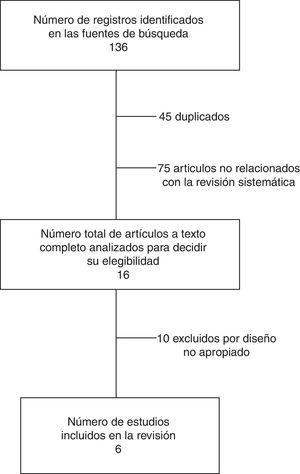
ResultadosResultados de la búsquedaLa revisión de la literatura permitió identificar 136 artículos que coincidían con los términos de búsqueda. Tras la evaluación del resumen, el texto completo y la aplicación de los criterios de inclusión y exclusión, fueron seleccionados para la evaluación cualitativa y cuantitativa un total de 6 estudios controlados (635 sujetos) que evaluaban por lo menos alguno de los desenlaces primarios o secundarios del presente metaanálisis (tabla 1). Tres de estos estudios se realizaron con asignación aleatoria a los grupos de tratamiento o control (ensayos clínicos)34,39,40.
Características de los estudios incluidos
| Autor | Diseño | E/C | Severidad | Reparación | Periodo de drenaje | Velocidad de drenaje |
|---|---|---|---|---|---|---|
| Klimo et al., 200424 | Observacional-retrospectivo | 81/86 | Ea: I=7/II=30/III=25/IV=15/V=4. C: I=5/II=25/III=22/IV=28/V=6 | Mixto | Desde la cirugía hasta que el LCR no era visiblemente hemorrágico y el periodo de riesgo de vasoespasmo había pasado | 5 a 10mL/h |
| Kwon et al., 200840 | ECA | 47/60 | Ea: II=12/III=27/IV=7/V=1. C: II=14/III=25/IV=11/V=10 | EV | Desde el momento de la embolización hasta que el LCR no estaba visiblemente hemorrágico o el día 14 posterior al sangrado | 5 a 10mL/h |
| Hänggi et al., 200823 | Observacional-prospectivo | 20/20 | Ea: II=3/III=2/IV=6/V=9. C: II=5/III=6/IV=8/V=1 | Mixto | Inmediatamente después de la oclusión del aneurisma y se mantuvo durante 5 días | No especificada |
| Al-Tamimi et al., 201239 | ECA | 105/105 | Ea: I=67/II=33/III=5. C: I=72/II=27/III=6 | Mixto | No especificado el momento de la colocación. Se mantuvo hasta el aclaramiento del LCR o hasta el décimo día desde su inserción | 5mL/h |
| Maeda et al., 201325 | Observacional-retrospectivo | 34/17 | Ea: I=12/II=11/III=3/IV=4/V=4.C: I=0/II=1/III=1/IV=3/V=12 | EV | Desde el día de la reparación del aneurisma al día 14 del sangrado | 5 a 10mL/h |
| Borkar, 201334 | ECA | 30/30 | Eb: II=11/III=14/IV=5. C: II=15/III=11/IV=4 | CM | Desde el día de la reparación del aneurisma y se mantuvo por 72h | No especificada |
C: control; CM: clip microquirúrgico; DLE: drenaje lumbar externo; E: caso de estudio; ECA: estudio controlado aleatorizado; EV: endovascular; LCR: líquido cefalorraquídeo.
Los resultados de la revisión de la literatura se presentan en la figura 1, y las características principales de los estudios, en la tabla 1.
Calidad de los estudiosEstudios observacionalesLa aplicación de la escala Newcastle-Ottawa demostró que todos los estudios observacionales mostraban descripciones adecuadas de las definiciones de los casos y de los desenlaces. Asimismo, la totalidad de los estudios incluyeron población representativa de aquella susceptible de beneficiarse del tratamiento (pacientes con HSA). En todos los estudios, los controles consistían en series paralelas conformadas por pacientes que no fueron seleccionados en base a otra dolencia diferente a la HSA. La evaluación de los resultados se realizó mediante entrevistas cegadas y revisión de historias clínicas, las cuales garantizan un aceptable nivel de certeza de la información. Los resultados de la evaluación de cada estudio se presentan en la tabla 2.
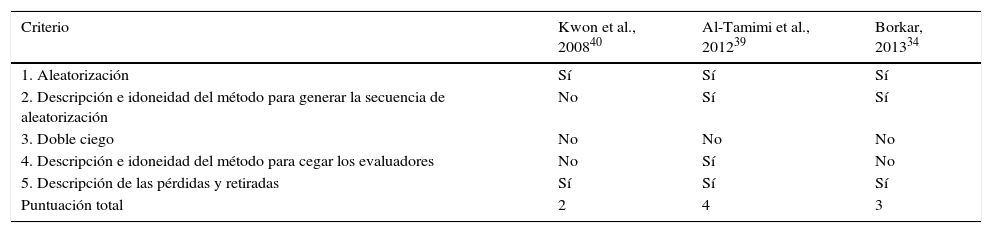
Estudios controlados aleatorizadosSe incluyeron un total de 3 estudios controlados, cuyo método de asignación a los grupos de comparación fueron descritos como aleatorizados34,39,40; sin embargo, en uno de ellos no se informó explícitamente el método utilizado para la secuencia de aleatorización40. Debido a que el DLE es una intervención en la cual el paciente no puede desconocer si se aplicó el tratamiento, ninguno de los estudios fue doble-ciego. Únicamente en el estudio realizado por Al-Tamimi et al. los desenlaces fueron evaluados por entrevistadores cegados39. Finalmente, tras la aplicación de la escala de Jadad, solo los estudios de Borkar y Al-Tamimi et al. fueron considerados de alta calidad metodológica34,39. La evaluación detallada de cada uno de los estudios se presenta en la tabla 3.
Evaluación de la calidad de los estudios clínicos controlados aleatorizados mediante la escala de Jadad
| Criterio | Kwon et al., 200840 | Al-Tamimi et al., 201239 | Borkar, 201334 |
|---|---|---|---|
| 1. Aleatorización | Sí | Sí | Sí |
| 2. Descripción e idoneidad del método para generar la secuencia de aleatorización | No | Sí | Sí |
| 3. Doble ciego | No | No | No |
| 4. Descripción e idoneidad del método para cegar los evaluadores | No | Sí | No |
| 5. Descripción de las pérdidas y retiradas | Sí | Sí | Sí |
| Puntuación total | 2 | 4 | 3 |
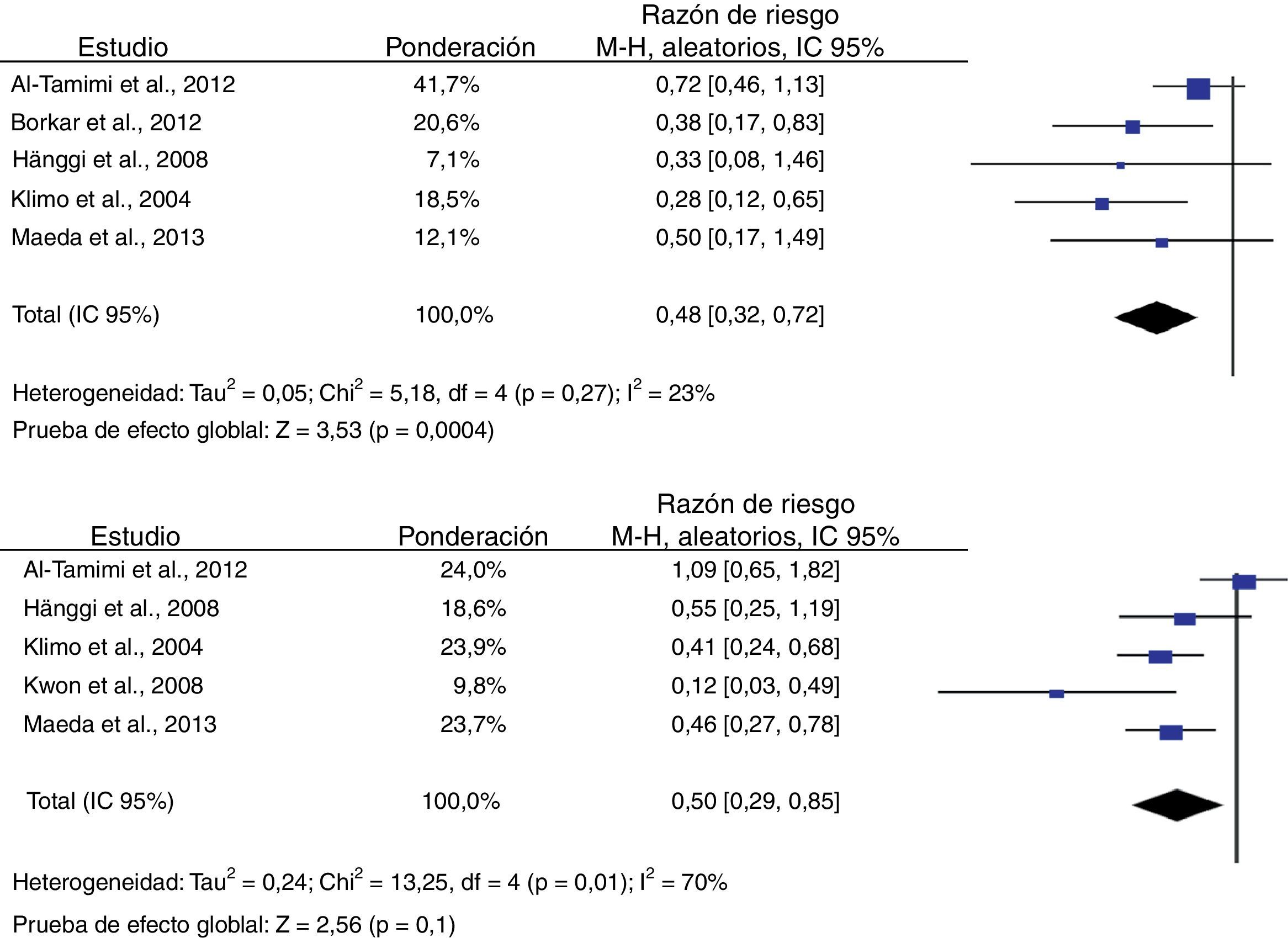
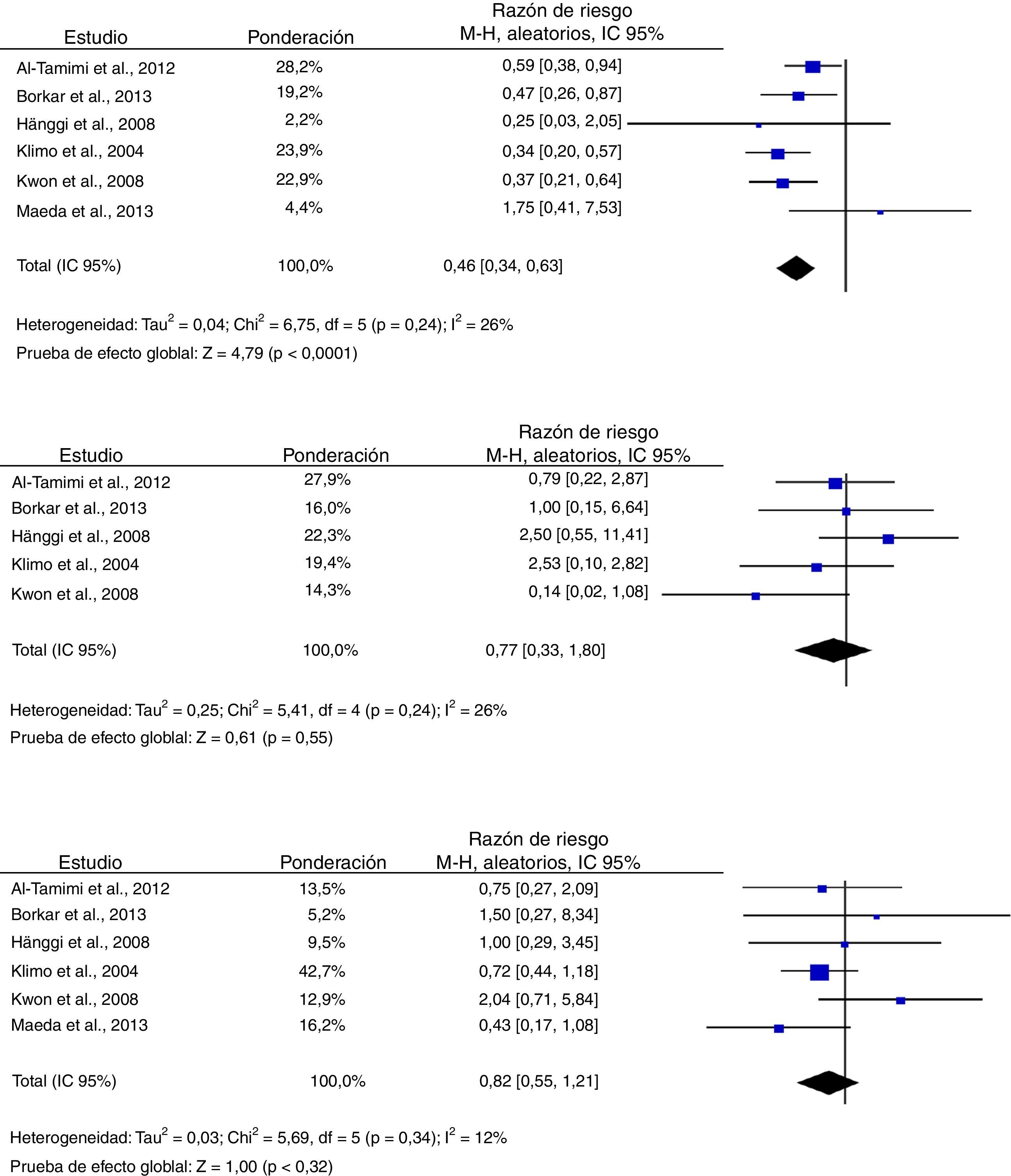
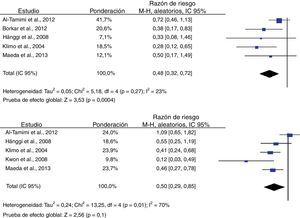
El análisis de los desenlaces primarios demostró que el DLE se asoció con un menor riesgo de aparición de nuevos infartos cerebrales observados en tomografía computarizada o resonancia magnética. El RR combinado entre los 5 estudios que evaluaron este desenlace fue de 0,48 (IC 95%: 0,32-0,72), cumpliendo los criterios preestablecidos de significación estadística (p<0,001). El índice I2 y el valor de p no demostraron heterogeneidad significativa (23% y 0,27, respectivamente)23–25,34,39. Seis estudios fueron incluidos en el análisis de discapacidad grave, cuyos resultados combinados demostraron que el uso del DLE se asoció con una reducción del riesgo (RR 0,50; IC 95%: 0,29-0,85; p=0,01), sin embargo, estos resultados fueron estadísticamente heterogéneos (I2=70%; p=0,01) (fig. 2)23–25,34,39,40.
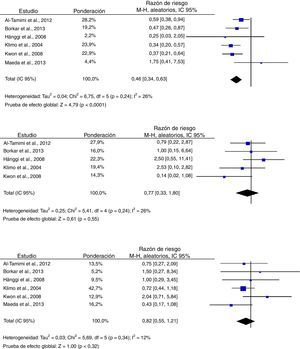
En referencia a los desenlaces secundarios, se encontraron resultados más homogéneos en los análisis correspondientes a deterioro clínico relacionado con ICT, mortalidad y necesidad de derivación ventricular definitiva de LCR. El riesgo de deterioro neurológico relacionado con ICT fue menor en los pacientes a quienes les fue implantado el DLE en comparación con los del grupo control (RR 0,46; IC 95%: 0,34-0,63; p<0,001), resultados que fueron consistentes en los estudios incluidos (I2=26%; p=0,24)23–25,34,39,40. Cinco estudios evaluaron el efecto del DLE sobre el riesgo de mortalidad, cuyo análisis arrojó un RR combinado de 0,77 (IC 95%: 0,33-1,80), que demuestra la ausencia de efectos beneficiosos o desfavorables (I2=44%; p=0,25)23,24,39,40. De forma similar, los resultados de los 6 estudios que examinaron la influencia del DLE sobre la necesidad de tratamiento quirúrgico de la hidrocefalia poshemorrágica demostraron que tampoco existe influencia del tratamiento (RR 0,82; IC 95%: 0,55-1,21; p=0,31) (fig. 3)23–25,34,39,40.
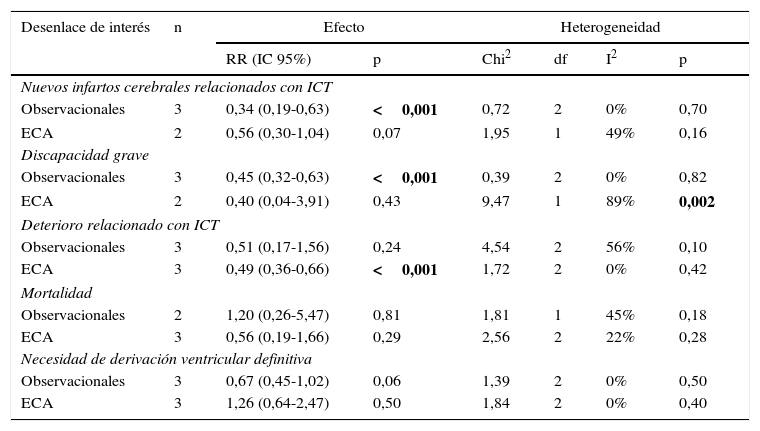
Análisis de subgruposEn la evaluación de subgrupos, fueron divididos los estudios de acuerdo con su metodología, realizándose análisis separados entre los estudios observacionales controlados y los ensayos clínicos. Los resultados de la estimación de los efectos y la heterogeneidad se presentan en la tabla 4.
Análisis de subgrupos de acuerdo con el diseño de los estudios
| Desenlace de interés | n | Efecto | Heterogeneidad | ||||
|---|---|---|---|---|---|---|---|
| RR (IC 95%) | p | Chi2 | df | I2 | p | ||
| Nuevos infartos cerebrales relacionados con ICT | |||||||
| Observacionales | 3 | 0,34 (0,19-0,63) | <0,001 | 0,72 | 2 | 0% | 0,70 |
| ECA | 2 | 0,56 (0,30-1,04) | 0,07 | 1,95 | 1 | 49% | 0,16 |
| Discapacidad grave | |||||||
| Observacionales | 3 | 0,45 (0,32-0,63) | <0,001 | 0,39 | 2 | 0% | 0,82 |
| ECA | 2 | 0,40 (0,04-3,91) | 0,43 | 9,47 | 1 | 89% | 0,002 |
| Deterioro relacionado con ICT | |||||||
| Observacionales | 3 | 0,51 (0,17-1,56) | 0,24 | 4,54 | 2 | 56% | 0,10 |
| ECA | 3 | 0,49 (0,36-0,66) | <0,001 | 1,72 | 2 | 0% | 0,42 |
| Mortalidad | |||||||
| Observacionales | 2 | 1,20 (0,26-5,47) | 0,81 | 1,81 | 1 | 45% | 0,18 |
| ECA | 3 | 0,56 (0,19-1,66) | 0,29 | 2,56 | 2 | 22% | 0,28 |
| Necesidad de derivación ventricular definitiva | |||||||
| Observacionales | 3 | 0,67 (0,45-1,02) | 0,06 | 1,39 | 2 | 0% | 0,50 |
| ECA | 3 | 1,26 (0,64-2,47) | 0,50 | 1,84 | 2 | 0% | 0,40 |
ECA: ensayos clínicos aleatorizados; ICT: isquemia cerebral tardía; IC 95%: intervalo de confianza del 95%; RR: riesgo relativo.
Todos los análisis se realizaron con el modelo de efectos aleatorios. Los valores estadísticamente significativos se resaltan en negrita.
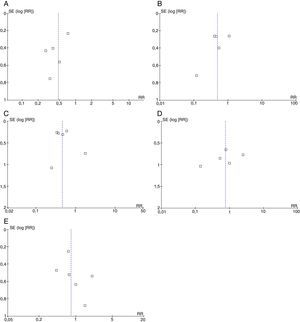
Los estudios, en general, fueron considerados con alto riesgo de sesgos debido a que en su texto completo no se mencionaron en detalle los métodos de evaluación de los desenlaces finales, especialmente en lo concerniente al cegamiento de los evaluadores. Los gráficos en embudo no demostraron asimetrías que evidenciaran sesgos de publicación para ninguno de los desenlaces, sin embargo, la certeza de estos análisis es baja debido a que el número total de estudios disponibles fue inferior a 1035(fig. 4) (Anexo)
DiscusiónLos resultados del presente metaanálisis muestran que el DLE es útil para la prevención de los infartos cerebrales asociados a ICT, lo cual fue observado tanto en el análisis combinado como en el subgrupo de estudios observacionales. Sin embargo, el análisis de los 2 estudios aleatorizados no demostró diferencias en el RR, posiblemente debido a la potencia estadística de los datos34,39. Este efecto es sumamente importante en los pacientes con HSA debido a que algunos estudios han demostrado su estrecha relación con la recuperación funcional a mediano y largo plazo41. Adicionalmente, también se encontró una reducción del riesgo de discapacidad grave asociado al uso del DLE, que es otro desenlace primario recomendado para la evaluación de intervenciones dirigidas a la prevención del vasoespasmo y la ICT8,9. No obstante, la heterogeneidad de los desenlaces referentes al resultado funcional fue estadísticamente significativa, lo cual impide emitir recomendaciones definitivas.
A pesar de los efectos beneficiosos de la eliminación del LCR a través del DLE en la aparición de ICT, no se encontraron diferencias estadísticamente significativas en el riesgo de mortalidad. Este hallazgo demuestra, una vez más, la disociación entre la incidencia de complicaciones relacionadas con la ICT y los desenlaces clínicos de los pacientes con HSA. Algunos autores han señalado que esta discrepancia podría estar causada por la aparición de eventos adversos y complicaciones, los cuales podrían contraponerse a los beneficios de un tratamiento determinado13. Esta hipótesis se vio reflejada en un metaanálisis acerca de la efectividad del tratamiento con clazosentan, un antagonista de los receptores de las endotelinas, el cual fue efectivo para la prevención de déficits neurológicos isquémicos e infartos cerebrales13; sin embargo, la mortalidad y la discapacidad no fueron menores que en el grupo tratado con placebo, debido a que las complicaciones pulmonares, hemodinámicas y hematológicas relacionadas con la administración del fármaco anulaban los beneficios del tratamiento42–44.
Aunque las complicaciones asociadas al uso del DLE pudieron haber influido en la similitud del riesgo de mortalidad, esta hipótesis es rebatible en base a varios estudios que han documentado su buen perfil de seguridad en los pacientes con HSA, ya que no aumentan el riesgo de resangrado o mortalidad45–47. Otra preocupación del implante de DLE en pacientes con HSA es el riesgo de herniación cerebral, especialmente en aquellos con hipertensión intracraneal. Por este motivo, los estudios incluidos en el presente metaanálisis excluyeron a los pacientes que presentaban compresión de las cisternas basales, así como a aquellos que a juicio del neurocirujano tratante fuese inseguro implantar el drenaje. Además, existen estudios preliminares que han demostrado la seguridad del DLE, incluso en pacientes con hipertensión intracraneal, siempre y cuando se coloque previamente una ventriculostomía y se mantenga un gradiente de presión a favor de la presión intracraneal46. Estas evidencias, en conjunto, demuestran que las complicaciones relacionadas con el implante del catéter lumbar no justifican la ausencia de efectos en el riesgo de mortalidad y, por tanto, en futuras investigaciones deberán explorarse otros posibles mecanismos.
Otro de los potenciales beneficios que se le ha atribuido al DLE es la disminución del riesgo de hidrocefalia poshemorrágica, ya que facilitaría la eliminación de los elementos hemáticos acumulados en el espacio subaracnoideo que ocasionan la obstrucción de las vellosidades aracnoideas de Pacchioni48,49. Sin embargo, el análisis combinado demostró que no existen diferencias en el riesgo de requerir derivación ventricular definitiva para el tratamiento de la hidrocefalia poshemorrágica, posiblemente debido a que la cantidad de detritus hemáticos capaces de impedir la reabsorción del LCR es muy baja, y el DLE podría ser insuficiente para eliminarlos49.
LimitacionesEn la interpretación de los hallazgos de este metaanálisis deben reconocerse varias limitaciones propias de su metodología y de los estudios que fueron incluidos. Quizás la de mayor relevancia sea la referente al análisis combinado de estudios aleatorizados y observacionales, lo cual supone un riesgo de diferencias entre los grupos de intervención (sesgos de selección) y de estudios que no reportaron explícitamente haberse realizado bajo un estricto protocolo de investigación (sesgos de reporte). Aunque el análisis combinado de estudios aleatorizados y observacionales se utiliza con frecuencia en las revisiones sistemáticas para aumentar la precisión de los resultados, este diseño no es recomendado por el Grupo Cochrane de Metodología de Estudios no-Aleatorizados, ya que puede acarrear riesgo de sesgos50. Valorando estas consideraciones, se realizó un análisis de subgrupos de acuerdo con la metodología de los estudios, el cual demostró que al analizar selectivamente los resultados de los ensayos clínicos, únicamente se pudieron confirmar los beneficios en la reducción del riesgo de deterioro clínico relacionado con ICT, lo que podría evidenciar la presencia de sesgos en los resultados de los análisis combinados.
También hay que señalar que aunque se realizaron los gráficos en embudo para la detección de potenciales sesgos de publicación, su certeza es limitada debido al bajo número de estudios que fueron analizados35.
En síntesis, los resultados del presente metaanálisis evidencian que el uso del DLE puede reducir el riesgo de complicaciones causadas por la ICT (infartos cerebrales y deterioro clínico), así como del riesgo de discapacidad grave, sin alterar el riesgo de mortalidad. No obstante, debido a la heterogeneidad cualitativa y cuantitativa entre los estudios, estos hallazgos no deben considerarse concluyentes y deberán ser actualizados tan pronto se cuente con los resultados de más ensayos clínicos, con definiciones homogéneas de sus desenlaces, para aclarar sus efectos en los pacientes con HSA51,52.
FinanciaciónEste estudio fue financiado por el Grupo de Investigación en Ciencias Neurológicas y Neurociencias, de Cartagena de Indias, Colombia.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Al Dr. Sachin A. Borkar, M. Ch. (Neurocirugía), del Departamento de Neurocirugía del All India Institute of Medical Sciences (Nueva Delhi, India), por su invaluable colaboración al facilitar los datos explícitos correspondientes a su estudio.
Al Dr. Keith Suárez-Jaramillo, del Departamento de Medicina Interna del University of Texas Health Science Center (San Antonio, Texas), por su invaluable colaboración en la revisión del resumen en inglés.
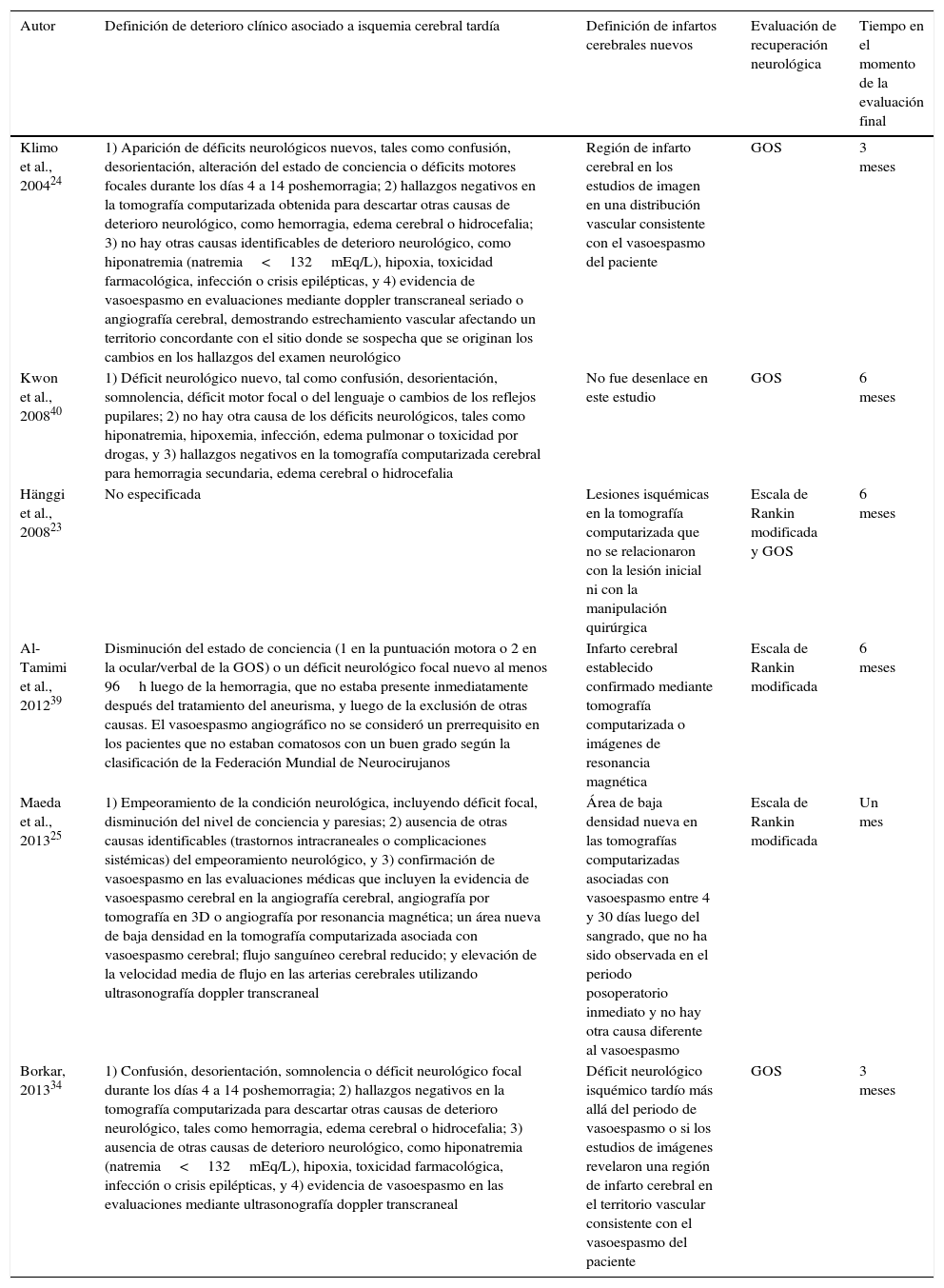
| Autor | Definición de deterioro clínico asociado a isquemia cerebral tardía | Definición de infartos cerebrales nuevos | Evaluación de recuperación neurológica | Tiempo en el momento de la evaluación final |
|---|---|---|---|---|
| Klimo et al., 200424 | 1) Aparición de déficits neurológicos nuevos, tales como confusión, desorientación, alteración del estado de conciencia o déficits motores focales durante los días 4 a 14 poshemorragia; 2) hallazgos negativos en la tomografía computarizada obtenida para descartar otras causas de deterioro neurológico, como hemorragia, edema cerebral o hidrocefalia; 3) no hay otras causas identificables de deterioro neurológico, como hiponatremia (natremia<132mEq/L), hipoxia, toxicidad farmacológica, infección o crisis epilépticas, y 4) evidencia de vasoespasmo en evaluaciones mediante doppler transcraneal seriado o angiografía cerebral, demostrando estrechamiento vascular afectando un territorio concordante con el sitio donde se sospecha que se originan los cambios en los hallazgos del examen neurológico | Región de infarto cerebral en los estudios de imagen en una distribución vascular consistente con el vasoespasmo del paciente | GOS | 3 meses |
| Kwon et al., 200840 | 1) Déficit neurológico nuevo, tal como confusión, desorientación, somnolencia, déficit motor focal o del lenguaje o cambios de los reflejos pupilares; 2) no hay otra causa de los déficits neurológicos, tales como hiponatremia, hipoxemia, infección, edema pulmonar o toxicidad por drogas, y 3) hallazgos negativos en la tomografía computarizada cerebral para hemorragia secundaria, edema cerebral o hidrocefalia | No fue desenlace en este estudio | GOS | 6 meses |
| Hänggi et al., 200823 | No especificada | Lesiones isquémicas en la tomografía computarizada que no se relacionaron con la lesión inicial ni con la manipulación quirúrgica | Escala de Rankin modificada y GOS | 6 meses |
| Al-Tamimi et al., 201239 | Disminución del estado de conciencia (1 en la puntuación motora o 2 en la ocular/verbal de la GOS) o un déficit neurológico focal nuevo al menos 96h luego de la hemorragia, que no estaba presente inmediatamente después del tratamiento del aneurisma, y luego de la exclusión de otras causas. El vasoespasmo angiográfico no se consideró un prerrequisito en los pacientes que no estaban comatosos con un buen grado según la clasificación de la Federación Mundial de Neurocirujanos | Infarto cerebral establecido confirmado mediante tomografía computarizada o imágenes de resonancia magnética | Escala de Rankin modificada | 6 meses |
| Maeda et al., 201325 | 1) Empeoramiento de la condición neurológica, incluyendo déficit focal, disminución del nivel de conciencia y paresias; 2) ausencia de otras causas identificables (trastornos intracraneales o complicaciones sistémicas) del empeoramiento neurológico, y 3) confirmación de vasoespasmo en las evaluaciones médicas que incluyen la evidencia de vasoespasmo cerebral en la angiografía cerebral, angiografía por tomografía en 3D o angiografía por resonancia magnética; un área nueva de baja densidad en la tomografía computarizada asociada con vasoespasmo cerebral; flujo sanguíneo cerebral reducido; y elevación de la velocidad media de flujo en las arterias cerebrales utilizando ultrasonografía doppler transcraneal | Área de baja densidad nueva en las tomografías computarizadas asociadas con vasoespasmo entre 4 y 30 días luego del sangrado, que no ha sido observada en el periodo posoperatorio inmediato y no hay otra causa diferente al vasoespasmo | Escala de Rankin modificada | Un mes |
| Borkar, 201334 | 1) Confusión, desorientación, somnolencia o déficit neurológico focal durante los días 4 a 14 poshemorragia; 2) hallazgos negativos en la tomografía computarizada para descartar otras causas de deterioro neurológico, tales como hemorragia, edema cerebral o hidrocefalia; 3) ausencia de otras causas de deterioro neurológico, como hiponatremia (natremia<132mEq/L), hipoxia, toxicidad farmacológica, infección o crisis epilépticas, y 4) evidencia de vasoespasmo en las evaluaciones mediante ultrasonografía doppler transcraneal | Déficit neurológico isquémico tardío más allá del periodo de vasoespasmo o si los estudios de imágenes revelaron una región de infarto cerebral en el territorio vascular consistente con el vasoespasmo del paciente | GOS | 3 meses |
GOS: Glasgow Outcome Scale.