Las neuropatías atáxicas crónicas inmunomediadas pueden ir asociadas a anticuerpos anti-disialosil y, en algunos casos, a oftalmoplejía y paraproteinemia IgM, un componente que actúa como aglutinina fría. Esta enfermedad se conoce generalmente como neuropatía atáxica crónica, oftalmoplejía, paraproteína IgM, aglutininas frías y anticuerpos disialosil (CANOMAD) o neuropatía atáxica crónica con anticuerpos disialosil (CANDA) en casos sin alteraciones oculomotoras1,2.
Los pacientes a menudo presentan un patrón remitente-recurrente, caracterizado por la aparición o empeoramiento de la oftalmoplejía, los síntomas sensitivos y la debilidad bulbar/extremidad.
Las recurrencias, habitualmente, suelen mejorar y resolverse, en unos días, con inmunoglobulinas intravenosas (IVIG) mensuales (cinco días al mes) o semanales3–5 y/o corticosteroides (C). Sin embargo, hasta el 30% de los pacientes con CANDA/CANOMAD no responden a la terapia de mantenimiento con IVIG y, por lo tanto, algunos autores han utilizado el rituximab (RTX), ya que se ha administrado con éxito en otras enfermedades neuromusculares inmunomediadas6–12.
Presentamos el caso de un paciente con una neuropatía crónica atáxica asociada a anticuerpos anti-disialosil que, tras varios brotes pese a tratamiento de mantenimiento con IVIG, se decide iniciar RTX manteniéndose asintomático durante 19 meses.
Caso clínicoVarón de 77 años fumador, sin antecedentes familiares de enfermedades neuromusculares y con antecedentes personales de hipertensión arterial y enfermedad pulmonar obstructiva crónica, que acudió a nuestro centro por dificultad para realizar tareas finas con las manos, así como inestabilidad de la marcha y parestesias en cuatro extremidades. No refería antecedentes de infección gastrointestinal o respiratoria. A la exploración física se objetiva hipoestesia en ambas manos y pies, hipopalestesia en ambos pies, arreflexia generalizada, marcha atáxica con necesidad de utilizar bastón y signo de Romberg positivo. No se detectó oftalmoplejía, así como el paciente tampoco explica diplopía. Con el objetivo de poder cuantificar la progresión de la enfermedad, se utiliza el INCAT (Inflammatory Neuropathy Cause and Treatment) score, una escala clínica que evalúa la discapacidad a nivel de extremidades superiores e inferiores. La puntuación es de 0-10 (siendo el 0 el valor que indica no afectación funcional y 10 una incapacidad para realizar cualquier movimiento voluntario con brazos y piernas) y en la primera visita presenta un INCAT de 4.
Se realiza estudio neurofisiológico que pone de manifiesto una neuropatía axonal sensitivo-motora en las cuatro extremidades con algunos signos desmielinizantes. En neurografía sensitiva, se objetiva una ausencia de respuesta en nervio mediano, cubital y sural bilateral, así como una disminución de la amplitud en nervio radial derecho. A nivel de neurografía motora se observa una prolongación de latencia, disminución de la amplitud y enlentecimiento de la velocidad desproporcionado a la caída de la amplitud, en nervios mediano, cubital y tibial anterior bilateral y peroneo derecho.
El análisis de líquido cefalorraquídeos mostró 0 células/mm3 (rango normal [NR]: 0-5), 5 eritrocitos/mm3 (NR: 0-5), 59 mg/dL de glucosa (NR: 50-80 mg/dL), 54,8 mg/dL de proteínas (NR: 15-60). Se detectaron antigangliósidos IgM ELISA en suero (GM1: 1/1.035, GM2: 1/15.996, GD1A: 1/5.016, GD1B: 1/17.326, GT1B: 1/16.796, GQ1B: 1/10.361, GD3: 1/14.966. NR: 1/500). Además, se objetivó paraproteinemia IgM (títulos IgM: 325 mg/dL. NR: 40-230) y, también, aglutininas frías.
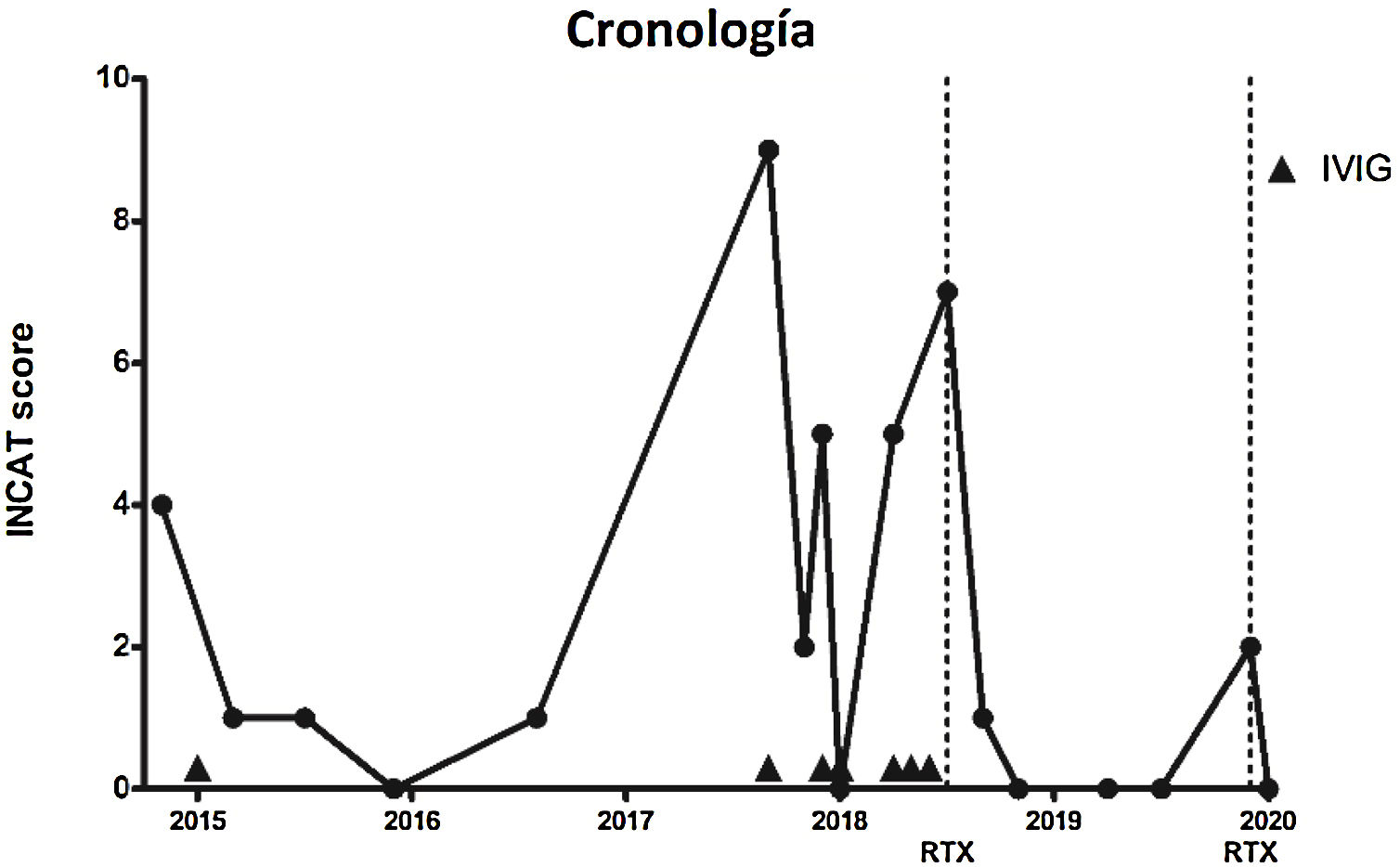
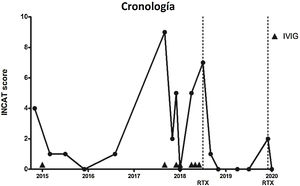
Ante estos resultados, en febrero 2015, se decidió administrar IVIG (0,4 mg/kg/día durante cinco días) presentando una mejoría de los síntomas sensitivos, así como de la marcha (INCAT score de 1 por leve inestabilidad de la marcha). Durante los años 2015 y 2016 no presentó recaídas, aunque sí que persistía leve hipoestesia en manos y pies, así como hipopalestesia en pies (INCAT 0-1).
En septiembre de 2017, el paciente sufrió una infección respiratoria y desarrolló tetraparesia, ataxia y debilidad bulbar, que requirió hospitalización en cuidados intensivos y soporte respiratorio. Presentaba un INCAT score de 9 debido a que el paciente no podía ponerse de pie sin ayuda y no podía realizar actividades útiles con las manos. Se administraron IVIG con una mejoría progresiva. Después de 18 días, el paciente fue dado de alta en sus condiciones basales (INCAT score de 2).
En diciembre de 2017 y abril de 2018, presentó dos episodios de empeoramiento de la ataxia severos (INCAT score de 5) que fueron tratados con IVIG. Posteriormente, se prescribió IVIG mensuales.
En julio de 2018, una nueva exacerbación en forma de ataxia de la marcha (INCAT score de 7) nos hizo iniciar RTX en dos dosis de 1.000 mg, con un intervalo de 14 días entre ellos.
El paciente sólo experimentó, 19 meses después de iniciar el tratamiento con RTX, en una ocasión, un leve empeoramiento de la ataxia (INCAT score de 2), que mejoró después de una dosis única de RTX (1.000 mg). Actualmente, el paciente no presenta ataxia de la marcha ni alteraciones sensitivas (INCAT score de 0) (fig. 1).
DiscusiónEsta nota tiene como objetivo destacar la eficacia del RTX como tratamiento para la neuropatía atáxica con anticuerpos antigangliósidos.
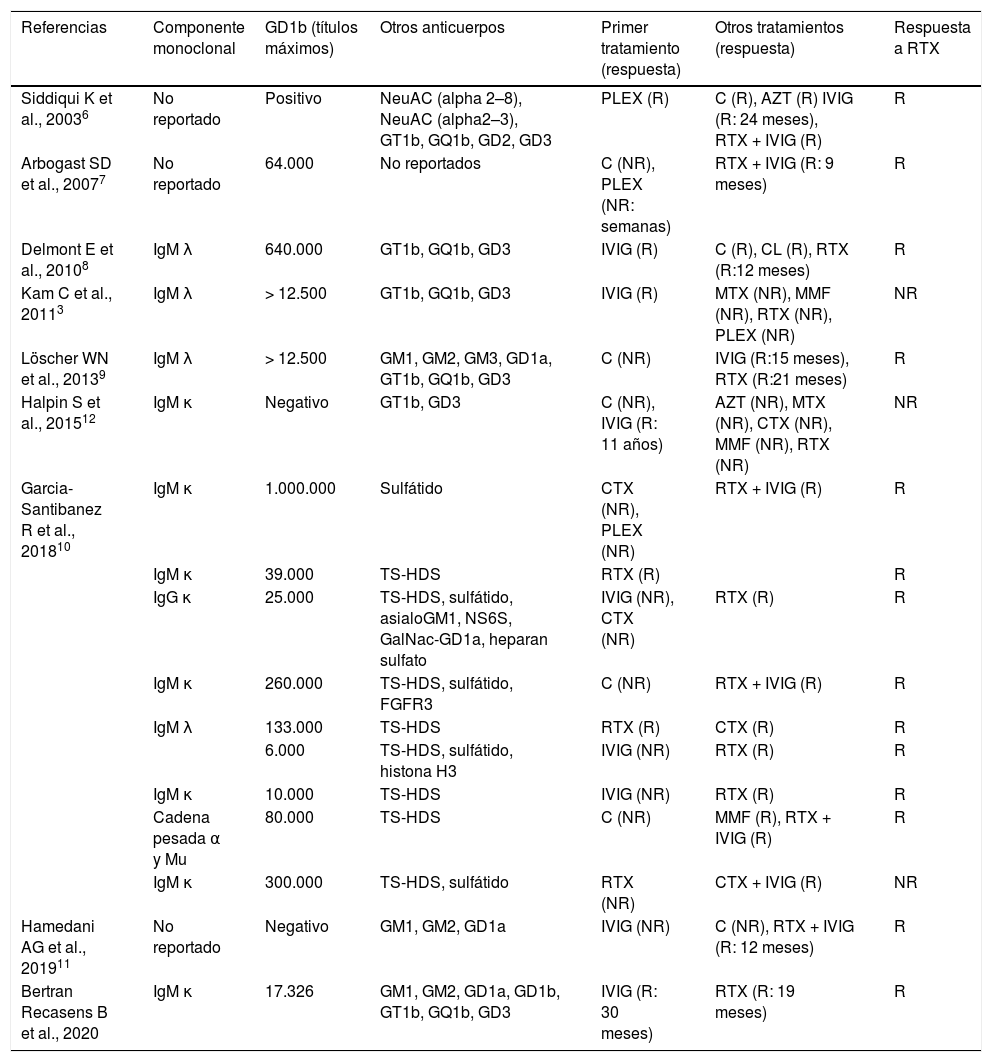
Actualmente, en la literatura hay 17 pacientes con CANOMAD/CANDA tratados con RTX (tabla 1)6–12. Basándonos en los criterios utilizados en los estudios de la polirradiculoneuropatía desmielinizante inflamatoria crónica (CIDP), revisamos aquellos casos tratados con RTX y clasificamos como respondedores, aquellos pacientes que mostraron alguna mejoría en los síntomas motores o sensitivos durante al menos seis meses sin necesidad de tratamiento adicional. Aquellos que necesitaban tratamiento alternativo han sido clasificados como no respondedores13.
Casos reportados de pacientes con CANOMAD/CANDA tratados con rituximab
| Referencias | Componente monoclonal | GD1b (títulos máximos) | Otros anticuerpos | Primer tratamiento (respuesta) | Otros tratamientos (respuesta) | Respuesta a RTX |
|---|---|---|---|---|---|---|
| Siddiqui K et al., 20036 | No reportado | Positivo | NeuAC (alpha 2–8), NeuAC (alpha2–3), GT1b, GQ1b, GD2, GD3 | PLEX (R) | C (R), AZT (R) IVIG (R: 24 meses), RTX + IVIG (R) | R |
| Arbogast SD et al., 20077 | No reportado | 64.000 | No reportados | C (NR), PLEX (NR: semanas) | RTX + IVIG (R: 9 meses) | R |
| Delmont E et al., 20108 | IgM λ | 640.000 | GT1b, GQ1b, GD3 | IVIG (R) | C (R), CL (R), RTX (R:12 meses) | R |
| Kam C et al., 20113 | IgM λ | > 12.500 | GT1b, GQ1b, GD3 | IVIG (R) | MTX (NR), MMF (NR), RTX (NR), PLEX (NR) | NR |
| Löscher WN et al., 20139 | IgM λ | > 12.500 | GM1, GM2, GM3, GD1a, GT1b, GQ1b, GD3 | C (NR) | IVIG (R:15 meses), RTX (R:21 meses) | R |
| Halpin S et al., 201512 | IgM κ | Negativo | GT1b, GD3 | C (NR), IVIG (R: 11 años) | AZT (NR), MTX (NR), CTX (NR), MMF (NR), RTX (NR) | NR |
| Garcia-Santibanez R et al., 201810 | IgM κ | 1.000.000 | Sulfátido | CTX (NR), PLEX (NR) | RTX + IVIG (R) | R |
| IgM κ | 39.000 | TS-HDS | RTX (R) | R | ||
| IgG κ | 25.000 | TS-HDS, sulfátido, asialoGM1, NS6S, GalNac-GD1a, heparan sulfato | IVIG (NR), CTX (NR) | RTX (R) | R | |
| IgM κ | 260.000 | TS-HDS, sulfátido, FGFR3 | C (NR) | RTX + IVIG (R) | R | |
| IgM λ | 133.000 | TS-HDS | RTX (R) | CTX (R) | R | |
| 6.000 | TS-HDS, sulfátido, histona H3 | IVIG (NR) | RTX (R) | R | ||
| IgM κ | 10.000 | TS-HDS | IVIG (NR) | RTX (R) | R | |
| Cadena pesada α y Mu | 80.000 | TS-HDS | C (NR) | MMF (R), RTX + IVIG (R) | R | |
| IgM κ | 300.000 | TS-HDS, sulfátido | RTX (NR) | CTX + IVIG (R) | NR | |
| Hamedani AG et al., 201911 | No reportado | Negativo | GM1, GM2, GD1a | IVIG (NR) | C (NR), RTX + IVIG (R: 12 meses) | R |
| Bertran Recasens B et al., 2020 | IgM κ | 17.326 | GM1, GM2, GD1a, GD1b, GT1b, GQ1b, GD3 | IVIG (R: 30 meses) | RTX (R: 19 meses) | R |
Respondedores (R) son aquellos casos que presentan alguna mejoría en los síntomas motores o sensitivos durante al menos seis meses sin necesidad de tratamiento adicional (excepto IVIG). Aquellos que necesitaban tratamiento alternativo han sido clasificados como no respondedores (NR).
TS-HDS: trisulfated heparin disaccharide, FGFR3: Fibroblast Growth Factor-3, IVIG: inmunoglobulinas intravenosas, MTX: metotrexate, MMF: micofenolato de mofetil, RTX: rituximab, PLEX: recambio plasmático, CTX: ciclofosfamida, C: corticosteroides, CL: clorambucil, AZT: azatioprina.
Según este criterio, 14 pacientes (82,35%) se consideran respondedores (RTX solo o asociado con IVIG). En la mayoría de los casos no se notifica la duración del efecto del RTX6–11. El RTX se utilizó asociado con IVIG en seis de 17 pacientes6,7,10,11 y se usó, principalmente, como tratamiento de segunda línea6–12.
El protocolo de readministración de RTX difiere entre los casos: seis meses después de la primera dosis8, cada ocho semanas6 o cuando los linfocitos CD19+/CD20+ son detectables9.
Los niveles de linfocitos CD19+/CD20+ se han utilizado en neuromielitis óptica como biomarcador de respuesta a RTX y como criterio para una nueva perfusión de RTX14. En pacientes con neuropatía con anticuerpos anti-MAG (glicoproteína asociada a mielina) y miastenia gravis tratados con RTX, las evidencias sugieren que los niveles de CD19+/CD20+ correlacionan con la actividad de la enfermedad14. Dicha relación no está del todo explorada en CANOMAD/CANDA9.
ConclusionesPresentamos el caso de un paciente que presenta una ataxia sensitiva crónica de cuatro extremidades con paraproteinemia IgM, anticuerpos anti-disialosil y aglutininas frías. El paciente es diagnosticado de síndrome CANDA y tratado, con IVIG, con una respuesta insatisfactoria en cuanto al control de los brotes. Desde el inicio de RTX (hace 19 meses), el paciente no ha vuelto a presentar ninguna exacerbación de la enfermedad y se encuentra asintomático.
A diferencia de otras neuropatías crónicas inmunomediadas, no existe un consenso general sobre el mejor tratamiento para el CANOMAD/CANDA. Dada la gran variabilidad de las características clínicas, la evolución de la enfermedad y su baja prevalencia es difícil llevar a cabo estudios aleatorizados1. Así pues, para intentar establecer un protocolo de tratamiento es necesario identificar nuevos marcadores de progresión de la enfermedad y escalas de respuesta clínica validadas.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.