Actualmente, el ictus representa un problema grave en la población, por lo que es necesario emplear técnicas de evaluación de diagnóstico y pronóstico más fiables y objetivas que permitan una eficaz toma de decisiones clínicas. La electroencefalografía es una herramienta sencilla, de bajo coste y no invasiva, que puede proporcionar conocimiento acerca de los cambios que acontecen en el córtex cerebral en el proceso de recuperación tras un ictus. Proporciona datos de evolución de los patrones de activación corticales, que permiten establecer un pronóstico para aprovechar el máximo potencial de las personas evitando compensaciones y plasticidad maladaptativa, redireccionar los tratamientos y desarrollar nuevas intervenciones con el objetivo de alcanzar el nuevo máximo nivel motor de los pacientes que han sufrido un ictus.
Given that stroke is currently a serious problem in the population, employing more reliable and objective techniques for determining diagnosis and prognosis is necessary in order to enable effective clinical decision-making. EEG is a simple, low-cost, non-invasive tool that can provide information about the changes occurring in the cerebral cortex during the recovery process after stroke. EEG provides data on the evolution of cortical activation patterns which can be used to establish a prognosis geared toward harnessing each patient's full potential. This strategy can be used to prevent compensation and maladaptive plasticity, redirect treatments, and develop new interventions that will let stroke patients reach their new maximum motor levels.
El ictus representa en España la segunda causa de muerte en la población general y la primera en la mujer1. En el año 2002, la tasa de incidencia acumulada por 100.000 habitantes en Cataluña, en la población mayor de 24 años, fue de 218 nuevos casos en varones y 127 nuevos casos en mujeres2. Además, supone el principal motivo de discapacidad, generando un importante gasto sanitario y social1.
El 80% de los sujetos que sufren un ictus sobrevive a la fase aguda y tras 6 meses de evolución, el 85% mantienen trastornos de la función motora, así como déficits neurológicos, trastornos de comunicación, cognitivos o de percepción visuo-espacial3,4.
La rehabilitación constituye un proceso terapéutico cuyo objetivo consiste en lograr que el paciente desarrolle su máximo potencial físico, psicológico y social5. Aunque muchas personas logran recuperar parcialmente la función motora de la extremidad inferior, la mayoría de los sujetos no logra usar su extremidad superior (ES) en actividades de la vida diaria tras meses de rehabilitación6. La recuperación funcional de la ES se observa en menos del 15% de los sujetos7. Una disfunción de la ES limita significativamente el nivel de actividad y la participación en el entorno físico y social8.
Las diferentes secuelas en la ES que deterioran el desempeño de las actividades de la vida diaria, han sido valoradas clínicamente a partir de las escalas estandarizadas actualmente disponibles. Considerando resultados obtenidos con estos instrumentos, el periodo de mayor potencial de recuperación sucede entre el segundo y el quinto mes postictus. A partir del sexto mes los cambios funcionales se consideran limitados9,10. Sin embargo, estos instrumentos disponen, en primer lugar, de capacidad reducida para detectar cambios menos sensibles pero necesarios para conocer el progreso de los sujetos con ictus; y en segundo lugar, constituyen instrumentos no exentos de la subjetividad propia del explorador11. Así, se sugiere combinar técnicas instrumentales con escalas estándar para obtener valoraciones más fiables y objetivas de recuperación12.
Nuevos instrumentos de valoraciónLa recuperación postictus representa uno de los mayores enigmas en neurociencias. Los patrones de recuperación motora son heterogéneos, y hasta la última década, los únicos indicadores de pronóstico empleados eran el grado de déficit motor13,14 y el subtipo de infarto cardioembólico. Este último constituye el 14-30% de los ictus isquémicos, siendo el infarto cerebral más grave por sus altas tasas de recurrencia y de mortalidad hospitalaria en la fase aguda15. No obstante, se está empleando mucho esfuerzo en investigar los cambios que acontecen en el sistema nervioso central después del ictus para establecer pronósticos más específicos y desarrollar nuevas estrategias que promuevan la recuperación motora16.
En este sentido, se viene produciendo un importante desarrollo de las técnicas de neuroimagen, como la resonancia magnética funcional (fMRI, del inglés Functional Magnetic Resonance Imaging), la estimulación eléctrica transcraneal (TMS, del inglés Transcraneal Magnetic Stimulation) o la tomografía de emisión de positrones (PET, del inglés Positron Emission Tomography).
A partir de diversos trabajos que han empleado dichas técnicas de valoración, se ha conseguido determinar los cambios producidos por la aplicación de nuevos y novedosos abordajes en rehabilitación como son la robótica17, musicoterapia18, y la TMS19, etc.; y además, se ha podido constatar que los cambios neuroplásticos juegan un rol importante en la recuperación postictus. Según la evidencia científica, existen cambios en ambos hemisferios que contribuyen a la recuperación motora. De un lado, diversos autores han demostrado que la presencia de potenciales evocados (MEPs, del inglés Motor Evoked Potentials) desencadenados por TMS, constituye un predictor de recuperación motora20,21. Por otro lado, algunos grupos sugieren que la plasticidad asociada con movimientos compensatorios puede contribuir a una plasticidad maladaptativa22,23. Los trabajos de Talelli et al. (2006)24 y Stinear et al. (2007)25 emplearon TMS para analizar las proyecciones del tracto corticoespinal ipsilesional. En ambos trabajos la información de TMS contribuyó a predecir la recuperación motora y permitió adaptar las estrategias de rehabilitación. Chelette et al. (2013)26 analizaron con TMS los cambios que generaba la rehabilitación de la ES afecta en sujetos crónicos. Entre los 7 y los 20 meses de evolución, se observó un crecimiento del área de activación en el hemisferio contralesional, seguido de una disminución del mismo a los 21 meses. Sin embargo, los mapas motores ipsilesionales se mantuvieron estables entre los 7 y los 13 meses y empezaron a ampliar su área entre los 13 y los 21 meses, especialmente entre los 20 y los 21. Al final del estudio, se observó también una mejora de un 10% en test funcionales estandarizados (Fugl Meyer Assessment y Wolf Motor Function Test), lo que remarca la asociación entre cambios a nivel de neuroplasticidad y recuperación motora. Estos hallazgos sugieren que, la no presencia de MEPs en las primeras fases no es indicativo de mal pronóstico, que ambos hemisferios contribuyen en diferentes etapas a la recuperación, y que la recuperación postictus es más dinámica de lo pensado26. Cramer et al. (2007)27 observaron con fMRI que, una menor actividad del córtex ipsilesional durante la actividad de la mano parética, estaba asociada a mayores ganancias funcionales después de 6 semanas de rehabilitación en pacientes crónicos. Ward et al. (2003)28, examinaron el grado de recuperación de pacientes crónicos, y el reclutamiento de regiones cerebrales durante una tarea de agarre empleando fMRI, y observaron que aquellos con pobre recuperación reclutaban áreas adicionales en el hemisferio sano, en comparación con los controles, y que aquellos con mejor recuperación mostraban un patrón de activación más normalizado. Por consiguiente, parece existir una asociación negativa entre los resultados funcionales y el grado de actividad del hemisferio ipsilateral relacionado con una tarea motora. Jang et al. (2013), a través de tractografía por tensor de difusión (DTT, del inglés Diffusion tensor tractography) y TMS, evaluaron el estado del tracto corticoespinal en un sujeto con 30 meses de evolución postictus que presentaba apraxia motora. Tras un mes de rehabilitación intensiva y el empleo de medicación dopaminérgica, el paciente obtuvo una recuperación motora del 22% (Motor Index Test). Sin embargo, las fibras del tracto corticoespinal no sufrieron modificaciones, según los parámetros de los potenciales evocados medidos con DTT y TMS. De esta manera, demostraron que la recuperación motora estaba ligada principalmente a la mejora de la apraxia motora y que el tracto corticoespinal no se encontraba implicado29.
En estudios publicados por Formaggio et al., en 2008 y 2010, se combinaron la fMRI con EEG para identificar el nivel de oxigenación en sangre y los cambios en la actividad oscilatoria cerebral asociados a eventos fisiológicos y patológicos acontecidos en áreas motoras. Estos trabajos obtuvieron una correlación significativa tanto para movimientos de los dedos como para imaginación de movimiento, ya que observaron una disminución de la ERD en las bandas α y β durante la ejecución/imaginación del movimiento en el hemisferio contralateral, asociado a una activación del nivel de oxigenación en sangre en las mismas áreas. Esta combinación proporcionaba información útil, permitiendo identificar más eficazmente qué regiones contribuyen a los cambios en las respuestas eléctricas30,31.
En definitiva, las técnicas de neuroimagen poseen implicaciones importantes en términos de diagnóstico y toma de decisiones clínicas29. En general, la evidencia demuestra que el análisis de la actividad cortical mediante dichos instrumentos, mejora nuestro entendimiento acerca de los mecanismos de recuperación motora y puede ayudar a diseñar nuevas estrategias de tratamiento y medidas sensibles de predicción de resultados. No obstante, no son accesibles a todos por su coste económico, contraindicaciones y difícil accesibilidad32.
Electroencefalografía como instrumento de diagnóstico y evaluación en sujetos con ictusAl contrario de lo que muchos pronosticaban, la llegada de las técnicas de neuroimagen no ha conseguido relegar la electroencefalografía (EEG) a un papel secundario, sino que todavía goza de extraordinaria vigencia en neurociencias, pues permite una aproximación al funcionamiento cerebral en tiempo real.
La EEG es comúnmente empleada para el diagnóstico de la epilepsia vascular del adulto secundaria a un ictus, ya que permite estudiar las características y la evolución clínica de los pacientes, así como analizar la eficacia de los diferentes tratamientos antiepilépticos33. Además, se utiliza tradicionalmente como un método de monitorización durante la endarterectomía carotídea para detectar la presencia de isquemia cerebral, que provoca una atenuación del voltaje ipsilateral34, así como para la evaluación de los estados de coma y pseudocoma y su diagnóstico diferencial con otros estados en los que está alterado el nivel de conciencia35, y para la confirmación de muerte cerebral36.
La caracterización y el manejo de las señales electrofisiológicas del sistema nervioso central con equipos de EEG, se han visto reforzados por diversas características que hacen de la EEG una herramienta óptima de evaluación clínica. Son dispositivos no invasivos, portátiles, y económicamente asequibles37. En este sentido, diferentes autores la han utilizado para evaluar la reorganización funcional cortical después de un ictus38–43. Los análisis con EEG han revelado características y usos de diferentes patrones de activación cerebral relativa al movimiento, y de mecanismos neuronales relacionados con el control motor44. Además, ha permitido conocer que la plasticidad dependiente de actividad ocurre en el sistema nervioso central a lo largo de la vida y que, por tanto, el estudio de su evolución puede ser un medio útil para determinar las consecuencias funcionales del ictus y su progresión45. Este potencial justifica la realización de una revisión actualizada que permita analizar y aunar la evidencia disponible, que emplea técnicas de EEG para determinar los cambios que acontecen en la corteza cerebral en sujetos con ictus. De este modo, se pretende responder a diferentes cuestiones no resueltas actualmente: ¿puede ser la EEG una herramienta útil para aumentar el conocimiento acerca de los patrones de evolución de la corteza cerebral tras un ictus?; ¿puede constituir en la práctica clínica un método de diagnóstico?; ¿puede representar una herramienta objetiva para determinar el pronóstico de los pacientes tras un ictus?; y por último, ¿podemos establecer conclusiones acerca de si son o no efectivas las intervenciones tradicionales de rehabilitación mediante el estudio de EEG?
DesarrolloCaracterísticas de la actividad cortical relacionada con el movimiento medida mediante electroencefalografía: potenciales lentos y actividad oscilatoria corticalLa actividad eléctrica del cerebro es consecuencia de corrientes iónicas generadas por procesos bioquímicos celulares, y fue puesta de manifiesto tras estudios de Richard Caton en 187537,46. Dichas corrientes se generan en forma de oscilaciones o fluctuaciones de los potenciales en grupos neuronales.
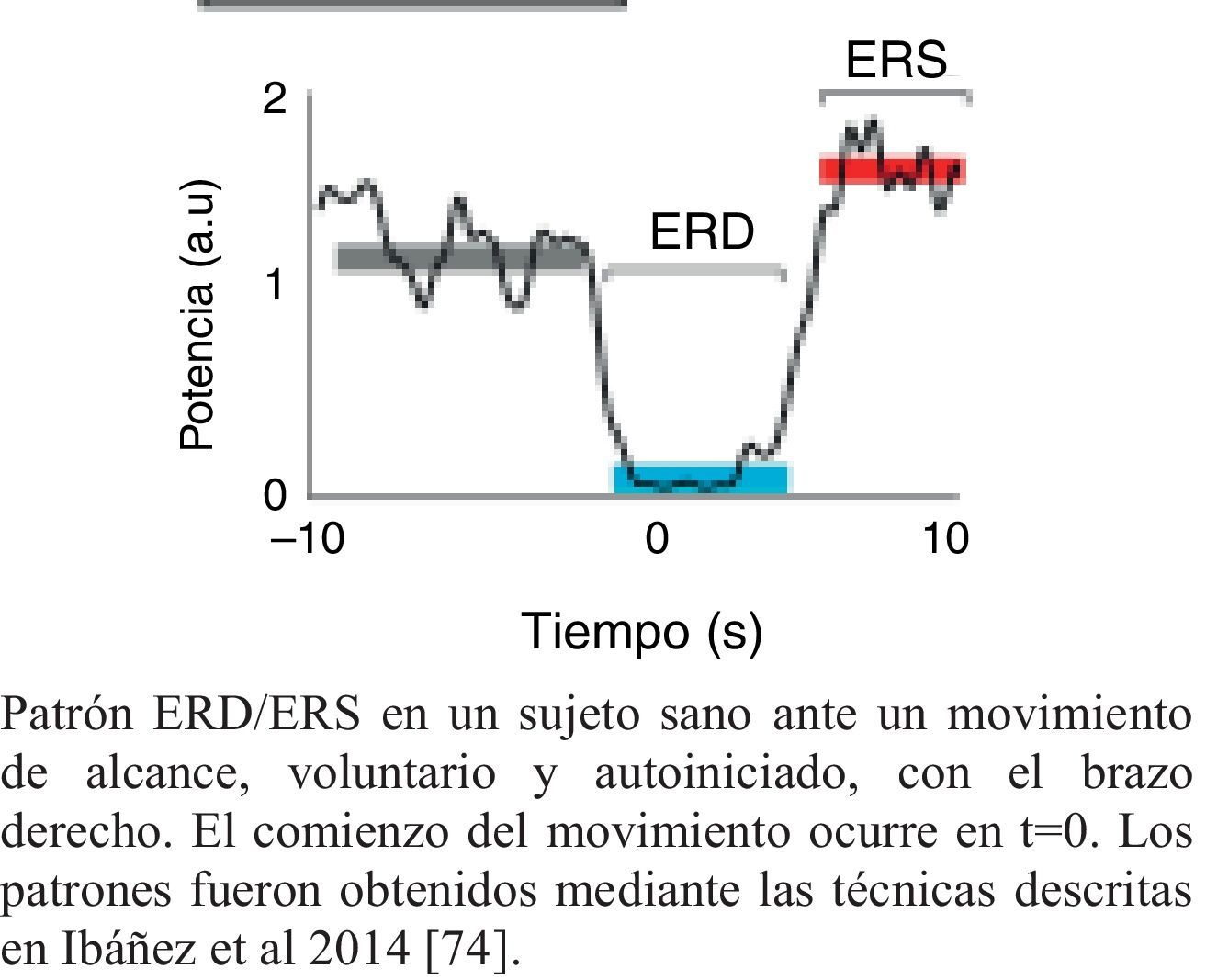
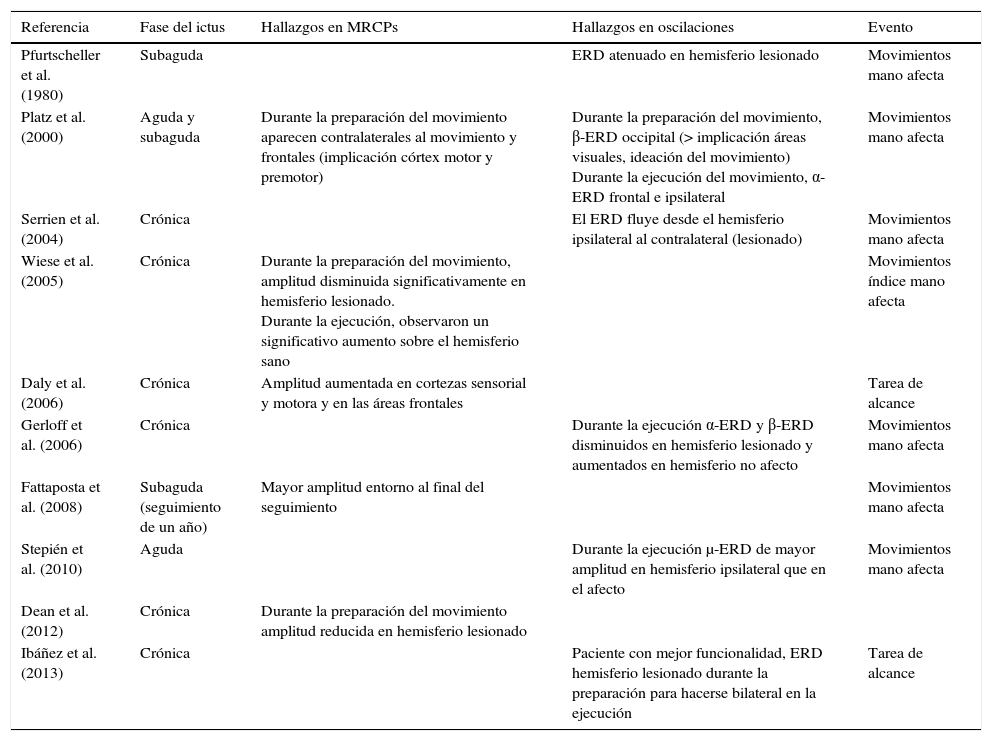
Un evento motor genera diversas respuestas de las estructuras neuronales del cerebro. Por un lado, desencadena potenciales lentos relativos al movimiento (MRCPs, del inglés Movement Related Cortical Potentials) que representan la evidencia electroencefalográfica de la implicación de la corteza motora durante el movimiento y su preparación47. Por otro lado, genera cambios en la amplitud de la actividad oscilatoria cortical. A groso modo, existen dos modalidades de oscilaciones corticales relacionadas con el comportamiento motor, los ritmos α y β48–51. Los cambios relacionados con una acción motora en las frecuencias α y β, suceden en forma de desincronización relacionada con un evento (ERD, del inglés Event Related Desincronization) o en forma de sincronización relacionada con un evento (ERS, del inglés Event Related Sincronization)52. El aumento de la amplitud de las frecuencias α y β se denomina ERS, mientras que la disminución se define como ERD47 (fig. 1).
Patrón ERD/ERS característico de un sujeto sano.
Patrón ERD/ERS en un sujeto sano ante un movimiento de alcance, voluntario y autoiniciado, con el brazo derecho. El comienzo del movimiento ocurre en t=0. Los patrones fueron obtenidos mediante las técnicas descritas en Ibáñez et al.74.
La frecuencia α es el ritmo de fondo principal del EEG normal del adulto46. Se explora en individuos despiertos con ojos cerrados. Esta actividad, registrada en su máxima amplitud en las áreas occipitales, ocurre en periodos de relajación en vigilia y muestra reactividad al cierre de ojos, atenuándose con la apertura de los mismos37,46. Por definición, la frecuencia del ritmo α es de 8-13Hz37. La amplitud de la frecuencia α suele ser simétrica, pero a menudo es mayor en el hemisferio no dominante. Si la persona no está relajada puede no aparecer, y su ausencia en un hemisferio es patológica46.
Según la región cortical, la frecuencia α adquiere características concretas y nomenclatura específica. Alrededor del surco central (cortezas motora y sensitiva primarias) se encuentra el ritmo mu (μ)37. Los ritmos μ poseen una peculiar reactividad, ya que aparecen en reposo y se bloquean con el movimiento de la extremidad contralateral. Son particularmente pronunciados en torno a la zona del córtex motor asociada a la mano, se bloquean al cerrar el puño e incluso cuando el paciente imagina la realización de un movimiento50. Están considerados como una frecuencia propia de la región central, de gran utilidad para la evaluación funcional de los pacientes con ictus53.
La actividad β, de menor amplitud, está definida por frecuencias de 14-30Hz e indica actividad mental y atención37. La amplitud β máxima se observa en las regiones frontocentrales. El hallazgo más importante en el análisis de la actividad β es la asimetría interhemisférica. Una disminución de la amplitud en uno de los hemisferios suele indicar la existencia de alteraciones46.
La amplitud de la actividad oscilatoria disminuye cuando aumenta su frecuencia. De este modo, el ritmo μ con una frecuencia entre 8 y 13Hz presenta una amplitud mayor que la actividad β. Además, la amplitud de las oscilaciones es proporcional al número de elementos neuronales activos sincronizados, de modo que las oscilaciones más lentas comprenden más neuronas que las rápidas52.
En general, la estimulación sensorial y el movimiento o imaginación del mismo, resultan en una ERD o ERS de los ritmos μ y β. En sujetos sanos, el movimiento está precedido de una ERD, y a medida que se desarrolla el movimiento ocurren variaciones en la sincronización de los ritmos corticales (ERS). La terminación del movimiento está seguida por una β-ERS que se genera en la región precentral, y refleja una desactivación de la corteza motora. Este hecho ocurre en el primer segundo después de la finalización del movimiento voluntario, cuando todavía el ritmo μ presenta una ERD de pequeña amplitud. Los movimientos bilaterales provocan una activación bilateral54.
La μ-ERD es independiente de la duración del movimiento y también de la localización, siendo igual para movimientos del índice, del pulgar o incluso de la mano. Esto refleja que la μ-ERD se debe a una preactivación no específica de las neuronas en áreas motoras52. En este sentido, estudios con electrocorticografía han mostrado que la β-ERD es más discreta que la μ-ERD. Asimismo, su localización es más anterior, en la corteza prerrolándica (área motora), mientras que la μ-ERD se localiza en la zona posrrolándica (área primaria somatosensitiva)55.
ERD y ERS pueden ocurrir simultáneamente, tanto en la actividad α, como en la actividad β. En el primer caso, durante la percepción de un estímulo visual, se puede observar mediante registros EEG, una α-ERD occipital y una μ-ERS de los ritmos centrales. Sin embargo, durante los movimientos voluntarios autoiniciados aparece una α-ERS occipital y una μ-ERD central56. Una posible explicación es la implicación de las estructuras talámicas que activan áreas corticales implicadas en ciertos movimientos, y desactivan otras que no se usan para el desarrollo de la tarea. A nivel de la actividad β, ERD y ERS ocurren de manera simultánea durante la imaginación del movimiento de la mano, el cual desencadena un ERD contralateral y un ERS ipsilateral52.
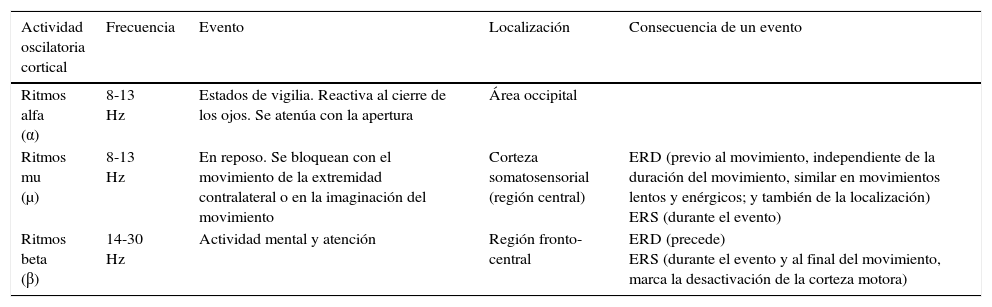
En el cálculo de ERD y ERS con respecto al inicio del movimiento a través de EEG, las variaciones en la amplitud de los ritmos μ y β se miden en referencia a valores tomados en un periodo de reposo, bastante lejano a la planificación y a la ejecución, con la finalidad de ser neutral57 (tablas 1 y 2).
Características de los ritmos motores corticales
| Actividad oscilatoria cortical | Frecuencia | Evento | Localización | Consecuencia de un evento |
|---|---|---|---|---|
| Ritmos alfa (α) | 8-13 Hz | Estados de vigilia. Reactiva al cierre de los ojos. Se atenúa con la apertura | Área occipital | |
| Ritmos mu (μ) | 8-13 Hz | En reposo. Se bloquean con el movimiento de la extremidad contralateral o en la imaginación del movimiento | Corteza somatosensorial (región central) | ERD (previo al movimiento, independiente de la duración del movimiento, similar en movimientos lentos y enérgicos; y también de la localización) ERS (durante el evento) |
| Ritmos beta (β) | 14-30 Hz | Actividad mental y atención | Región fronto-central | ERD (precede) ERS (durante el evento y al final del movimiento, marca la desactivación de la corteza motora) |
ERD: desincronización relacionada con un evento, del inglés Event Related Desynchronization; ERS: sincronización relacionada con un evento, del inglés Event Related Synchronization.
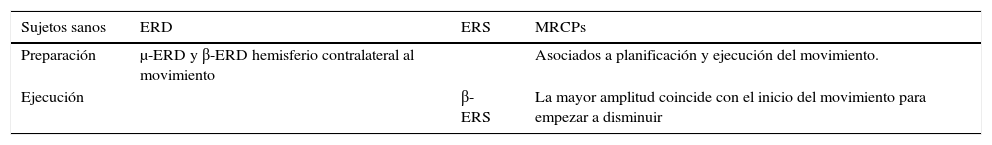
Características de las oscilaciones del córtex motor en sujetos sanos durante la planificación y ejecución del movimiento
| Sujetos sanos | ERD | ERS | MRCPs |
|---|---|---|---|
| Preparación | μ-ERD y β-ERD hemisferio contralateral al movimiento | Asociados a planificación y ejecución del movimiento. | |
| Ejecución | β-ERS | La mayor amplitud coincide con el inicio del movimiento para empezar a disminuir |
μ-ERD, β-ERD: desincronización relacionada con un evento, del inglés Event Related Desynchronization, en las bandas de frecuencia μ y β; β-ERS: sincronización relacionada con un evento, del inglés Event Related Synchronization, en la banda de frecuencia β;
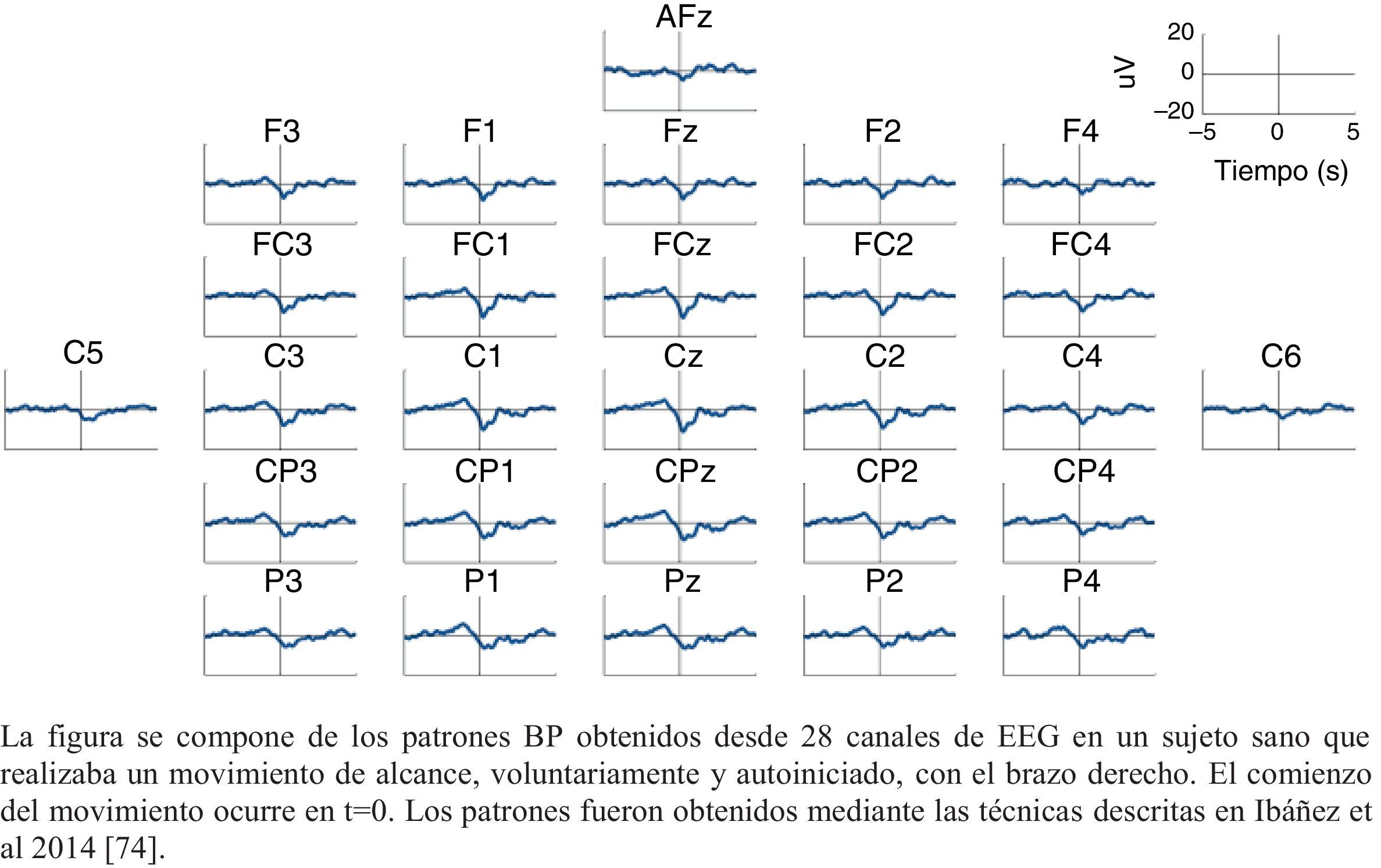
Los MRCPs son de especial interés en la evaluación de los patrones de activación cortical, ya que están asociados con la planificación y ejecución del movimiento. En este sentido, se ha hecho hincapié en el estudio del Bereitschaftspotential (BP), considerado la parte inicial de los MRCPs41,47,58. Este parámetro, introducido en 1964 por Kornhuber y Deecke, es una señal eléctrica correspondiente al área motora suplementaria, la cual se activa antes que el área motora primaria59. Se trata de un potencial lento y negativo que refleja actividad preparatoria, cuyo pico máximo coincide con el inicio del movimiento voluntario60. El BP presenta dos componentes: uno temprano, que se detecta 2 s antes del comienzo del movimiento; y uno tardío, que aparece 400ms antes del comienzo del movimiento. El BP temprano es máximo en la línea media del área centroparietal, extenso y simétrico entre ambos hemisferios, y el BP tardío es mayor en la región central, contralateral al movimiento (fig. 2). En términos generales, cuando existe una pauta de movimiento, el BP aparece antes que cuando el movimiento se ejecuta en condiciones más naturales47.
Patrón BP (bereitschaftspotential) característico de un sujeto sano.
La figura se compone de los patrones BP obtenidos desde 28 canales de EEG en un sujeto sano que realizaba un movimiento de alcance, voluntariamente y autoiniciado, con el brazo derecho. El comienzo del movimiento ocurre en t=0. Los patrones fueron obtenidos mediante las técnicas descritas en Ibáñez et al.74.
Aunque no se conocen exactamente los mecanismos generadores de BP, estos potenciales están modulados por el modo en que se ejecuta la tarea. Existen diversos factores que influyen en la forma del BP, el estado de preparación, selección del movimiento (libre o pautado), adquisición de aprendizajes, ritmo de repetición del movimiento, práctica, complejidad, velocidad y lesiones patológicas de las estructuras cerebrales, entre otros41,50. Las alteraciones neurológicas modifican el momento de aparición y la amplitud de los MRCPs, por lo que estos pueden ser de utilidad en el diagnóstico y seguimiento de las mismas61.
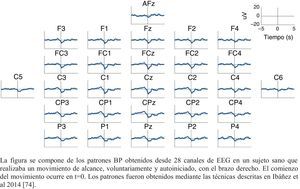
Características de la actividad cortical en pacientes lesionados con ictus medida mediante electroencefalografíaYa en los años 80, estudios con EEG de Pfurtscheller62–65, revelaron que la amplitud dinámica de las oscilaciones neuronales era un indicador de la activación neuronal durante la preparación y la ejecución del movimiento. Pfurtscheller et al. (1980), encontraron una atenuación de la ERD en el hemisferio afecto de pacientes con ictus comparado con el hemisferio no afecto durante el desarrollo de movimientos de la mano afecta64.
En la última década, numerosos estudios han evaluado la actividad cortical con EEG en sujetos que han sufrido un ictus, para analizar los patrones de reorganización del córtex a lo largo del periodo de recuperación.
Platz et al. (2000)44, evaluaron con EEG, los MRCPs y la ERD en las frecuencias α y β en sujetos con hemiparesia en fase aguda y subaguda (3-20 semanas de evolución). Analizaron las fases de preparación y ejecución durante movimientos autoiniciados y repetidos de la mano afecta. Los autores observaron que en los controles sanos, los potenciales lentos se expandían desde el electrodo central abarcando toda la corteza durante la preparación del movimiento, para hacerse más evidentes en el hemisferio contralateral al movimiento durante su ejecución. En cuanto a la ERD, comprobaron que esta comenzaba en el hemisferio contralateral, y se extendía al hemisferio ipsilateral haciéndose bilateral durante la ejecución. Sin embargo, los pacientes mostraron diferencias notables con respecto a los controles, principalmente durante la preparación. Los autores registraron una distribución de los MRCPs más contralateral al movimiento y frontal, distribución que podría indicar una mayor implicación del córtex motor y premotor en la planificación en sujetos con ictus. Respecto a la actividad oscilatoria cortical, durante la preparación del movimiento, la β-ERD apareció más localizada en la zona occipital que en los controles, hallazgo que podría sugerir una mayor implicación de las áreas visuales (ideación del movimiento). Además, durante la ejecución, se observó un incremento de la α-ERD en la zona frontal y homolateral del córtex, lo cual se relaciona con una mayor necesidad de centrar la atención en la tarea y de realizar compensaciones con el hemisferio sano44.
Serrien et al. (2004)66, establecieron un significado funcional del hemisferio ipsilateral durante el movimiento de la mano afecta en pacientes con ictus en fase crónica. Para la realización de una misma tarea, el reclutamiento de la corteza somatosensorial y motora se originaba desde el hemisferio contralateral en los controles y en aquellos pacientes con buena recuperación, mientras que lo hacía desde el hemisferio ipsilateral en pacientes con mala recuperación. Así establecieron que, a mayor implicación de las áreas contralaterales, mejor pronóstico de recuperación funcional presentaban los pacientes.
Wiese et al. (2005)67, compararon los MRCPs entre pacientes crónicos y sujetos sanos para la realización de movimientos del índice de la mano afecta. En los pacientes, el componente que precede directamente al inicio del movimiento de los MRCP, aparecía significativamente reducido en el hemisferio lesionado, observándose durante la ejecución un aumento significativo de los MRCPs sobre el hemisferio sano. La aparición de este componente temprano de los MRCPs, generado por la corteza motora primaria, sugiere que en el ictus estas estructuras están dañadas en el hemisferio lesionado.
Daly et al. (2006)68, analizaron con EEG los MRCPs en diez pacientes con ictus crónico, para determinar la planificación motora del alcance. Observaron una elevada amplitud de los MRCPs en la corteza sensorial y motora, así como en las áreas frontales, lo que refleja menor automatización de la tarea y la necesidad de emplear estrategias compensatorias para ejecutar el movimiento. Gerloff et al. (2006)69, mostraron que las α-ERD y β-ERD estaban reducidas en el hemisferio lesionado de pacientes crónicos y aumentados en el hemisferio no afecto durante movimientos de la mano afecta, lo que sugiere un cambio en la conectividad funcional compensatorio hacia el hemisferio contralesional.
Fattapposta et al. (2008)70, realizaron un seguimiento de 9 pacientes con ictus en fase aguda durante un año, realizando cuatro mediciones, a los 0, 3, 9 y 12 meses de evolución. Desarrollaron un estudio en el que evaluaron la preprogramación del movimiento durante la realización de una tarea sencilla. En la primera medición, los pacientes alcanzaron una amplitud del BP significativamente más baja que los controles, para aumentar en las tres mediciones consecutivas. Este resultado, podría asociarse a la plasticidad neuronal temprana y otros procesos implicados en los fenómenos de neurorreparación, como son la angiogénesis y neurogénesis que acontecen en estadios primarios tras una lesión71, pero que el periodo para que tareas sencillas se automaticen sería más prolongado. Justificaría la existencia de un fenómeno de habituación en el que la tarea motor se memorizaría. Respecto a las escalas de movilidad, se obtuvieron considerables mejoras en las habilidades motoras (Nine Hole Peg Test y Motricity Index Test) a lo largo del proceso. Los autores argumentaron que los pacientes alcanzaban un relativo buen nivel de recuperación en las habilidades motoras, sin una adecuada recuperación de las habilidades atencionales sobre la tarea, en base al desarrollo de estrategias motoras compensatorias, lo que resulta crucial en la automatización de habilidades, y en la recuperación, ya que las tareas cotidianas son automáticas.
Stepién et al. (2010)72, evaluaron la ERD en pacientes con ictus en fase aguda de menos de ocho días de evolución utilizando EEG. Determinaron que en las áreas sensoriomotoras (área pericentral), el movimiento de la mano lesionada provocaba un α-ERD más fuerte en el hemisferio ipsilateral que en el hemisferio afecto. Además, observaron que la amplitud de α-ERD se mantenía en el hemisferio lesionado durante la actividad de la mano no afecta, en comparación con la actividad de la mano afecta, para la que había un enlentecimiento de la frecuencia de las oscilaciones α en el hemisferio lesionado. La ERD es un parámetro sensible en la recuperación de las redes neuronales producida tras un ictus. Una ERD relativamente bien conservada en el hemisferio lesionado para los movimientos de la mano no afecta, parece ser un indicativo de buen potencial de recuperación y, por tanto, de buen pronóstico, lo que plantea como importante el trabajo bilateral durante al menos las primeras fases de recuperación72.
Dean et al. (2012)73, analizaron la planificación motora en pacientes con ictus en fase crónica, y observaron una amplitud reducida de MRCPs sobre el hemisferio lesionado, especialmente durante la preparación del movimiento en ambas manos. Esto denota una alteración en la capacidad anticipatoria y en el procesamiento motor de aquellas personas que tienen una pobre recuperación funcional.
Ibañez et al. (2013)74, utilizaron EEG para detectar la intención de los movimientos voluntarios con precisión temporal en tres pacientes con ictus crónico. Emplearon la ERD como parámetro para medir la actividad oscilatoria. Los autores observaron que un sujeto presentó una ERD bilateral, mientras que otro presentó una predominancia significativa de la zona central, sugiriendo ambos casos una reorganización cortical. Un tercero presentó una activación de las regiones contralaterales al miembro afecto para volverse bilateral una vez comenzada la ejecución del movimiento. Este paciente fue el que presentó el mayor nivel funcional en la ES (tabla 3).
Resumen de la evidencia científica que emplea la EEG como método de evaluación del córtex motor en sujetos con ictus
| Referencia | Fase del ictus | Hallazgos en MRCPs | Hallazgos en oscilaciones | Evento |
|---|---|---|---|---|
| Pfurtscheller et al. (1980) | Subaguda | ERD atenuado en hemisferio lesionado | Movimientos mano afecta | |
| Platz et al. (2000) | Aguda y subaguda | Durante la preparación del movimiento aparecen contralaterales al movimiento y frontales (implicación córtex motor y premotor) | Durante la preparación del movimiento, β-ERD occipital (> implicación áreas visuales, ideación del movimiento) Durante la ejecución del movimiento, α-ERD frontal e ipsilateral | Movimientos mano afecta |
| Serrien et al. (2004) | Crónica | El ERD fluye desde el hemisferio ipsilateral al contralateral (lesionado) | Movimientos mano afecta | |
| Wiese et al. (2005) | Crónica | Durante la preparación del movimiento, amplitud disminuida significativamente en hemisferio lesionado. Durante la ejecución, observaron un significativo aumento sobre el hemisferio sano | Movimientos índice mano afecta | |
| Daly et al. (2006) | Crónica | Amplitud aumentada en cortezas sensorial y motora y en las áreas frontales | Tarea de alcance | |
| Gerloff et al. (2006) | Crónica | Durante la ejecución α-ERD y β-ERD disminuidos en hemisferio lesionado y aumentados en hemisferio no afecto | Movimientos mano afecta | |
| Fattaposta et al. (2008) | Subaguda (seguimiento de un año) | Mayor amplitud entorno al final del seguimiento | Movimientos mano afecta | |
| Stepién et al. (2010) | Aguda | Durante la ejecución μ-ERD de mayor amplitud en hemisferio ipsilateral que en el afecto | Movimientos mano afecta | |
| Dean et al. (2012) | Crónica | Durante la preparación del movimiento amplitud reducida en hemisferio lesionado | ||
| Ibáñez et al. (2013) | Crónica | Paciente con mejor funcionalidad, ERD hemisferio lesionado durante la preparación para hacerse bilateral en la ejecución | Tarea de alcance |
ERD: desincronización relacionada con un evento, del inglés Event Related Desynchronization; ERS: sincronización relacionada con un evento, del inglés Event Related Synchronization; MRCPs: potenciales lentos corticales relativos al movimiento, del inglés movement related cortical potentials; α, β y μ: bandas de frecuencia en que aparecen las oscilaciones.
En cuanto al diagnóstico, existe escasa evidencia sobre el empleo de los equipos de EEG. Pfurtscheller et al. (1981)62 realizaron un estudio en una amplia muestra de pacientes (n=50), en el que evaluaron la actividad oscilatoria cortical durante movimientos de la mano afecta, para predecir la localización de la lesión en el territorio de la arteria cerebral media. Los resultados relataron que, un ritmo μ aumentado en el hemisferio ipsilateral, en conexión con una ERD simétrico, indicaba en un 95% de los casos la existencia de una lesión profunda y en un 5% una lesión superficial. Sin embargo, una amplitud simétrica del ritmo μ y una ERD asimétrico, indicaba una isquemia superficial cortical con una probabilidad del 81%; mientras que un ritmo μ ipsilateral atenuado, acompañado de una asimétrica o abolida ERD, indicaba una amplia extensión del infarto en todo el territorio de la arteria.
ConclusionesEl análisis mediante EEG de la preparación y la ejecución del movimiento en el ictus en comparación con sujetos sanos, permite establecer resultados acerca de pronóstico y diagnóstico. Un comportamiento próximo a la normalidad de la activación cortical se asocia a mejor funcionalidad, y la evolución hacia la normalidad de las características de la activación cortical sugiere la eficacia de las terapias. Pacientes con un determinado tiempo de evolución son excluidos de programas de rehabilitación tras haber sido evaluados con escalas estandarizadas. Son necesarios instrumentos sensibles a cambios funcionales que sean capaces de determinar la evolución del paciente, la efectividad de las intervenciones llevadas a cabo e informar sobre el pronóstico real, para facilitar así la toma de decisiones en la práctica clínica.
La EEG es una técnica de bajo coste, no invasiva, sencilla, transportable, y potencialmente útil como herramienta diagnóstica y pronóstica pues proporciona conocimiento acerca de los cambios neuroplásticos en términos de recuperación motora, permitiendo evaluar la eficacia de las intervenciones y facilitar la toma de decisiones clínicas y aprovechar el máximo potencial de las personas con discapacidad motora, evitando la plasticidad maladaptativa, y desarrollando nuevas intervenciones que permitan modular la función cerebral. Una predicción temprana del modelo de recuperación motora podría ayudar a determinar el tiempo, la duración y los objetivos de protocolos terapéuticos individualizados para cada paciente, desarrollados en base a la neuroplasticidad.
Una prometedora línea de investigación futura es el estudio del comportamiento del córtex motor mediante EEG de superficie, en función del tipo de lesión y del tiempo de evolución en una amplia muestra de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.