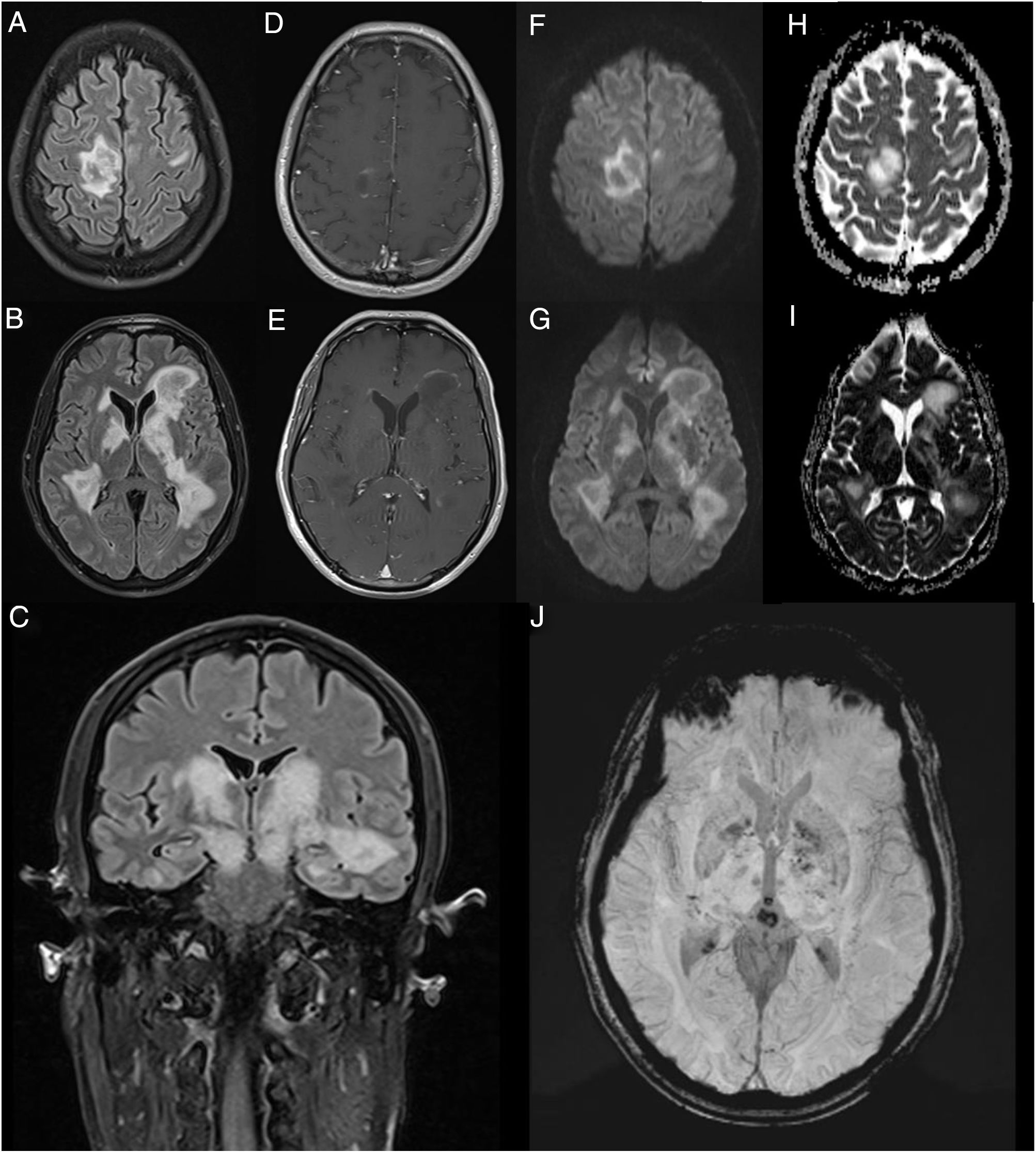
Un hombre de 45 años sin antecedentes de interés consultó por un cuadro de una semana de evolución de encefalopatía y hemiparesia faciobraquiocrural izquierda progresivas. No había antecedentes infecciosos, vacunales, tóxicos, síndrome constitucional ni ningún otro dato relevante en la anamnesis dirigida. Una primera resonancia magnética (RM) cerebral con contraste mostró múltiples lesiones nodulares hemisféricas bilaterales hiperintensas en la secuencia potenciada en T2 afectando a la unión corticosubcortical y a los ganglios basales, así como troncoencefálicas, sin edema perilesional ni efecto de masa significativos; únicamente una de ellas realzaba con gadolinio (Gd+). Ante estos hallazgos, se plantearon las etiologías infecciosa y tumoral como primeras opciones diagnósticas, que quedaron fehacientemente descartadas tras un exhaustivo estudio serológico y del líquido cefalorraquídeo, así como mediante una tomografía computarizada toracoabdominal que también fue normal. El estudio de autoinmunidad reveló la presencia de bandas oligoclonales, mientras que los anticuerpos antiacuaporina 4 y anti-MOG (glicoproteína de la mielina de oligodendrocitos) fueron negativos. El resto del estudio de autoinmunidad fue negativo a excepción de unos anticuerpos antinucleares y antitiroideos positivos a títulos bajos. El perfil hormonal y vitamínico fue normal, y el cribado de tóxicos negativo. Una nueva RM cerebral evidenció un aumento de la extensión de las lesiones, con leve restricción de la difusión y realce marginal en anillo incompleto, así como microhemorragias petequiales en la secuencia de susceptibilidad magnética (fig. 1). La RM medular con contraste fue normal. Ante la sospecha de un proceso inflamatorio autoinmune del sistema nervioso central (SNC), el paciente recibió inicialmente 1g de metilprednisolona intravenosa (MPiv) durante 5 días consecutivos. Sin embargo, la clínica continuó progresando en las semanas posteriores a expensas de un deterioro del nivel de consciencia, por lo que el paciente ingresó en la unidad de cuidados intensivos. Durante su estancia en la unidad de críticos se objetivaron signos sospechosos de comicialidad, confirmada mediante un registro electroencefalográfico que mostró frecuentes descargas epileptiformes intercríticas frontales derechas. Una nueva RM cerebral y medular con contraste no mostraron cambios significativos que justificasen el empeoramiento clínico. Se realizaron 5 sesiones de plasmaféresis a días alternos con un nuevo curso de 1g de MPiv durante 5 días sin mejoría clínica. A continuación se administraron dos infusiones de rituximab dosificado por m2 de superficie corporal, con lo que el paciente presentó una franca mejoría clínica y radiológica. Tras 11 meses de seguimiento y sin tratamiento inmunosupresor, no ha presentado recurrencias clínicas ni nuevas lesiones inflamatorias en las RM craneomedulares de control y ha logrado una recuperación funcional hasta la independencia parcial para las actividades de la vida diaria.
RM cerebral con contraste; cortes axiales A-B, D-J) y coronal C). Se aprecian múltiples lesiones parenquimatosas pseudonodulares en ambos hemisferios cerebrales, hiperintensas en las secuencias FLAIR A-C), afectando la sustancia blanca principalmente periventricular y yuxtacortical del giro precentral derecho, así como los ganglios de la base y las cápsulas internas, con extensión caudal a los pedúnculos cerebrales del mesencéfalo. No presentan edema ni ejercen un efecto de masa significativos. Algunas de ellas realzan discretamente en la periferia en forma de anillo semiabierto tras la administración de gadolinio D-E) y presentan discreta restricción de la difusión periférica –diffusion weighted imaging (DWI): F-G); apparent diffusion coefficient (ADC): H-I)–. Las lesiones más profundas contienen focos petequiales en las secuencias de susceptibilidad magnética (susceptibility weighted imaging [SWI]: J).
Las características radiológicas de las lesiones, así como la evolución clínica y la respuesta a la tercera línea de inmunoterapia con rituximab, son compatibles con una encefalitis desmielinizante multifocal catastrófica.
Los síndromes inflamatorios desmielinizantes fulminantes del SNC son un grupo de enfermedades autoinmunes muy raras que históricamente se han caracterizado por un pronóstico infausto debido a una cascada inmunológica descontrolada, a la localización estratégica –p. ej. el tronco encefálico– y a la extensión de las lesiones, que cuando sobrepasan los 2cm de diámetro reciben la descripción de pseudotumorales en alusión a su comportamiento clínico-radiológico más propio de las masas cerebrales1,2. Se han considerado entidades estrechamente relacionadas con la esclerosis múltiple (EM), pero aún hoy no es posible identificar precozmente aquellos pacientes que, tras un primer episodio de desmielinización catastrófica, presentan un mayor riesgo de desarrollar una forma recurrente de enfermedad desmielinizante del SNC1. La literatura disponible sobre estas enfermedades es confusa debido a su baja frecuencia y a un gran solapamiento entre ellas2,3; únicamente unas pocas cuentan con unos criterios diagnósticos ampliamente aceptados, siendo este el caso de la EM fulminante, la encefalomielitis aguda diseminada (ADEM) y los trastornos del espectro de la neuromielitis óptica3. La tabla 11–7 recoge las características clínicas, radiológicas, de laboratorio y anatomopatológicas de las principales entidades entre las que plantea el diagnóstico diferencial el caso clínico presentado, que reúne particularidades de diversas de ellas, sirviendo esto como prueba del solapamiento existente entre los distintos síndromes inflamatorios desmielinizantes fulminantes del SNC.
Diagnóstico diferencial de cuatro de los principales síndromes inflamatorios desmielinizantes fulminantes del SNC en base a sus características clínicas, radiológicas, de laboratorio y anatomopatológicas
| EM fulminante* | Enfermedad de Marburg | ADEM** | Leucoencefalitis aguda hemorrágica/Síndrome de Weston-Hurst | |
|---|---|---|---|---|
| Epidemiología | < 4% de los nuevos casos de EM | Muy pocos casos descritos | Incidencia: 0,4-0,8 casos/100.000 niños y año | Muy rara |
| Adultos jóvenes | Adultos jóvenes | |||
| ♀ > ♂ | ||||
| EM conocida o de debut | ||||
| Niños (< 10 años) >>> adultos | ||||
| Pocas series de casos en adultos | ||||
| ♀ = ♂ | ||||
| Invierno y primavera | ||||
| Etiopatogenia | HLA DR15 | MBP isoforma 18’5 kDa | Infección o vacunación 1-2 semanas antes: ¿mimetismo molecular? | |
| Clínica | Signos neurológicos focales que causan discapacidad grave o muerte | Clínica de hipertensión intracraneal | FiebreCefalea/meningismoEncefalopatíaCrisis comicialessobre todo en niñosSignos neurológicos polifocales niños y adultos | |
| Signos neurológicos focales | Clínica de hipertensión intracraneal | |||
| RM | Lesiones: | Lesiones: | Lesiones: | Lesiones: |
| Ovaladas, márgenes bien definidos | Pseudotumorales (> 2 cm) | De diversos tamaños (> 1 cm) | De tamaño variable | |
| Cerebro ± médula (no LETM) | Patrón infiltrativo | Márgenes mal definidos | Múltiples | |
| Sustancia blanca > gris; no ggbb | Múltiples, confluyentes | Múltiples | Hemorragia | |
| Periventriculares | Sustancia blanca (no gris) | Cerebro (suprainfratentorial) ± médula (LETM) | Edema perilesional | |
| Gadolinio (+/-) | Supratentoriales (centros semiovales) > infratentoriales (tronco), médula | Sustancia blanca y gris (córtex, ggbb, tálamo) | Gd+ | |
| Diferentes estadios evolutivos; black holes | Edema perilesional +++, efecto masa | Menos afectación periventricular (sí en adultos) | ||
| Gd+ | ± Gd+ | |||
| ≥ 2 de los siguientes: | Diferentes estadios evolutivos | En el mismo estadio evolutivo; | ||
| Lesiones pseudotumorales (> 2 cm) | no black holes en T1 | |||
| > 10 lesiones en T2 | ||||
| > 5 (o ≥ 1 pseudotumoral) Gd+ | ||||
| LCR | Pleocitosis (linfocitos) | Normal, o: | Pleocitosis (niños: linfocitos; adultos: neutrófilos) transitoria | Eritrocitos +++ |
| > 90% BOC (+) permanentes | ± pleocitosis | Hiperproteinorraquia | Pleocitosis (neutrófilos) | |
| ± hiperproteinorraquia | 20% BOC (+) transitorias (a menudo en espejo) | Hiperproteinorraquia | ||
| ± BOC (+) | ||||
| Serología | 40% IgG anti-MOG transitorias (niños >> adultos) | |||
| Anatomía | Desmielinización difusa | Lesiones más destructivas: | Desmielinización perivenular | |
| patológica | Lesiones en diferentes estadios evolutivos: | Neutrófilos ± Ig y complemento | ||
| Agudas: macrófagos, LT ± Ig y complemento | Destrucción de mielina y axones | |||
| Crónicas: destrucción mielina y axones | Necrosis tisular | |||
| Lesiones en el mismo estadio evolutivo | Hemorragia | |||
| Macrófagos y linfocitos; pocos granulocitos | Neutrófilos, linfocitos | |||
| Sustancia blanca y gris: agregados corticales de microglía (se postulan como causa de la encefalopatía) | Edema | |||
| Necrosis fibrinoide perivascular | ||||
| Destrucción de mielina y axones | ||||
| Evolución natural | Recurrente | Monofásico | Monofásico (< 5% multifásico ¿vs. EM atípica?) | Monofásico |
| Muerte en meses-años | Muerte en semanas-meses | 80% recuperación ad integrum en semanas; | 70% muerte en días-semanas | |
| (afectación directa del tronco encefálico, | sin tratamiento, mortalidad 5-20% | |||
| herniación por hipertensión intracraneal) | 8,5% diagnóstico de EM | |||
ADEM: encefalomielitis aguda diseminada; EM: esclerosis múltiple; ggbb: ganglios basales; LETM: mielitis transversa longitudinal extensa; MBP: proteína básica de la mielina.
Hoy en día el pronóstico de estas enfermedades es menos desolador gracias a una mayor disponibilidad de la RM, que permite un diagnóstico más precoz, así como a una mejora de los tratamientos inmunosupresores y de soporte vital4. Consideramos necesario comunicar los casos de desmielinización fulminante del SNC para contribuir al incremento del conocimiento sobre este grupo de enfermedades y a la mejora de su atención médica.






![RM cerebral con contraste; cortes axiales A-B, D-J) y coronal C). Se aprecian múltiples lesiones parenquimatosas pseudonodulares en ambos hemisferios cerebrales, hiperintensas en las secuencias FLAIR A-C), afectando la sustancia blanca principalmente periventricular y yuxtacortical del giro precentral derecho, así como los ganglios de la base y las cápsulas internas, con extensión caudal a los pedúnculos cerebrales del mesencéfalo. No presentan edema ni ejercen un efecto de masa significativos. Algunas de ellas realzan discretamente en la periferia en forma de anillo semiabierto tras la administración de gadolinio D-E) y presentan discreta restricción de la difusión periférica –diffusion weighted imaging (DWI): F-G); apparent diffusion coefficient (ADC): H-I)–. Las lesiones más profundas contienen focos petequiales en las secuencias de susceptibilidad magnética (susceptibility weighted imaging [SWI]: J). RM cerebral con contraste; cortes axiales A-B, D-J) y coronal C). Se aprecian múltiples lesiones parenquimatosas pseudonodulares en ambos hemisferios cerebrales, hiperintensas en las secuencias FLAIR A-C), afectando la sustancia blanca principalmente periventricular y yuxtacortical del giro precentral derecho, así como los ganglios de la base y las cápsulas internas, con extensión caudal a los pedúnculos cerebrales del mesencéfalo. No presentan edema ni ejercen un efecto de masa significativos. Algunas de ellas realzan discretamente en la periferia en forma de anillo semiabierto tras la administración de gadolinio D-E) y presentan discreta restricción de la difusión periférica –diffusion weighted imaging (DWI): F-G); apparent diffusion coefficient (ADC): H-I)–. Las lesiones más profundas contienen focos petequiales en las secuencias de susceptibilidad magnética (susceptibility weighted imaging [SWI]: J).](https://static.elsevier.es/multimedia/02134853/0000003700000002/v2_202203180842/S0213485321000426/v2_202203180842/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

