La efectividad y seguridad de natalizumab en pacientes con esclerosis múltiple remitente recurrente (EMRR) se demostró en ensayos clínicos. Sin embargo, por las limitaciones de estos es importante saber cómo se comporta en condiciones de práctica clínica a largo plazo.
ObjetivoConocer la eficacia a largo plazo de natalizumab en pacientes con EMRR mediante la evaluación anual del no evidence of disease activity (NEDA), que incluye número de brotes, discapacidad medida con EDSS y parámetros de RM cerebral.
Pacientes y métodosEstudio retrospectivo y multicéntrico (n=3) de pacientes con EMRR tratados con una o más dosis de natalizumab. Se evaluó el estado NEDA cada año y la seguridad a partir del porcentaje de pacientes que discontinuaron y que presentaron efectos adversos.
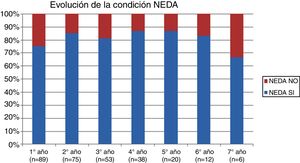
ResultadosIncluimos 89 pacientes, la mayoría recibieron tratamiento durante 2 a 4 años, con una duración del seguimiento de hasta 7 años. Natalizumab reduce significativamente la progresión radiológica y clínica de la enfermedad, así como la tasa anual de brotes, demostrándose su eficacia con el parámetro NEDA, 75,28% al primer año y 66,67% al séptimo año. Veinticinco pacientes (28,1%) han abandonado el estudio en una mediana de tiempo de 4 años, 14 pacientes (56%) por aparición de anticuerpos contra el virus JC, como causa única o asociada a otro motivo, 4 abandonos (16%) fueron por ineficacia, un paciente falleció a causa de LMP.
ConclusionesNatalizumab presenta una alta eficacia medida mediante el parámetro de remisión NEDA a largo plazo.
The safety and effectiveness of natalizumab in patients with relapsing-remitting multiple sclerosis (RRMS) has been demonstrated in clinical trials. However, due to the limitations of these trials, it is important to know how the condition behaves under long-term clinical practice conditions.
ObjectiveTo determine the long-term effectiveness of natalizumab in patients with RRMS by means of annual evaluation of the “no evidence of disease activity” (NEDA) parameter, which includes number of relapses, disability (measured with the Expanded Disability Status Scale), and brain MRI parameters.
Patients and methodsWe performed a retrospective study of patients with RRMS from 3 centres who were treated with one or more doses of natalizumab. Each year, we evaluated NEDA status and safety based on the percentage of patients who discontinued treatment with natalizumab and experienced adverse reactions.
ResultsThe study included 89 patients, most of whom received treatment for 2 to 4 years, with a follow-up period of up to 7 years. Natalizumab significantly reduces the radiological and clinical progression of the disease, as well as the annual rate of relapses. The NEDA parameter demonstrates the effectiveness of the drug, with values of 75.28% for year one and 66.67% for year 7. Twenty-five patients (28.1%) dropped out after a median of 4 years. Fourteen of these patients (56%) dropped out due to the appearance of anti–JC virus antibodies, either in isolation or associated with another cause. Four dropouts (16%) were due to treatment ineffectiveness, with one patient dying due to progressive multifocal leukoencephalopathy.
ConclusionsNatalizumab is highly effective as measured by the NEDA long-term remission parameter.
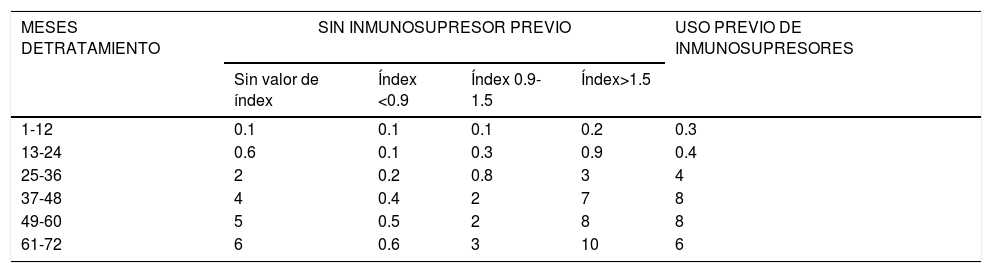
La efectividad y seguridad de natalizumab en pacientes con esclerosis múltiple remitente recurrente (EMRR) se demostró en ensayos clínicos1–3. Sin embargo, por las limitaciones de estos es importante saber cómo se comporta en condiciones de práctica clínica a largo plazo. En la actualidad se recomienda una selección rigurosa de los pacientes, principalmente por el riesgo potencial de sufrir como efecto adverso una leucoencefalopatía multifocal progresiva (LMP)4,5. Se ha visto que el riesgo de desarrollo de LMP es proporcional al título de anticuerpos frente al virus John Cunningham (VJC), y aumenta al haber recibido tratamiento previo con inmunosupresores y con el tiempo de administración del fármaco6. En pacientes con serologías negativas para VJC, el riesgo anual de desarrollar una LMP es de 0,1 casos/1.000 pacientes tratados. El riesgo en pacientes con serologías positivas se resume en la tabla 17.
Riesgo estimado de LMP en pacientes con serologías positivas para VJC (por cada 1000 pacientes tratados)
| MESES DETRATAMIENTO | SIN INMUNOSUPRESOR PREVIO | USO PREVIO DE INMUNOSUPRESORES | |||
|---|---|---|---|---|---|
| Sin valor de índex | Índex <0.9 | Índex 0.9-1.5 | Índex>1.5 | ||
| 1-12 | 0.1 | 0.1 | 0.1 | 0.2 | 0.3 |
| 13-24 | 0.6 | 0.1 | 0.3 | 0.9 | 0.4 |
| 25-36 | 2 | 0.2 | 0.8 | 3 | 4 |
| 37-48 | 4 | 0.4 | 2 | 7 | 8 |
| 49-60 | 5 | 0.5 | 2 | 8 | 8 |
| 61-72 | 6 | 0.6 | 3 | 10 | 6 |
El objetivo de este estudio es conocer la eficacia a largo plazo de natalizumab mediante la evaluación no evidence of disease activity (NEDA) anual y acumulado. Se considera un paciente NEDA cuando no tiene actividad clínica (ausencia de brotes y de progresión de discapacidad medida con la EDSS) ni radiológica (sin nuevas lesiones en T2 ni captación de Gd).
Material y métodosRealizamos un estudio retrospectivo multicéntrico en el que participaron 3 hospitales de Galicia, el hospital POVISA de Vigo, el Complejo Hospitalario Universitario de Santiago de Compostela y el Complejo Hospitalario Universitario de Pontevedra.
Los pacientes eran mayores de edad, capacitados legalmente y otorgaron su consentimiento para utilizar los datos clínicos y radiológicos en este estudio.
Siguiendo las indicaciones autorizadas según la ficha técnica los principales criterios de inclusión en el estudio fueron:
- -
Pacientes con elevada actividad de la enfermedad a pesar de un curso completo (normalmente un año) de tratamiento con interferón beta o acetato de glatirámero. Se considera elevada actividad la presencia de una recidiva durante el último año y tener, al menos, 9 lesiones hiperintensas en T2 o, al menos, una lesión realzada con gadolinio. También se incluyeron aquellos pacientes que presentaron una tasa de recidivas igual o mayor que el año previo a iniciar el tratamiento o recidivas graves.
- -
Pacientes con EMRR grave de evolución rápida, definida por 2 o más brotes incapacitantes en un año y una o más lesiones realzadas con gadolinio en la RM craneal, o un incremento significativo de la carga lesional en T2 en comparación con una RM realizada en el año anterior.
Fueron excluidos del estudio aquellos pacientes con edades superiores a 65 años e inferiores a 18 años, así como las mujeres embarazadas, por no estar aprobado el uso de natalizumab en dichos grupos demográficos. También se excluyeron aquellos pacientes con hipersensibilidad al fármaco, en situación de inmunosupresión o con neoplasias activas (a excepción de carcinoma basocelular).
Los pacientes incluidos en el estudio recibieron una perfusión intravenosa de 300mg de natalizumab cada 28 días. El tiempo de infusión fue de 1hora y permanecieron en observación durante otra hora para detectar posibles reacciones de hipersensibilidad. El tratamiento se suspendió en aquellos pacientes con riesgo elevado de LMP que no aceptaron continuar con el fármaco, o en caso de fracaso terapéutico. Se consideró fracaso terapéutico la presencia de un número de brotes mayor al año previo de iniciar el tratamiento, la presencia de brotes graves o la progresión de discapacidad.
En todos los casos se disponía de una evaluación clínica, una RM cerebral y un análisis de sangre previos al inicio de tratamiento con natalizumab.
Durante el periodo de tratamiento los pacientes fueron revisados de forma mensual. En cada visita se registró el número de brotes desde la visita anterior. Se consideró como brote la aparición de nuevos síntomas o la reaparición de síntomas antiguos, durante al menos 24horas, y en ausencia de fiebre o infección. La cuantificación de brotes de forma retrospectiva siempre está sujeta a sesgos, puesto que el paciente puede no recordar síntomas leves que no le han condicionado limitaciones para su vida diaria. No obstante, la frecuencia mensual de las revisiones minimiza este sesgo.
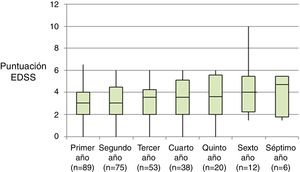
La progresión clínica se evaluó mediante la escala de discapacidad EDSS, realizada anualmente. Se consideró progresión el incremento de 0,5 puntos en la escala EDSS confirmada a los 3 meses.
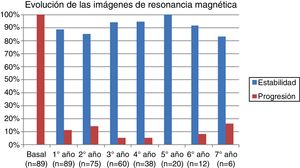
Las serologías de VJC se realizaron de forma semestral. Los controles de neuroimagen se realizaron con una periodicidad anual, excepto en los pacientes con serologías positivas para el VJC, en los que la RM se hizo cada 3 o 6 meses siguiendo las recomendaciones de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y la ficha técnica de natalizumab. La RM cerebral se realizó con reposición de imagen. Se consideró progresión radiológica cuando en la RM cerebral anual aparecieron lesiones captantes de gadolinio en T1, o se apreciaron nuevas lesiones en T2.
El objetivo del estudio fue valorar el número de pacientes NEDA. Esta es una variable dicotómica cuyo resultado se define como ausencia de progresión clínica (ausencia de brotes y no progresión de discapacidad) y radiológica. El resultado negativo de los 3 parámetros en cada control resulta en un NEDA positivo, que implica la ausencia de actividad de la enfermedad.
El análisis estadístico de los datos se llevó a cabo con los programas estadísticos SPSS versión 21. Se consideró como nivel de significación estadística un valor de p<0,05. Se efectuó un análisis descriptivo de todas las variables. La comparación de 2 muestras cuantitativas independientes se realizó con el test «t» de Student (bajo supuesto de normalidad) o el test no paramétrico de Mann-Whitney. La comparación de más de 2 muestras independientes se realizó con la técnica ANOVA bajo supuestos de normalidad o con el test no paramétrico de Kruskal-Wallis. La asociación de las variables se realizó mediante el test de la «t» de Student para la comparación de medias entre datos no pareados y el estadístico χ2 (Chi cuadrado) para el estudio de asociación entre variables cualitativas.
ResultadosDesde el momento de la instauración del tratamiento hasta la fecha de suspensión del fármaco o, en su defecto, hasta septiembre de 2016, se han estudiado un total de 89 pacientes. En el grupo había 38 varones (42,7%) y 51 mujeres (57,3%), con una edad media de 41,09±8,19 años (entre 22 y 63 años) siguiendo una distribución normal. De ellos, casi la mitad eran pacientes del Complejo Hospitalario Universitario de Santiago de Compostela (43 pacientes) y el resto, en proporción similar, de POVISA (25 pacientes) y del Complejo Hospitalario Universitario de Pontevedra (21 pacientes).
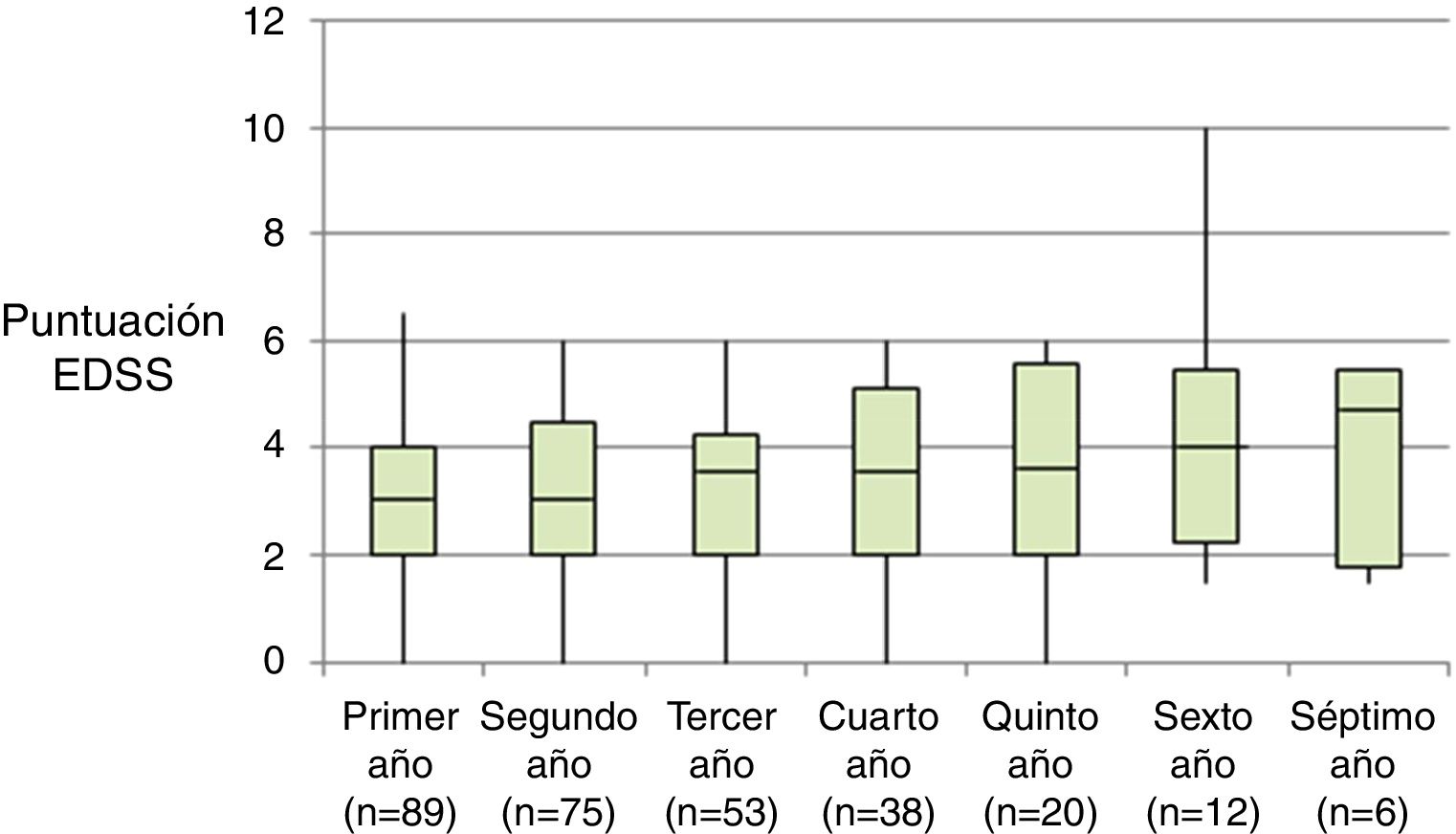
Al inicio del estudio la mediana de la EDSS era 3 (RI=2,0-4,5) y en el año anterior a la instauración del tratamiento habían tenido una media de 1,67±0,81 brotes. Todos los pacientes tenían actividad radiológica al inicio del tratamiento.
La mayoría de pacientes recibieron tratamiento durante 2 a 4 años. Los 89 pacientes completaron un año de tratamiento, 74 pacientes completaron el segundo, 53 el tercero, 38 el cuarto, 20 el quinto, 12 el sexto y 6 el séptimo año.
Los motivos de suspensión del tratamiento fueron riesgo de LMP, no aceptado por el paciente en un 14% (5 pacientes en el segundo año de tratamiento, 3 en el tercer año, otros 3 en el cuarto año, uno en el quinto y uno en el sexto año), ineficacia en un 5% (3 pacientes en el segundo año, uno en el cuarto y uno en el sexto), 2% por decisión propia (2 pacientes en el primer año de tratamiento), 6% por efectos secundarios (un paciente en el tercer año, 2 en el cuarto año, uno en el quinto año y otro en el sexto). Además hubo 2 suspensiones temporales por embarazo, una en el primer mes y otra en el cuarto año de tratamiento.
Con respecto a los efectos secundarios fueron una trombocitopenia en el tercer año de tratamiento, un cáncer de mama en el cuarto año de tratamiento y 3 procesos infecciosos, un absceso amigdalar que precisó cirugía en el cuarto año de tratamiento, una espondilodiscitis con ingreso prolongado durante el quinto año de tratamiento y un paciente que falleció a consecuencia de una LMP en el sexto año. La tasa de efectos secundarios fue de 0% durante los 2 primeros años, de un 2% durante el tercer año, de un 5% en el cuarto y quinto años, de un 8% en el sexto año y de 0% en el séptimo.
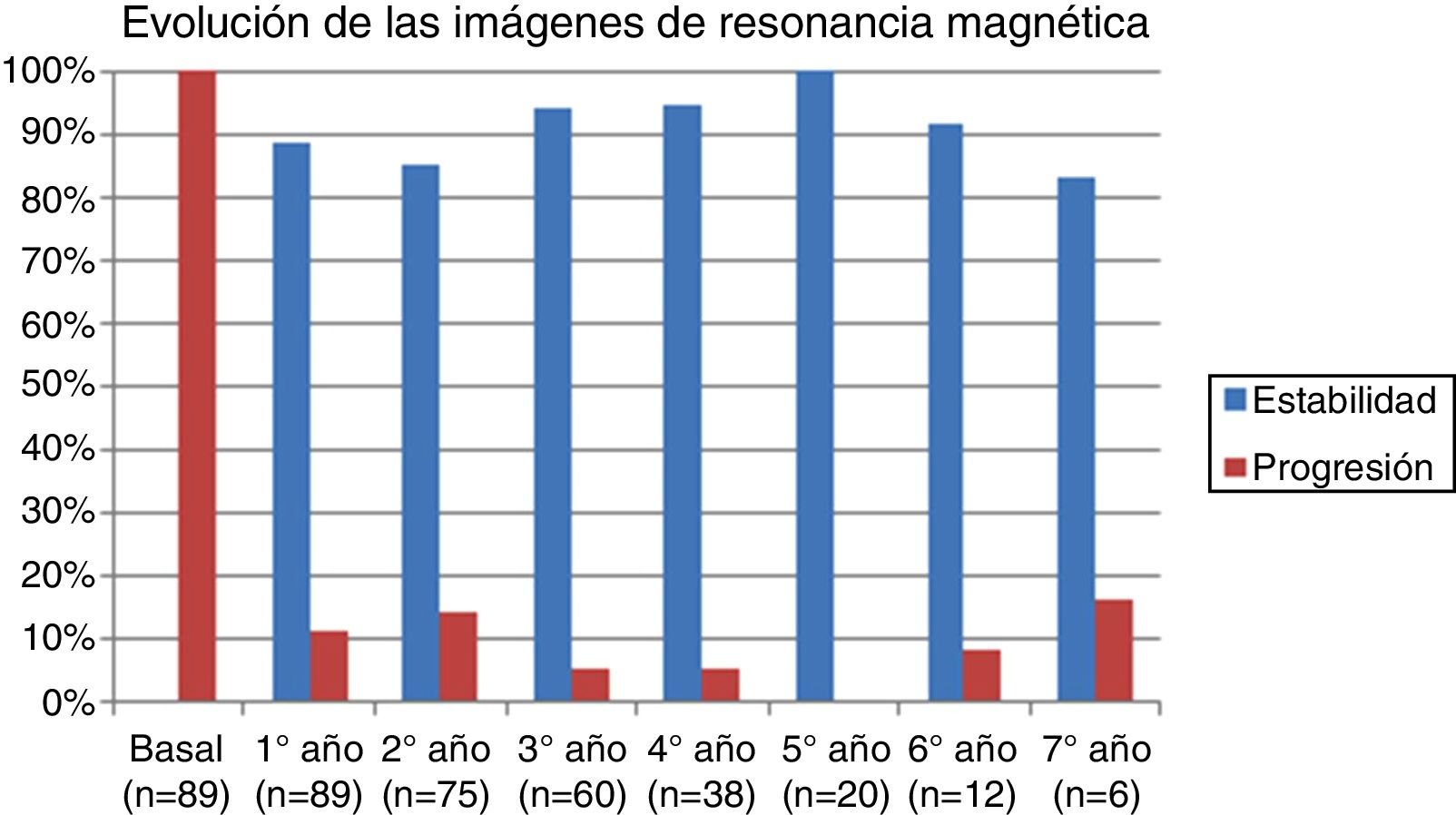
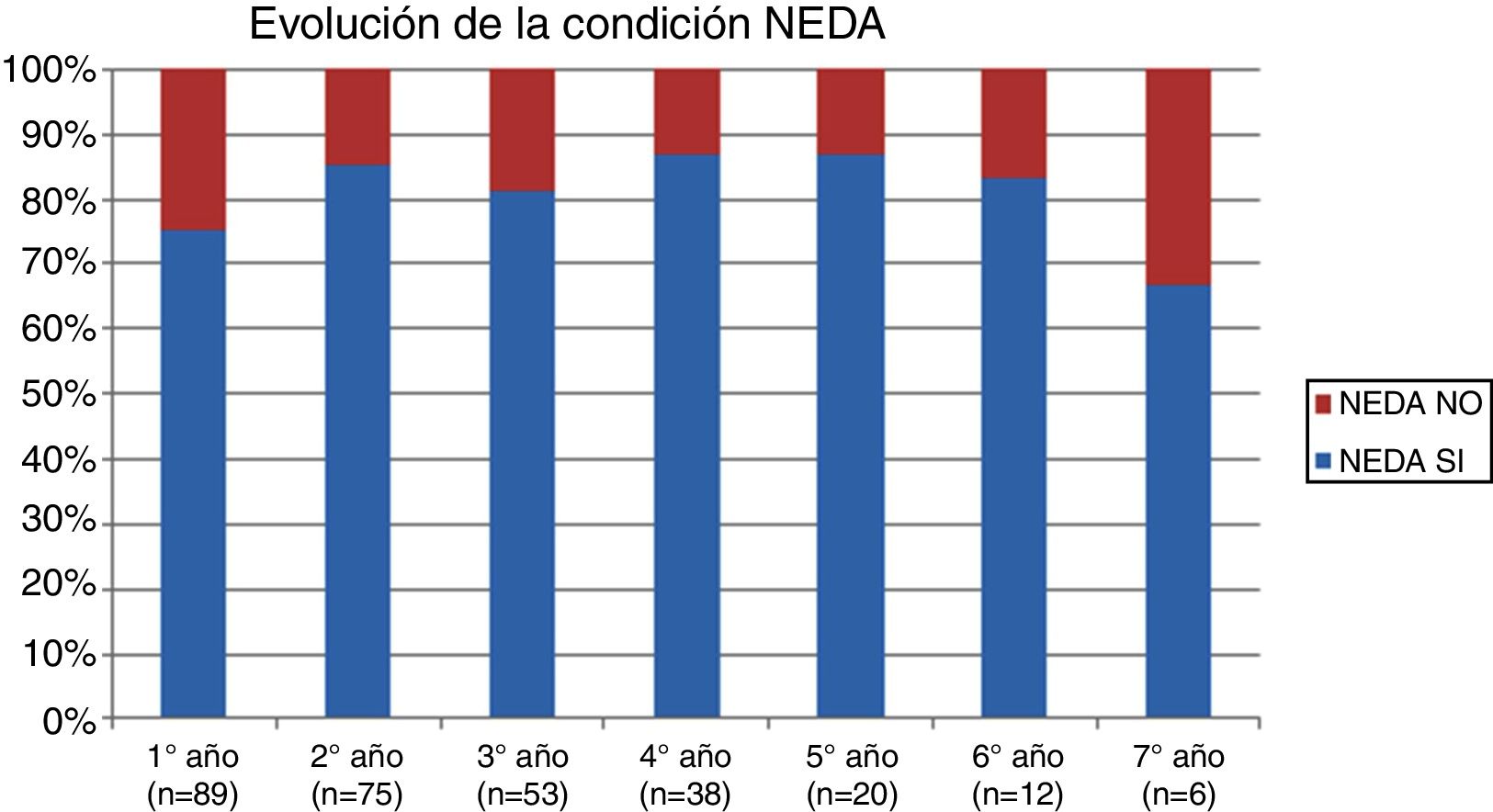
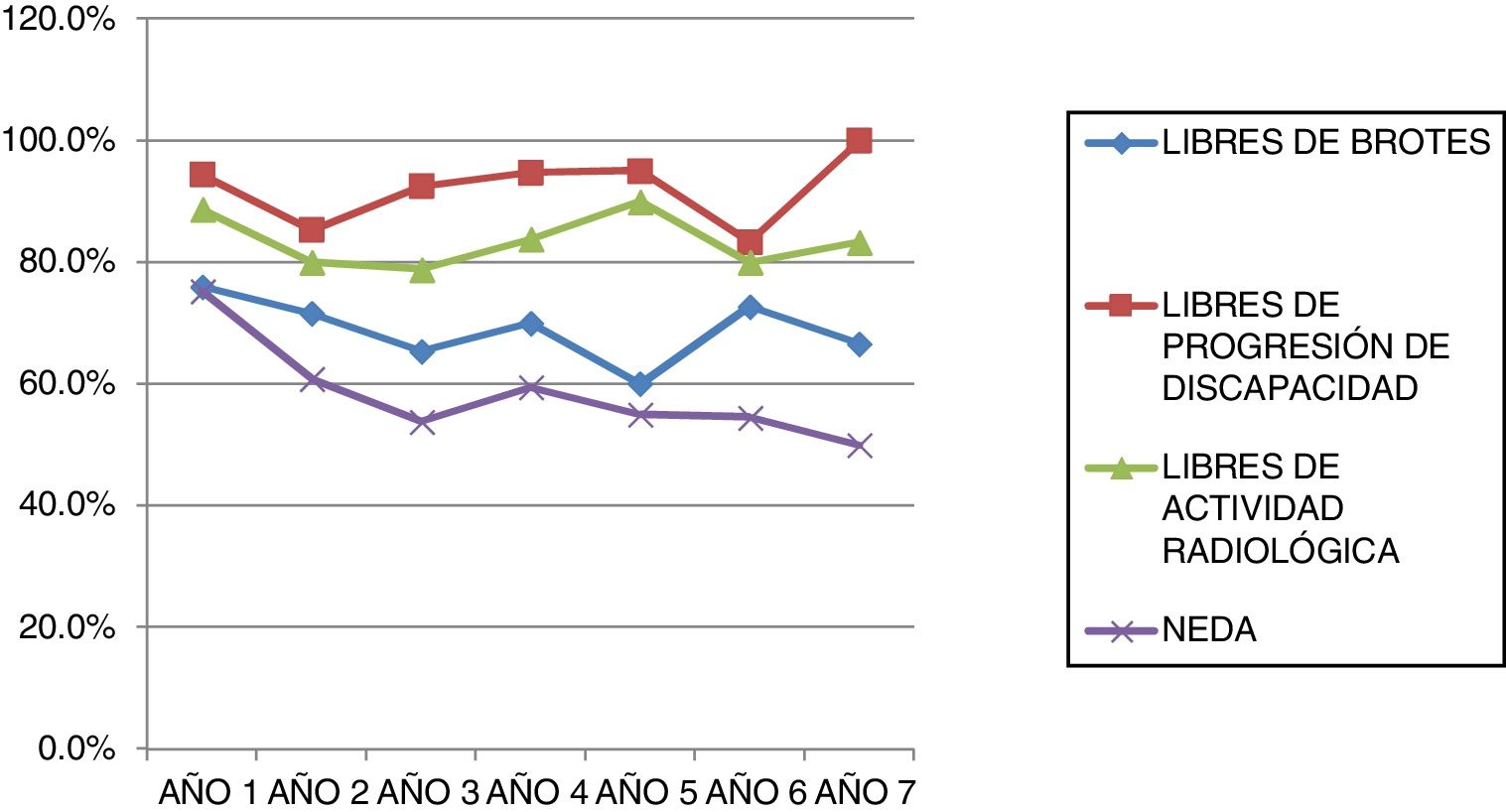
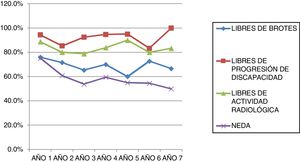
La tabla 2 representa la evolución de los diferentes parámetros medidos anualmente para todos los pacientes. En la figura 1 se representa la evolución anual de la escala EDSS, en la figura 2 se muestra la evolución de las imágenes de resonancia magnética año a año y en la figura 3 se representa la proporción de pacientes con NEDA año a año. En cuanto a la comparativa anual por edad y sexo, no se han observado diferencias estadísticamente significativas entre hombres y mujeres en la reducción del número de brotes, en la estabilidad radiológica ni por grupos de edad (p>0,05). En el caso de la progresión de EDSS, únicamente se han hallado diferencias significativas (p<0,05) al segundo y séptimo años de seguimiento, demostrándose una mayor progresión en varones que en mujeres, pero que no se apreciaron en el resto de años del estudio.
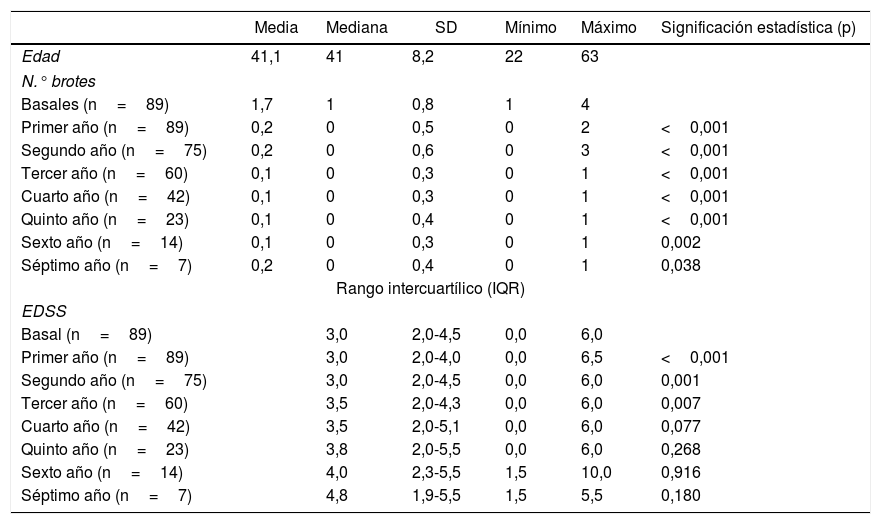
[{Tabla 1)}] Distribución de la edad muestral, y de las variables Número de brotes y Escala EDSS de Krutzke anualmente. El nivel de significación estadística (p<0.05) alude a la comparación de los resultados anuales respecto al nivel basal
| Media | Mediana | SD | Mínimo | Máximo | Significación estadística (p) | |
|---|---|---|---|---|---|---|
| Edad | 41,1 | 41 | 8,2 | 22 | 63 | |
| N.° brotes | ||||||
| Basales (n=89) | 1,7 | 1 | 0,8 | 1 | 4 | |
| Primer año (n=89) | 0,2 | 0 | 0,5 | 0 | 2 | <0,001 |
| Segundo año (n=75) | 0,2 | 0 | 0,6 | 0 | 3 | <0,001 |
| Tercer año (n=60) | 0,1 | 0 | 0,3 | 0 | 1 | <0,001 |
| Cuarto año (n=42) | 0,1 | 0 | 0,3 | 0 | 1 | <0,001 |
| Quinto año (n=23) | 0,1 | 0 | 0,4 | 0 | 1 | <0,001 |
| Sexto año (n=14) | 0,1 | 0 | 0,3 | 0 | 1 | 0,002 |
| Séptimo año (n=7) | 0,2 | 0 | 0,4 | 0 | 1 | 0,038 |
| Rango intercuartílico (IQR) | ||||||
| EDSS | ||||||
| Basal (n=89) | 3,0 | 2,0-4,5 | 0,0 | 6,0 | ||
| Primer año (n=89) | 3,0 | 2,0-4,0 | 0,0 | 6,5 | <0,001 | |
| Segundo año (n=75) | 3,0 | 2,0-4,5 | 0,0 | 6,0 | 0,001 | |
| Tercer año (n=60) | 3,5 | 2,0-4,3 | 0,0 | 6,0 | 0,007 | |
| Cuarto año (n=42) | 3,5 | 2,0-5,1 | 0,0 | 6,0 | 0,077 | |
| Quinto año (n=23) | 3,8 | 2,0-5,5 | 0,0 | 6,0 | 0,268 | |
| Sexto año (n=14) | 4,0 | 2,3-5,5 | 1,5 | 10,0 | 0,916 | |
| Séptimo año (n=7) | 4,8 | 1,9-5,5 | 1,5 | 5,5 | 0,180 | |
Teniendo en cuenta que en 15 pacientes de un total de 89 se suspendió el fármaco tras la aparición de anticuerpos positivos frente al VJC, decidimos estudiar el alcance del estado NEDA entre estos pacientes, y no hemos observado diferencias estadísticamente significativas cuando los comparamos con el grupo que no suspendió el fármaco (p=0,584): al final de su seguimiento alcanzan NEDA el 73,3% de los afectados por VJC (incluyendo al paciente que falleció por LMP).
Hemos comparado la respuesta NEDA en función de la EDSS previa a la administración de natalizumab: un primer grupo (n=45) incluye pacientes con una EDSS entre 0 y 3 y el segundo grupo (n=44) tiene EDSS entre 3 y 6 puntos. No se han encontrado diferencias estadísticamente significativas entre ambos grupos de enfermos.
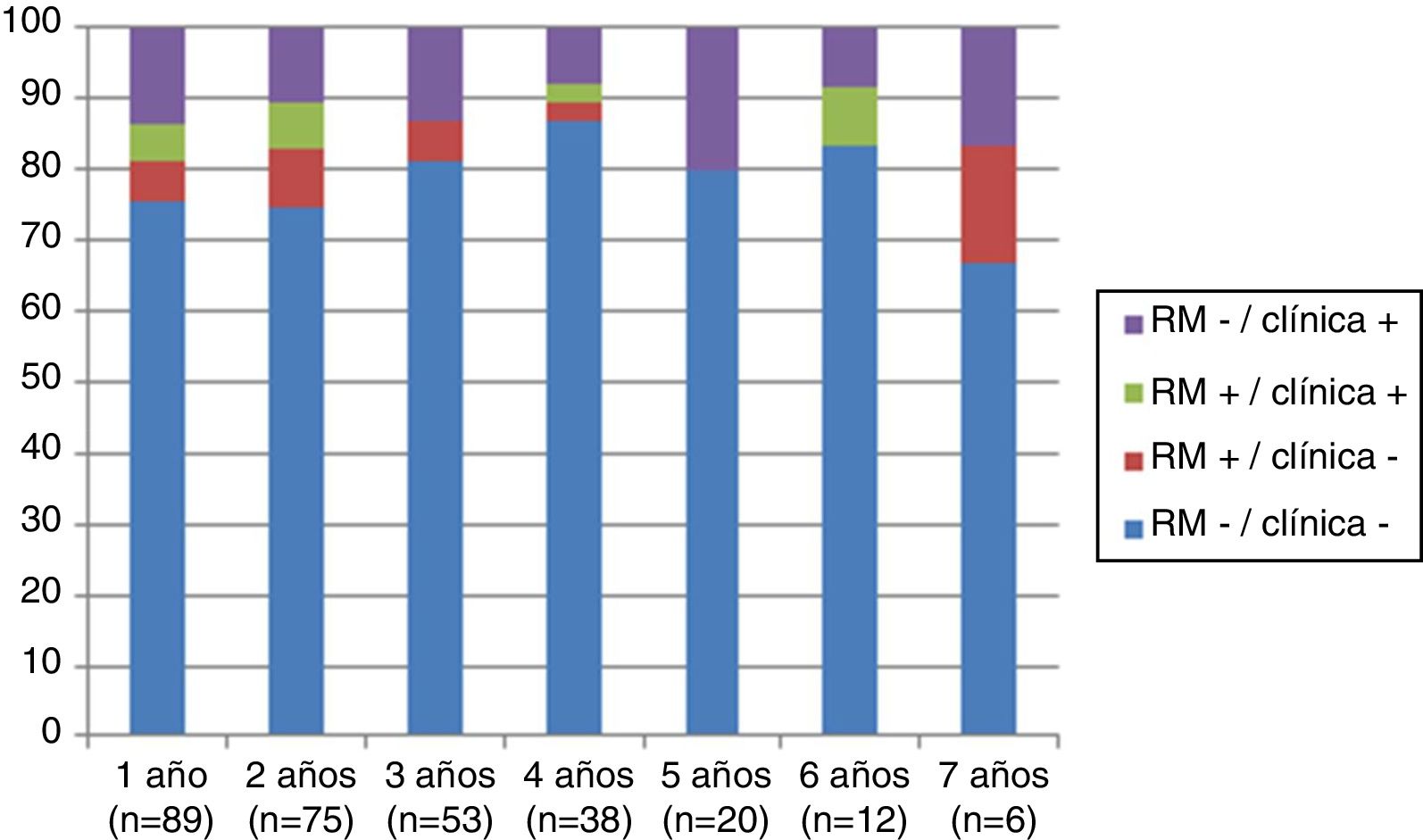
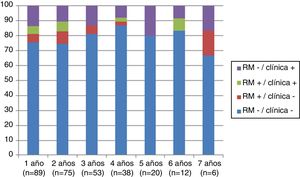
Analizando separadamente la progresión clínica y radiológica a lo largo del estudio, en la figura 4 se puede observar que en prácticamente todos los años y en proporciones prácticamente constantes la pérdida de la condición de NEDA es debida a progresión clínica no asociada a alteraciones radiológicas (desde el 13,48% el primer año al 16,67% el séptimo año) y únicamente 4 de 53 pacientes han tenido alteraciones en sus pruebas de imagen a partir del tercer año de seguimiento. En la figura 5 se resume el porcentaje de pacientes con libertad de actividad clínica y radiológica en cada año de tratamiento.
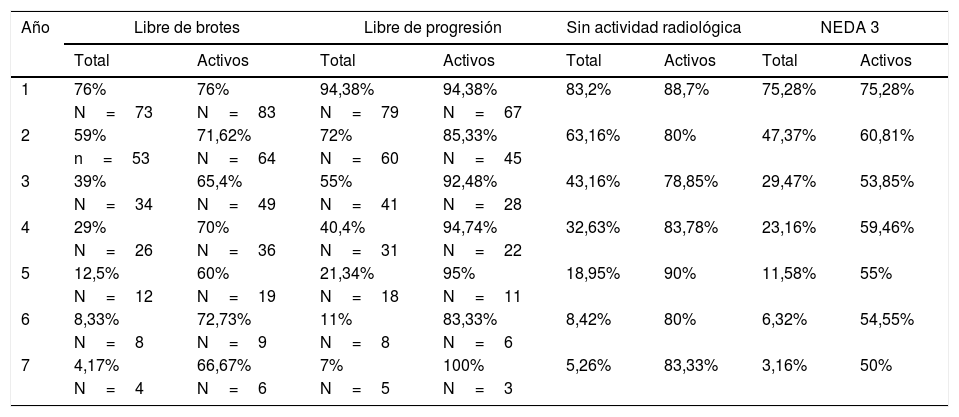
En la tabla 3 se resumen los datos de NEDA acumulado durante los años de tratamiento. El valor de NEDA se va reduciendo de forma progresiva a medida que se suceden los años de tratamiento, aunque siempre se mantiene por encima del 50%. El NEDA acumulado es del 75,28% al primer año, del 60,81% al segundo año, del 53,85% al tercer año, del 59,46% al cuarto año, del 55% al quinto año, del 54,55% al sexto año y del 50% en el séptimo año.
NEDA acumulado en cada año de tratamiento
| Año | Libre de brotes | Libre de progresión | Sin actividad radiológica | NEDA 3 | ||||
|---|---|---|---|---|---|---|---|---|
| Total | Activos | Total | Activos | Total | Activos | Total | Activos | |
| 1 | 76% | 76% | 94,38% | 94,38% | 83,2% | 88,7% | 75,28% | 75,28% |
| N=73 | N=83 | N=79 | N=67 | |||||
| 2 | 59% | 71,62% | 72% | 85,33% | 63,16% | 80% | 47,37% | 60,81% |
| n=53 | N=64 | N=60 | N=45 | |||||
| 3 | 39% | 65,4% | 55% | 92,48% | 43,16% | 78,85% | 29,47% | 53,85% |
| N=34 | N=49 | N=41 | N=28 | |||||
| 4 | 29% | 70% | 40,4% | 94,74% | 32,63% | 83,78% | 23,16% | 59,46% |
| N=26 | N=36 | N=31 | N=22 | |||||
| 5 | 12,5% | 60% | 21,34% | 95% | 18,95% | 90% | 11,58% | 55% |
| N=12 | N=19 | N=18 | N=11 | |||||
| 6 | 8,33% | 72,73% | 11% | 83,33% | 8,42% | 80% | 6,32% | 54,55% |
| N=8 | N=9 | N=8 | N=6 | |||||
| 7 | 4,17% | 66,67% | 7% | 100% | 5,26% | 83,33% | 3,16% | 50% |
| N=4 | N=6 | N=5 | N=3 | |||||
Se representa el NEDA acumulado, así como cada uno de los parámetros que contribuyen a él en cada año sobre el total de pacientes que comenzaron el tratamiento (total) y sobre el número de pacientes que completaron cada año de tratamiento (activos).
En la actualidad el objetivo del tratamiento de la EM es mantener la remisión clínica y radiológica el mayor tiempo posible, y por ello se ha creado el parámetro terapéutico denominado NEDA.
En nuestro estudio las características demográficas de la muestra cumplen los criterios de prescripción del natalizumab8, y el valor de 3 para la mediana de la EDSS indica que estos pacientes tenían una discapacidad leve-moderada al inicio del tratamiento.
Por otra parte, el período de seguimiento de hasta 7 años nos permite estudiar a medio-largo plazo la eficacia y la seguridad del fármaco. Un paciente de nuestra serie falleció por LMP y otros 3 sufrieron eventos adversos graves que obligaron a interrumpir su administración: uno por reacción anafiláctica y 2 por infecciones (absceso amigdalar y espondilodiscitis) que requirieron ingreso hospitalario y que hemos relacionado con su efecto inmunosupresor. No obstante, la elevada tasa de abandonos del tratamiento en el intervalo de 2 a 7 años (mediana 4 años) a causa de la seropositividad al virus JC (56% del total de enfermos) hace que las otras posibles complicaciones que puedan suceder probablemente estén infravaloradas, por lo que las conclusiones a este respecto han de ser tomadas con cautela y los resultados obtenidos en ese intervalo de tiempo solo sirven para obtener una idea aproximada de lo que ocurre en ese período. Solo 12 pacientes cumplieron 6 años de tratamiento, y solo 6 llegaron a los 7 años. A pesar de ello es importante destacar que no se han encontrado diferencias significativas en cuanto a la progresión clínica entre los pacientes con diferentes duraciones de tratamiento, sugiriendo esto que los abandonos debidos a la gestión del riesgo de LMP puede llevar consigo la condición de renunciar a una buena respuesta de natalizumab sobre la enfermedad.
En nuestro estudio apreciamos una reducción significativa del número de brotes y de la progresión de la EDSS durante los 4 primeros años de tratamiento respecto a la situación basal. Sin embargo, a partir del cuarto año los pacientes no presentan mayor número de brotes, pero existe una progresión de la EDSS que interpretamos como debida al componente degenerativo de la EM.
En cuanto al objetivo fundamental de nuestro estudio, tras un año de tratamiento 67 de 89 pacientes (75,28%) cumplían criterios de NEDA y estos porcentajes se mantuvieron estables a lo largo de los 7 años de seguimiento (entre 74,67% y 86,84%), aunque hay que considerar que en este tiempo el número de pacientes en tratamiento ha ido disminuyendo de forma progresiva, fundamentalmente debido a la gestión del riesgo de seguridad por conversión a JVC, y solo en muy pocos casos por falta de eficacia.
El NEDA acumulado disminuye a lo largo del tiempo, pero se mantiene elevado, siendo del 50% incluso tras 7 años de tratamiento.
En relación con la adherencia tenemos una tasa del 72% a los 4 años, superponible a las del resto de la literatura, pero después de 7 años continúan en tratamiento menos de la mitad de los pacientes, lo cual se relaciona principalmente con la serología frente al virus JC y la gestión del beneficio-riesgo. Cuando evaluamos la situación del estado NEDA al final del seguimiento entre los pacientes que abandonaron el tratamiento por ser JVC positivos no encontramos diferencias significativas con el grupo restante, lo que demuestra que la pérdida de casos se produce fundamentalmente por el manejo del riesgo del fármaco y no por pérdida de eficacia.
En nuestro estudio observamos una mayor progresión de la EDSS en varones que en mujeres durante el segundo y el séptimo año de seguimiento, que podría explicarse porque la enfermedad tiende a ser más discapacitante en varones que en mujeres durante los primeros años de la enfermedad, aunque tiende a igualarse a partir del quinto año de seguimiento9.
Natalizumab parece ser más eficaz en la clínica habitual que en los estudios experimentales10,11, algo comprobado en estudios abiertos. En el estudio GEXNE realizado en España12 se analizó retrospectivamente la eficacia de natalizumab en 825 pacientes tratados durante un año, y el NEDA se registró en el 63%, con una reducción del número de brotes del 88%. En el estudio de Horga et al.13 siguieron durante un año a 112 pacientes tratados con natalizumab y cumplían criterios NEDA el 33%, con un 76% de estabilidad clínica. En ambos estudios los pacientes analizados tenían una mayor discapacidad y tasa de brotes que los nuestros, lo que podría explicar las diferencias en eficacia.
Hay muy pocos estudios que evalúen la eficacia del natalizumab a largo plazo. Prosperini et al.14 estudian 152 pacientes durante 7 años, y solo el 34% de sus pacientes estaban en NEDA al final del estudio, y no hubo progresión de la EDSS en el 41% contra un 79,7% de nuestro estudio. Las características clínicas basales de ambas series son bastante similares, por lo que esta discrepancia podría explicarse al menos en parte por las diferencias en los parámetros de seguimiento, ya que estos autores realizaron RM encéfalo-medulares, aumentado con ello la sensibilidad para detectar la progresión (detectaron un 10% más de nuevas lesiones).
Al analizar la progresión clínica y radiológica separadamente a lo largo del estudio, encontramos que prácticamente en todos los años en la mayoría de pacientes la pérdida de la condición de NEDA es debida a progresión clínica no asociada a alteraciones radiológicas, ya que a partir del tercer año de seguimiento únicamente 4 de 53 pacientes presentaron alteraciones en sus pruebas de imagen. Además, esta pérdida se produce en proporciones prácticamente constantes (desde el 13,48% el primer año al 16,67% el séptimo año). Esto puede explicarse porque en la EM hay una disparidad clínico-radiológica que se explica por la dificultad para detectar lesiones pequeñas15, sobre todo a nivel cortical, y porque las RM se realizaron en ocasiones en ausencia de brotes clínicos. Nuestras observaciones coinciden con las de Rotsein et al.16, en las que la mayor proporción de pacientes empeoran debido a progresión clínica, sin detección previa de cambios en las imágenes de RM. Por otra parte, en el futuro habría que plantear la realización de estudios de la médula espinal para poder determinar de forma más completa esta estabilidad14,16.
Aunque la condición NEDA es difícil de obtener a largo plazo, un aspecto a considerar en estudios futuros es la inclusión de medidas de atrofia cerebral (NEDA-4), ya que esta medida se correlaciona con el grado de neurodegeneración17 y constituye un importante factor pronóstico.
Conflicto de interesesIsabel Muñoz Pousa y Lucía Naya Ríos declaran no tener conflicto de intereses.
El resto de autores han recibido subvenciones para la asistencia a congresos o cursos y han participado en diferentes estudios por parte de Biogen, Novartis, Genzyme, Serono y Bayer-Schering.
En relación con este artículo declaramos no tener ningún conflicto de intereses.