Diversos polimorfismos en genes candidatos que codifican proteínas del sistema hemostático se han propuesto como factores de riesgo para el desarrollo de trombosis.
MétodosCasos y controles, sobrevivientes de enfermedad vascular cerebral (EVC) isquémica idiopática≤45 años de edad del servicio de neurología incluidos de manera consecutiva de 2006 a 2014. Por PCR-RFLP se identificaron los polimorfismos: Thr325Ile y Ala147Thr del gen de TAFI, 4G/5G del gen de PAI-1, PLA1/A2 del gen de la glucoproteína plaquetaria IIb/IIIa, Glu298Asp del gen de eNOS, y C677T del gen de la 5,10 MTHFR. Se realizó un análisis multivariado de regresión logística para calcular el riesgo independiente de EVC.
ResultadosDoscientos cuatro casos y 204 controles pareados por edad y sexo. Se asoció al polimorfismo Glu298Asp (genotipo p=0,001 y frecuencia alélica p=0,001), C677T (genotipo p=0,01), hipertensión (p=0,03) y tabaquismo (p=0,02) con la presencia de EVC isquémico, no así para los polimorfismos Ala147Thr, Thr325IIe, 4G/5G y PLA1/A2. Se identificó como factor de riesgo independiente al alelo 298Asp (p=0,03), T (p=0,01), hipertensión (p=0,03), tabaquismo (p=0,01) y AHFEAT (p=0,04).
ConclusionesLos polimorfismos Glu298Asp y C677T de los genes que codifican a la enzima eNOS y 5,10 MTHFR, tabaquismo, hipertensión y AHFEAT se asociaron a la presencia de EVC isquémico en jóvenes mexicanos, no así el Thr325Ile, Ala147Thr, 4G/5G, PLA1/A2 en genes que codifican proteínas del sistema de fibrinólisis y receptores plaquetarios.
Numerous polymorphisms in candidate genes coding for haemostatic system proteins have been proposed as risk factors for thrombosis.
MethodsWe performed a case-control study of consecutive ischaemic stroke survivors aged ≤ 45 years, treated at our neurology department from 2006 to 2014. Polymerase chain reaction–restriction fragment length polymorphism identified the following polymorphisms: Thr325Ile and Ala147Thr in TAFI, 4G/5G in PAI-1, PLA1/A2 in platelet glycoprotein IIb/IIIa, Glu298Asp in eNOS, and C677T in 5,10-MTHFR. A multivariate logistic regression analysis was performed to evaluate the independent risk of stroke.
Results204 cases and 204 age- and sex-matched controls were included in the study. Clinical and genetic variables associated with ischaemic stroke were hypertension (P=.03), tobacco use (P=.02), and the polymorphisms Glu298Asp (genotype: P=.001, allele frequency: P=.001) and C677T (genotype: P=.01); the Ala147Thr, Thr325IIe, 4G/5G, and PLA1/A2 mutations were not associated with ischaemic stroke. The 298Asp (P=.03) and T (P=.01) alleles, hypertension (P=.03), tobacco use (P=.01) and family history of stroke (P=.04) were identified as independent risk factors.
ConclusionsThe polymorphisms Glu298Asp and C677T, affecting the eNOS and 5,10-MTHFR enzymes, respectively, and smoking, hypertension, and family history of stroke were associated with ischaemic stroke in young Mexican patients; this was not the case for the Thr325Ile, Ala147Thr, 4G/5G, and PLA1/A2 polymorphisms of the genes coding for fibrinolytic proteins and platelet receptors.
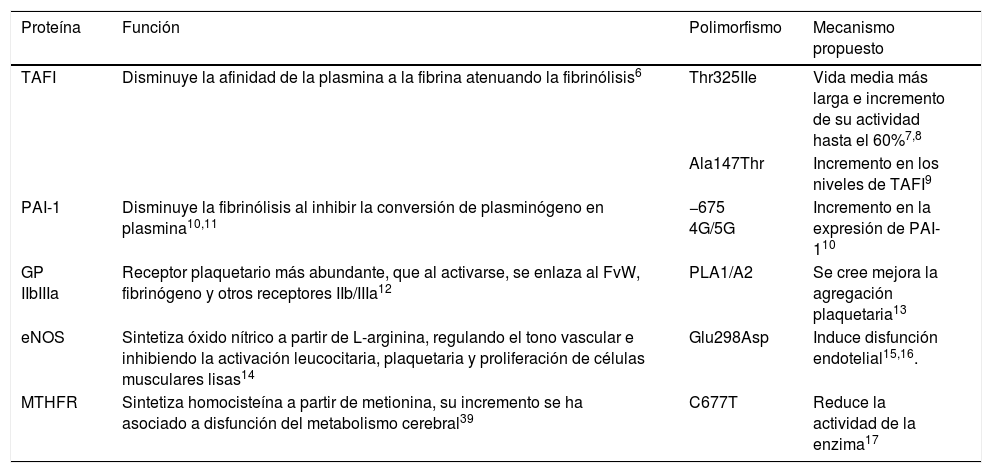
Las enfermedades cardiovasculares se han convertido en la primera causa de muerte en el mundo, y es la trombosis el mecanismo etiológico en común1. Aproximadamente el 67% de los casos de enfermedad vascular cerebral (EVC) son isquémicos, y se ha observado una notable reducción en su incidencia probablemente por la identificación temprana y adecuado control de los factores de riesgo tradicionales1,2. Su prevalencia en pacientes de edad <45 años varía del 3% al 5%, y en más de la mitad de los casos no se identifica la etiología3. Debido al menor tiempo de exposición a los factores de riesgo cardiovascular ambientales se considera que los factores de riesgo genéticos tienen una participación crucial en el desarrollo de trombosis en pacientes jóvenes4. Diversos polimorfismos en genes candidatos que codifican proteínas del sistema hemostático han sido propuestos como factores de riesgo para el desarrollo de trombosis5. El inhibidor de la fibrinólisis activable por trombina (TAFI) es una procarboxipeptidasa que atenúa la fibrinólisis, al eliminar los residuos de lisina C-terminal de la fibrina en la superficie del coágulo, disminuyendo la afinidad de la plasmina a su sustrato6. El polimorfismo Thr325IIe en el gen que codifica a TAFI, localizado en el cromosoma 13q14.11, resulta en la sustitución de treonina (Thr) por isoleucina (Ile) en la posición 325, confiriéndole una vida media más larga y un incremento de hasta el 60% en su actividad7,8. El polimorfismo Ala147Thr en el gen de TAFI se ha asociado a un incremento en sus niveles, que explica hasta el 61,6% de su variabilidad plasmática9. El inhibidor del activador del plasminógeno tisular tipo-1 (PAI-1) disminuye la fibrinólisis al inhibir la conversión de plasminógeno en plasmina, e inhibir la migración y proliferación de células musculares lisas entre el núcleo lipídico de la placa de ateroma y la luz arterial, predisponiendo la rotura de la placa al disminuir la síntesis de colágeno10,11. La inserción de una guanina (5G) en la posición 675 corriente arriba del sitio de inicio de la transcripción del gen que codifica al PAI-1, localizado en el cromosoma 7q22.1, se asocia con un incremento en su expresión10. El receptor plaquetario más abundante, la glucoproteína plaquetaria (GP) IIb/IIIa, es un heterodímero dependiente de calcio que al activarse sufre un cambio estructural que le permite enlazarse a ligandos que contienen la secuencia de aminoácidos: arginina-glicina-ácido aspártico-serina, como el factor de Von Willebrand, fibrinógeno y otros receptores IIb/IIIa12. La sustitución de timidina (T) por citosina (C) en la posición 1565 en el exón 2 del gen que codifica a la subunidad IIIa, localizado en el brazo largo del cromosoma 17, induce la sustitución de leucina por prolina en la posición 33, que se cree mejora la agregación plaquetaria13. La enzima óxido nítrico sintasa endotelial (eNOS) cataliza la síntesis de óxido nítrico a partir de L-arginina; el óxido nítrico regula el tono vascular y previene la enfermedad aterotrombótica al inhibir la activación leucocitaria, plaquetaria y proliferación de células musculares lisas14. El cambio de una G por T en la posición 894 en el exón 7 del gen que codifica a la enzima eNOS, localizado en el cromosoma 7q35-36, se traduce en la sustitución de glutamina (Glu) por aspargina (Asp) en la posición 298, induciendo disfunción endotelial15,16. El polimorfismo C677T en el gen que codifica a la enzima 5,10 metilentetrahidrofolato reductasa (5,10 MTHFR), localizado en el cromosoma 1p36.3, resulta en la sustitución de valina (Val) por alanina (Ala), y es responsable de una reducción en la actividad de la enzima17 (tabla 1).
Genotipos propuestos como factores de riesgo de enfermedad vascular cerebral de tipo isquémico idiopático
| Proteína | Función | Polimorfismo | Mecanismo propuesto |
|---|---|---|---|
| TAFI | Disminuye la afinidad de la plasmina a la fibrina atenuando la fibrinólisis6 | Thr325IIe | Vida media más larga e incremento de su actividad hasta el 60%7,8 |
| Ala147Thr | Incremento en los niveles de TAFI9 | ||
| PAI-1 | Disminuye la fibrinólisis al inhibir la conversión de plasminógeno en plasmina10,11 | −675 4G/5G | Incremento en la expresión de PAI-110 |
| GP IIbIIIa | Receptor plaquetario más abundante, que al activarse, se enlaza al FvW, fibrinógeno y otros receptores IIb/IIIa12 | PLA1/A2 | Se cree mejora la agregación plaquetaria13 |
| eNOS | Sintetiza óxido nítrico a partir de L-arginina, regulando el tono vascular e inhibiendo la activación leucocitaria, plaquetaria y proliferación de células musculares lisas14 | Glu298Asp | Induce disfunción endotelial15,16. |
| MTHFR | Sintetiza homocisteína a partir de metionina, su incremento se ha asociado a disfunción del metabolismo cerebral39 | C677T | Reduce la actividad de la enzima17 |
eNOS: enzima óxido nítrico sintasa endotelial; FvW: Factor de Von Willebrand; GP IIb/IIIa: glucoproteína plaquetaria IIb/IIIa; 5,10 MTHFR: 5,10 metilentetrahidrofolato reductasa; PAI-1: inhibidor del activador de plasminógeno tisular tipo-1; TAFI: inhibidor de la fibrinólisis activado por trombina.
El objetivo del presente estudio es identificar la asociación e interacción entre los polimorfismos: Thr325Ile y Ala147Thr en el gen que codifica a TAFI, 4G/5G en el gen que codifica a PAI-1, PLA1/A2 en el gen que codifica la subunidad IIIa de la GP, Glu298Asp en el gen que codifica a eNOS y C677T en el gen que codifica a la 5,10 MTHFR, con la presencia de EVC de tipo isquémico en pacientes jóvenes mexicanos.
Pacientes y métodosSe realizó un estudio de casos y controles en pacientes con diagnóstico de EVC isquémico idiopático ≤45 años de edad, ingresados de manera consecutiva de 2006 a 2014. Previo consentimiento informado los pacientes fueron referidos a la Unidad de Investigación Médica en Trombosis, Hemostasia y Aterogénesis del Hospital General Regional n.° 1 del Instituto Mexicano del Seguro Social (IMSS). Se obtuvieron las variables: edad, sexo, antecedente de diabetes mellitus tipo 2 (DM2), hipertensión arterial sistémica (HAS), dislipidemia, tabaquismo, y antecedente heredofamiliar de enfermedad aterotrombótica (AHFEAT). Los polimorfismos: Thr325Ile, Ala147Thr, 4G/5G, PLA1/A2, Glu298Asp y C677T fueron determinados en todos los participantes. Este proyecto fue revisado y aprobado por el Comité de Ética del Instituto Mexicano del Seguro Social, conforme a las directrices de la Declaración de Helsinki de la Asociación Médica Mundial y la Organización Mundial de la Salud, modificada en Tokio, Japón.
Todos los pacientes con diagnóstico de EVC isquémico confirmado por tomografía axial computarizada fueron previamente protocolizados mediante la realización de los siguientes estudios: ultrasonido Doppler carotídeo y vertebral, ecocardiograma transtorácico o transesofágico, angiografía, resonancia magnética cardiaca, electrocardiograma de 12 derivaciones y monitorización del ritmo cardiaco automatizado por al menos 24horas, para descartar aquellos pacientes con factores de riesgo para EVC cardioembólico como: fibrilación auricular, trombo intraventricular, infarto agudo de miocardio, prótesis valvular, cardiomiopatía, endocarditis, mixoma auricular, persistencia del foramen oval, aneurisma del septum auricular, estenosis de la arteria carotídea ≥50%, disección de la arteria vertebrobasilar y arteritis. Se determinaron las concentraciones de antitrombina, proteína C y proteína S (Diagnostica Stago), anticoagulante lúpico (DVV test, DVV confirm®; American Diagnostic, EE. UU.), resistencia a la proteína C activada modificada (rango normal >2,0, Coatest+APC Resistance V-S; Chromogenix, Suecia) y anticuerpos anticardiolipinas (valor normal <10U; Sanofi Diagnostics Pasteur, Francia) en todos los participantes a los 6 meses posteriores al ictus.
El diagnóstico de EVC isquémico se realizó de acuerdo con los criterios Trial of Org 10172 in Acute Stroke Treatment18. El grupo control se integró por sujetos voluntarios aparentemente sanos, que acudieron al banco de sangre de manera consecutiva como potenciales donadores, sin antecedente de enfermedad (DM, HAS, EVC o enfermedad trombótica), con parámetros bioquímicos en rangos normales y que aceptaron participar en el estudio, pareados por edad y género con el grupo de casos.
Identificación de polimorfismosLos polimorfismos Thr325Ile y Thr147Ala del gen del TAFI se amplificaron bajo las siguientes condiciones térmicas: desnaturalización a 94°C por 30segundos, alineación a 60°C por 30segundos y extensión a 72°C por 60segundos por 30 ciclos. Mediante la enzima de restricción SpeI se obtuvo una banda de 245pb para el alelo Thr y 364pb para el alelo Ile del polimorfismo Thr325Ile. Con la enzima BbvI se obtuvieron bandas de 124 y 304pb para el alelo Ala y 428pb para el alelo Thr del polimorfismo Thr147Ala.
Para el polimorfismo 4G/5G del PAI-1 se aplicó una desnaturalización inicial a 94°C por 3minutos, seguida de 30 ciclos de desnaturalización a 94°C por 3segundos, alineación a 60°C por 30segundos y extensión a 72°C por 30segundos, y una extensión final a 72°C por un minuto. Se utilizó la enzima Bsl I y se obtuvo una banda de 99pb para el alelo 5G y 98pb para el 4G.
Para el polimorfismo PLA1/A2 en el gen de la subunidad IIIa de la GP: una desnaturalización inicial a 94°C por 5minutos, seguida de 35 ciclos de desnaturalización a 94°C por un minuto, alineación a 57°C por 45segundos y extensión a 72°C por 60segundos, y una extensión final a 72°C por 15minutos. Se empleó la enzima MspI y se obtuvo una banda de 221pb para el alelo PLA1 y 177pb para PLA2.
El polimorfismo Glu298Asp del gen de eNOS requirió una desnaturalización a 94°C por 30segundos, alineación a 60°C por 30segundos, y extensión a 72°C por 30segundos, por 30 ciclos. Se utilizó la enzima Mbo I y se obtuvo 2 fragmentos de 119 y 87pb para el alelo Asp298 y 206 pb para el Glu298.
El polimorfismo C677T del gen de la 5,10 MTHFR ameritó una desnaturalización a 94°C por 20segundos, alineación a 62°C por 20segundos y extensión a 72°C por 20segundos, por 30 ciclos. Se utilizó la enzima Hinf I y se obtuvo una banda 175pb para el alelo T y 198pb para el alelo C.
Análisis estadísticoLas variables continuas se expresaron en media±desviación estándar. Las variables categóricas se expresaron en número de pacientes (n) y porcentajes (%). Las variables continuas fueron comparadas entre el grupo de casos y controles utilizando la prueba «t» de Student. Las variables categóricas fueron comparadas entre ambos grupos a través de la prueba Chi cuadrado. Todas las variables fueron sometidas a pruebas de normalidad (test Shapiro-Wilk) para determinar la distribución de los datos. La frecuencia alélica de cada polimorfismo fue evaluada en cada grupo utilizando la prueba Chi cuadrado conforme a las proporciones de acuerdo al equilibrio de Hardy-Weinberg. Se realizó un análisis multivariado de regresión logística para calcular el riesgo independiente de presentar EVC isquémica expresada con la razón de momios, incluyendo en el modelo como variables independientes las variables clínicas y los polimorfismos que resultaron con significación estadística en el análisis univariado. Se consideró como diferencia estadísticamente significativa un valor de p≤0,05. Los análisis estadísticos se efectuaron utilizando el programa estadístico SPSS versión 20 (SPSS Inc., Chicago, IL, EE. UU.).
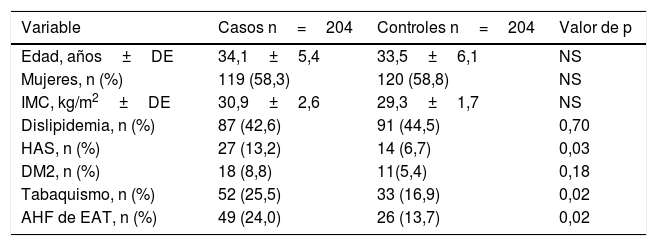
ResultadosSe incluyeron 251 pacientes de edad ≤45 años con diagnóstico de EVC isquémico, en un periodo de 8 años, de 2006 a 2014. Se excluyeron 33 pacientes por presentar: deficiencia de proteína S (n=7), deficiencia de proteína C (n=1), anticuerpos anticardiolipinas (n=15), anticoagulante lúpico (n=6), resistencia adquirida a la proteína C activada (n=4), deficiencia de antitrombina (n=1) y 14 pacientes por hemorragia cerebral. La muestra analizada estuvo constituida por 204 pacientes jóvenes con EVC isquémica de origen idiopático y 204 controles pareados por edad y sexo. En la tabla 2 se muestran las características clínicas y demográficas del grupo de casos y controles. En el grupo de casos la edad promedio fue de 34,1±5,4 años, predominando el sexo femenino en el 58,3% (n=119), con un IMC de 30,9±2,6kg/m2. Los factores de riesgo cardiovascular tradicionales por orden de frecuencia fueron: dislipidemia en 42,6% (n=87), tabaquismo en 25,5% (n=52), AHFEAT en 24% (n=49), HAS en 13,2% (n=27) y DM2 en 8,8% (n=18). Se observó una mayor frecuencia de HAS (13,2% vs. 6,7%, p=0,03), tabaquismo (25,5% vs. 16,9%, p=0,02) y AHFEAT (24% vs. 13,7%, p=0,02) en el grupo de casos vs. controles. No hubo diferencia estadística para las variables edad, sexo, IMC, dislipidemia y DM2 entre ambos grupos.
Características clínicas y demográficas de 204 pacientes de edad ≤45 años con EVC de tipo isquémica idiopática y 204 controles
| Variable | Casos n=204 | Controles n=204 | Valor de p |
|---|---|---|---|
| Edad, años±DE | 34,1±5,4 | 33,5±6,1 | NS |
| Mujeres, n (%) | 119 (58,3) | 120 (58,8) | NS |
| IMC, kg/m2±DE | 30,9±2,6 | 29,3±1,7 | NS |
| Dislipidemia, n (%) | 87 (42,6) | 91 (44,5) | 0,70 |
| HAS, n (%) | 27 (13,2) | 14 (6,7) | 0,03 |
| DM2, n (%) | 18 (8,8) | 11(5,4) | 0,18 |
| Tabaquismo, n (%) | 52 (25,5) | 33 (16,9) | 0,02 |
| AHF de EAT, n (%) | 49 (24,0) | 26 (13,7) | 0,02 |
AHF de EAT: antecedente heredofamiliar de enfermedad aterotrombótica; DM2: diabetes mellitus tipo 2; HAS: hipertensión arterial sistémica; IMC: índice de masa corporal; NS: no significativa.
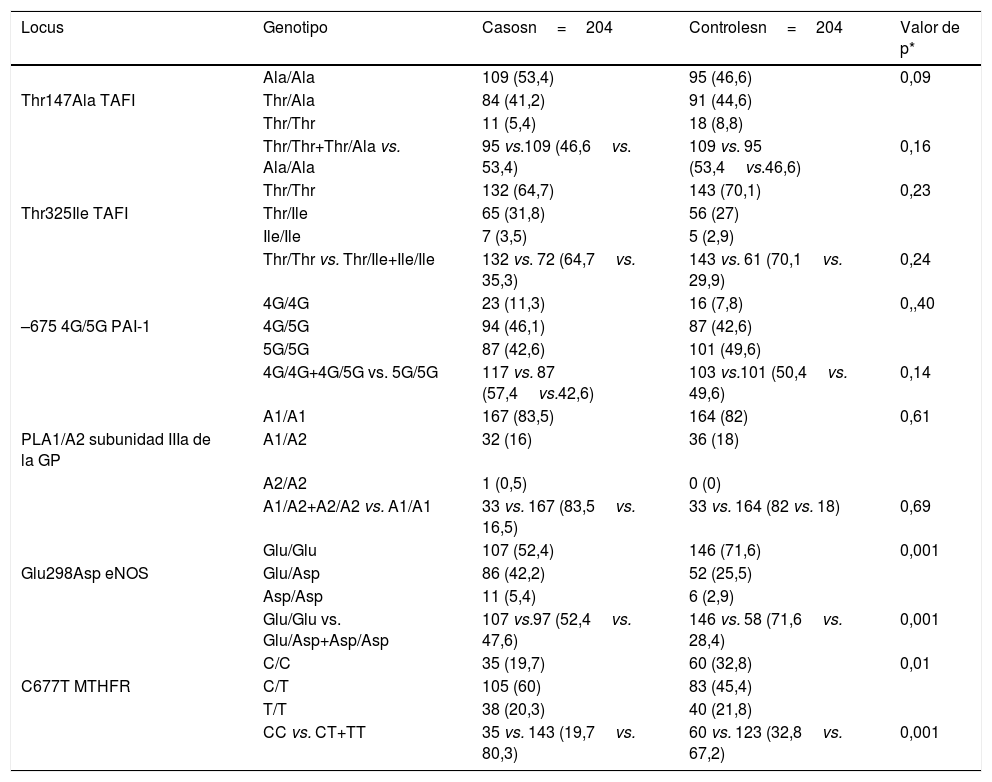
La tabla 3 muestra la distribución genotípica de los polimorfismos Thr325Ile, Ala147Thr, 4G/5G, PLA1/A2, Glu298Asp y C677T en el grupo de casos y controles.
Distribución genotípica de los polimorfismos Ala147Thr, Thr325Ile, 4G/5G, PLA1/A2, Glu298Asp y C677T en 204 pacientes de edad ≤45 años con EVC isquémica idiopática y 204 controles
| Locus | Genotipo | Casosn=204 | Controlesn=204 | Valor de p* |
|---|---|---|---|---|
| Ala/Ala | 109 (53,4) | 95 (46,6) | 0,09 | |
| Thr147Ala TAFI | Thr/Ala | 84 (41,2) | 91 (44,6) | |
| Thr/Thr | 11 (5,4) | 18 (8,8) | ||
| Thr/Thr+Thr/Ala vs. Ala/Ala | 95 vs.109 (46,6vs. 53,4) | 109 vs. 95 (53,4vs.46,6) | 0,16 | |
| Thr/Thr | 132 (64,7) | 143 (70,1) | 0,23 | |
| Thr325Ile TAFI | Thr/Ile | 65 (31,8) | 56 (27) | |
| Ile/Ile | 7 (3,5) | 5 (2,9) | ||
| Thr/Thr vs. Thr/Ile+Ile/Ile | 132 vs. 72 (64,7vs. 35,3) | 143 vs. 61 (70,1vs. 29,9) | 0,24 | |
| 4G/4G | 23 (11,3) | 16 (7,8) | 0,,40 | |
| –675 4G/5G PAI-1 | 4G/5G | 94 (46,1) | 87 (42,6) | |
| 5G/5G | 87 (42,6) | 101 (49,6) | ||
| 4G/4G+4G/5G vs. 5G/5G | 117 vs. 87 (57,4vs.42,6) | 103 vs.101 (50,4vs. 49,6) | 0,14 | |
| A1/A1 | 167 (83,5) | 164 (82) | 0,61 | |
| PLA1/A2 subunidad IIIa de la GP | A1/A2 | 32 (16) | 36 (18) | |
| A2/A2 | 1 (0,5) | 0 (0) | ||
| A1/A2+A2/A2 vs. A1/A1 | 33 vs. 167 (83,5vs. 16,5) | 33 vs. 164 (82 vs. 18) | 0,69 | |
| Glu/Glu | 107 (52,4) | 146 (71,6) | 0,001 | |
| Glu298Asp eNOS | Glu/Asp | 86 (42,2) | 52 (25,5) | |
| Asp/Asp | 11 (5,4) | 6 (2,9) | ||
| Glu/Glu vs. Glu/Asp+Asp/Asp | 107 vs.97 (52,4vs. 47,6) | 146 vs. 58 (71,6vs. 28,4) | 0,001 | |
| C/C | 35 (19,7) | 60 (32,8) | 0,01 | |
| C677T MTHFR | C/T | 105 (60) | 83 (45,4) | |
| T/T | 38 (20,3) | 40 (21,8) | ||
| CC vs. CT+TT | 35 vs. 143 (19,7vs. 80,3) | 60 vs. 123 (32,8vs. 67,2) | 0,001 |
eNOS: enzima óxido nítrico sintasa endotelial; GP IIb/IIIa: glucoproteína plaquetaria IIb/IIIa; 5,10 MTHFR: 5,10 metilentetrahidrofolato reductasa; PAI-1: inhibidor del activador de plasminógeno tisular tipo-1; TAFI: inhibidor de la fibrinólisis activado por trombina.
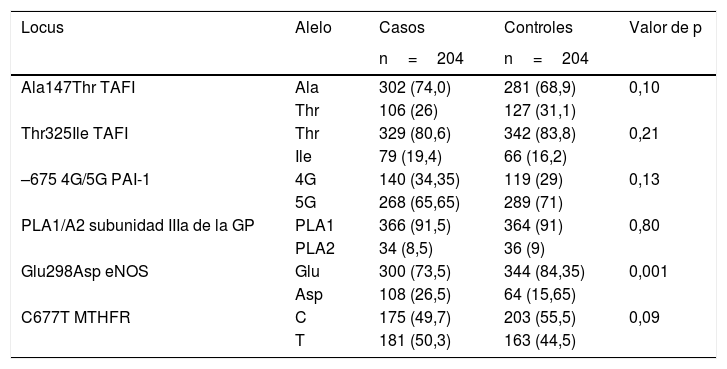
En la tabla 4 se muestra la frecuencia alélica de los polimorfismos Thr325Ile, Ala147Thr, 4G/5G, PLA1/A2, Glu298Asp y C677T en el grupo de casos y controles.
Frecuencia alélica de los polimorfismos Ala147Thr, Thr325Ile, 4G/5G, PLA1/A2, Glu298Asp y C677T en 204 pacientes de edad ≤45 años con EVC de tipo isquémico idiopático y 204 controles
| Locus | Alelo | Casos | Controles | Valor de p |
|---|---|---|---|---|
| n=204 | n=204 | |||
| Ala147Thr TAFI | Ala | 302 (74,0) | 281 (68,9) | 0,10 |
| Thr | 106 (26) | 127 (31,1) | ||
| Thr325Ile TAFI | Thr | 329 (80,6) | 342 (83,8) | 0,21 |
| Ile | 79 (19,4) | 66 (16,2) | ||
| –675 4G/5G PAI-1 | 4G | 140 (34,35) | 119 (29) | 0,13 |
| 5G | 268 (65,65) | 289 (71) | ||
| PLA1/A2 subunidad IIIa de la GP | PLA1 | 366 (91,5) | 364 (91) | 0,80 |
| PLA2 | 34 (8,5) | 36 (9) | ||
| Glu298Asp eNOS | Glu | 300 (73,5) | 344 (84,35) | 0,001 |
| Asp | 108 (26,5) | 64 (15,65) | ||
| C677T MTHFR | C | 175 (49,7) | 203 (55,5) | 0,09 |
| T | 181 (50,3) | 163 (44,5) |
eNOS: enzima óxido nítrico sintasa endotelial; GP IIb/IIIa: glicoproteína plaquetaria IIb/IIIa; 5,10 MTHFR: 5,10 metilentetrahidrofolato reductasa; PAI-1: inhibidor del activador de plasminógeno tisular tipo-1;TAFI: inhibidor de la fibrinólisis activado por trombina.
*Prueba Chi cuadrado.
Se identificó como factor de riesgo independiente al alelo 298Asp (p=0,03), T (p=0,01), hipertensión (p=0,03), tabaquismo (p=0,01) y AHFEAT (p=0,04) (tabla 5).
Análisis multivariado de regresión logística considerando a la EVC isquémica como variable dependiente
| Factor de riesgo | Razón de momios (IC 95%) | Valor de p |
|---|---|---|
| Glu298Asp | 1,4 (1,0-3,8) | 0,02 |
| C677T | 2,3 (1,3-4,2) | 0,001 |
| HAS | 2,7 (1,2-4,6) | 0,03 |
| Tabaquismo | 2,4 (1,1-4,5) | 0,01 |
| AHF de EAC | 1,6 (1,3-2,7) | 0,04 |
AHF de EAT: antecedente heredofamiliar de enfermedad aterotrombótica; HAS: hipertensión arterial sistémica.,
En el presente estudio se analizaron 6 diferentes polimorfismos localizados en genes que codifican proteínas del sistema fibrinolítico, y relacionados con la disfunción endotelial e hiperagregabilidad plaquetaria.
Se ha asociado el aumento en la concentración plasmática de TAFI a un mayor riesgo y severidad de EVC isquémico19–21. Aunque los niveles plasmáticos de TAFI están determinados al menos en un 25% por diversos polimorfismos ubicados en el gen CPB222, el efecto de los polimorfismos Thr325IIe y Ala147Thr en el incremento del riesgo cardiovascular no es concluyente23. En el presente estudio los polimorfismos Ala147Thr y Thr325IIe del gen de TAFI no se asociaron con la presencia de EVC isquémico (genotipo p=0,09 y frecuencia alélica p=0,10; y genotipo p=0,23 y frecuencia alélica p=0,21, respectivamente) en jóvenes de edad ≤45 años. Resultados negativos también fueron reportados por Ladenvall et al. en sujetos <70 años de edad con EVC isquémico24, y por Akatsu et al. en 253 pacientes con una edad promedio de 80 años25. En contraste, Kozian et al., en una cohorte >3.300 individuos, demostraron una asociación entre el genotipo homocigoto Ile del gen de TAFI con una mayor incidencia de EVC isquémica prematura, pero no para el polimorfismo Ala147Thr26. La EVC isquémica posee un espectro clínico y etiológico altamente heterogéneo, la prevalencia de factores de riesgo cardiovascular tradicionales y ambientales varía en distintas poblaciones, así como el trasfondo genético entre distintos grupos étnicos. La combinación específica entre factores de riesgo genéticos y ambientales en las diferentes etapas de la vida probablemente determine el desarrollo y la edad de presentación de EVC isquémica27, explicando en parte la inconsistencia de los resultados.
El rol del PAI-1 en la fisiopatología de la EVC isquémica es más complejo en comparación con el de otras enfermedades trombóticas, como el infarto de miocardio. Aunque el PAI-1 promueve la ateroesclerosis y es considerado el principal inhibidor de la fibrinólisis, paradójicamente su expresión por los astrocitos del parénquima cerebral es un factor protector contra la lesión de la barrera hematoencefálica por tPA, el edema cerebral y la transformación hemorrágica de la zona de infarto28,29. Estudios recientes sugieren que el alelo 4G del gen del PAI-1 tiene un efecto neuroprotector para EVC isquémica, y de riesgo para infarto de miocardio30. Sin embargo, la distribución genotípica del polimorfismo 4G/5G en distintas áreas geográficas alrededor del mundo es muy variable, tanto en sujetos sanos como en pacientes con EVC isquémica (del 28% al 90% para el heterocigoto 4G/5G)31. En nuestra muestra ni el genotipo (p=0,40) ni la frecuencia alélica (p=0,13) con el alelo de riesgo 4G del gen que codifica a PAI-1 se asoció con la presencia de EVC isquémico en sujetos jóvenes mexicanos de edad≤45 años. En contraste, Ranellou et al. reportaron una frecuencia mayor del genotipo heterocigoto 4G/5G en sujetos griegos con EVC de edad<50 años vs. controles (p=0,02)31. Hu et al., en un metaanálisis que incluyó 8.336 casos y 14.403 controles, identificó al homocigoto 4G/4G como factor de riesgo para EVC isquémico32. Por otra parte, nuestro grupo de investigación ha identificado un incremento en los niveles séricos de PAI-1 en pacientes jóvenes con EVC isquémico. Se han observado niveles más elevados de PAI-1 en sujetos con EVC isquémico en fase aguda en comparación con sujetos convalecientes y en fase crónica33. En ratones con oclusión transitoria la arteria cerebral media, la inhibición de TAFI y PAI-1 por anticuerpos monoclonales disminuyó significativamente la formación de fibrina y el tamaño del infarto cerebral en un 50%34. La evidencia sugiere que el PAI-1 tiene un efecto dual en la fisiopatología del EVC isquémico, interviniendo en el desarrollo y progresión de la placa ateroesclerótica, pero también como neuroprotector, limitando la severidad de la lesión.
En nuestra muestra el polimorfismo Leu33Pro en el gen que codifica a la subunidad IIIa de la GP no se asoció con la presencia de EVC isquémico (genotipo p=0,61 y frecuencia alélica p=0,80) en jóvenes de edad ≤45 años. Resultados similares fueron reportados por Van Goor et al., al no encontrar asociación entre el alelo PLA2 con la presencia de EVC criptogénico en 80 pacientes de edad ≤45 años35. Sin embargo, demostró una interacción entre el genotipo PLA1/A2 y el antecedente de tabaquismo en un subgrupo de pacientes de 55 a 69 años de edad con EVC lacunar (p=0,024)36. En nuestro estudio el antecedente de tabaquismo se presentó con mayor frecuencia en el grupo de casos vs. controles (p=0,02). Se ha observado en pacientes con EVC isquémico con el genotipo heterocigoto PLA1/A2 un incremento en la agregación plaquetaria, en la expresión del receptor GP IIb/IIIa y en su capacidad de unión al fibrinógeno, en comparación con aquellos sujetos con el genotipo PLA1/A1 en estudios in vitro37. Esta variabilidad de los resultados entre diferentes estudios pudiera deberse a la interacción entre diversos factores ambientales y genéticos. Se requieren más estudios que evalúen la interacción entre el tabaquismo, las concentraciones séricas de fibrinógeno y polimorfismos en genes que codifican receptores plaquetarios.
En el presente estudio el polimorfismo Glu298Asp del gen de eNOS se asoció con la presencia de EVC isquémico en sujetos jóvenes mexicanos de edad ≤45 años (genotipo p=0,001 y frecuencia alélica p=0,001, respectivamente). Kumar et al., en un estudio de casos y controles, identificaron el polimorfismo Glu298Asp como factor de riesgo para EVC isquémica en sujetos del norte de la India (p=0,028)38. En un metaanálisis que incluyó un total de 6.733 casos y 7.305 controles se observó una asociación significativa (p<0,001) del polimorfismo Glu298Asp con la presencia de EVC isquémico39.
La homocisteína es un aminoácido formado durante el metabolismo de la metionina; el incremento en sus concentraciones plasmáticas se ha asociado a disfunción del metabolismo cerebral, y es considerado un factor de riesgo independiente de EVC isquémico40. En el presente estudio se asoció al genotipo homocigoto TT y heterocigoto CT del polimorfismo C677T en el gen de la 5,10 MTHFR con la presencia de EVC isquémica en sujetos jóvenes mexicanos de edad ≤45 años (p=0,01). Jiang et al., en una cohorte de 39.165 individuos, identificaron 251 casos de EVC isquémica en un periodo de 6,2 años; aquellos sujetos con HAS y el genotipo TT presentaron un mayor riesgo de desarrollar EVC con una razón de momios=10,641. En contraste, Ranellou et al. no observaron diferencia significativa en la frecuencia alélica del polimorfismo C677T en pacientes griegos de edad <50 años con EVC isquémico vs. controles (p=0,78)31. Un estudio previo realizado por nuestro grupo de investigación identificó un incremento significativo (p<0,001) en los niveles séricos de homocisteína posterior a una carga oral de metionina en un grupo de pacientes jóvenes con EVC isquémica vs. controles42.
La inconsistencia de los resultados entre los diferentes estudios sugiere que los pacientes con EVC isquémica poseen un genotipo cerebrovascular complejo; se necesita de una cuidadosa estratificación etiológica de los pacientes, estudios epidemiológicos en poblaciones más grandes, una detallada evaluación funcional de la variante genética, y de la validación de los resultados en diferentes grupos étnicos para determinar el rol exacto de estos genes en el desarrollo de EVC isquémica43.
En relación con los factores de riesgo modificables pudimos identificar la hipertensión, el tabaquismo y la historia familiar de enfermedad arterial cerebral como factores de riesgo independiente para EVC isquémica en este grupo de pacientes.
Algunas fortalezas del estudio son: 1) los grupos de estudio fueron pareados por edad y sexo, 2) la edad se limitó a ≤45 años para minimizar el efecto del tiempo de exposición a los factores de riesgo tradicionales; y 3) se analizaron 6 polimorfismos en 5 genes candidatos del sistema hemostático en un mismo individuo. Las limitantes del estudio fueron la falta de medición de los niveles séricos de TAFI, óxido nítrico y pruebas de agregometría.
De acuerdo con los resultados obtenidos proponemos a los polimorfismos Glu298Asp y C677T de los genes que codifican a la enzima eNOS y 5,10 MTHFR, respectivamente, como posibles factores de riesgo de EVC isquémico. Los resultados sugieren como mecanismo fisiopatológico implicado la disfunción endotelial. Se requiere de más estudios en el futuro que exploren los mecanismo trombóticos del paciente con EVC idiopático, y esperar si nuestros resultados son consistentes en otras poblaciones.
FinanciaciónEl proyecto fue financiado por los apoyos económicos del CONACyT Fondo Sectorial de investigación en Salud y Seguridad Social (No.261887) (FIS/IMSS/PROT/PRIO/13/023) (FIS/IMSS/PROT/G13/1195) (FIS/IMSS/PROT/G16/1616) del Fondo de Investigación en Salud IMSS y la Fundación IMSS.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.