El objetivo es evaluar los efectos de la estimulación cerebral profunda del núcleo subtalámico bilateral (STN-DBS) sobre el estado cognitivo de los pacientes con enfermedad de Parkinson 5 años después de la cirugía.
Materiales y métodosEn este estudio prospectivo se incluyeron 50 pacientes con enfermedad de Parkinson (62,5% hombres, edad media 62,2±8,2 años y duración de la enfermedad 14,1±6,3 años) sometidos a STN-DBS. Todos los pacientes fueron evaluados preoperatoriamente y un año después de la cirugía, y 40 pacientes fueron seguidos hasta 5 años. En cada visita se realizaron las siguientes evaluaciones neuropsicológicas: Mini-Mental State Examination, Mattis Dementia Rating Scale (MDRS), test de secuencias números-letras de WAIS III-LN, Prueba de dibujo de reloj, Prueba de aprendizaje verbal auditivo Rey, la Prueba de retención visual de Benton, la Prueba de juicio de orientación de línea de Benton, la fluidez verbal fonética y semántica, la Prueba Stroop y la Escala de clasificación de depresión de Montgomery-Asberg.
ResultadosAnualmente se observaron reducciones en la puntación de Mini-Mental State Examination (–0,89%), Prueba del dibujo de reloj (–2,61%) y MDRS (–1,72%), fueron más marcados tanto para la fluidez verbal fonética (–13,28%) como semántica (–12,40%). Para la Prueba de aprendizaje verbal auditivo Rey observamos un deterioro en la capacidad de recuerdo diferido (–10,12%) un año después de la cirugía. A los 5 años la mayor parte del deterioro se produjo en la fluidez verbal, con reducciones adicionales de 16,10% y 16,60% para la fluidez verbal semántica y fonética, respectivamente. Se observó un empeoramiento más moderado del recuerdo inmediato (–16,87%), WAIS III-LN (–16,67%) y de la prueba de orientación lineal de Benton (–11,56%).
DiscusiónLa STN-DBS no condujo a deterioro cognitivo global a los 5 años de la cirugía. Hubo un deterioro significativo en la función verbal desde el primer año de la cirugía. El deterioro de la capacidad de aprendizaje y de las funciones visuoespaciales podría atribuirse al propio proceso degenerativo de la enfermedad.
The aim of this study was to evaluate the effects of deep brain stimulation of the subthalamic nucleus (DBS-SN) on cognitive function in patients with Parkinson's disease (PD) 5 years after surgery.
Material and methodsWe conducted a prospective study including 50 patients with PD who underwent DBS-SN (62.5% were men; mean age of 62.2±8.2 years; mean progression time of 14.1±6.3 years). All patients were assessed before the procedure and at one year after surgery; 40 patients were further followed up until the 5-year mark. Follow-up assessments included the following neuropsychological tests: Mini–Mental State Examination (MMSE), Mattis Dementia Rating Scale (MDRS), letter-number sequencing of the WAIS-III (WAIS-III-LN), clock-drawing test, Rey auditory verbal learning test (RAVLT), Benton Visual Retention Test (BVRT), Judgment of Line Orientation (JLO) test, FAS Phonemic Verbal Fluency Test, Stroop test, and the Montgomery-Asberg Depression Rating Scale (MADRS).
ResultsPatients were found to score lower on the MMSE (−0.89%), clock-drawing test (−2.61%), MDRS (−1.72%), and especially phonemic (−13.28%) and sematic verbal fluency tests (−12.40%) at one year after surgery. Delayed recall on the RAVLT worsened one year after the procedure (−10.12%). At 5 years, impairment affected mainly verbal fluency; scores decreased an additional 16.10% and 16.60% in semantic and phonemic verbal fluency, respectively. Moderate decreases were observed in immediate recall (−16.87%), WAIS-III-LN (−16.67%), and JLO test (−11.56%).
DiscussionIn our sample, DBS-SN did not result in global cognitive impairment 5 years after surgery. Verbal function was found to be significantly impaired one year after the procedure. Impaired learning and visuospatial function may be attributed to degeneration associated with PD.
La estimulación cerebral profunda (DBS) ha demostrado ser eficaz a corto plazo sobre los síntomas motores de la enfermedad de Parkinson (EP). También se ha observado una reducción de la medicación dopaminérgica, con la consiguiente reducción de las complicaciones motoras1,2. En el caso de la función cognitiva no se han observado déficits importantes en los primeros años tras la intervención, excepto por una reducción de la fluidez verbal probablemente causada por la propia cirugía sobre el núcleo subtalámico (STN), cuando la diana es el globo pálido interno (GPi) es menos frecuente esta alteración3–5. Podría haber diferencias en la función cognitiva con los generadores conectados6,7: en esta situación la capacidad de inhibición de respuesta evaluada en el Stroop Test (interferencia) está alterada6. También, como se ha comentado, hay diferencias dependiendo de la diana quirúrgica seleccionada. Diferentes trabajos informan de una peor capacidad de aprendizaje condicionado en pacientes en los que se utiliza STN a diferencia del GPi6. Sin embargo, la DBS del STN (STN-DBS) mejoraría la flexibilidad cognitiva reflejada en las pruebas neuropsicológicas6,8. La mejoría en aspectos motores y cognitivos tras la intervención refleja en definitiva una mejora en la calidad de vida9–11.
Hasta la fecha se sabe poco del curso clínico de los síntomas motores a largo plazo de los pacientes operados. Los primeros trabajos a los 5 años parecen indicar una pérdida parcial del beneficio obtenido durante los primeros años posteriores a la cirugía12–15. En cuanto a los aspectos cognitivos hay pocos estudios específicos a los 5 años. En uno de ellos, con una pequeña muestra de pacientes, se confirma el deterioro de la fluidez verbal y el razonamiento abstracto16. Otros trabajos que se centraron en el curso clínico de la situación motora detectaron un deterioro de funciones cognitivas a los 5 años de la intervención atribuido al curso clínico de la enfermedad14,15.
El objetivo de este estudio es evaluar los efectos de la cirugía sobre el estado cognitivo de los pacientes a los 5 años de la intervención quirúrgica, y diferenciarlos del propio proceso degenerativo de la enfermedad.
Materiales y métodosPresentamos los resultados obtenidos en 50 pacientes diagnosticados de EP de acuerdo con los criterios del Banco de cerebros de Londres (a excepción de antecedentes familiares) y siguiendo las recomendaciones Core Assessment Program for Surgical Interventional Therapies. Se implantaron de manera bilateral electrodos tetrapolares (Modelo 3389 DBS, Medtronic, Minneapolis, MN) en ambos núcleos subtalámicos. La intervención y programación se realizó en la Unidad de Trastornos del Movimiento del Hospital Universitario de Cruces. La edad promedio de los pacientes en el momento de la cirugía fue de 62,2±8,2 años, con una duración media de la enfermedad de 14,1±6,3 años. La distribución por género fue de 32 hombres (64%) y 18 mujeres (36%). Los criterios de exclusión fueron la existencia de demencia, manifestaciones clínicas atípicas que sugieren Parkinsonismo atípico, enfermedades concomitantes que contraindiquen la cirugía y trastornos psiquiátricos graves. Se excluyeron del estudio aquellos pacientes con intervenciones unilaterales en la STN, aquellos con GPi como diana quirúrgica y los intervenidos en otros centros. Anteriormente se excluyeron del análisis 19 pacientes que habían sido evaluados con otro protocolo neuropsicológico, previo al actual, diseñado según trabajos publicados y consensuado por el equipo quirúrgico.
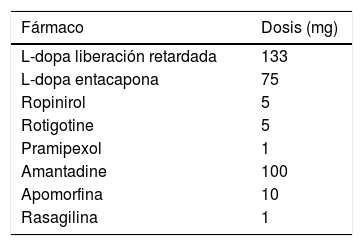
Se registraron las fechas de nacimiento, el diagnóstico de la EP y el inicio del tratamiento de la terapia dopaminérgica, el nivel educativo, la historia médica y psiquiátrica y la dosis equivalente de LD. Se calculó la dosis diaria equivalente de L-dopa (LEDD)17 para los diferentes tratamientos dopaminérgicos (tabla 1). Además, se registraron las puntuaciones en la Unified Parkinson's Disease Rating Scale (UPDRS I-IV) para todos los pacientes. La calidad de vida se evaluó aplicando la escala del Cuestionario de calidad de vida de la enfermedad de Parkinson (PDQ-39) en on fármacos en situación basal (antes de la cirugía) y en on fármacos y con los generadores encendidos durante el seguimiento. Se registraron el número de horas en off que los pacientes completaron en los diarios de 24horas.
Se muestra la dosis diaria equivalente de L-dopa (LEDD)17 (equivalencia de 100mg de L-dopa) para los diferentes tratamientos dopaminérgicos
| Fármaco | Dosis (mg) |
|---|---|
| L-dopa liberación retardada | 133 |
| L-dopa entacapona | 75 |
| Ropinirol | 5 |
| Rotigotine | 5 |
| Pramipexol | 1 |
| Amantadine | 100 |
| Apomorfina | 10 |
| Rasagilina | 1 |
El procedimiento quirúrgico utilizado es el mismo que el descrito previamente9,13.
Estudio neuropsicológicoSe realizó un estudio neuropsicológico basal en los 2 meses previos a la intervención quirúrgica. Los pacientes fueron evaluados prospectivamente 12 y 60 meses después de la neurocirugía. Todos los pacientes fueron estudiados en la situación de on fármacos antes de la cirugía, y en situación on fármacos y on DBS durante las visitas postoperatorias. El mismo neuropsicólogo realizó todos los estudios. El protocolo de estudio neuropsicológico se compone de 2 partes: en primer lugar una entrevista semiestructurada con el paciente y un informante y, en segundo lugar, una batería de pruebas neuropsicológicas diseñadas para evaluar una amplia gama de dominios cognitivos con frecuencia deteriorados en la EP. Se pasaron escalas que medían el estatus cognitivo global como el Mini-Mental State Examination (MMSE) y la escala de clasificación de demencia de Mattis II (MDRS) con subescalas de atención, memoria, iniciación-perseveración, construcción y conceptualización. Se realizaron otras 2 pruebas para evaluar la memoria: la prueba de aprendizaje verbal auditivo de Rey que evalúa la memoria verbal episódica (suma de ensayos de aprendizaje o recuperación inmediata y recuperación retardada) y prueba de retención visual de Benton, que evalúa la memoria visual. La prueba de Stroop se realizó como una medida de la velocidad de procesamiento, atención selectiva y flexibilidad cognitiva. La subescala de letras y números de la batería de inteligencia de Wechsler para adultos, 3.ª edición, fue también administrada para valorar la atención y la memoria de trabajo. Para evaluar la función visuoespacial se utilizó el test de orientación de líneas de Benton y el Test del dibujo del reloj. Además se realizaron pruebas de fluidez verbal fonética y semántica. La fluidez verbal fonética se evaluó utilizando la letra «P» y la fluidez verbal semántica con la categoría «animales», ambos con un tiempo límite de un minuto. En todas las pruebas las puntuaciones altas equivalen a un mejor rendimiento. La Escala de Valoración de Depresión de Montgomery-Asberg (MADRS) se administró en cada visita para evaluar la depresión.
A falta de grupo de control, por ser éticamente inapropiado en estudios quirúrgicos, se seleccionó retrospectivamente un grupo de 47 pacientes con EP (66,1±6,1 años con una duración media de la enfermedad de 8,8±4,4 años) que fueron seguidos durante 5 años, y que habrían sido seleccionables para DBS basándonos en criterios neurológicos, pero no se realizó por diversas razones (rechazo del paciente, enfermedades concomitantes…). Aunque metodológicamente no es apropiado, esta parte se incluyó considerando que da una idea de la incidencia de demencia en este período de tiempo en un grupo de pacientes de similares características del grupo quirúrgico. Se analizó la incidencia de demencia basada en criterios de DSM IV, revisando la historia, las puntuaciones de escalas (UPDRS I y MMSE principalmente) y la entrevista familiar.
Consentimiento informadoAntes de la intervención quirúrgica los pacientes tenían que leer y firmar un formulario de consentimiento informado, aprobado por el comité de ética local en presencia de miembros de la familia como testigo.
Análisis estadísticoSe calcularon la media y la desviación estándar para las variables cuantitativas y las proporciones para las variables cualitativas como variables descriptivas. Dado lo limitado del tamaño muestral se utilizaron pruebas no paramétricas para comparar las medias (pruebas de Friedman y Wilcoxon). Para el análisis de las variables predictoras de demencia a los 5 años en función de la puntuación de la escala Mattis (punto de corte <123) hemos utilizado correlaciones bivariadas (correlación de Pearson), método de regresión lineal por pasos y curvas ROC para establecer las puntuaciones escalares con más sensibilidad como método de screening de cara a predecir el riesgo futuro de demencia. Para el análisis se utilizó el paquete de software estadístico SPSS vs. 20.0 (IBM Corp., Armonk, NY, EE. UU.).
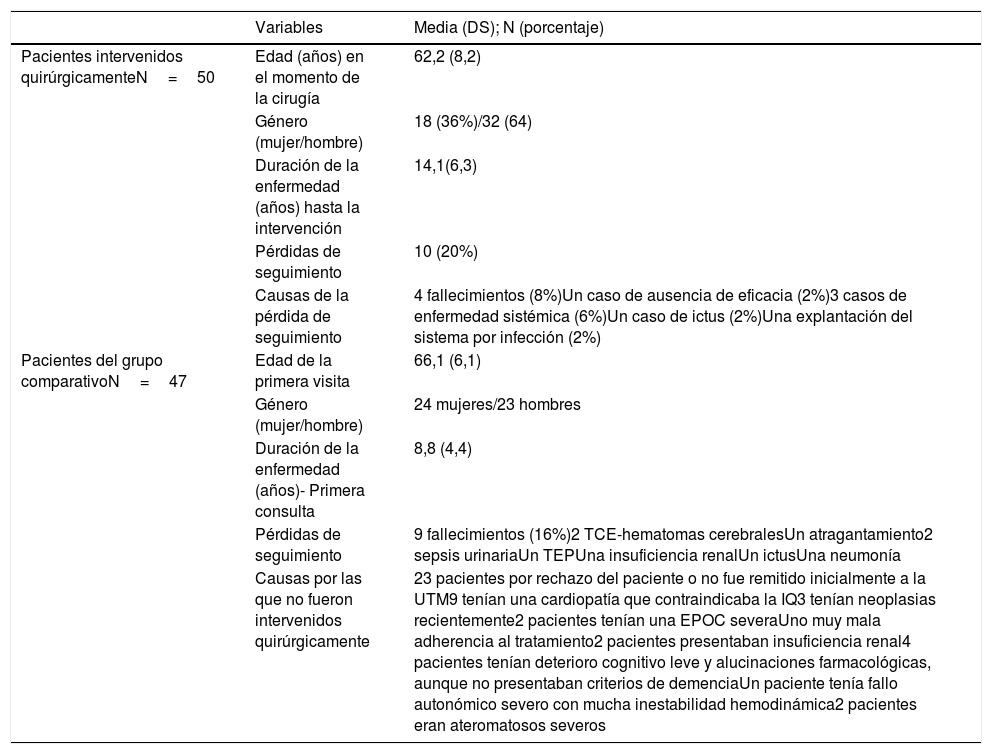
ResultadosEl 80% de los pacientes con EP intervenidos pudo ser evaluado a los 5 años de la intervención. El 20% de los pacientes no pudo ser evaluado debido a la pérdida durante el periodo de seguimiento: 4 pacientes fallecieron, en 5 hubo una enfermedad concomitante que impidió la evaluación y un paciente no fue evaluado debido a la falta de eficacia de la cirugía (se explantaron los electrodos y el generador) (tabla 2). Al año y a los 5 años de la intervención fueron evaluados 48 y 40 pacientes respectivamente.
Se muestra los datos de los 50 pacientes estudiados en situación basal. Se describen las pérdidas de seguimiento en los primeros 5 años y las causas. Se muestran también los datos basales del grupo comparativo y las causas de pérdida de seguimiento (todas fallecimiento) y de la no intervención quirúrgica en su momento
| Variables | Media (DS); N (porcentaje) | |
|---|---|---|
| Pacientes intervenidos quirúrgicamenteN=50 | Edad (años) en el momento de la cirugía | 62,2 (8,2) |
| Género (mujer/hombre) | 18 (36%)/32 (64) | |
| Duración de la enfermedad (años) hasta la intervención | 14,1(6,3) | |
| Pérdidas de seguimiento | 10 (20%) | |
| Causas de la pérdida de seguimiento | 4 fallecimientos (8%)Un caso de ausencia de eficacia (2%)3 casos de enfermedad sistémica (6%)Un caso de ictus (2%)Una explantación del sistema por infección (2%) | |
| Pacientes del grupo comparativoN=47 | Edad de la primera visita | 66,1 (6,1) |
| Género (mujer/hombre) | 24 mujeres/23 hombres | |
| Duración de la enfermedad (años)- Primera consulta | 8,8 (4,4) | |
| Pérdidas de seguimiento | 9 fallecimientos (16%)2 TCE-hematomas cerebralesUn atragantamiento2 sepsis urinariaUn TEPUna insuficiencia renalUn ictusUna neumonía | |
| Causas por las que no fueron intervenidos quirúrgicamente | 23 pacientes por rechazo del paciente o no fue remitido inicialmente a la UTM9 tenían una cardiopatía que contraindicaba la IQ3 tenían neoplasias recientemente2 pacientes tenían una EPOC severaUno muy mala adherencia al tratamiento2 pacientes presentaban insuficiencia renal4 pacientes tenían deterioro cognitivo leve y alucinaciones farmacológicas, aunque no presentaban criterios de demenciaUn paciente tenía fallo autonómico severo con mucha inestabilidad hemodinámica2 pacientes eran ateromatosos severos |
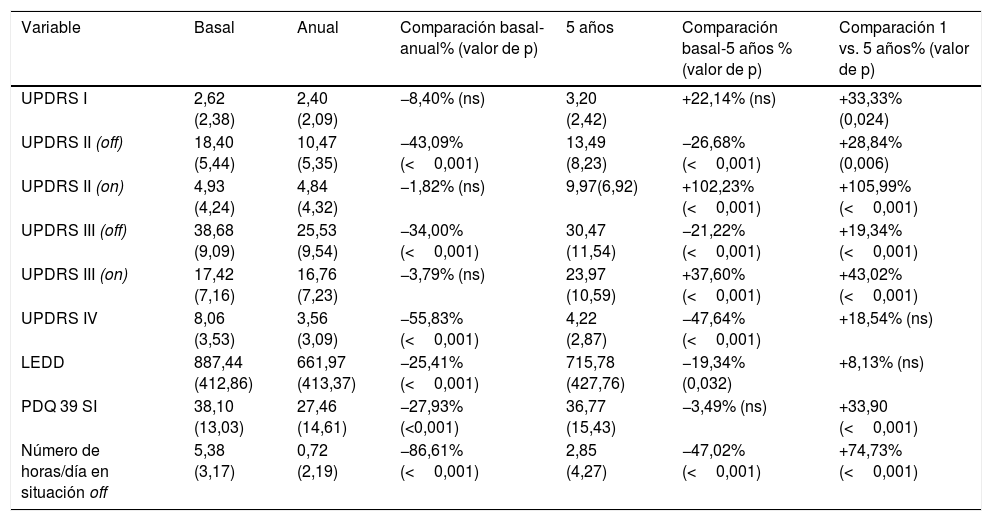
Los resultados de la UPDRS I-IV se resumen en la tabla 3. Los pacientes eran relativamente jóvenes (62,2±8,2 años en el momento de la cirugía), aunque con muchos años de enfermedad (14,1±6,3 años). En situación basal, antes de la intervención, el grado de mejora obtenido con una dosis supramáxima de levodopa fue del 56% en la puntuación UPDRS III. Se observó una mejoría significativa al comparar las cifras pre y posquirúrgicas (UPDRS III off-STN DBS on): 34% al primer año y 22% a los 5 años después de la cirugía (tabla 3). Sin embargo, en la situación de on fármacos/on DBS observamos un empeoramiento a los 5 años de la intervención (37,60% de empeoramiento en la UPDRS III) con respecto a la situación basal y anual, que son similares (tabla 3). En cuanto al número de horas en situación off hubo una importante disminución en el primer año tras la intervención; este beneficio se mantuvo parcialmente a los 5 años (tabla 3).
Puntuación en las diferentes escalas que conforman la Unified Parkinson's Disease Rating Scale (UPDRS)
| Variable | Basal | Anual | Comparación basal-anual% (valor de p) | 5 años | Comparación basal-5 años % (valor de p) | Comparación 1 vs. 5 años% (valor de p) |
|---|---|---|---|---|---|---|
| UPDRS I | 2,62 (2,38) | 2,40 (2,09) | −8,40% (ns) | 3,20 (2,42) | +22,14% (ns) | +33,33% (0,024) |
| UPDRS II (off) | 18,40 (5,44) | 10,47 (5,35) | −43,09%(<0,001) | 13,49 (8,23) | −26,68% (<0,001) | +28,84% (0,006) |
| UPDRS II (on) | 4,93 (4,24) | 4,84 (4,32) | −1,82% (ns) | 9,97(6,92) | +102,23% (<0,001) | +105,99% (<0,001) |
| UPDRS III (off) | 38,68 (9,09) | 25,53 (9,54) | −34,00% (<0,001) | 30,47 (11,54) | −21,22% (<0,001) | +19,34% (<0,001) |
| UPDRS III (on) | 17,42 (7,16) | 16,76 (7,23) | −3,79% (ns) | 23,97 (10,59) | +37,60% (<0,001) | +43,02% (<0,001) |
| UPDRS IV | 8,06 (3,53) | 3,56 (3,09) | −55,83% (<0,001) | 4,22 (2,87) | −47,64% (<0,001) | +18,54% (ns) |
| LEDD | 887,44 (412,86) | 661,97 (413,37) | −25,41% (<0,001) | 715,78 (427,76) | −19,34% (0,032) | +8,13% (ns) |
| PDQ 39 SI | 38,10 (13,03) | 27,46 (14,61) | −27,93% (<0,001) | 36,77 (15,43) | −3,49% (ns) | +33,90 (<0,001) |
| Número de horas/día en situación off | 5,38 (3,17) | 0,72 (2,19) | −86,61% (<0,001) | 2,85 (4,27) | −47,02% (<0,001) | +74,73% (<0,001) |
UPDRS II y III son administradas durante la situación off y on fármacos. Se valoran también la dosis equivalente de levodopa (LEDD) y la calidad de vida (Parkinson's disease Questionnaire-summary index [PDQ-39 SI]). Se reflejan también las horas en off en función de los diarios rellenados por los propios pacientes. Se comparan la situación basal con la anual y la de los 5 años. También se compara el cambio a los 5 años con respecto al primer año después de la intervención.
ns: no significativo.
La dosis de medicación (LEDD) presentó una reducción significativa en el primer año (–25,41%) y el quinto año después de la cirugía (–19,34%) con respecto a la situación basal. Solo un paciente recibió tratamiento con terapias avanzadas durante el periodo de seguimiento de 5 años (un paciente con bomba de apomorfina). Las complicaciones derivadas de este tratamiento (UPDRS IV) también revelaron una mejora importante y sostenida (–55,83% a un año y –47,64% a los 5 años). Todos estos cambios tuvieron un impacto en la mejora significativa de las actividades de la vida diaria (UPDRS II), más importante en el primer año (–43,09%), que se mantienen a 5 años de la cirugía (–26,28%). Sin embargo, esta mejoría se refleja mal en la calidad de vida (PDQ-39) a los 5 años de la cirugía, donde apenas hubo cambios con respecto a la situación basal (–3,49%) y se observó un empeoramiento entre el primer año y el quinto de cirugía (+33,90%) (tabla 3).
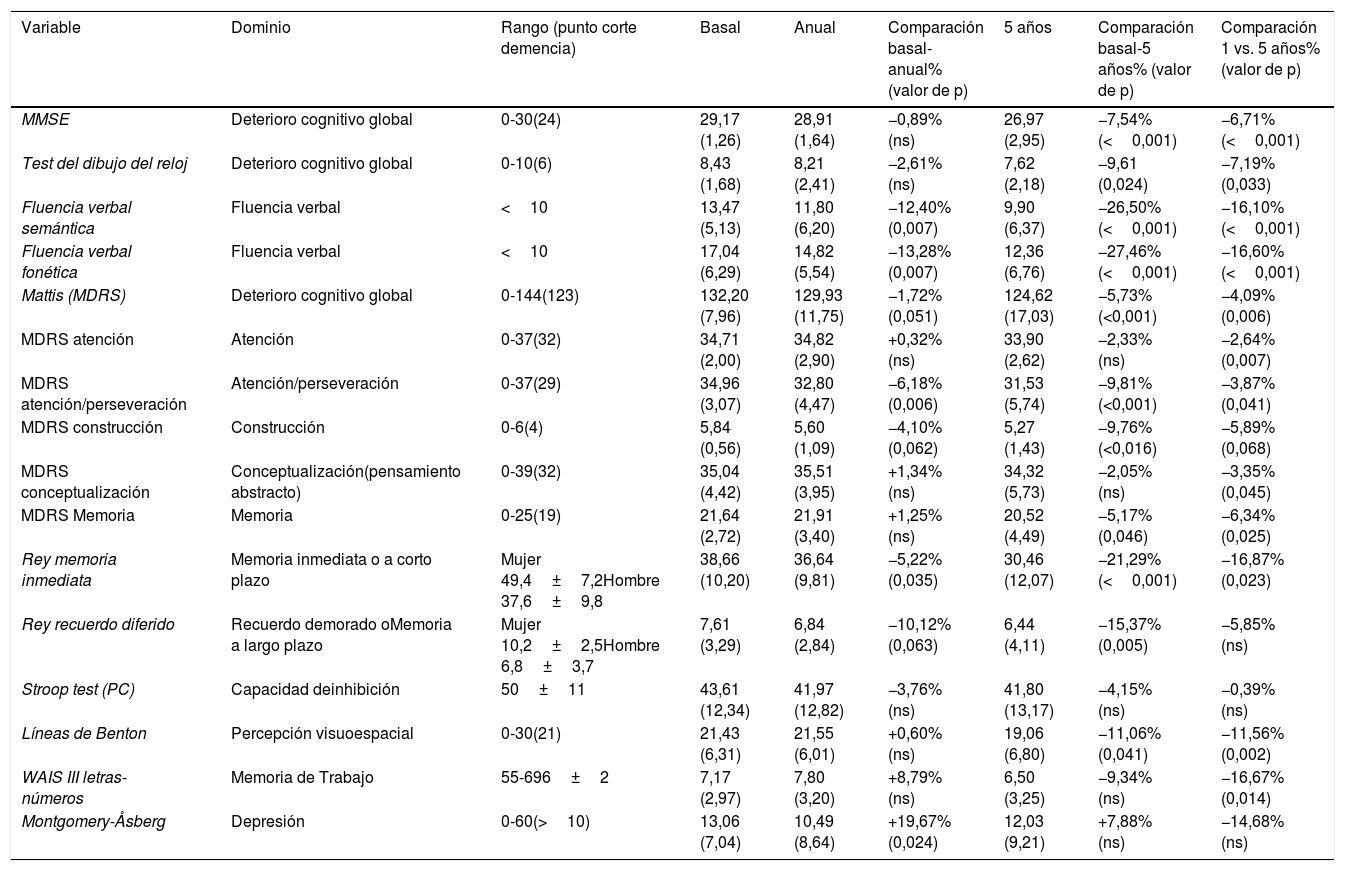
Resultados en los test neuropsicológicos al año de la intervenciónDesde el punto de vista del estado cognitivo (tabla 4) un año después de la cirugía se observó una pequeña disminución no significativa en las puntuaciones de las escalas que evaluaron el deterioro cognitivo global como MMSE (–0,89%), Test del reloj (–2,61%) y MDRS (–1,72%). Las habilidades visuoespaciales (prueba de Benton JLO) apenas se modificaron en el primer año. Los pacientes tuvieron problemas al aprender a realizar la Prueba de Stroop, de manera que basalmente 4 pacientes, a un año 11 pacientes y a los 5 años 11 pacientes, no pudieron realizar correctamente el test. Los que pudieron realizar la prueba no presentaron un deterioro significativo en las puntuaciones obtenidas (tabla 4). Se observó un deterioro significativo tanto en la fluencia verbal fonética (–13,28%) como en las semántica (–12,40%). Para la prueba RVLT se observó un deterioro en la capacidad de memoria diferida (–10,12%) un año desde la cirugía, y en menor medida la memoria inmediata (–5,22%). La memoria de trabajo (WAIS III-LN) presentó una mejora, aunque no alcanzó el rango de significación estadística. Desde el punto de vista de los cambios del estado de ánimo hubo una mejora del 19,67% en la puntuación MADRS que refleja una mejora en la sintomatología depresiva (tabla 4).
Puntuaciones en las escalas que miden la función cognitiva y síntomas depresivos en situación basal, al año y a los 5 años de la intervención quirúrgica
| Variable | Dominio | Rango (punto corte demencia) | Basal | Anual | Comparación basal-anual% (valor de p) | 5 años | Comparación basal-5 años% (valor de p) | Comparación 1 vs. 5 años% (valor de p) |
|---|---|---|---|---|---|---|---|---|
| MMSE | Deterioro cognitivo global | 0-30(24) | 29,17 (1,26) | 28,91 (1,64) | −0,89% (ns) | 26,97 (2,95) | −7,54% (<0,001) | −6,71% (<0,001) |
| Test del dibujo del reloj | Deterioro cognitivo global | 0-10(6) | 8,43 (1,68) | 8,21 (2,41) | −2,61% (ns) | 7,62 (2,18) | −9,61 (0,024) | −7,19% (0,033) |
| Fluencia verbal semántica | Fluencia verbal | <10 | 13,47 (5,13) | 11,80 (6,20) | −12,40% (0,007) | 9,90 (6,37) | −26,50% (<0,001) | −16,10% (<0,001) |
| Fluencia verbal fonética | Fluencia verbal | <10 | 17,04 (6,29) | 14,82 (5,54) | −13,28% (0,007) | 12,36 (6,76) | −27,46% (<0,001) | −16,60% (<0,001) |
| Mattis (MDRS) | Deterioro cognitivo global | 0-144(123) | 132,20 (7,96) | 129,93 (11,75) | −1,72% (0,051) | 124,62 (17,03) | −5,73% (<0,001) | −4,09% (0,006) |
| MDRS atención | Atención | 0-37(32) | 34,71 (2,00) | 34,82 (2,90) | +0,32% (ns) | 33,90 (2,62) | −2,33% (ns) | −2,64% (0,007) |
| MDRS atención/perseveración | Atención/perseveración | 0-37(29) | 34,96 (3,07) | 32,80 (4,47) | −6,18% (0,006) | 31,53 (5,74) | −9,81% (<0,001) | −3,87% (0,041) |
| MDRS construcción | Construcción | 0-6(4) | 5,84 (0,56) | 5,60 (1,09) | −4,10% (0,062) | 5,27 (1,43) | −9,76%(<0,016) | −5,89% (0,068) |
| MDRS conceptualización | Conceptualización(pensamiento abstracto) | 0-39(32) | 35,04 (4,42) | 35,51 (3,95) | +1,34% (ns) | 34,32 (5,73) | −2,05% (ns) | −3,35% (0,045) |
| MDRS Memoria | Memoria | 0-25(19) | 21,64 (2,72) | 21,91 (3,40) | +1,25% (ns) | 20,52 (4,49) | −5,17% (0,046) | −6,34% (0,025) |
| Rey memoria inmediata | Memoria inmediata o a corto plazo | Mujer 49,4±7,2Hombre 37,6±9,8 | 38,66 (10,20) | 36,64 (9,81) | −5,22% (0,035) | 30,46 (12,07) | −21,29% (<0,001) | −16,87% (0,023) |
| Rey recuerdo diferido | Recuerdo demorado oMemoria a largo plazo | Mujer 10,2±2,5Hombre 6,8±3,7 | 7,61 (3,29) | 6,84 (2,84) | −10,12% (0,063) | 6,44 (4,11) | −15,37% (0,005) | −5,85% (ns) |
| Stroop test (PC) | Capacidad deinhibición | 50±11 | 43,61 (12,34) | 41,97 (12,82) | −3,76% (ns) | 41,80 (13,17) | −4,15% (ns) | −0,39% (ns) |
| Líneas de Benton | Percepción visuoespacial | 0-30(21) | 21,43 (6,31) | 21,55 (6,01) | +0,60% (ns) | 19,06 (6,80) | −11,06% (0,041) | −11,56% (0,002) |
| WAIS III letras-números | Memoria de Trabajo | 55-696±2 | 7,17 (2,97) | 7,80 (3,20) | +8,79% (ns) | 6,50 (3,25) | −9,34% (ns) | −16,67% (0,014) |
| Montgomery-Åsberg | Depresión | 0-60(>10) | 13,06 (7,04) | 10,49 (8,64) | +19,67% (0,024) | 12,03 (9,21) | +7,88% (ns) | −14,68% (ns) |
Se analiza la situación basal con respecto a la anual, con respecto a los cinco años y entre el primer y quinto año de la intervención. Se añaden los dominios explorados y los puntos de corte cuando existan.
MDRS: Mattis Dementia Rating Scale; MMSE: Mini Mental State Examination; ns: no significativo.
A los 5 años de la cirugía se observó una caída en las pruebas cognitivas que miden las funciones globales (–7,54% MMSE, –9,61% prueba de dibujo de reloj, –5,73% para la escala Mattis) al compararlas con la situación basal. El deterioro mayor se observó en la fluidez verbal. En este quinto año en comparación con la situación anual se produjo una disminución adicional del 16,10% para la fluidez semántica y del 16,6% para la fluencia fonética. Se produjo un importante deterioro a los 5 años (–26,50% de fluidez semántica, –27,46% de fluidez verbal fonética). Las puntuaciones más alteradas en el primer año se produjeron en relación con la capacidad de aprendizaje (Rey recuerdo inmediato –16,87%) y la memoria de trabajo (WAIS III-LN 16,67%). La capacidad visuoespacial también presentó un deterioro significativo con respecto al primer año de la cirugía (–11,56%).
Al año 2 pacientes (4%) obtuvieron una puntuación de 26 o menos en la escala MMSE, mientras que a los 5 años 9 pacientes (22%) obtuvieron calificaciones por debajo del punto de corte. Ningún paciente puntuó menos de 20 puntos en la escala 5 años después de la cirugía. En el caso de la escala de MDRS 10 y 14 pacientes (21% y 35%) obtuvieron puntuaciones por debajo del punto de corte (130 puntos) en el primer y quinto año de la cirugía, respectivamente. La puntuación más baja obtenida para esta escala fue de 81 puntos. Desde el punto de vista de los síntomas depresivos medidos por el MADRS se observó una mejoría durante el primer año después de la cirugía, que virtualmente volvió a la situación basal a los 5 años de la cirugía (tabla 4).
Predictores de deterioro cognitivoObservamos una correlación importante entre la puntuación basal y a los 5 años de la MDRS (cc 0,78; p<0,001). Utilizando regresión lineal por pasos, introduciendo como variable dependiente a los 5 años la puntuación en la MDRS y como variables independientes todas las variables cuantitativas en la visita basal (edad, años de evolución, puntuaciones de la UPDRS I-IV, LEDD, MRDS, MMSE, Test del reloj, WAIS LN, FAS, Stroop), el modelo seleccionó una única variable como predictora: la puntuación basal de la MDRS. En las curvas ROC utilizando como evento la puntuación a los 5 años de la escala MDRS inferior a 123 (punto de corte) observamos que la puntuación basal de dicha escala tenía una sensibilidad del 23% para puntuaciones superiores a 130 y del 0% si era superior a 137 a la hora de predecir el desarrollo de demencia a los 5 años (área bajo la curva 0,15; p<0,001).
Resultados en el grupo de comparación (tabla 2)De los 47 pacientes registrados 9 (19%) fallecieron dentro de los 5 años de observación, con una edad media de 73,4±4,5 años. Los que murieron tuvieron un promedio de 13,1±4,8 años de enfermedad. Dentro de los 5 años de la primera visita cumplieron criterios de demencia (DSM IV) 18 pacientes (38,3%). La edad promedio de los pacientes con demencia fue 71,3±4,6 años. Las causas de exclusión de la intervención quirúrgica se muestran en la tabla 2.
DiscusiónNuestro estudio de seguimiento a largo plazo (5 años) sugiere que hay una ligera disminución en las puntuaciones obtenidas en el MDRS, MMSE y el Test del reloj para los supervivientes a los 5 años de la cirugía no atribuible a la propia STN-DBS, ya que el mayor empeoramiento se produjo entre el primer y quinto año desde la intervención. Durante este mismo período de tiempo se observó un aumento significativo en el número de pacientes que obtuvieron puntuaciones por debajo de 26 en la escala MMSE. El porcentaje de pacientes con deterioro cognitivo aumentó cuando se utilizaron escalas más sensibles como MDRS. De esta manera el 35% (14/40 pacientes) puntuaron por debajo de 130 en la escala MDRS a los 5 años de la intervención. Llama también la atención que el 21% ya puntuaba por debajo de 130 en el primer año, a expensas del déficit en iniciación-perseveración. Para otros estudios que utilizan el MDRS también se observa un descenso porcentual similar 5 años después de la cirugía14,15. En un trabajo reciente con un período más corto de seguimiento (3 años) el 14% tenía una puntuación de MDRS por debajo de 13018. Sin embargo, en otro artículo publicado el 28% desarrolló demencia durante un seguimiento de 3 años aplicando los criterios para la demencia del el DMS-IV19. Fasano et al.20 estudiaron a 32 pacientes consecutivos con STN-DBS, encontraron un discreto deterioro en funciones cognitivas a los 8 años de la intervención, principalmente pensamiento abstracto y funciones ejecutivas. El deterioro en función verbal fue más importante. Hay que tener en cuenta que sólo 20 de los 32 pacientes iniciales fueron examinados a los 8 años y que la muestra provenía de un grupo de pacientes jóvenes (56,9±7,2 años).
En nuestro estudio, el grupo de referencia, para el que la presencia de demencia fue definida usando los criterios recogidos en el DSM IV, el 38,3% presentaba criterios diagnósticos de demencia a los 5 años de seguimiento. Aunque, por tratarse de un estudio basado en la práctica clínica diaria, la definición de demencia para el grupo de interés (STN-DBS) y el de referencia haya sido diferente, los cambios en el último por criterios DSM IV nos sirven para inferir que la incidencia de demencia a 5 años no aumenta en la serie quirúrgica. En otros estudios se ha observado una variabilidad en las estimaciones de la incidencia de demencia en la EP, con un rango similar en los estudios que tratan a pacientes con tratamiento médico21. El efecto del deterioro cognitivo leve en los resultados después de la estimulación cerebral profunda (DBS) en la EP es poco conocido. En un trabajo reciente la presencia de deterioro cognitivo leve no afectó de manera global a los resultados de DBS. Sin embargo, algunos tipos de deterioro de los dominios fueron más perjudiciales, por ejemplo la afectación visuoespacial predijo un menor beneficio de la cirugía22. En nuestro estudio destacar que ningún paciente puntuando por encima de 137 en la MDRS en situación basal bajó de 123 puntos en dicha escala a los 5 años. Solo el 23% de los que puntuaban por encima de 130 se deterioró a los 5 años. En esta escala observamos un mayor deterioro en la praxis y la iniciación/perseveración en relación con el resto de las funciones cognitivas. El deterioro de las funciones corticales posteriores, como la praxis, la función visuoespacial y la fluidez verbal semántica han resultado ser los mayores predictores de demencia en pacientes con EP23. En nuestro estudio observamos un deterioro significativo en la fluencia verbal semántica y fonética 5 años tras la cirugía; este deterioro fue mayor a partir del primer año, por lo que es difícil de justificar por el acto quirúrgico o el efecto de la estimulación en exclusiva3,16,24.
La capacidad de aprendizaje se alteró a partir del primer año después de la intervención, como puede verse en la prueba de aprendizaje verbal auditivo de Rey (memoria inmediata)3, con menor impacto en la memoria diferida. No hemos considerado evaluables los resultados de la Prueba de Stroop, ya que el 22% y el 27% de los pacientes al primer y quinto año respectivamente no pudieron realizar esta prueba. Los que lograron realizar la prueba no presentaron deterioro significativo. Otros estudios han demostrado un deterioro a corto plazo en la capacidad de interferencia8.
Después de STN-DBS puede haber un empeoramiento de los síntomas depresivos según la situación de los electrodos25, la reducción de la medicación dopaminérgica13,26 o las expectativas del paciente establecidas en esta cirugía. Sin embargo, en la mayoría de los estudios se observó una mejoría global en la depresión y en las escalas que evalúan este trastorno27. En nuestro estudio se observó una mejora de aproximadamente el 20% en la puntuación MADRS en el primer año de la cirugía; este beneficio se perdió a los 5 años de la intervención.
Al igual que para otros estudios, se observó un beneficio sostenido en los síntomas motores de la enfermedad en pacientes sometidos a STN-DBS; este beneficio se mantuvo parcialmente los 5 años13–15. La dosis de la medicación dopaminérgica y las complicaciones motoras se redujeron significativamente en el primer y quinto año de la cirugía. Sin embargo, se observó un empeoramiento en la situación motora bajo el efecto de los fármacos (on fármacos-on DBS) a los 5 años13,15, especialmente centrado en los síntomas axiales13,15,28,29. Nuestra muestra tiene una serie de características especiales, la primera es que los pacientes son más jóvenes (62,2±8,2 años) y basalmente están en mejor situación motora (UPDRS III off: 38,68±9,09) que la de los otros estudios14,15. El beneficio motor resulta en una mejoría en las actividades de la vida diaria (UPDRS II) en el primer (43,09%, p<0,001) y quinto año de la intervención (26,48%, p<0,001). Sin embargo, a los 5 años no se observó mejoría en la calidad de vida medida por la escala PDQ-3913; este hecho puede deberse en parte al empeoramiento de los síntomas axiales y cognitivos, que tienen un impacto importante en la calidad de vida30,31. En nuestra serie quirúrgica la mortalidad es la esperada por la edad (8%) en los pacientes intervenidos. Es de destacar que en el grupo comparativo la mortalidad era superior (19%), en gran parte motivada porque muchas de las causas de la exclusión quirúrgica eran enfermedades concomitantes que contraindicaban la cirugía (cardiopatías, nefropatías…).
Nuestro estudio tiene limitaciones; la más importante es la ausencia de grupo control en los estudios neuroquirúrgicos. Esto puede enmascarar el deterioro producido por el curso natural de la propia EP. Hemos incluido un grupo retrospectivo, con la idea de analizar sólo el número de pacientes que desarrollan demencia tras 5 años. El otro es el tamaño de la muestra y la pérdida durante el seguimiento del 20% de los pacientes, la mayoría debido a la muerte o enfermedades sistémicas. Sin embargo, dado el número limitado de estudios a los 5 años que analizan los aspectos cognitivos y la homogeneidad de la muestra, y que los pacientes han sido evaluados por el mismo neuropsicólogo, creemos que esto da consistencia y validez a sus resultados.
La conclusión principal es que un deterioro significativo de la función verbal ocurre al año de la cirugía, aunque esto aumenta hasta el quinto año, este último aspecto no puede justificarse exclusivamente por la cirugía. El proceso degenerativo de la enfermedad en sí podría explicar el deterioro en la función visuoespacial y las funciones de aprendizaje. A nivel motor hay una reducción en el beneficio en comparación con el primer año de la cirugía. Se observa una mejora de las actividades de la vida diaria, todo ello con una menor dosis de fármacos antiparkinsonianos y, en consecuencia, una reducción de las complicaciones motoras derivadas de dicha terapia.
FinanciaciónEste proyecto ha sido financiado parcialmente gracias al contrato para la intensificación de la actividad investigadora del Instituto de Investigación Sanitaria Biocruces. Expediente INT-BC-2016-1
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.