Determinar si la administración de fármacos antiepilépticos (FAE) puede alterar la probabilidad de encontrar anomalías epileptiformes en EEG realizados de forma precoz tras una primera crisis epiléptica (CE).
MétodoEstudio observacional retrospectivo en el que se incluyó a los pacientes atendidos en urgencias de nuestro centro por una primera CE entre julio del 2014 y noviembre del 2019. Se recogieron los datos clínicos, las características técnicas de adquisición e interpretación de los EEG efectuados durante las primeras 72 h tras la CE y los factores relacionados con la recurrencia.
ResultadosSe recogieron 155 pacientes; edad media 48,6±22,5 años; 61,3% hombres. El 51% presentó crisis tónico-clónicas de inicio desconocido y el 12% focales con progresión a tónico-clónica bilateral. El 25,2% (39/155) recibió tratamiento con FAE antes de la realización del EEG; en 33 pacientes se administró un FAE no benzodiacepínico y en 6 una benzodiacepina. Se observaron anomalías epileptiformes en 29,7% de los pacientes. La administración previa de FAE no se asoció de forma significativa ni con la probabilidad de detectar anomalías epileptiformes (p=0,25) ni con el riesgo de recurrencia a los 6 meses (p=0,63).
ConclusionesLa administración de un FAE previo a la realización del EEG precoz tras una primera CE no disminuye la probabilidad de detectar anomalías epileptiformes. Estos hallazgos sugieren que iniciar un FAE de forma inmediata en aquellos pacientes con alto riesgo de recurrencia precoz no implica un menor rendimiento diagnóstico de dicha prueba.
This study aimed to determine whether the administration of antiepileptic drugs (AED) alters the likelihood of detecting epileptiform abnormalities in electroencephalographies (EEG) performed early after a first epileptic seizure.
MethodWe performed a retrospective, observational study including patients with a first seizure attended at our centre's emergency department between July 2014 and November 2019. We collected clinical data, as well as technical data on the acquisition and interpretation of the EEG performed within the first 72hours after the seizure, and the factors related with seizure recurrence.
ResultsWe recruited 155 patients with a mean (SD) age of 48.6 (22.5) years; 61.3% were men. Regarding seizure type, 51% presented tonic-clonic seizures of unknown onset and 12% presented focal to bilateral tonic-clonic seizures. Thirty-nine patients (25.2%) received AED treatment before the EEG was performed: 33 received a non-benzodiazepine AED and 6 received a benzodiazepine. Epileptiform abnormalities were observed in 29.7% of patients. Previous administration of AEDs was not significantly associated with the probability of detecting interictal epileptiform abnormalities (P=.25) or with the risk of recurrence within 6 months (P=.63).
ConclusionsAdministration of AEDs before an early EEG following a first seizure does not decrease the likelihood of detecting epileptiform abnormalities. These findings suggest that starting AED treatment immediately in patients with a high risk of early recurrence does not imply a reduction in the diagnostic accuracy of the test.
El electroencefalograma (EEG) es una de las herramientas diagnósticas más importantes tras una primera crisis epiléptica (CE). El hallazgo de alteraciones epileptiformes intercríticas en EEG tras una CE se traduce en un riesgo mayor de recurrencia1; este riesgo de recurrencia ha sido estudiado por diferentes autores y varía ligeramente en la población adulta respecto a la pediátrica, pero se considera significativamente alto entre el 64-77% en estos casos2-4. Desde 2014 la Liga Internacional contra la Epilepsia (ILAE)5 propone una nueva definición de epilepsia con la que es posible realizar el diagnóstico de epilepsia tras una primera CE no provocada y eso incluye a los pacientes en los que en el EEG se objetiven anomalías epileptiformes intercríticas.
El efecto de los fármacos antiepilépticos (FAE) en la presencia de descargas epileptiformes intercríticas en el EEG sigue siendo un tema de debate. Si bien algunos estudios clásicos han demostrado una relación inversa entre el nivel de medicación antiepiléptica y la frecuencia de las descargas epileptiformes6-9, otros estudios muestran mayor presencia de actividad tras la administración de FAE10, o bien no observan ninguna asociación entre la frecuencia de actividad interictal y los niveles de FAE11-14. En un estudio reciente, se observó un descenso de la actividad epileptiforme interictal durante una monitorización EEG tras la retirada de la medicación antiepiléptica15.
Así, como vemos, el hecho de empezar un FAE en una primera CE no provocada antes de realizar el EEG podría afectar a la posibilidad de encontrar anomalías epileptiformes y por tanto dificultar el diagnóstico de epilepsia. Hasta el momento no disponemos de evidencia consistente al respecto; por lo tanto, el objetivo del presente trabajo es determinar si precisamente la administración de un FAE altera la detección de patrones diagnósticos en los EEG realizados precozmente en este grupo de pacientes.
Material y métodosSe trata de un estudio observacional retrospectivo, en que se incluyó todos los pacientes atendidos consecutivamente en urgencias del Hospital Vall d’Hebron por primeras CE no provocadas entre julio del 2014 y noviembre del 2019, y en las que se realizó un EEG en las primeras 72 h tras la CE.
Todos los pacientes fueron evaluados por un neurólogo de guardia y se realizaba EEG si se trataban de episodios altamente indicativos de semiología crítica, que incluía episodios paroxísticos con movimientos tónicos, clónicos o tónico-clónicos involuntarios; con o sin alteración de la consciencia, postura versiva, automatismos, aura sensorial, trastorno del lenguaje o del comportamiento característicos. La clasificación semiológica realizada es la descripción clínica de la crisis en el momento en que el paciente consultó en urgencias, en ausencia de neuroimagen ni EEG. Se adaptaron los grupos semiológico a la última clasificación de la ILAE: crisis tónico-clónicas (TC) de inicio desconocido, crisis focales con progresión a TC bilateral y crisis focales sin progresión a bilateral TC16.
Nuestro centro presenta disponibilidad para realización e interpretación del EEG los 365 días del año. Se administró tratamiento antiepiléptico previo al EEG por criterio del facultativo a cargo. El protocolo de inicio de FAE tras una primera crisis no provocada de nuestro centro no establece si se ha de administrar antes o después del EEG. En la práctica clínica habitual, el hallazgo de una lesión estructural en neuroimagen o en casos que se consideran de más riesgo según las características clínicas del paciente (edad avanzada, comorbilidades, mujeres gestantes, en algunos casos de CTCG, etc.) con frecuencia se decide iniciar tratamiento antiepiléptico sin esperar a la realización de un EEG.
A todos los pacientes con CE se realizó una anamnesis detallada para investigar la presencia de historia familiar relevante, alteraciones periparto o retraso psicomotor, crisis febriles, traumatismo cráneo-encefálico o infecciones del sistema nervioso central. Se tuvieron en cuenta la presencia de episodios paroxísticos sutiles previos, así como presencia de episodios sugestivos de ausencias o mioclonías previas.
En todos los pacientes se realizó estudio de neuroimagen con tomografía computarizada o resonancia magnética y se consideró como patológica cuando mostraban lesiones potencialmente epileptogénicas, tales como tumores, patología cerebrovascular, áreas de encefalomalacia, etc.5. Finalmente, en base a los datos clínicos y las exploraciones complementarias, los pacientes eran diagnosticados por un neurólogo de guardia como primera CE no provocada, y posteriormente confirmados por un epileptólogo experto de la Unidad de Epilepsia. Posteriormente para el análisis, se adaptó la clasificación de manera retrospectiva siguiendo la última clasificación de la ILAE16.
Se recogieron datos demográficos, clasificación semiológica de las crisis, día y hora de presentación de la CE, día y hora de realización del EEG, administración de FAE previo a la realización del EEG e inicio o no de tratamiento antiepiléptico crónico. Se realizó seguimiento por historia clínica en un periodo mínimo de 6 meses.
Se excluyeron las crisis sintomáticas agudas y a los pacientes con historia de CE y aquellos con sospecha de estado epiléptico. También se excluyó a aquellos pacientes en los que se registró actividad crítica durante la realización del EEG.
Respecto del EEG, la duración mínima del registro fue 20 min, con un aparato EEG del modelo Deltamed Coherence de 64 canales (Natus Europe GmbH, München, Alemania). Los electrodos se colocaron según el Sistema Internacional 10/20 y se emplearon montajes bipolares y referenciales (average). Se realizaron maniobras de activación en todos los pacientes, exceptuando aquellos pacientes cuyo estado de consciencia basal o comorbilidades lo impedían. Los registros EEG fueron evaluados por 2neurofisiólogos independientes y según los hallazgos se dividieron en 3categorías17:
- a.
Descargas epileptiformes intercríticas, en la que se incluía actividad paroxística focal o generalizada en forma de puntas, polipuntas u ondas agudas.
- b.
Anomalías no epileptiformes, incluyendo lentificaciones focales o bilaterales.
- c.
Sin anomalías significativas (registros EEG normales).
Posteriormente, para simplificar el análisis estadístico y ajustarlo al objetivo inicial del estudio, hemos agrupado en un solo grupo a los pacientes con anomalías no epileptiformes y sin anomalías significativas.
Análisis estadísticoEl análisis estadístico se realizó mediante el software IBM SPSS Statistics 26.0 (IBM Corp., Armonk, nY).
La comparación entre los grupos con y sin FAE previos al EEG y las diferentes características y recurrencia a los 6 meses se realizó mediante la prueba de la ji al cuadrado de Pearson o el test exacto de Fisher en variables categóricas y el test de la t de Student en variables continuas.
Se consideró estadísticamente significativo un p-valor inferior a 0,05.
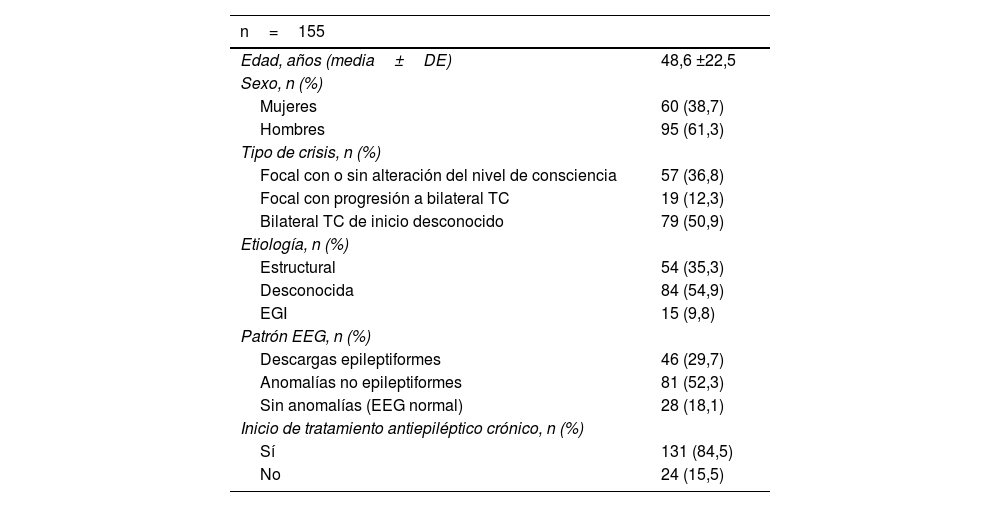
ResultadosSe reclutó a un total de 155 pacientes. La tabla 1 expone las características basales de la muestra. La edad media fue 48 años y el 38,7% eran mujeres. Respecto al tipo de crisis, presentaron crisis focales el 37%, crisis focales con progresión a tónico-clónica bilateral 12% y crisis TC de inicio desconocido el 51%. La etiología más frecuente tras el estudio etiológico fue la causa desconocida en el 55% de los casos, seguida de la estructural en 35%. En un 30% del total de los registros EEG se objetivaron anomalías epileptiformes intercríticas. Se iniciaron FAE como tratamiento continuado al alta hospitalaria en el 84,5% de los casos.
Características demográficas y clínicas de la muestra
| n=155 | |
|---|---|
| Edad, años (media±DE) | 48,6 ±22,5 |
| Sexo, n (%) | |
| Mujeres | 60 (38,7) |
| Hombres | 95 (61,3) |
| Tipo de crisis, n (%) | |
| Focal con o sin alteración del nivel de consciencia | 57 (36,8) |
| Focal con progresión a bilateral TC | 19 (12,3) |
| Bilateral TC de inicio desconocido | 79 (50,9) |
| Etiología, n (%) | |
| Estructural | 54 (35,3) |
| Desconocida | 84 (54,9) |
| EGI | 15 (9,8) |
| Patrón EEG, n (%) | |
| Descargas epileptiformes | 46 (29,7) |
| Anomalías no epileptiformes | 81 (52,3) |
| Sin anomalías (EEG normal) | 28 (18,1) |
| Inicio de tratamiento antiepiléptico crónico, n (%) | |
| Sí | 131 (84,5) |
| No | 24 (15,5) |
Bilateral TC: crisis bilateral tónico-clónica; DE: desviación estándar; EEG: electroencefalograma; EGI: epilepsia generalizada idiopática.
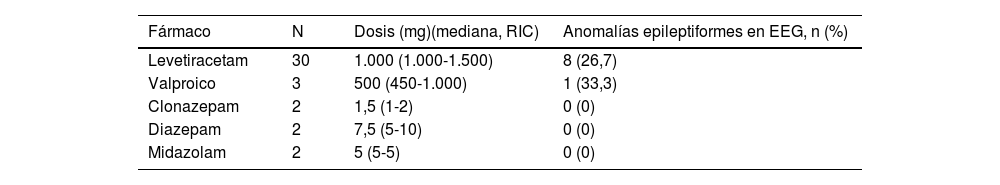
En 39 pacientes (25,2%) se inició tratamiento antiepiléptico antes de la obtención del registro EEG. Levetiracetam (LEV) fue el FAE más utilizado, en 30 de los casos. Otros fármacos utilizados, fueron ácido valproico (VPA) (3), clonazepam (2), diazepam (2) y midazolam (2). Las benzodiacepinas se utilizaron a criterio del facultativo a cargo siempre en forma de dosis única y para evitar el riesgo de recurrencia precoz durante su estancia en urgencias. En la tabla 2 se muestran las dosis de los FAE administrados; además del porcentaje de EEG patológicos con descargas epileptiformes encontrados en cada caso. Las dosis de LEV y VPA utilizadas fueron las usuales para el inicio de medicación antiepiléptica y en estos casos se hallaron anomalías epileptiformes en el 26,7 y el 33,3% respectivamente. En ninguno de los 6 pacientes tratado con fármacos benzodiacepínicos se registró actividad epileptiforme en el EEG.
Fármacos antiepilépticos utilizados antes de la exploración del EEG
| Fármaco | N | Dosis (mg)(mediana, RIC) | Anomalías epileptiformes en EEG, n (%) |
|---|---|---|---|
| Levetiracetam | 30 | 1.000 (1.000-1.500) | 8 (26,7) |
| Valproico | 3 | 500 (450-1.000) | 1 (33,3) |
| Clonazepam | 2 | 1,5 (1-2) | 0 (0) |
| Diazepam | 2 | 7,5 (5-10) | 0 (0) |
| Midazolam | 2 | 5 (5-5) | 0 (0) |
Se incluye el número de pacientes en los que se ha prescrito el FAE, en qué dosis y cuántos de ellos han presentado anomalías epileptiformes en el EEG.
EEG: electroencefalograma; FAE: fármaco antiepiléptico; mg: miligramo; RIC: rango intercuartílico.
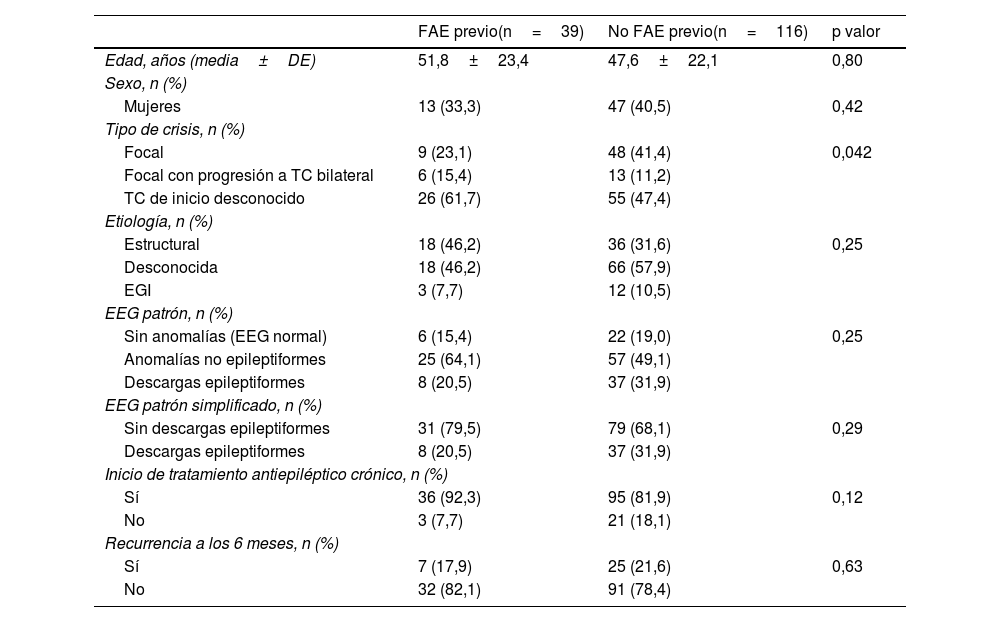
No observamos diferencias significativas en edad, sexo ni etiología al comparar los pacientes que habían recibido tratamiento antiepiléptico antes o después de la realización del EEG (tabla 3). La prescripción precoz de FAE fue significativamente más frecuente (p=0,042) en los pacientes que habían acudido por crisis TC de inicio desconocido (32,1% [26/81]) y por crisis focales con progresión a tónico-clónica bilateral (31,6% [6/19]), que en aquellos pacientes que habían presentado crisis focales aisladas (15,8% [9/57]).
Comparación entre el grupo de pacientes en que se administró un fármaco antiepiléptico antes del EEG y el grupo que no recibió FAE previamente
| FAE previo(n=39) | No FAE previo(n=116) | p valor | |
|---|---|---|---|
| Edad, años (media±DE) | 51,8±23,4 | 47,6±22,1 | 0,80 |
| Sexo, n (%) | |||
| Mujeres | 13 (33,3) | 47 (40,5) | 0,42 |
| Tipo de crisis, n (%) | |||
| Focal | 9 (23,1) | 48 (41,4) | 0,042 |
| Focal con progresión a TC bilateral | 6 (15,4) | 13 (11,2) | |
| TC de inicio desconocido | 26 (61,7) | 55 (47,4) | |
| Etiología, n (%) | |||
| Estructural | 18 (46,2) | 36 (31,6) | 0,25 |
| Desconocida | 18 (46,2) | 66 (57,9) | |
| EGI | 3 (7,7) | 12 (10,5) | |
| EEG patrón, n (%) | |||
| Sin anomalías (EEG normal) | 6 (15,4) | 22 (19,0) | 0,25 |
| Anomalías no epileptiformes | 25 (64,1) | 57 (49,1) | |
| Descargas epileptiformes | 8 (20,5) | 37 (31,9) | |
| EEG patrón simplificado, n (%) | |||
| Sin descargas epileptiformes | 31 (79,5) | 79 (68,1) | 0,29 |
| Descargas epileptiformes | 8 (20,5) | 37 (31,9) | |
| Inicio de tratamiento antiepiléptico crónico, n (%) | |||
| Sí | 36 (92,3) | 95 (81,9) | 0,12 |
| No | 3 (7,7) | 21 (18,1) | |
| Recurrencia a los 6 meses, n (%) | |||
| Sí | 7 (17,9) | 25 (21,6) | 0,63 |
| No | 32 (82,1) | 91 (78,4) | |
Bilateral TC: crisis bilateral tónico-clónica; DE: desviación estándar; EGI: epilepsia generalizada idiopática; EEG: electroencefalograma; FAE: fármaco antiepiléptico.
Significación estadística: p <0,05.
La probabilidad de detectar anomalías epileptiformes no varió significativamente en relación con la administración previa de FAE; en el grupo en el que no se había administrado ningún FAE se detectaron descargas epileptiformes intercríticas en el 31,9%, en comparación con el 20,5% de los pacientes en los que se había administrado tratamiento con FAE previamente (p=0,3).
Al evaluar si en alguno de los 3 grupos etiológicos se producía con más probabilidad desaparición de las anomalías epileptiformes tras la administración de un FAE previo al EEG, no encontramos diferencias significativas (p=0,41): estructural (31,3%), epilepsia generalizada idiopática (18,2%) y desconocido (11,1%).
Además, tampoco se observaron diferencias en el riesgo de recurrencia a los 6 meses entre los 2 grupos (17,9% vs. 21,6%; p=0,63).
DiscusiónNuestro estudio observa que la administración de FAE previa a la realización del EEG no altera significativamente la detección de descargas epileptiformes intercríticas en pacientes que han sufrido una primera CE no provocada.
Actualmente el diagnóstico de epilepsia es posible con la presencia de una única CE no provocada y un riesgo de recurrencia de más de 60% al cabo de 10 años o con el diagnóstico de un síndrome epiléptico determinado5. Por lo tanto, será de gran importancia la detección de anomalías epileptiformes para esta definición, sobre todo en aquellos casos de epilepsia generalizadas genéticamente determinadas y en los que no objetivamos una lesión estructural. De esta forma, tendremos que rentabilizar al máximo esta herramienta diagnóstica. Existe suficiente evidencia de que la realización de un EEG de forma precoz presenta una rentabilidad muy superior al compararlo con su realización tardía, siendo esta rentabilidad superior en un margen inicial de entre 12-16h desde la CE17-20 y como neurólogos nos surgirá la duda razonable de iniciar un FAE de forma inmediata previa a la realización del EEG o bien diferida tras la interpretación del mismo. Nuestro estudio aporta datos a favor de que el hecho de iniciar un FAE de manera precoz no disminuye la rentabilidad diagnóstica del EEG, sobre todo en el caso del LEV, uno de los fármacos más comúnmente utilizados en el tratamiento de la epilepsia en los servicios de urgencias.
Pese a que se requiere un mayor nivel de evidencia para confirmar estos hallazgos, parecería prudente iniciar un tratamiento antiepiléptico en las aquellas crisis de alto riego de recurrencia, recogidas en el Documento de consenso para el tratamiento agudo de pacientes con crisis epilépticas en urgencias de la Sociedad Española de Neurología21, como los casos de crisis en gestante, fiebre, comorbilidad psiquiátrica grave, y la presencia de un traumatismo craneal u otras lesiones secundarias a las crisis. Asimismo, aquellas crisis que con una puntuación en escala ADAN >1 también las podemos considerar de alto riesgo22.
Debemos de considerar que en nuestro estudio no se ha podido establecer diferencias en relación al FAE utilizado, puesto que en 30 de los 39 pacientes que iniciaron tratamiento antes del EEG el fármaco de elección fue el LEV. En base a esta limitación, es posible que no en todos los FAE se cumpla el mismo fenómeno, sobre todo en el caso de las benzodiacepinas, en el que no se observaron descargas epileptiformes en ninguno de los 6 casos en nuestro estudio. Distintos trabajos que han analizado la actividad intercrítica con la retirada de distintos FAE aportan evidencia muy dispar en este sentido7,8,10-13, por lo que en parte también podemos suponer que el uso de distintos FAE puede influir en estos hallazgos. En concreto, en el caso del LEV es incierto el efecto que tiene sobre la actividad epileptiforme; si bien ciertos trabajos descartan un decremento de la actividad interictal en su inicio en monoterapia14, otros sugieren que en el caso de las epilepsias generalizadas puede producirse un mayor control de la actividad epileptiforme intercrítica9. Nuestros resultados irían en consonancia con el trabajo de Pro et al.14, en el que no se encontró reducción significativa de las descargas epileptiformes intercríticas en el grupo de pacientes en que se inició LEV en monoterapia. En el caso de las benzodiacepinas, podemos afirmar que se tratan de un conjunto de fármacos con alta potencia para la supresión de actividad epileptiforme, demostrado tanto en estudios experimentales23,24 como en ensayos clínicos en que demuestran una mayor eficacia para la resolución de la situación de estado epiléptico en comparación con otros FAE25.
La principal limitación del estudio es el carácter retrospectivo de los datos, que implican que no podemos controlar en que grupo de pacientes se ha realizado la intervención. Aunque podemos afirmar, que al margen del tipo de crisis (generalizada o focal) no hubo diferencias entre los 2 grupos. Otra limitación importante es que a pesar de que no haya diferencias significativas, el porcentaje de pacientes con actividad epileptiforme es llamativamente menor entre los que recibieron FAE previo al EEG; en su mayor parte estas diferencias podrían estar justificada por el grupo de pacientes que han recibido benzodiacepinas. Si bien en el global de la muestra la ausencia de significación estadística puede ser debido al tamaño de la muestra. Futuras líneas de investigación deberían validar estos hallazgos mediante estudios aleatorizados reglados, en el que se analice el efecto de los diferentes tipos de FAE y en función de los tipos de crisis.
ConclusiónEl tratamiento con FAE de forma inmediata en aquellos pacientes con una primera CE no provocada no disminuiría la rentabilidad diagnóstica del EEG precoz para la detección de actividad epileptiforme, por lo que su inicio no debería diferirse en casos de alto riesgo de recurrencia precoz, mayoritariamente en pacientes tratados con LEV y con la probable excepción de las BZD.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaramos no tener ningún conflicto de intereses.