La mayoría de los estudios muestran que la incidencia del síndrome de Guillain-Barré aumenta con la edad, con un máximo entre los 70 y los 80 años y un descenso posterior. El objetivo del estudio es describir la incidencia global y específica por sexo y grupos de edad y las características clínicas del síndrome de Guillain-Barré en la comarca de Osona (Barcelona, España).
MétodosEstudio descriptivo retrospectivo de base poblacional en el periodo 2003-2016.
ResultadosLa incidencia global es de 2,07/100.000 habitantes-año. La incidencia aumenta con la edad, salvo un pequeño pico en la infancia y entre los 40 y los 50 años, alcanzando la máxima de 6,26/100.000 habitantes-año pasados los 80 años. Los porcentajes de las variantes fueron: AIDP (72,1%), AMAN (16,3%), ANSAN (4,7%) y síndrome de Miller-Fisher (4,7%). Presentaron infección previa de vías respiratorias el 41,9% e infección gastrointestinal el 20,9%. Se halló proteinorraquia en el 76,7%. El EMG mostraba un predominio desmielinizante en el 73,7% y axonal en el 26,3%. Necesitaron soporte ventilatorio el 20,9%. La mortalidad a los 6 meses fue del 9,3%. Las variables que se asociaron a un peor pronóstico fueron la edad superior a los 80 años, la demora en el ingreso, presentar infección gastrointestinal previa y la variante AMAN.
ConclusionesLa incidencia descrita en nuestro estudio se encuentra en el rango más alto de las estimadas en Europa y Estados Unidos. En ancianos pudiera estar infradiagnosticado y se requeriría de una mayor alerta ante una enfermedad con alta mortalidad si no se trata de forma precoz.
According to most studies, the incidence of Guillain-Barré syndrome increases with age, with a peak incidence occurring between 70 and 80 years of age. The objective of this study is to describe the incidence (overall and by sex and age group) and clinical characteristics of Guillain-Barré syndrome in Osona (Barcelona, Spain).
MethodsWe performed a retrospective, descriptive, population-based study covering the period 2003 to 2016.
ResultsThe global incidence of Guillain-Barré syndrome is 2.07 cases per 100,000 person-years. Incidence increases with age, except for small peaks during childhood and between 40 and 50 years, and reaches a maximum of 6.26 cases per 100,000 person-years above the age of 80. The incidences of the different variants were: AIDP, 72.1%; AMAN, 16.3%; ANSAN, 4.7%; and Miller Fisher syndrome, 4.7%. A total of 41.9% of patients had a history of respiratory tract infections, and 20.9% had a history of gastrointestinal infections. Protein in the cerebrospinal fluid was found in 76.7%. EMG findings suggested demyelination in 73.7% of the patients and axonal degeneration in 26.3%. A total of 20.9% of patients needed ventilatory support. Six-month mortality was 9.3%. Variables associated with worse prognosis were age over 80 years, delay in admission, previous gastrointestinal infection, and AMAN variant.
ConclusionsThe incidence observed in our study is in the upper range of estimated incidence rates reported in European and North American studies. The syndrome may be underdiagnosed in elderly patients; physicians must be vigilant to the possibility of the disease, which is associated with a high mortality rate if it is not treated early.
El síndrome de Guillain-Barré (SGB) es una polirradiculoneuropatía inflamatoria disinmune que puede ser desencadenada por múltiples estímulos antigénicos, principalmente infecciones víricas o bacterianas y vacunas. Se presenta habitualmente como una parálisis motora ascendente con arreflexia y disociación albuminocitológica en el líquido cefalorraquídeo. La forma clásica del SGB es la polirradiculoneuropatía desmielinizante aguda (AIDP, por acute inflammatory demyelinating polyrradiculoneuropathy). Con posterioridad se han descrito variantes como la polirradiculoneuropatía motora axonal aguda (AMAN, por acute motor axonal neuropathy), la polirradiculoneuropatía sensitivo-motora axonal aguda (AMSAN, por acute motor and sensory axonal neuropathy), la polirradiculoneuropatía sensitiva axonal aguda (ASAN, por acute sensory axonal neuropathy) y el síndrome de Miller-Fisher.
La incidencia del SGB varía desde 0,16 a 4/100.000 habitantes-año, si bien en la mayoría de los estudios se halla entre 1,1 y 1,8×105/año. En Europa y Estados Unidos las incidencias descritas se encuentran por debajo de 2×105/año1,2. Un estudio reciente realizado en toda Francia3 a partir de los diagnósticos codificados de altas hospitalarias muestra una incidencia de 2,42, si bien el mismo estudio no excluye una sobrecodificación de los casos. Las incidencias más altas se describen en regiones de Asia4,5 y Caribe (Curaçao6 y la máxima, de 3,93, en Aruba7). En España las incidencias publicadas8–11 se encuentran entre 0,85 y 1,56×105/año.
La mayoría de los estudios1,2 muestran que la incidencia del SGB aumenta con la edad, con un pico máximo entre los 70 y los 80 años y un descenso posterior. Otros estudios muestran que el incremento de la incidencia relacionada con la edad se mantiene por encima de los 80 años12,13. En un metaanálisis2 de las incidencias descritas en Estados Unidos y Europa, tras aplicar un modelo de regresión binomial, se observa un incremento exponencial de la incidencia a lo largo de los años, alcanzando la más alta pasados los 80 años.
En nuestra comarca se han realizado estudios epidemiológicos con base poblacional de miastenia gravis14 y de esclerosis lateral amiotrófica15, y en ambas se han hallado altas incidencias a expensas de los mayores de 80 años, lo que apunta a un infradiagnóstico de estas enfermedades neuromusculares en los más ancianos.
Incluido en el proyecto de neuroepidemiología en la comarca de Osona, se ha realizado un estudio con base poblacional con el propósito de describir la incidencia global y específica por sexo y grupos de edad, y así contribuir al conocimiento del mapa epidemiológico europeo y global del SGB. Se plantea la hipótesis de que la incidencia de SGB sea alta a expensas de una mayor incidencia en los más ancianos. Se describen también las características clínicas del SGB de los casos estudiados.
Pacientes y métodosEl Hospital Universitario de Vic tiene de referencia geográfica la comarca de Osona, situada al norte de la provincia de Barcelona (Cataluña Central, España) y que atendió una población censada promedio de 151.907 habitantes en el periodo estudiado (Instituto de Estadística de Cataluña). El Hospital Universitario de Vic es el centro de referencia de la sanidad pública, que es la mayoritaria en este ámbito geográfico.
El Hospital Universitario de Vic dispone de un registro de las principales enfermedades neurológicas, que incluye el SGB. En el mantenimiento de este registro colaboran todos los neurólogos de la comarca de Osona. Este registro específico nos permite realizar estudios de seguimiento, ya sean clínicos, sobre los tratamientos llevados a cabo, o epidemiológicos, sobre incidencia, prevalencia y supervivencia.
El periodo de estudio abarca desde el 1 de enero del 2003 al 31 de diciembre del 2016.
La definición de los casos de SGB se basa en los criterios de Brighton, con su nivel de certeza diagnóstica16 (tabla 1).
Criterios y nivel de certeza diagnóstica de Brighton para el síndrome de Guillain-Barré
| Nivel de certeza diagnóstica | ||||
|---|---|---|---|---|
| Criterios diagnósticos | 1 | 2 | 3 | 4 |
| Debilidad flácida y bilateral de las extremidades | + | + | + | +/− |
| Disminución o ausencia de los reflejos tendinosos profundos | + | + | + | +/− |
| Curso monofásico y tiempo entre el inicio y el nadir de 12h a 28 días | + | + | + | +/− |
| Número de células LCR<50/μl | + | +a | − | +/− |
| Concentración de proteínas en el LCR>valor normal | + | +/−a | − | +/− |
| Electrofisiología consistente con uno de los subtipos de SGB | + | +/− | − | +/− |
| Ausencia de diagnóstico alternativo | + | + | + | + |
LCR: líquido cefalorraquídeo; SGB: síndrome de Gillain-Barré; +: presente; −: ausente; +/−: presente o ausente.
Si no se recoge líquido cefalorraquídeo o no se dispone de conclusiones, los resultados de la electrofisiología deben ser coherentes con el diagnóstico del síndrome de Guillain-Barré.
Fuente: Fokke et al.16.
En cada caso se registraron las variables demográficas (sexo, edad), la fecha de inicio del SGB, el posible desencadenante en las 4 semanas previas (infección con síntomas respiratorios o digestivos, vacuna), las variantes (AIDP, AMAN, AMSAN, ASAN, síndrome de Miller-Fisher), la presencia de proteinorraquia al ingreso, las características del EMG realizado tras 2-3 semanas de evolución (predominio axonal o desmielinizante), la necesidad de soporte ventilatorio, el tratamiento con inmunoglobulina intravenosa (IgIV) y el estado funcional valorado con la escala de Rankin a los 6 meses.
Para el cálculo de la incidencia se ha utilizado el número de pacientes diagnosticados de SGB en el periodo 2003-2016 y residentes en alguno de los 51 municipios que conforman la comarca de Osona (Cataluña Central), entre la población total (población de derecho) de dicha comarca. Se consideraron casos incidentes los pacientes que presentaron el inicio de la clínica de SGB durante el periodo de estudio. Para el cálculo de la incidencia por sexo se ha utilizado el número de hombres y de mujeres, vivos y residentes en Osona, para el mismo periodo, entre la población masculina y femenina de la citada comarca, respectivamente; y para los cálculos de la incidencia por grupos de edad, el número de casos de cada grupo de edad, entre la población correspondiente.
Se realiza un estudio epidemiológico sobre este grupo de pacientes a partir de la instauración de un registro de casos. Los valores cuantitativos se presentan como media, la correspondiente desviación típica y frecuencias relativas (porcentajes y por 100.000). Las pruebas estadísticas utilizadas han sido el test de la χ2 corregido o de Yates y el test de Mann-Whitney. Los programas utilizados para el análisis estadístico han sido Microsoft Office Excel 2007 e IBM® SPSS® Statistics versión 23.
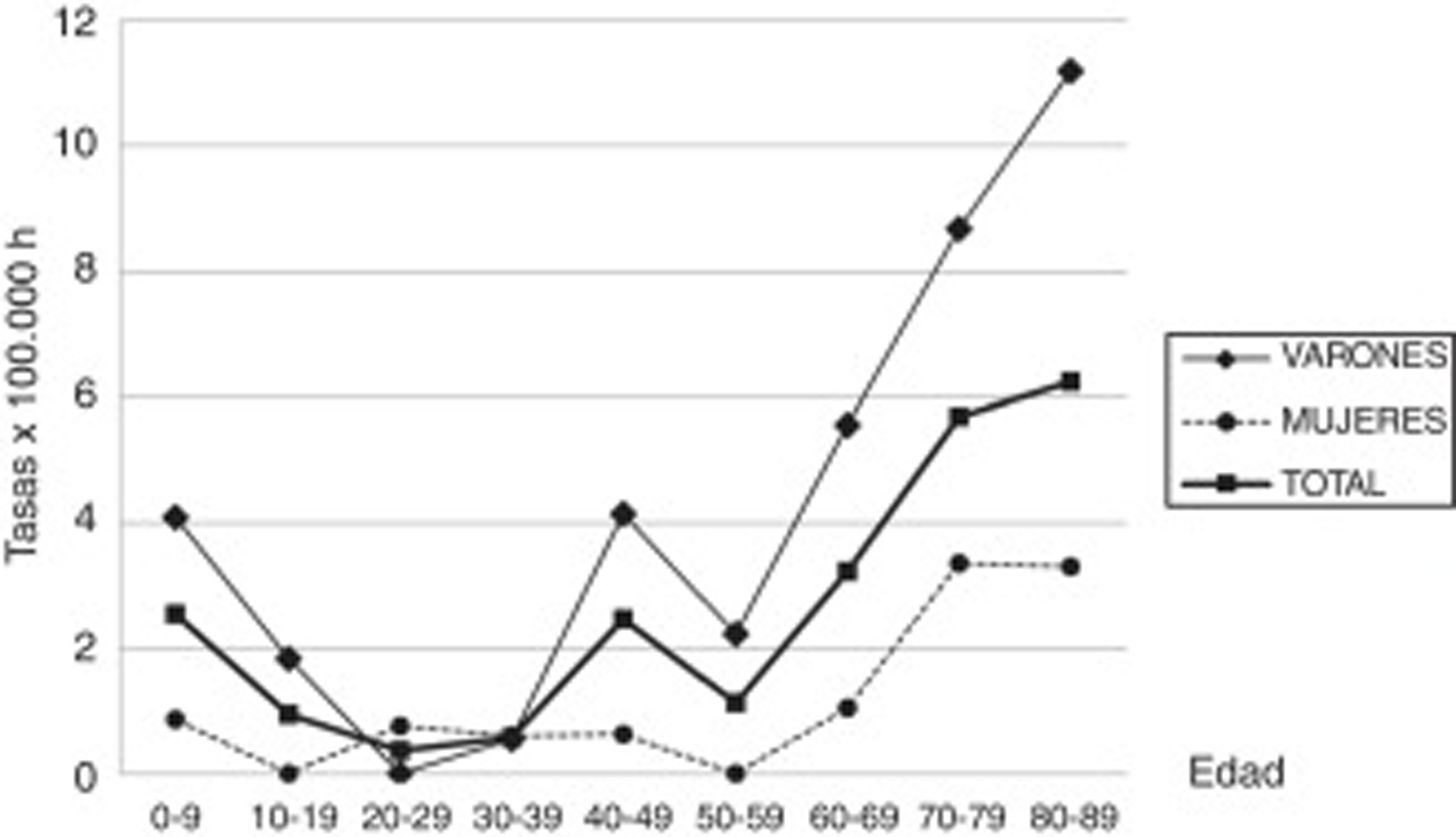
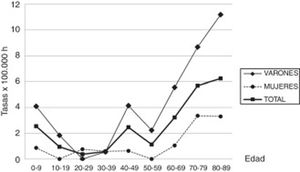
ResultadosEn el periodo de estudio (2003-2016) se encontraron en la comarca de Osona 43 nuevos casos de SGB o algunas de sus variantes. El nivel de certeza diagnóstica según los criterios de Brighton fue de nivel i en el 58,2%, de nivel ii en el 30,2%, de nivel iii en el 2,3% y de nivel iv en el 9,3%. La incidencia del SGB en la comarca de Osona (2003-2016) ha sido de 2,07/100.000 habitantes. Entre los hombres es de 3,16/100.000 habitantes y entre las mujeres, de 0,97/100.000 habitantes. Respecto al sexo, hay una razón de hombres respecto a mujeres del 3,3. La media de edad es de 51,21±26,9 años. Las incidencias del SGB por grupos de edad y sexo se muestran en la tabla 2 y el gráfico 1.
Incidencias por grupos de edad y sexo del síndrome de Guillain-Barré, en la comarca de Osona (2003-2016)
| Total | Hombres | Mujeres | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Grupos de edad (años) | Casos, n | Personas-año | Incidencia (×105) | Casos, n | Personas-año | Incidencia (×105) | Casos, n | Personas-año | Incidencia (×105) |
| 0-9 | 6 | 235.607 | 2,55 | 5 | 122.166 | 4,09 | 1 | 113.441 | 0,88 |
| 10-19 | 2 | 209.114 | 0,96 | 2 | 107.978 | 1,85 | 0 | 101.136 | 0 |
| 20-29 | 1 | 265.491 | 0,38 | 0 | 135.947 | 0 | 1 | 129.544 | 0,77 |
| 30-39 | 2 | 344.273 | 0,58 | 1 | 182.135 | 0,55 | 1 | 162.138 | 0,62 |
| 40-49 | 8 | 323.641 | 2,47 | 7 | 168.904 | 4,14 | 1 | 154.737 | 0,65 |
| 50-59 | 3 | 261.932 | 1,15 | 3 | 133.437 | 2,25 | 0 | 128.495 | 0 |
| 60-69 | 6 | 185.164 | 3,24 | 5 | 89.774 | 5,57 | 1 | 95.390 | 1,05 |
| 70-79 | 9 | 158.101 | 5,69 | 6 | 69.197 | 8,67 | 3 | 88.904 | 3,37 |
| 80-89 | 6 | 95.900 | 6,26 | 4 | 35.686 | 11,21 | 2 | 60.214 | 3,32 |
| Total | 43 | 2.079.223 | 2,07 | 33 | 1.045.224 | 3,16 | 10 | 1.033.999 | 0,97 |
En el grupo de edad de 0-9 años se observa una incidencia distinta entre los inmigrantes (12,0×105) y los autóctonos (1,24×105).
El porcentaje de las infecciones previas de vías respiratorias fue del 41,9% y el de infecciones del tracto gastrointestinal, del 20,9%. Solo en un caso existía el antecedente de vacunación en las semanas previas.
Presentaron proteinorraquia el 76,7% de los casos. Se realizó EMG en el 86,0%, de los cuales el 73,7% mostraba una neuropatía de predominio desmielinizante y en el 26,3% era axonal.
Los porcentajes de las variantes del SGB fueron: AIDP (72,1%), AMAN (16,3%), AMSAN (4,7%) y síndrome de Miller-Fisher (4,7%).
Los pacientes tratados con IgIV fueron el 90,2%. Necesitaron soporte ventilatorio el 20,9%. Un caso presentó una recaída dentro de los primeros 2 meses. Se le administró nueva pauta de IgIV y no necesitó soporte respiratorio.
La distribución temporal no mostró diferencias estacionales significativas, aunque se aprecia un menor número de casos en agosto y septiembre.
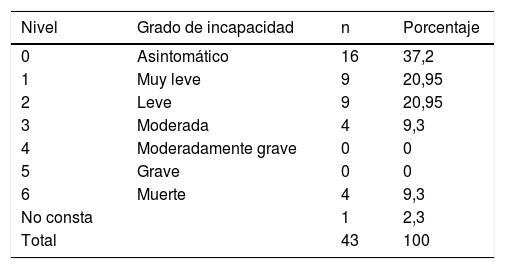
El estado funcional de los pacientes a los 6 meses según la escala de Rankin modificada viene detallado en la tabla 3. Las muertes en los primeros 6 meses fueron 4, todas producidas por insuficiencia respiratoria y/o neumonía como complicación del SGB. Suponen una mortalidad a los 6 meses del 9,3%. La media de la puntuación de la escala de Rankin a los 6 meses, exceptuando las defunciones, fue de 1,44.
Escala de Rankin modificada. Frecuencias absolutas y relativas de los distintos niveles en el estudio del síndrome de Guillain-Barré, en Osona
| Nivel | Grado de incapacidad | n | Porcentaje |
|---|---|---|---|
| 0 | Asintomático | 16 | 37,2 |
| 1 | Muy leve | 9 | 20,95 |
| 2 | Leve | 9 | 20,95 |
| 3 | Moderada | 4 | 9,3 |
| 4 | Moderadamente grave | 0 | 0 |
| 5 | Grave | 0 | 0 |
| 6 | Muerte | 4 | 9,3 |
| No consta | 1 | 2,3 | |
| Total | 43 | 100 |
Nivel 1: pueden realizar tareas y actividades habituales, sin limitaciones; nivel 2: incapacidad para realizar algunas actividades previas, pero pueden valerse por sí mismos, sin necesidad de ayuda; nivel 3: requieren algo de ayuda, pero pueden caminar solos; nivel 4: dependientes para actividades básicas de la vida diaria, pero sin necesidad de supervisión continuada (necesidades personales sin ayuda); nivel 5: totalmente dependientes, requieren asistencia continuada.
Fuente: Van Swieten et al.17.
Las variables asociadas a peor pronóstico y mortalidad (Rankin≥3) a los 6 meses fueron la edad igual o superior a 80 años (el 50% de los casos de 80 y más años presenta un Rankin≥3 a los 6 meses), la demora desde el inicio de los síntomas al ingreso hospitalario (Rankin 0-2 media de 7,9 días, Rankin≥3 media de 19 días; p=0,015), presentar infección gastrointestinal previa (el 33,3% de las infecciones gastrointestinales presenta un Rankin≥3 a los 6 meses) y la variante AMAN (el 57,1% de los casos AMAN presenta un Rankin≥3 a los 6 meses). La mayoría (77,8%) de los pacientes con necesidad de soporte respiratorio tienen afectación de los pares craneales (p=0,005). El porcentaje de pacientes con necesidad de soporte respiratorio fue mayor entre aquellos con peor pronóstico a los 6 meses, aunque no de forma significativa (p>0,05).
El grupo de 80 años y mayores se caracteriza por presentar una mayor demora entre el inicio de los síntomas y el ingreso (media de 20,7 días; p=0,012), además de un peor pronóstico y mortalidad a los 6 meses (50% de los casos y 50% de la mortalidad total). No se encontraron diferencias (p>0,05) en cuanto a variantes, variables clínicas recogidas en los criterios diagnósticos (tabla 1) y presencia de infección previa.
DiscusiónLa incidencia descrita en nuestro estudio se encuentra en el rango más alto de las estimadas en Europa y Estados Unidos1,2. Respecto a los estudios realizados en España, es discretamente superior a la encontrada en el área iii de Aragón18 y presenta mayor diferencia con el resto de los estudios8–11,19. Las características del estudio, realizado en una población con un único hospital de referencia, con todos los neurólogos implicados en el registro, permiten disminuir el riesgo de pérdida de casos incidentes y podría explicar la alta incidencia encontrada. Aunque la población del estudio no es muy grande, el largo periodo de estudio (14 años) da fuerza y validez al mismo.
A excepción de un pico encontrado en la infancia y en varones de 40 a 49 años, la incidencia aumenta con la edad, siendo la más alta después de los 80 años. El aumento de la incidencia relacionada con la edad es conocido, pero la mayoría de los estudios muestran un descenso de la incidencia después de los 80 años. La mayor incidencia encontrada en los mayores de 80 años en nuestro estudio y en otros12, y la anómala inversión de la curva de incidencia por encima de esta edad en el resto de los estudios evidencian que pudiera existir un infradiagnóstico del SGB en los más ancianos. En los estudios realizados en nuestra comarca de miastenia gravis14 y de esclerosis lateral amiotrófica15 también se hallaron las mayores incidencias descritas por encima de los 80 años, apuntando a un infradiagnóstico de estas enfermedades neuromusculares en población geriátrica. La alta incidencia encontrada en los muy ancianos también contribuiría a la alta incidencia global.
El pico de incidencia encontrado en la infancia es a expensas de niños menores de 6 años. Este pico se había descrito en Sudamérica20, con una mayor incidencia a los 2 años y un lento descenso hasta los 14 años, y en alguna región de Asia21. Algún estudio europeo3,22 muestra un leve aumento de la incidencia en el grupo de 2 a 4 años. Los casos recogidos de este pico en la infancia y adolescencia en nuestro estudio son en su mayoría hijos de emigrantes de etnia magrebí o hindú. Se encontró también un pequeño pico en varones de 40 a 49 años que, si bien no se describe habitualmente, había sido reportado previamente23,24.
A diferencia de la mayoría de las enfermedades autoinmunes, se describe una mayor incidencia del SGB en varones. El marcado predominio respecto a las mujeres se encuentra en la mayoría de los estudios1,2, sin que exista una explicación para ello.
La variante del SGB más frecuente en nuestro estudio es la AIDP, que es la forma más común en Europa25 y Estados Unidos26, donde representa entre el 58 y el 90% de los casos, respectivamente, a diferencia de lo que ocurre en China27 y Japón28, donde el porcentaje de las variantes axonales es más alto (30-65%).
Se describe una infección previa al SGB en el 62,8% de los casos, con un predominio de las infecciones de vías respiratorias, que concuerda con el resto de los estudios realizados en Europa1.
En occidente, la mayoría de los casos son tratados con IgIV, o bien con plasmaféresis. En nuestra serie, el 86% de los casos recibieron IgIV. Necesitaron soporte ventilatorio un 20,9% de los casos. La disponibilidad de estos tratamientos ha permitido reducir la mortalidad, que se encuentra en nuestro estudio por debajo del 10%, sin embargo, es algo superior a la mortalidad descrita en Europa29 y Estados Unidos30, que está alrededor del 5%. La muerte después del SGB es mayor en pacientes ancianos y severamente afectados o con alta comorbilidad. La mayor incidencia en muy ancianos en nuestro estudio justifica en parte esta mayor mortalidad global, pues la mitad de las muertes se dieron en ancianos de más de 80 años. Por otro lado, el valor de la mortalidad en una cohorte tan reducida, con solo 4 muertes, tiene escasa significación.
La edad superior a los 80 años, presentar la variante AMAN y la demora en el ingreso son variables de nuestro estudio que ya habían sido asociadas a un peor pronóstico26,31,32. Otra variable del estudio asociada a un peor pronóstico, la infección gastrointestinal previa, es también conocida y está incluida en una escala pronóstica, donde la edad, la presencia o ausencia de diarrea previa y la discapacidad a las 2 semanas predicen si un paciente podrá andar a los 6 meses33. Otra escala pronóstica que incluye los días de demora entre el inicio de la debilidad y el ingreso, la presencia de parálisis facial o bulbar y la severidad de la parálisis de las extremidades predice la necesidad de soporte respiratorio34. Nuestro estudio también identificó la parálisis facial como factor predictivo de la necesidad de soporte respiratorio.
Los pacientes de 80 años y mayores pueden ser infradiagnosticados si no se valoran correctamente, al atribuirse los síntomas de debilidad o insuficiencia respiratoria a otras afecciones frecuentes en edad avanzada. No se encontraron diferencias en las características de la enfermedad al compararlos con los menores de 80 años, excepto una mayor demora entre el inicio de los síntomas y el ingreso, y un peor pronóstico con mayor mortalidad a los 6 meses.
En conclusión, nuestro estudio muestra una de las incidencias más altas de SGB. La incidencia aumenta con la edad, salvo un pequeño pico en la infancia y entre los 40 y los 50 años, siendo máxima por encima de los 80 años. Esta alta incidencia encontrada en los más ancianos, no descrita habitualmente, podría evidenciar un infradiagnóstico y requeriría de una mayor alerta en estos pacientes, ya que si no se realiza el diagnóstico y el tratamiento de forma precoz, la mortalidad puede ser alta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.