En la esclerosis lateral amiotrófica (ELA) se ha descrito recientemente la presencia de neuroinflamación. Sin embargo, no se ha definido el rol de citoquinas proinflamatrorias como la proteína quimiotáctica de monocitos-1 (MCP-1) y la proteína inflamatoria macrofágica-1β (MIP-1β) en ELA. En este estudio evaluamos niveles de MCP-1 y MIP-1β en líquido cefalorraquídeo (LCR), analizando su participación en la duración y gravedad de la ELA.
MétodosEn 77 pacientes con ELA definida y 13 sujetos controles, se comparó el nivel de citoquinas MCP-1 y MIP-1β en LCR. Se analizaron estos niveles con relación a la duración de la ELA (<12meses vs. >12meses) y a la gravedad de esta determinada mediante el puntaje obtenido al ingreso en la escala funcional estratificada de la ELA (<30puntos vs. >30puntos).
ResultadosEn los 77 pacientes con ELA, se encontraron aumentados los niveles de MIP-1β (4,69pg/ml vs. 10,68pg/ml, p<0,0001) y MCP-1 (160,95pg/ml vs. 234,89pg/ml, p=0,011) en comparación con sujetos controles. No se observó diferencia de los niveles de estas citoquinas con la duración o la gravedad de la enfermedad. Sin embargo, observamos una correlación positiva significativa entre MIP-1β y MCP-1 en pacientes con ELA.
ConclusionesEl aumento de MIP-1β y MCP-1 sugiere que estas citoquinas parecen tener un efecto sinérgico en la patogénesis de la ELA. Sin embargo, en nuestra cohorte no se asociaron con la duración o la gravedad de la ELA.
Neuroinflammation has recently been described in amyotrophic lateral sclerosis (ALS). However, the precise role of such proinflammatory cytokines as monocyte chemoattractant protein-1 (MCP-1) and macrophage inflammatory protein-1β (MIP-1β) in ALS has not yet been determined. In this study, we determined cerebrospinal fluid (CSF) MCP-1 and MIP-1β levels and assessed their association with the duration and severity of ALS.
MethodsConcentrations of MCP-1 and MIP-1β were determined in the CSF of 77 patients diagnosed with ALS and 13 controls. Cytokine levels were analysed in relation to ALS duration (<12months vs. >12months) and severity (<30points vs. >30points on the ALS Functional Rating Scale administered at hospital admission).
ResultsHigher CSF MIP-1β (10.68pg/mL vs. 4.69pg/mL, P<.0001) and MCP-1 (234.89pg/mL vs. 160.95pg/mL, P=.011) levels were found in the 77 patients with ALS compared to controls. There were no differences in levels of either cytokine in relation to disease duration or severity. However, we did observe a significant positive correlation between MIP-1β and MCP-1 in patients with ALS.
ConclusionsThe increase in MIP-1β and MCP-1 levels suggests that these cytokines may have a synergistic effect on ALS pathogenesis. However, in our cohort, no association was found with either the duration or the clinical severity of the disease.
La esclerosis lateral amiotrófica (ELA) es una enfermedad neurodegenerativa y fatal a corto plazo, caracterizada por un rápido deterioro debido a la muerte selectiva de las neuronas motoras en la corteza cerebral, el tronco encefálico y la médula espinal1-3. La ELA ha sido tradicionalmente definida como un proceso neurodegenerativo; sin embargo, su etiología y mecanismos patogénicos no han sido bien definidos3,4.
De acuerdo con estudios recientes, la neuroinflamación es un hallazgo patológico prominente en los sitios de lesión de la neurona motora. Se caracteriza por activación de la microglía, astrogliosis e infiltración de monocitos y células-T5. Adicionalmente, se ha descrito que un proceso inflamatorio contribuye a la patogénesis de la ELA, el cual es mediado por el sistema inmune dentro del sistema nervioso central (SNC), incluidas las citoquinas proinflamatorias, que desempeñan un papel crítico en la activación microglial5-9. Además, se considera que las citoquinas participan en el proceso de migración de monocitos periféricos/macrófagos y otros leucocitos al SNC de pacientes con ELA5,10-13.
La proteína quimiotáctica de monocitos1 (MCP-1) y la proteína inflamatoria macrofágica1-β (MIP-1β) pertenecen a la subfamilia CC de las quimiocinas y actualmente se conoce su participación en otras enfermedades neurodegenerativas14-16. Se ha descrito el aumento de la expresión de MCP-1 en modelos murinos de ELA y en médula espinal de sujetos con ELA12,16. Sin embargo, según nuestro conocimiento, no existe reporte previo alguno que describa la expresión de MIP-1β en sujetos con esta entidad clínica. Además, en la actualidad no se ha definido si los cambios en estas citoquinas tienen un efecto protector o perjudicial en la ELA5.
En el presente estudio, comparamos los niveles de MCP-1 y MIP-1β en el líquido cefalorraquídeo (LCR) de pacientes con ELA y sujetos controles y se determinó su relación con la gravedad clínica y la duración de la enfermedad.
Sujetos y métodosSujetosSe incluyeron 77 pacientes con ELA (edad media: 50,18±10,85años) y 13 controles (edad media: 39,15±11,32años) atendidos en el Servicio de Neurología del Hospital Zambrano-Hellion del Tecnológico de Monterrey y en el Servicio de Neurología del Hospital Universitario de la Universidad Autónoma de Nuevo León (UANL). Los sujetos del grupo de control se incluyeron después de la realización de estudios para la evaluación de pacientes con cefalea que acudieron a urgencias de ambas instituciones. Este grupo de pacientes contaban con LCR y resonancia magnética de cerebro (RMN) sin alteraciones y se confirmó su diagnóstico definitivo de cefalea tensional.
Un neurólogo certificado evaluó a los pacientes con ELA y el diagnóstico se estableció de acuerdo con los criterios clínicos y neurofisiológicos de El Escorial17. En el momento de la inclusión se obtuvieron los siguientes datos clínicos adicionales: el intervalo de inicio clínico al diagnóstico (ICD), el intervalo de diagnóstico a inclusión en el estudio (IDI) y la escala funcional para ELA (ALSFRS-R, por sus siglas en inglés)18. Este estudio fue aprobado por el Comité de Ética e Investigación de la Escuela Nacional de Medicina del Tecnológico de Monterrey y por el Comité de Investigación de la Facultad de Medicina de la UANL.
Preparación de líquido cefalorraquídeo y análisis de quimiocinasSe obtuvieron muestras de LCR de pacientes con ELA y controles al firmar la carta de consentimiento informado por escrito. Las muestras se almacenaron a –70°C hasta que se analizaron. Los niveles de MCP-1 y MIP-1β se cuantificaron usando un kit comercialmente disponible (Bio-PlexProTM, Bio-Rad Laboratories, Inc., Hercules, CA, EE.UU.) siguiendo las instrucciones del fabricante. En breve, 50μl de muestra se incuban con 50μl de microesferas magnéticas cubiertas con anticuerpos que reaccionan específicamente con cada citoquina. La discriminación de cada citoquina en una suspensión determinada se realizó por medio del análisis espectral por fluorescencia con un citómetro de flujo con láser. Después de una serie de lavados, se añadió un anticuerpo de detección para crear un complejo «sándwich» a cada muestra y posteriormente se agregó conjugado de estreptavidina-ficoeritrina. Finalmente, se agregó una solución buffer a cada pozo de la placa para detener la reacción; los datos se adquirieron y analizaron en un sistema de lectura Bio-Plex 200. El límite de detección para cada citoquina fue de 1pg/ml.
Análisis estadísticoLas variables se describieron en términos de media±desviación estándar y medianas (rango intercuartil) para datos de distribuciones normales y no normales, respectivamente. Se realizó una prueba no paramétrica U de Mann-Whitney para comparar los niveles de MCP-1 y MIP-1β en LCR de pacientes con ELA y sujetos controles. Los pacientes fueron divididos en dos subgrupos según el IDI: pacientes con menos de 12 meses de evolución (ELA<12meses) y aquellos con IDI de más de 12 meses evolución (ELA>12meses). Se realizó una comparación adicional entre los niveles de quimiocinas y la condición clínica de los pacientes: puntaje <30puntos en la escala funcional de ELA (ALSFRS-R) contra aquellos pacientes con puntaje ≥30puntos. Los efectos de la duración y la gravedad de la enfermedad en relación con los niveles de MIP-1β y MCP-1 se analizaron mediante la prueba U de Mann-Whitney. Las correlaciones bivariadas simples se evaluaron con la prueba de Spearman. Todos los análisis estadísticos se realizaron con el programa estadístico SPSS 20.0.
ResultadosMuestraDe los 77 pacientes incluidos, 48 (62,3%) eran varones. Veinte pacientes presentaron ELA de inicio bulbar, 53 tuvieron inicio espinal y 4 tuvieron un inicio bulbospinal. La mediana del IDI fue de 11meses (rango intercuartil de 6 a 19) y la mediana del ICD fue de 10 meses (rango intercuartil de 7 a 18 meses).
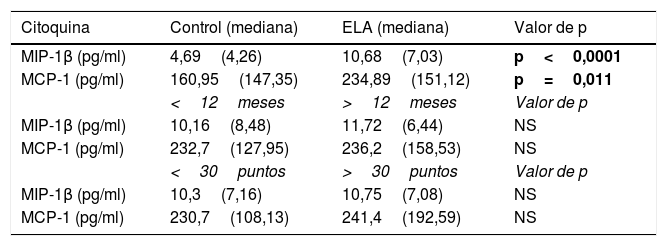
Concentración de quimiocinas en líquido cefalorraquídeoLa mediana de MCP-1 en LCR fue de 234,89(151,12)pg/ml en los pacientes con ELA y de 160,95(147,35)pg/ml en los controles (p=0,011). La mediana de MIP-1β fue de 10,68(7,03)pg/ml en los pacientes con ELA y de 4,69(4,26)pg/ml en los controles (p<0,0001) (tabla 1). No se encontraron diferencias en cuanto al sexo en las concentraciones de MCP-1 o MIP-1β.
Niveles de citoquinas del LCR en la ELA que muestran los subgrupos de ELA por duración de la enfermedad y gravedad clínica
| Citoquina | Control (mediana) | ELA (mediana) | Valor de p |
|---|---|---|---|
| MIP-1β (pg/ml) | 4,69(4,26) | 10,68(7,03) | p<0,0001 |
| MCP-1 (pg/ml) | 160,95(147,35) | 234,89(151,12) | p=0,011 |
| <12meses | >12meses | Valor de p | |
| MIP-1β (pg/ml) | 10,16(8,48) | 11,72(6,44) | NS |
| MCP-1 (pg/ml) | 232,7(127,95) | 236,2(158,53) | NS |
| <30puntos | >30puntos | Valor de p | |
| MIP-1β (pg/ml) | 10,3(7,16) | 10,75(7,08) | NS |
| MCP-1 (pg/ml) | 230,7(108,13) | 241,4(192,59) | NS |
Los valores expresados entre paréntesis indican rango intercuartil.
En negrita, los valores estadísticamente significativos.
Los pacientes con ELA >12meses de evolución tuvieron una mediana de MIP-1β de 11,72(6,44)pg/ml y aquellos con ELA <12meses, una mediana de MIP-1β de 10,16(8,48)pg/ml (p=0,4). Los pacientes con ELA >12meses tuvieron una mediana de MCP-1 de 236,2(158,53)pg/ml y aquellos con ELA <12meses, una mediana de 232,7(127,95)pg/ml (p=0,7).
Los pacientes con mejor condición clínica (puntuación >30puntos en la escala funcional ALSFRS-R) tuvieron una mediana de MIP-1β de 10,75(7,08)pg/ml y de MCP-1 de 241,4(192,59)pg/ml (p=0,4). Aquellos con mayor deterioro clínico (puntuación <30 en la escala funcional) tuvieron una mediana de MIP-1β de 10,3(7,16)pg/ml y de MCP-1 de 230,7(108,13)pg/ml. Los casos con mejor condición clínica tuvieron un incremento en MCP-1 y en MIP-1β; pero sin mostrar significación estadística (p=0,5).
CorrelacionesSe encontró una correlación positiva y significativa entre los niveles de MIP-1β y MCP-1 en toda la muestra (r=0,365, p=0,001), así como en el grupo de pacientes con ELA (r=0,309, p=0,006). Ninguna citoquina se correlacionó con la edad o la puntuación de la escala funcional (datos no presentados).
DiscusiónLa ELA ha sido tradicionalmente considerada un trastorno neurodegenerativo1,3. Sin embargo, los cambios neuroinflamatorios con activación de células microgliales se han descrito en la corteza motora y la médula espinal de sujetos con esta enfermedad19. El proceso subyacente de activación celular y las moléculas de señalización que median las interacciones celulares en la ELA, en la actualidad, no están bien definidos7. Las citoquinas de la clase CC (MCP-1 y MIP-1β) se han descrito como mediadoras de inflamación crónica en otras enfermedades neurodegenerativas15,20,21. De manera similar, estudios recientes describen la infiltración de monocitos periféricos/macrófagos en el SNC de pacientes con ELA10,11. Estos monocitos invasores exhiben una expresión prominente de MCP-1 y otras citoquinas relacionadas con la quimiotaxis12. La elevación de MCP-1 durante el curso de la patogénesis de ELA se ha descrito previamente16,22,23; sin embargo, los mecanismos que desencadenan este incremento se desconocen en la actualidad16.
En el presente estudio, hemos identificado un aumento significativo de MCP-1 y MIP-1β en pacientes con ELA definida. Estas citoquinas también se correlacionaron significativamente. Para nuestro conocimiento, este es el primer estudio que sugiere que MIP-1β podría, también, estar participando en la patogénesis ELA.
Se cree que la microglía que reside en el SNC es la principal moduladora de la respuesta inmunológica alterada en la ELA, y la participación de monocitos periféricos es controversial24. Nuestro hallazgo de mayores niveles de MCP-1 y MIP-1β en el LCR sugiere que las células dendríticas y los macrófagos periféricos pudieran participar en la fisiopatología de la ELA16. La falta de información acerca de una correlación con niveles séricos de estas citoquinas no nos permite determinar si su origen es central o periférico (por alteración de la barrera hematoencefálica). Ambas células inmunes pueden modificar la función de las células-T y controlar la inmunidad innata y adaptativa. Sin embargo, no se sabe si participan como efectores del daño o se encuentran en un papel protector.
En nuestra cohorte, los casos de ELA con mayor duración de la enfermedad tuvieron un ligero aumento en MIP-1β y una disminución en MCP-1, pero estas diferencias no alcanzaron significación estadística. Nuestros resultados no asocian los niveles de estas citoquinas con la gravedad de la enfermedad. Sin embargo, en la ELA, no está claro el momento en que inicia la expresión de citoquinas y si estas respuestas tienen efecto protector o perjudicial16.
La ELA es una entidad clínica bastante heterogénea4. La amplia variación en la expresión clínica, duración y severidad de la enfermedad determinada por la escala funcional de ELA (ALSFRS-R) pueden explicar que las diferencias observadas en MCP-1 y MIP-1β fueran no significativas en nuestra cohorte. La correlación de estas citoquinas con la supervivencia y la progresión clínica serían de mayor utilidad para definir la participación del proceso inflamatorio mediado por citoquinas en la ELA. La comprensión del ambiente de las citoquinas en el curso de la ELA y su participación en la progresión clínica son un aspecto crucial para el desarrollo de biomarcadores y de estrategias terapéuticas eficaces. Limitantes en nuestro estudio que deberán analizarse en futuros estudios incluyen: el tamaño de la muestra, la heterogeneidad de la cohorte, el número de sujetos controles y la evaluación de MCP-1 y MIP-1β en sangre y LCR. La progresión mediante escalas más objetivas además de la sobrevida son factores a considerar. Sin embargo, nuestros resultados sugieren, por primera vez, que las concentraciones de MIP-1β pueden estar elevadas en pacientes con ELA y participar en su patogénesis.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.
Agradecemos al Dr. Sergio Lozano-Rodríguez, por su ayuda en la revisión del manuscrito.