La infección por el coronavirus SARS-CoV-2 originada en diciembre de 2019 en la región china de Wuhan ha adquirido proporciones pandémicas. A día de hoy ha ocasionado más de 1,7 millones de contagios y más de 100.000 muertes en todo el mundo. La investigación científica actual se centra en el mejor conocimiento de la infección aguda y de sus estrategias terapéuticas. Dada la magnitud de la epidemia, planteamos una revisión especulativa sobre las posibles consecuencias en patología neurológica a medio/largo plazo, con especial atención a enfermedades neurodegenerativas y neuropsiquiátricas con base neuroinflamatoria, teniendo en cuenta la evidencia directa de afectación neurológica a causa de la infección aguda.
DesarrolloRevisamos de forma sistemática lo conocido sobre los mecanismos patogénicos de la infección por SARS-CoV-2, la repercusión de la tormenta de citoquinas sobre el sistema nervioso central y su persistencia en el tiempo y las consecuencias que la neuroinflamación puede tener sobre el sistema nervioso central.
ConclusionesEl SARS-CoV-2 es un virus neuroinvasivo capaz de provocar una tormenta de citoquinas que podría convertirse en persistente en población seleccionada. Aunque nuestra hipótesis tiene alto componente especulativo, la repercusión que esta situación puede tener en la puesta en marcha y progresión de enfermedades neurodegenerativas y neuropsiquiátricas con base neuroinflamatoria debe ser considerada como posible germen de una pandemia demorada que podría tener un gran impacto en salud pública a medio o largo plazo. Se hace necesario un estrecho seguimiento de la salud cognitiva y neuropsiquiátrica de los pacientes supervivientes a infección COVID-19.
SARS-CoV-2 was first detected in December 2019 in the Chinese city of Wuhan and has since spread across the world. At present, the virus has infected over 1.7 million people and caused over 100 000 deaths worldwide. Research is currently focused on understanding the acute infection and developing effective treatment strategies. In view of the magnitude of the epidemic, we conducted a speculative review of possible medium- and long-term neurological consequences of SARS-CoV-2 infection, with particular emphasis on neurodegenerative and neuropsychiatric diseases of neuroinflammatory origin, based on the available evidence on neurological symptoms of acute SARS-CoV-2 infection.
DevelopmentWe systematically reviewed the available evidence about the pathogenic mechanisms of SARS-CoV-2 infection, the immediate and lasting effects of the cytokine storm on the central nervous system, and the consequences of neuroinflammation for the central nervous system.
ConclusionsSARS-CoV-2 is a neuroinvasive virus capable of triggering a cytokine storm, with persistent effects in specific populations. Although our hypothesis is highly speculative, the impact of SARS-CoV-2 infection on the onset and progression of neurodegenerative and neuropsychiatric diseases of neuroinflammatory origin should be regarded as the potential cause of a delayed pandemic that may have a major public health impact in the medium to long term. Cognitive and neuropsychological function should be closely monitored in COVID-19 survivors.
En el mes de diciembre de 2019, un nuevo virus perteneciente a la familia de los coronavirus irrumpió como agente patógeno en la región china de Wuhan provocando un síndrome respiratorio agudo severo (SARS) de alta letalidad1–3. La Organización Mundial de la Salud (OMS) le dio el nombre de SARS-CoV-2 dada su similitud desde el punto de vista virológico y también en su expresión clínica con el SARS-CoV-1 (229E [HCoV-229E]), responsable de un síndrome de similares características también originado en los mercados de animales de China en el año 2003.
Dada la expansión vertiginosa que se produjo en las semanas siguientes a su primera descripción por muchos países del mundo, la propia OMS declaró a la enfermedad producida por el SARS-CoV-2 como pandemia de alcance mundial el día 11 de marzo de 2020. En el momento de redactar este artículo, ha sido capaz de infectar a más de 1,7 millones de personas en más de 200 países del mundo y acabar con la vida de 100.000 personas, aunque con toda probabilidad ambas cifras están subestimadas4. El nombre oficial de esta enfermedad según la OMS es enfermedad por coronavirus 2019 (COVID-19).
En general, los coronavirus que afectan a los seres humanos, y cuyo origen y posible reservorio son animales salvajes incluyendo los murciélagos, pueden ser clasificados en aquellos con baja capacidad patogénica, que incluyen los HCoV-229E, HCoV-OC43, HCoV-NL63, y HCoV-HKU (coronavirus α) y aquellos otros altamente patogénicos, denominados bajo la categoría CoV, tales como el SARS-CoV (responsable del brote de SARS de 2003), el actual (SARS-CoV-2), junto con el que produjo el Middle East Respiratory Síndrome (MERS-CoV) en el año 2012. A estos se los denomina también coronavirus β.
Los coronavirus β se han convertido en un verdadero problema de salud pública por su alta patogenicidad e infectividad. Durante la epidemia de 2002-2003 el SARS-CoV infectó aproximadamente a 8400 personas, con una tasa de mortalidad del 9,6%5. El MERS-CoV, por su parte, infectó a un total de 1936 individuos, dejando un resultado mortal de 690 muertos, lo que equivale a una tasa de mortalidad de aproximadamente el 36%6.
En el caso del SARS-CoV-2, aunque hay formas prácticamente asintomáticas, también es cierto que, en grupos de riesgo determinados, puede progresar a síndromes severos con alta letalidad cuyas principales manifestaciones clínicas se producen a nivel respiratorio, con una neumonía atípica bilateral con importante afectación de la función respiratoria por daño alveolar difuso y que constituye su marca patogénica. Pero el SARS-CoV-2 también puede infectar otros órganos y tipos celulares durante el curso de la enfermedad, incluyendo las células mucosas del intestino, las células tubulares del riñón, células del sistema linfoide y retículo endotelial y también las células del sistema nervioso7.
Precisamente, esa capacidad de afectar al sistema nervioso será objeto de esta revisión, centrándonos en la posibilidad de generar afectación en el medio plazo como resultado de la invasión neurológica y su posible incidencia sobre procesos neurodegenerativos.
Fases de la expresión clínica de las infecciones por CoV
La expresión clínica de la infección por SARS-CoV (que ha servido de modelo para el SARS-CoV-2 dado que usa mecanismos de infectividad parecidos, incluyendo la enzima convertidora de la angiotensina II [ECA-II] como receptor de internalización), consta de tres fases. La fase inicial se caracteriza por gran replicación viral, con fiebre, tos y quebrantamiento general que se prolonga durante varios días. La segunda fase se asocia con fiebre alta, hipoxemia y progresión de la sintomatología respiratoria hasta una neumonía bilateral a pesar de que se aprecia analíticamente ya un declive en la carga viral al final de esta fase8. Durante la tercera fase, aproximadamente un 20% de los pacientes progresan a un SARS, que con frecuencia tiene desenlace fatal9,10. Como durante esta fase hay una progresiva caída de carga viral, la patogenia de esta crisis se cree que es debida a una exacerbada respuesta inflamatoria por parte del huésped a la que se ha denominado «tormenta de citoquinas», y que al generar daño alveolar difuso e hipoxemia grave, facilita la aparición de sepsis secundarias letales.
Un hecho esencial para comprender la respuesta inflamatoria a las infecciones CoV es comprender el punto de partida. Dado que se trata de agentes patógenos de muy reciente aparición, existe una ausencia completa de memoria inmunitaria en la comunidad. Nunca antes el sistema inmunitario del ser humano se ha enfrentado a un coronavirus de este tipo. En situaciones como esta, el sistema inmunológico recurre a la denominada inmunidad innata como primera línea de defensa. Precisamente es la respuesta inmunológica excesiva y desregulada de esta primera línea defensiva la que puede ser responsable de una severa inmunopatología11,12.
En el caso del SARS-CoV, la invasión de células hematopoyéticas, tales como células dendríticas, monocitos o macrófagos induce una expresión de bajo nivel de citoquinas antivirales como el IFN-αβ y una sobreexpresión de citoquinas proinflamatorias como el factor de necrosis tumoral (TNF) y la interleukina-6 (IL6) y también de quimioquinas inflamatorias como CCL3, CCL5, CCL2, y CXCL1013. Por el contrario, los pacientes con SARS-CoV con enfermedad severa muestran muy bajos niveles de citoquinas antiinflamatorias tales como la IL1014 y elevados niveles de IFN-α y IFN-γ así como de genes estimuladores del IFN (CXCL10 y CCL-2) en comparación con pacientes con enfermedad leve sugiriendo un posible papel del IFN en la inmunopatogénesis del SARS en humanos14.
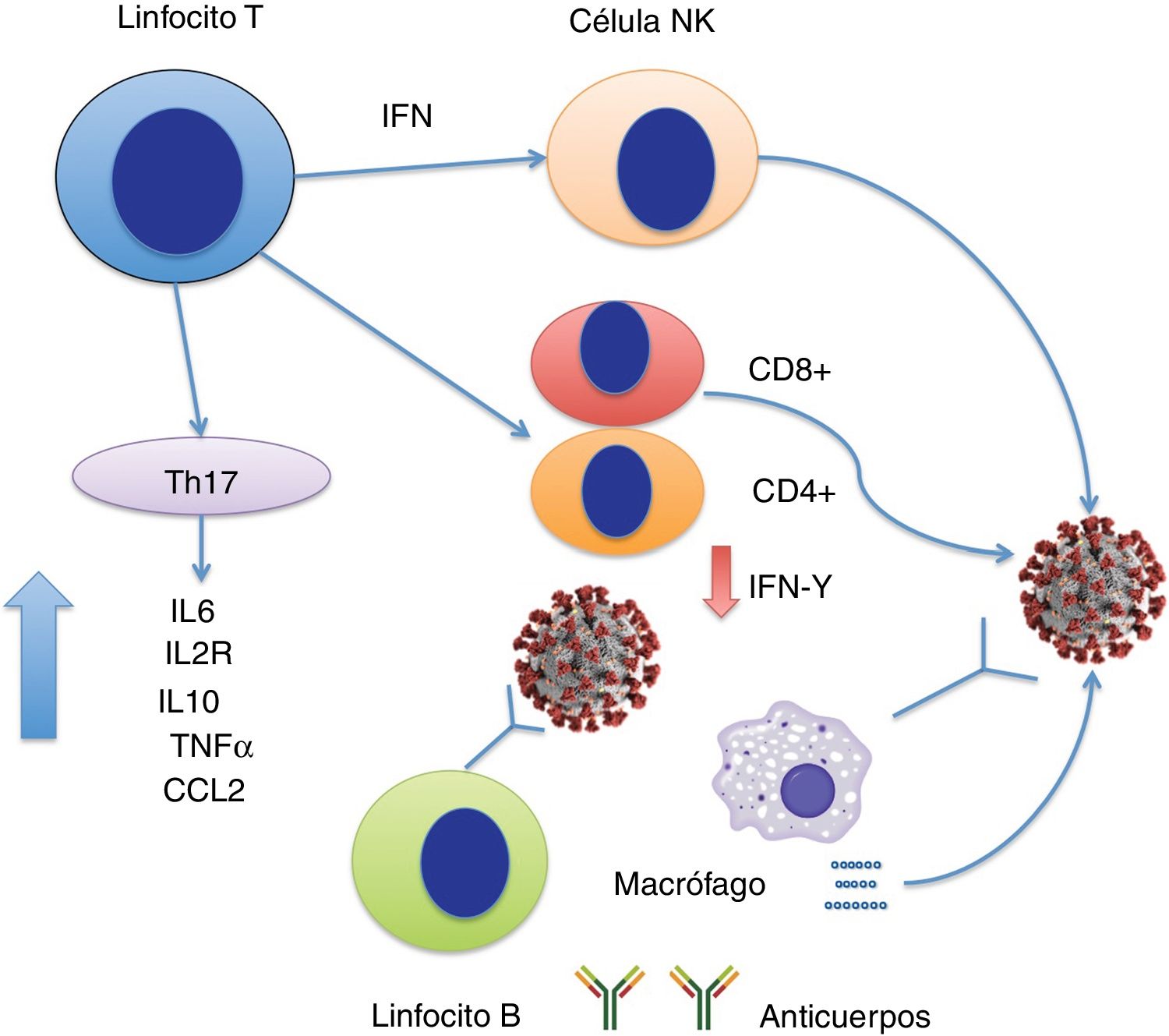
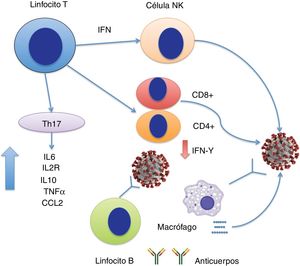
En el momento de redactar este artículo, existen pocas publicaciones que aborden la dinámica de la tormenta de citoquinas en la infección por SARS-CoV-2. Muy recientemente, Chen et al. presentaron un estudio en el que demuestran que la infección por SARS-CoV-2 severa se asocia con linfopenia a expensas de caídas de linfocitos T CD4+ y CD8+ pero no de linfocitos B, hiperproducción de citoquinas IL6, IL2R (receptor soluble de la IL2), IL10, TNFα y CCL2 y descenso en la expresión de IFN-γ en linfocitos T CD4+15. Los niveles de IL6, IL2R, IL10 y TNFα suben discretamente o permanecen en rango normal en casos moderados pero muy elevados en casos severos (fig. 1). Este estudio parece apuntar que la tormenta de citoquinas se asocia con enfermedad COVID-19 severa de manera similar a como lo hacía en el síndrome SARS-CoV.
Persistencia de la respuesta neuroinflamatoria
Es relevante la pregunta de si la reacción neuroinflamatoria ocurre de manera puntual o en determinadas circunstancias puede tener un carácter persistente tras su puesta en marcha. En este sentido se sabe que las respuestas inmunes desreguladas tras infecciones pueden persistir en lo que se ha denominado síndrome de inflamación-inmunosupresión y catabolismo persistente. Se ha propuesto que esta situación inmunológica específica es iniciada por una tormenta de citoquinas durante fases agudas de cuadros infecciosos de forma similar a como ocurre en la enfermedad COVID-19 y es el resultado de la liberación continua de unas moléculas a las que se ha llamado «alarminas endógenas» o «patrones moleculares asociados al peligro» por parte de los órganos dañados que provoca una situación de inflamación crónica sistémica y un cambio en la producción de células madre de médula ósea hacia células mieloides, lo que contribuye a la anemia crónica y la linfopenia16.
No existen, por razones obvias, datos concluyentes acerca de la posible aparición de una situación de persistencia de inflamación en pacientes supervivientes a enfermedad COVID-19, pero dado que este síndrome se relaciona con la gravedad del cuadro agudo, consideramos que sería una hipótesis plausible.
Tormenta de citoquinas y sistema nervioso
Es conocido el efecto devastador que la tormenta de citoquinas produce a nivel del sistema respiratorio, fuente mayor de la letalidad del síndrome. Sin embargo, una pregunta relevante como neurólogos es si esta tormenta molecular que ocurre en la tercera fase de la enfermedad puede provocar afectación aguda o subaguda en el sistema nervioso central (SNC). Recientemente se ha descrito el caso de una mujer adulta con diagnostico de COVID-19 que tras unos días de fiebre, tos y estado mental alterado ha derivado a una encefalopatía hemorrágica necrosante aguda, una patología poco frecuente que se relaciona con tormenta de citoquinas intracraneal y rotura de barrera hematoencefálica aunque sin invasión viral directa17.
Recurriendo a evidencias previas, se sabe que la neuroinflamación crónica asociada a elevados niveles de citoquinas/quimioquinas se han asociado con la fisiopatogenia de algunas enfermedades neurodegenerativas (END) tales como la esclerosis múltiple, enfermedad de Parkinson, enfermedad de Alzheimer, enfermedad de Huntington o la esclerosis lateral amiotrófica18. En muchas ocasiones, los mecanismos inmunológicos detonantes de la tormenta de citoquinas, típica de los síndromes SARS severos, juegan un papel relevante en el inicio de numerosas END, así como en su progresión.
Así, en el caso de la enfermedad de Alzheimer, se ha reportado que en presencia de citoquinas proinflamatorias (IL1 o IL6 fundamentalmente), la microglía pierde capacidad para fagocitar la proteína Aβ, responsable de los depósitos patogénicos de esta proteinopatía19. Esta observación apoya la idea de que la persistencia y acumulación de placas amiloides in vivo puede ser un resultado directo de la neuroinflamación. Además, la cantidad de microglía con IL1α es mayor en las capas corticales afectadas por depósito de placas amiloides en pacientes con enfermedad de Alzheimer20.
Una serie de estudios han confirmado la presencia de mediadores inflamatorios (incluyendo TNF, IL-1β, IL-6, e IFNγ) en el LCR de pacientes con enfermedad de Parkinson así como en el cerebro de pacientes en estudios posmortem21,22. Además, un interesante estudio muestra cómo los niveles de TNF se mantenían elevados en modelos de primate tratados con MPTP un año después de la administración de la toxina, sugiriendo el papel de este biomarcador en la muestra neuronal asociada con el parkinsonismo de origen tóxico23.
En el caso de la esclerosis múltiple, se ha descrito la existencia de un incremento de la expresión de citoquinas proinflamatorias (IFNγ, TNF, IL2, e IL22) y de moléculas relacionadas con la actividad mantenida de linfocitos B y con la neogénesis linfoide (CXCL13, CXCL10, LTα, IL6, e IL10). Estos factores han sido detectados en las meninges y en el LCR de casos de esclerosis múltiple posmortem con altos niveles de inflamación meníngea. Similar patrón proinflamatorio incluyendo niveles de CXCL13, TNF, IFNγ, CXCL12, IL6, IL8, e IL10, se ha detectado en el LCR de pacientes de EM con alto nivel de daño en sustancia gris en el momento del diagnóstico. De alguna manera estos datos apoyarían el papel de la neuroinflamación en la fase de neurodegeneración de esta enfermedad24.
Un caso singular es el de la patología psiquiátrica, para la que también se ha demostrado que la neuroinflamación constituye un factor patogénico de primer nivel. Los procesos neuroinflamatorios son capaces de producir cambios en el metabolismo de neurotransmisores, provocar desregulación del eje hipotálamo-hipofisario-adrenal, activar la microglía, afectar a la neuroplasticidad y provocar cambios estructurales y funcionales en el cerebro, afectando a cognición y conducta. Se ha postulado que las citoquinas proinflamatorias son la base de la disrupción de todos estos sistemas, estando en la base patogénica de trastornos afectivos, pero también de procesos como la esquizofrenia, el trastorno bipolar y el consumo de drogas, en especial de alcohol25.
La idea de que los procesos de neuroinflamación juegan un papel importante en la fisiopatología de cuadros neurológicos de instauración aguda cada vez es más aceptada. Por ejemplo, en el caso de las crisis y/o síndromes epilépticos es ampliamente reconocida, habiéndose descrito neuroinflamación secundaria a activación de la microglía y los astrocitos mediante la liberación de marcadores inflamatorios como IL-1β, IL-6, y TNF en regiones como el hipocampo o el neocórtex26.
Por último, es conocida la base neuroinflamatoria de otros muchos procesos neurológicos, entre los que podemos incluir prácticamente toda la patología neurológica, desde cuadros encefalíticos inmunomediados o postinfecciosos, hasta la patología cerebrovascular y, por supuesto enfermedades del sistema nervioso periférico. En este sentido, no deja de ser llamativa la variable respuesta de acuerdo con la edad que presenta la infección por SARS-CoV-2 en la población, afectando en mayor severidad a los individuos de edad avanzada. La menor eficiencia y capacidad de respuesta de la inmunidad innata en edad avanzada es un hecho que aporta vulnerabilidad frente a una infección27. Son diversos los estudios que sugieren que el aumento del entorno proinflamatorio contribuye al desarrollo de enfermedades asociadas a la edad, demostrándose una relación entre la inmunosenescencia y su contribución a la neuroinflamación y el consiguiente desarrollo de la patología neurodegenerativa, como, por ejemplo, ocurre en la enfermedad de Alzheimer donde la disfunción microglial conlleva a una acumulación de Aβ conducente a pérdida de respuesta inmune periférica28.
Todo ello nos lleva a la conclusión de que el sistema nervioso, tanto a nivel central como periférico, puede considerarse como una diana preferente de los mecanismos neuroinflamatorios, con especial interés en la influencia que esta infección pudiera tener sobre la puesta en marcha o la progresión de enfermedades neurodegenerativas.
Otro aspecto completamente desconocido que habrá que vigilar es la posibilidad de que la infección aparentemente leve en niños y adolescentes pueda modificar en el largo plazo tanto las capacidades cognitivas como facilitar la aparición de cuadros psiquiátricos. La alteración del sistema inmunológico ocasionado por el virus podría dar lugar a modificaciones del pruning sináptico/celular durante la infancia y adolescencia, ocasionando problemas que solo se pondrán de manifiesto en la edad adulta.
Capacidad neuroinvasiva directa del SARS-CoV-2
Un tema de especial interés puede ser la posibilidad de que el SARS-COVID-19 tenga capacidad neuroinvasiva. Alguna evidencia se empieza a tener a este respecto.
El mecanismo molecular subyacente a invasión celular del SARS-CoV-2 se relaciona con su habilidad para unirse selectivamente a los receptores de la enzima convertidora de la angiotensina 2 (ECA-2) de forma similar a como es conocido en el caso del SARS-CoV. Estos receptores presentan una alta expresión en las células epiteliales del sistema respiratorio e intestinal29–32, pero también en el SNC, tanto en células gliales, como en neuronas, lo que hace del SNC una diana potencial del SARS-CoV-233. Además, estudios previos han demostrado la capacidad de este virus para causar muerte neuronal en ratones a través de la invasión del SNC por la lámina cribiforme del etmoides y la posterior invasión del neuroepitelio olfatorio34.
También existe la posibilidad de invasión del SNC por vía hematógena. La presencia del COVID-19 en la circulación general está comprobada. Siendo esto cierto, a nivel cerebral, el movimiento lento de la sangre dentro de la microcirculación podría ser uno de los factores que pueden facilitar la interacción del virus con ACE2 expresada en el endotelio capilar30. Interesantemente, este mecanismo puede estar involucrado con el daño endotelial y subsecuente tendencia al sangrado cerebral que se ha observado en pacientes durante las fases agudas de la enfermedad COVID-19.
Además, algunas evidencias preliminares sugieren que la capacidad neuroinvasiva del virus podría tener implicaciones pronósticas incluso en fase aguda. En este sentido, se especula con la posibilidad de que la causa de la muerte en casos de afectación respiratoria severa está mediada, al menos en parte, por la existencia de un síndrome de hipoventilación central secundario a la invasión del SNC35.
Una revisión retrospectiva sobre pacientes asistidos en Wuhan analiza la sintomatología neurológica de 214 pacientes consecutivos, describiendo la existencia de un 36,4% de pacientes con síntomas neurológicos, fundamentalmente en pacientes con afectación severa, siendo los síntomas más reportados, el deterioro de conciencia, los ictus en fase aguda (tanto isquémico como hemorrágico) y el daño muscular esquelético36.
Con posterioridad, se han descrito algunos casos en los que hubo evidencia de invasión del virus en el SNC. Así el equipo del Beijing Ditan Hospital confirmó la presencia de SARS-CoV-2 en el LCR de pacientes con enfermedad COVID-19 a través de secuenciación genómica en un paciente con una encefalitis clínica37.
Nada se sabe de la posible persistencia del SARS-CoV-2 en el SNC a medio o largo plazo. Pero sí se ha descrito esta propiedad en otros virus, incluso dentro de su misma categoría. Así, el HCoV-OC43RNA, un coronavirus humano, mostró que podía ser detectado en el SNC de un modelo murino de encefalitis por coronavirus durante más de un año después de la inoculación38.
La pregunta de por qué esto es posible en el sistema nervioso es objeto de debate. Así, se propone que las estrategias citolíticas e inflamatorias que son efectivas en el control de las infecciones virales en otros órganos, no pueden ser empleadas por nuestro sistema inmune en el cerebro por las devastadoras consecuencias que ocasionarían. Tal vez por esta razón, el sistema inmunológico arbitra otro tipo de respuestas a nivel del SNC que favorecen que algunos virus permanezcan acantonados en el mismo y puedan reactivarse al cabo de un tiempo en situaciones favorables para el virus39.
No es descartable que el SARS-CoV-2 pueda pertenecer a este grupo de virus. De ser así, no sería descartable la aparición de manifestaciones neurológicas relacionadas con la reactivación del virus a medio o largo plazo que podrían suponer la reactivación de los procesos neuroinflamatorios y de toda la cascada descrita fundamentalmente en pacientes con END.
Actuación indirecta del SARS-CoV-2 sobre el SNC
La infección por SARS-CoV-2 sobre otros órganos podría, de forma indirecta, tener incidencia sobre el SNC y más concretamente sobre el desarrollo de END. Así, en los últimos años se ha objetivado una estrecha relación entre la microbiota intestinal y la neuroinflamación con enfermedades del SNC. Sabemos que el SARS-CoV-2 invade las células de la mucosa intestinal provocando fenómenos inflamatorios y disbiosis intestinal, pudiendo alterar la microbiota tanto a corto como a largo plazo que podrían contribuir a la neuroinflamación y por ende faciliten la neurodegeneración y la aparición de END40.
ConclusionesLa irrupción de la pandemia COVID-19ha supuesto un problema de salud pública de dimensiones épicas no conocido en la historia reciente de la humanidad, no solo por la extensión de la infección entre la población o por su letalidad aguda asociada, sino también por los interrogantes que despierta sobre su posible evolución a medio o largo plazo.
En este sentido, existen una serie de indicios que nos hacen pensar que el sistema nervioso no va a ser precisamente ajeno a esta infección y puede que adquiera protagonismo en el futuro.
Una reciente revisión publicada en castellano, ya insiste en este problema incidiendo fundamentalmente en patología directa derivada de la infección por SARS-CoV-241. Nuestro trabajo puede ser considerado complementario a este, centrándose en aspectos relacionados con la incidencia sobre patologías neurológicas con base patogénica neuroinflamatoria.
El SARS-CoV-2 provoca una tormenta de citoquinas cuyos efectos sobre el SNC pueden tener consecuencias imprevisibles de forma aguda, pero también de manera demorada en el tiempo. Así, es conocido que múltiples enfermedades neurológicas incluyen entre sus mecanismos patogénicos una base neuroinflamatoria que involucra precisamente a los factores que son estimulados en la tercera fase de la enfermedad aguda COVID-19. De especial relevancia es la repercusión que este movimiento molecular pudiera tener en la puesta en marcha y progresión de determinadas END como la enfermedad de Alzheimer, la enfermedad de Parkinson o la esclerosis múltiple en su fase neurodegenerativa y también sobre enfermedades psiquiátricas en las que los mecanismos neuroinflamatorios han adquirido relevancia en los últimos tiempos, en especial los trastornos afectivos. Será especialmente importante el seguimiento desde el punto de vista cognitivo y psiquiátrico de los pacientes supervivientes a una enfermedad COVID-19 severa, máxime teniendo en cuenta que se sabe que la situación de desregulación neuroinflamatoria puede ser persistente en casos de enfermedad severa siguiendo el modelo denominado síndrome de inflamación-inmunosupresión y catabolismo persistente.
Además, el SARS-CoV-2 tiene capacidad neuroinvasiva directa. Gracias a la experiencia con el SARS-CoV, se conocen aceptablemente los mecanismos de invasión del SNC que puede usar el virus. Es especialmente interesante desde el punto de vista evolutivo conocer cómo se va a comportar el virus en el SNC una vez se produjo la invasión. Si el virus es capaz de mantenerse latente en el SNC de forma similar a como lo hacen otros coronavirus, no sería descartable que permaneciera y se potenciara también la cascada inflamatoria descrita, con su posible influencia sobre el inicio y desarrollo de END.
Somos conscientes de que este trabajo tiene un fuerte componente especulativo, pero si las hipótesis esbozadas fueran realidad, la magnitud de la pandemia neurológica a medio plazo podría ser muy importante, pues induciría la puesta en marcha o la aceleración de los mecanismos básicos de las END en pacientes predispuestos desde el punto de vista genético o ambiental dentro del amplio grupo de población que sea finalmente infectado, además de los efectos directos que sobre el sistema nervioso podría tener la respuesta neuroinflamatoria y la invasión directa del virus.
La Neurología no puede interpretar la enfermedad COVID-19 como una pandemia ajena a la especialidad. Al contrario, es previsible que sus repercusiones le involucren de manera directa a medio plazo, tanto desde el punto de vista asistencial como investigador.
Neuro-RECA ha diseñado un proyecto de investigación colaborativo multicéntrico que pretende seguir prospectivamente a los pacientes supervivientes a una infección severa por COVID-19 desde el punto de vista cognitivo, psiquiátrico, virológico, neurofisiológico y de calidad de vida en el año posterior a su alta hospitalaria que pretende desentrañar buena parte de los interrogantes vertidos en este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Neuro-RECA es una Red de investigación clínica y traslacional en Neurología financiada por la Línea de Proyectos de Investigación, Desarrollo e Innovación Biomédica y en Ciencias de la Salud (modalidad proyectos de investigación clínica en red) de la Secretaría General de Investigación, Desarrollo e Innovación en Salud de la Consejeria de Salud y Familias de la Junta de Andalucía (Expte RIC-0111-2019). Está integrada por más de 90 investigadores pertenecientes a 18 centros asistenciales y de investigación clínica en Neurología y grupos de investigación preclínica en Neurociencias en Andalucía. Cuenta con la colaboración del Centro de Biología Molecular y Medicina Regenerativa (CABIMER), de la Red Andaluza de Diseño y Traslación de Terapias Avanzadas y de las Sociedades científicas de Atención primaria SEMFyC y SEMERGEN.