La melanosis neurocutánea (MNC) es un síndrome congénito no hereditario infrecuente caracterizado por la presencia de nevos congénitos gigantes o múltiples nevos satélites y de tumores melanocíticos tanto benignos como malignos a nivel de las leptomenínges (tabla 1)1. Se cree que fisiopatológicamente corresponde a una facomatosis, probablemente secundaria a trastornos en el desarrollo de células melánicas derivadas de la cresta neural2. La edad de presentación más frecuente es los 2 años, siendo extremadamente infrecuente en adultos3. Se presenta un caso de MNC de inicio a los 19 años. El objetivo de nuestro trabajo es analizar el abordaje diagnóstico realizado y la conducta terapéutica tomada.
| 1. Presencia de nevo congénito gigante (> 20cm de diámetro en el adulto) o múltiples (3 o más) nevos congénitos asociados a melanosis meníngea o melanoma |
| 2. No debe haber evidencia de melanoma cutáneo excepto en aquellos pacientes en los que las lesiones meníngeas sean histológicamente benignas |
| 3. No debe haber evidencia de melanoma meníngeo excepto en aquellos pacientes en que las lesiones cutáneas son histológicamente benignas |
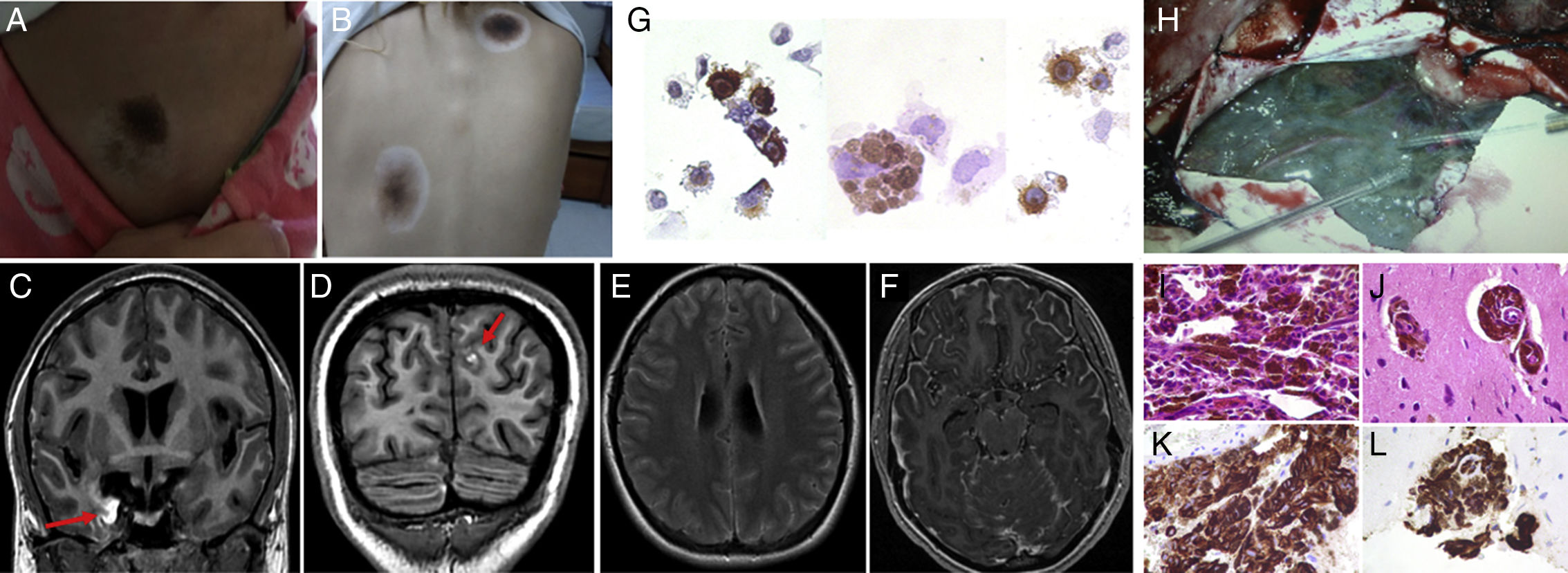
Mujer de 20 años de edad, con antecedentes de vitíligo y múltiples nevos congénitos, consultó por cefalea, vómitos, fotofobia, visión borrosa, diplopía y crisis parciales secundariamente generalizadas. Dieciocho meses antes había presentado crisis uncinadas, en seguimiento en otra institución sin diagnóstico ni tratamiento. Al examen físico de ingreso se constató edema de papila bilateral, paresia del VI par craneal izquierdo, hiperreflexia generalizada, Hoffman, clonus aquileano y Babinski bilateral, rigidez de nuca y signos de Brudzinski y Kernig positivos. Además, en la exploración de piel, se observó nevos acrales en cuatro miembros y 3 nevus de Sutton en flanco derecho y tronco (fig. 1 A y B). Debido al síndrome de hipertensión endocraneana asociado al síndrome meníngeo presentado, se realizó en primera instancia RM de cerebro a fin de descartar lesión estructural con riesgo de herniación encefálica; la misma evidenció engrosamiento leptomeníngeo encefálico difuso a predominio temporopolar derecho con zonas hiperintensas en T1 (fig. 1 C-F). Dado el compromiso meníngeo extenso y a pesar de la ausencia de fiebre, a fin de descartar etiologías infecciosas, inflamatorias y oncológicas, se realizó punción lumbar, que mostró un líquido cefalorraquídeo (LCR) turbio, con presión de apertura de 52cmH20, leucorraquia 14/mm3 (60% mononuclear), glucorraquia 95mg/dl (90mg/dl glucemia), proteinorraquia 1.415mg/dl y ácido láctico de 2,3mmol/l. El examen citológico del LCR evidenció células melánicas atípicas, HMB-45 positivas (fig. 1 G). Los análisis microbiológicos fueron negativos. Por dicho motivo, se realizó tomografía computada corporal total con doble contraste que no reveló compromiso ajeno al sistema nervioso central (SNC). Debido a los hallazgos en piel y SNC, con demostración de células melánicas en LCR, se interpretó como MNC. Para descartar transformación maligna a nivel del SNC y efectuar el análisis genético de las células melánicas que pudieran condicionar un tratamiento oncológico dirigido, se decidió efectuar biopsia meníngea a cielo abierto (fig. 1 H). La anatomía patológica meníngea evidenció infiltración melanocítica extensa de alto grado, Ki67 de 8% y mutación negativa para el gen BRAFv600E (fig. 1 I-L). Ante la ausencia de BRAFv600E, se inició tratamiento con temozolamida y medidas antiedema cerebral con dexametasona, con mala evolución falleciendo tras un mes de tratamiento, debido a complicación de estatus epiléptico. La sobrevida global desde el inicio de los síntomas fue de 20 meses.
A y B) Lesión névica rodeada de halo de despigmentación (nevus de Sutton). C-F): RM de cerebro: lesión hiperintensa en T1 (C-D) a nivel temporomesial derecho y frontal izquierdo (flechas rojas), con hiperintensidad subaracnoidea difusa en FLAIR (E) y realce leptomeníngeo con gadolinio (F). G) Citológico de LCR: células melánicas HMB-45 positivas. H) Biopsia meníngea a cielo abierto: leptomeninge negruzca, adherida al parénquima encefálico, sangrante al mínimo tacto. I-L) Anatomía patológica: células melánicas atípicas visualizada con hematoxilina-eosina (I-J) y HMB-45 positivas (K-L).
Las manifestaciones clínicas iniciales de la MNC más comunes son aquellas que se deben a la hipertensión endocraneana (HTE), probablemente secundaria a hidrocefalia no comunicante (por obstrucción acueductal) o comunicante (por alteración de la reabsorción de LCR), debido a la infiltración por parte de los melanocitos. Otras manifestaciones frecuentes son las crisis epilépticas1,4. El estudio del LCR muestra en general aumento de la presión de apertura, pleocitosis, hiperproteinorraquia marcada y glucorraquia variable, incluso hiperglucorraquia5,6. En el estudio citológico del LCR pueden observarse células melánicas HMB-45 positivas3,4, aunque en ocasiones puede ser negativo5,7. En RM de cerebro y/o columna se observa en general extenso infiltrado leptomeníngeo, que plantea el diagnóstico diferencial con diversas patologías: oncológicas (carcinomatosis meníngea secundaria a tumores sólidos, linfomatosis meníngea y tumores neuroectodérmicos primitivos), inflamatorias (sarcoidosis, lupus eritematoso sistémico, artritis reumatoidea, Sjögren, Vogt-Koyanagi-Harada) e infecciosas (tuberculosis, esquistosomiasis y micosis sistémicas)8. Sin embargo, el comportamiento paramagnético distintivo en RM que presenta la melanina, la cual se observa hiperintensa en T1, sugiere el diagnóstico de MNC valorándose en el contexto clínico4–9. La transformación maligna a melanoma cutáneo o a nivel del SNC ocurre en el 40-60% de los casos1,10,11. Desde el punto de vista clínico, en muchos casos resulta dificultoso diferenciar cuándo se produce dicha transformación; la presencia en RM de una masa nodular o engrosamiento en forma de placa, marcado realce con contraste, edema perilesional, crecimiento en controles sucesivos y zonas hemorrágicas, hacen sospechar la transformación a melanoma11, aunque ninguno de estos hallazgos es definitivo para comprobar la misma. Actualmente no existen tratamientos estandarizados; los mismos se basan en radioterapia, quimioterapia y derivación de LCR por hidrocefalia, con escaso beneficio, presentando una sobrevida menor a 3 años desde el inicio de los síntomas neurológicos1,3,4. A pesar de las mencionadas características en RM que puedan sugerir la transformación maligna a melanoma, algunas de las cuales presentaba nuestra paciente, la confirmación de dicha transformación mediante biopsia leptomeníngea es de crucial jerarquía, ya que de producirse la misma oscurece el pronóstico y modifica la conducta terapéutica a seguir1,10. Por otro lado, los avances a nivel molecular permiten tipificar con mayor precisión a los pacientes con transformación a melanoma, pudiendo identificar distintas mutaciones genéticas, como por ejemplo el BRAFv600E12. Desde la aprobación de la terapia dirigida con inhibidores de BRAFv600E (vemurafenib y dabrafenib) para casos de melanoma metastásico, la búsqueda de dicha mutación debe hacerse en todos los pacientes candidatos a terapia sistémica13, ya que mejora la sobrevida global y libre de progresión comparada con otros fármacos14. Si bien no hay evidencia de la eficacia en casos de MNC, los pacientes con compromiso a nivel de SNC extenso e irresecable podrían ser candidatos a dicha terapia. Otro aspecto a discutir es la elección del sitio de biopsia para confirmar el diagnóstico, evaluar si existe transformación a melanoma y realizar la tipificación genética, ya que podría plantearse optar por la biopsia de las lesiones cutáneas, que son más accesibles que las leptomeníngeas. Sin embargo, en muchos casos los nevos de Sutton dan falsos negativos debido a su marcada reacción citotóxica contra los melanocitos. Además, la transformación maligna que dicta el pronóstico es la producida a nivel del SNC, por lo que la demostración de la misma junto con el análisis genético (BRAFv600E) que en ocasiones puede ser distinto al de la piel, determinan la conducta oncológica. En nuestro caso, la mutación del BRAFv600E fue negativa, por lo que se decidió el uso de temozolamida como alternativa oral. Por presentar síndrome de hipertensión endocraneana, se planteó la posibilidad de realizar derivación ventricular como medida paliativa. Dada la posibilidad de metástasis a distancia a través de la derivación que presentan estos tumores15 y ante las características inflamatorias notorias con marcado aumento de proteínas observadas en el LCR con posibilidad de obstrucción del flujo del mismo, se decidió privilegiar tratamiento médico con dexametasona. A pesar del tratamiento instaurado, la paciente evolucionó desfavorablemente falleciendo, con una sobrevida global de 20 meses.
En conclusión, la MNC no solo debe sospecharse en pacientes en la primera-segunda década de la vida, sino también en adultos jóvenes. Además de los signos neurológicos (fundamentalmente, hipertensión endocraneana y crisis epilépticas), el examen dermatológico es de vital importancia para orientar el diagnóstico. El compromiso extenso de las leptomenínges en RM con regiones hiperintensas en T1 es muy sugestivo de esta entidad. La toma de biopsia meníngea y su análisis anatomopatológico cumple tanto un valor diagnóstico como potencialmente terapéutico, ya que podría utilizarse para identificar blancos genéticos a fin de poder brindar un tratamiento más preciso, pudiendo mejorar el pronóstico que, en la actualidad, es ominoso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Dra. Naomi Arakaki, por las figuras de anatomía patológica brindadas. Servicio de Anatomía patológica, Instituto de Investigaciones Neurológicas Raúl Carrea (FLENI), Buenos Aires, Argentina.
Dr. Ernesto Castellani, por la imagen de la biopsia de meninges. Servicio de Neurocirugía, Instituto de Investigaciones Neurológicas Raúl Carrea (FLENI), Buenos Aires, Argentina.