La meningitis neoplásica (MN) es una complicación metastásica relativamente frecuente en pacientes con cáncer, con alta morbilidad neurológica y en general pobre pronóstico. La prevalencia está en torno al 5-15% de los tumores sólidos, y los más frecuentes son el cáncer de mama, el de pulmón y el melanoma. La clínica se produce por afectación de hemisferios cerebrales, nervios craneales, médula y raíces nerviosas, siendo en muchos casos multifocal, y presenta a menudo síntomas y signos de hipertensión intracraneal. Las principales herramientas diagnósticas son la exploración neurológica, la resonancia magnética cerebral y medular con contraste, y el análisis y la citología del líquido cefalorraquídeo (LCR), aunque recientemente se están investigando técnicas como la detección de células tumorales y ADN circulante en el LCR, que aumentan la sensibilidad diagnóstica. Con las terapias disponibles en la actualidad el objetivo del tratamiento no es curativo, sino retrasar y disminuir los síntomas y preservar la calidad de vida de los pacientes, e implica un enfoque multimodal que puede incluir radioterapia, quimioterapia intratecal y/o sistémica y cirugía. El tratamiento debe ser individualizado y se basa principalmente en guías y opiniones de expertos. Actualmente se están llevando a cabo ensayos clínicos prometedores de fármacos contra dianas moleculares e inmunoterápicos. Este artículo es una revisión actualizada de la MN, e incluye epidemiologia, presentación clínica, diagnóstico, pronóstico, manejo y opciones terapéuticas; se dirige al neurólogo general, y en particular al neurólogo que ejerce su práctica en centros con pacientes oncológicos.
Neoplastic meningitis (NM) is a relatively frequent metastatic complication of cancer associated with high levels of neurological morbidity and generally poor prognosis. It appears in 5%-15% of patients with solid tumours, the most frequent being breast and lung cancer and melanoma. Symptoms are caused by involvement of the cerebral hemispheres, cranial nerves, spinal cord, and nerve roots, and are often multifocal or present with signs and symptoms of intracranial hypertension. The main diagnostic tools are the neurological examination, brain and spinal cord contrast-enhanced magnetic resonance imaging, and cerebrospinal fluid analysis including cytology, although studies have recently been conducted into the detection of tumour cells and DNA in the cerebrospinal fluid, which increases diagnostic sensitivity. With the currently available therapies, treatment aims not to cure the disease, but to delay and ameliorate the symptoms and to preserve quality of life. Treatment of NM involves a multimodal approach that may include radiotherapy, intrathecal and/or systemic chemotherapy, and surgery. Treatment should be individualised, and is based mainly on clinical practice guidelines and expert opinion. Promising clinical trials are currently being conducted to evaluate drugs with molecular and immunotherapeutic targets. This article is an updated review of NM epidemiology, clinical presentation, diagnosis, prognosis, management, and treatment; it is aimed at general neurologists and particularly at neurologists practicing in hospital settings with oncological patients.
La meningitis neoplásica (MN) es una complicación metastásica frecuente en pacientes con cáncer con alta morbilidad neurológica y en general corta supervivencia, incluso con tratamiento intensivo, aunque con excepciones. Su pronto diagnóstico y establecimiento de un régimen terapéutico y/o paliativo según los casos tiene enorme importancia. Por estos motivos consideramos que una revisión actualizada de su epidemiologia, presentación clínica, diagnóstico, pronóstico y opciones terapéuticas es de interés para el neurólogo general, y en particular para el neurólogo de práctica hospitalaria en centros con pacientes oncológicos.
La MN se define como la diseminación metastásica de células tumorales procedentes de neoplasias sólidas o hematológicas a las meninges y al espacio subaracnoideo1. Puede ocurrir de manera aislada, o asociada a metástasis intraparenquimatosas en el cerebro y/o la médula espinal. Esta complicación ocurre en el 4-15% de tumores sólidos1-3, denominándose también carcinomatosis leptomeníngea, y es la que principalmente se trata en esta revisión. En series autópsicas se describe una prevalencia aún mayor, de hasta el 20% en los pacientes que presentaban síntomas y del 8% en pacientes asintomáticos. La MN también ocurre en el 5-15% de pacientes con neoplasias hematológicas1,3 y en el 1-2% de los tumores primarios del sistema nervioso, más frecuentemente en ependimomas, meduloblastomas y linfomas primarios del sistema nervioso, pero también en gliomas y otros1,4.
El cáncer de pulmón, con una prevalencia de MN del 9-25%1, y el melanoma, con el 6-18%1,5, son los tumores sólidos que más tendencia tienen a metastatizar en las meninges. Sin embargo, dada la alta incidencia del cáncer de mama, este es el tumor sólido primario que con más frecuencia se asocia a MN (27-50% de los casos de MN), seguido del cáncer de pulmón (22-36%) y el melanoma (12%)1,3,6. Otros tumores sólidos, como carcinoma gástrico7, ovario8, próstata9 y colon10, también pueden asociarse a MN, aunque con menor frecuencia.
La MN se suele presentar en pacientes con enfermedad avanzada en más del 70% de los casos, pero también tras un intervalo libre de enfermedad (20%), e incluso como la primera manifestación de la neoplasia (5-10%)3,6, por lo cual se debe mantener un alto índice de sospecha en pacientes con presentación clínica compatible, incluso en ausencia de neoplasia sistémica activa o conocida.
ClínicaLa clínica en la MN se produce por afectación focal o global de hemisferios cerebrales (15%), nervios craneales (35%), y/o de la médula y las raíces nerviosas (60%)2,6, siendo frecuente la afectación multifocal3,6,11,12, así como la clínica por aumento de la presión intracraneal (26%)1. La presentación suele ser subaguda y el curso progresivo en semanas, más raramente en días o en meses (tabla 1).
Clínica de la meningitis neoplásica
| Hemisferios cerebrales 15% |
| Cefalea |
| Confusión |
| Hemiparesia |
| Disminución del nivel de consciencia |
| Crisis epilépticas focales y/o con generalización secundaria |
| Nervios craneales 35% |
| Diplopía (el VI nervio craneal es el más frecuentemente afectado, seguido del III y del IV) |
| Alteración motora o sensitiva del V nervio craneal |
| Hipoacusia por afectación del VIII nervio craneal |
| Médula y/o raíces nerviosas 60% |
| Debilidad |
| Alteración sensitiva segmentaria |
| Pérdida del control de esfínteres |
| Dolor de espalda o con distribución radicular |
| Hidrocefalia 26% (comunicante u obstructiva) |
| Síntomas por incremento de la presión intracraneal (náuseas, vómitos, cefalea, disminución del nivel de consciencia) |
| Episodios de disfunción neurológica transitoria (ondas «plateau») |
Las manifestaciones más frecuentes de la afectación hemisférica por irritación meníngea son cefalea, confusión, hemiparesia y crisis epilépticas. Los signos y síntomas comunes secundarios a la afectación de los nervios craneales son: diplopía (VIes el más frecuentemente afectado, seguido delIII y delIV nervios craneales), alteración motora o sensitiva del Vnervio craneal, e hipoacusia por afectación del VIIInervio craneal. Finalmente, los síntomas producidos por afectación medular y de las raíces nerviosas son debilidad (de predominio en miembros inferiores), alteración sensitiva segmentaria, pérdida del control de esfínteres, anestesia perineal y dolor de espalda o con distribución radicular3,6.
La clínica producida por presión intracraneal es típicamente cefalea, náuseas, vómitos y alteración del nivel de consciencia, acompañados de papiledema en la exploración1. Este aumento de presión intracraneal es debido a alteración del flujo cefalorraquídeo y puede manifestarse como hidrocefalia comunicante u obstructiva13. Algunos pacientes con MN y presión intracraneal experimentan episodios de disfunción neurológica transitorios atribuibles a ondas «plateau» o «en meseta», que son elevaciones paroxísticas de la presión intracraneal, normalmente inducidos por cambios posturales, que producen disminución de la presión de perfusión cerebral y que se manifiestan clínicamente como disminución de la conciencia, postura tónica de las extremidades, vómitos e incontinencia, y que pueden plantear diagnóstico diferencial con crisis epilépticas14.
DiagnósticoUna vez establecida la sospecha clínica, las dos herramientas principales para el diagnóstico de MN son la resonancia magnética (RM) y el análisis del líquido cefalorraquídeo (LCR) (tabla 2).
Pruebas diagnósticas y sensibilidad
| RM cerebral | Cerebro y médula tres segmentos con contraste | Sensibilidad 70-80% |
| Análisis LCR, parámetros generales | Presión de apertura elevada (>20cmH2O) | 50% |
| Pleocitosis linfocitaria (>4 leucocitos/mm3) | 25-64% | |
| Hipoglucorraquia (<60mg glucosa/dl) | 50% | |
| Hiperproteinorraquia (>50mg/dl) | 60-90% | |
| Citología LCR (gold standard) | Aumenta la sensibilidad diagnóstica si:• 2 punciones lumbares repetidas• 2 muestras• Volumen de cada muestra de al menos 10,5ml• Procesada inmediatamente | Sensibilidad 60-90% Especificidad 95% |
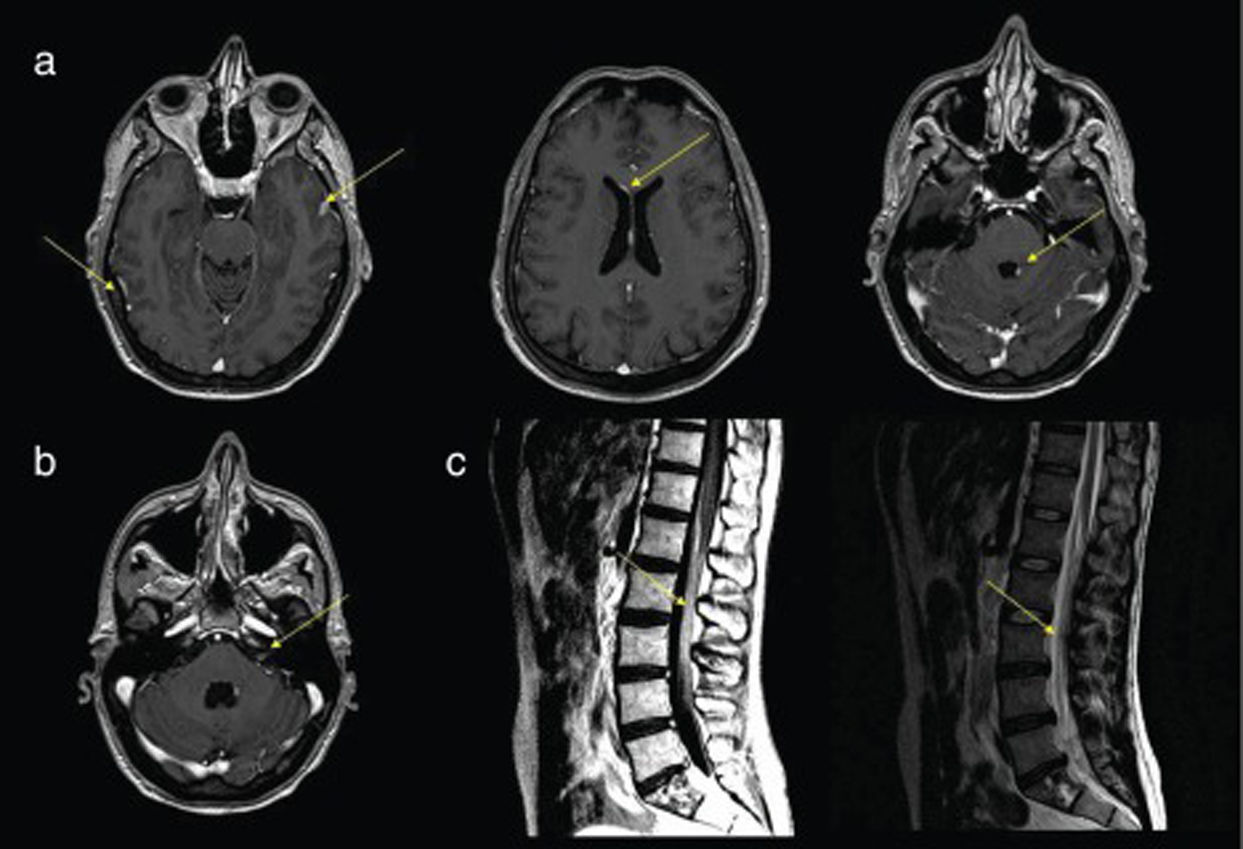
La RM con gadolinio de cerebro y médula espinal es la prueba de neuroimagen de elección en los pacientes con sospecha de MN, con una sensibilidad del 70-80%2,3,15,16, comparada con el 30% de la TC craneal. Los signos compatibles con el diagnóstico de MN que con más frecuencia aparecen en la RM son: realce focal o difuso de las meninges, nódulos subaracnoideos o intraventriculares y realce focalizado en estructuras como el epéndimo, los nervios craneales o las raíces nerviosas15,17,18. Es recomendable realizar las pruebas de neuroimagen antes de la punción lumbar, dado que esta puede causar un realce meníngeo transitorio, dando lugar a falsos positivos (fig. 1).
a)RM cerebral axial a distintos niveles en secuencia T1 con contraste donde se observa realce y engrosamiento de la duramadre y leptomeninges, realce periventricular y realce nodular del IVventrículo. b)RM cerebral a nivel de la salida de los nervios craneales en secuencia T1 con contraste donde se observa realce del paquete estato-acústico-facial izquierdo. c)RM medular lumbar, corte sagital, en secuencias T2 y T1 con contraste donde se observa engrosamiento y realce de las raíces de la cola de caballo.
Entre los hallazgos sugestivos, aunque no específicos, de MN en el análisis de LCR se incluyen presión de apertura elevada (>20cmH2O) en el 30-57% de los casos13, pleocitosis linfocitaria (>4leucocitos/mm3)7 en el 33-79%13, hipoglucorraquia (<60mg de glucosa/dl) en el 24-62%13 e hiperproteinorraquia (>50mg/dl) en el 63-90%13, siendo esta última determinación la más sensible19-21, pero no la más específica.
La mejor prueba disponible en la actualidad para el diagnóstico de MN en tumores sólidos es la citología de LCR, con la que se demuestra la presencia de células malignas con una sensibilidad del 60-90%1-3 y una especificidad del 95%17,22. Esta sensibilidad aumenta al realizar dos punciones lumbares (PL) repetidas. Sin embargo, a partir de la tercera PL el aumento de sensibilidad diagnóstica es escaso. Otras medidas que aumentan la probabilidad de detectar células malignas son: obtener dos muestras, que el volumen de cada una sea de al menos 10,5ml, que la muestra sea procesada inmediatamente, y que cerca del lugar de la punción haya una zona con manifestaciones clínicas o radiológicas de enfermedad1-3,17.
En diversos estudios, como en el de Subirá et al.23, se ha analizado la utilidad de la citometría de flujo en el diagnóstico de MN de tumores sólidos, no pudiendo demostrar un beneficio claro comparado con la citología, por lo que no se realiza de rutina en el análisis de LCR. Sin embargo, en las neoplasias hematológicas múltiples estudios han demostrado un aumento de sensibilidad claro de la citometría de flujo con respecto a la citología para determinar la presencia de células malignas en el LCR, por lo que su uso está recomendado17,24-26.
Otra técnica en estudio para el análisis del LCR es la detección de células tumorales circulantes usando el sistema CellSearch modificado. Este sistema se ha usado para el recuento de células malignas en sangre periférica en pacientes con tumores sólidos como cáncer de mama o colon, demostrando ser un factor pronóstico. Se han publicado estudios en los que esta técnica se aplicó para realizar recuento celular en el LCR, observando una elevada sensibilidad y una alta correlación con la citología. En estos estudios se evidencia la utilidad potencial de esta técnica como marcador de afectación temprana del SNC y de respuesta al tratamiento27,28. Sin embargo, su uso es todavía solo experimental. Finalmente, otro de los métodos experimentales para detectar afectación metastásica del SNC es el estudio del ADN circulante en el LCR. En varios estudios se ha observado una mayor sensibilidad que la citología; además, esta técnica puede ayudar a la caracterización molecular de células tumorales metastásicas29,30.
En ausencia de hallazgos compatibles en pruebas de neuroimagen y de LCR, el diagnóstico de MN se puede realizar en base a las manifestaciones clínicas y la historia oncológica previa, una vez descartadas otras causas31, aunque es preferible la confirmación diagnóstica con citología positiva y/o hallazgos compatibles en RM para iniciar una terapia específica1. Aunque la probabilidad de desarrollar MN es baja en pacientes con resultados negativos en la evaluación inicial, se debe realizar un seguimiento clínico en todos y repetir RM o análisis de LCR en aquellos con síntomas nuevos o progresivos32.
Pronóstico e indicaciones de tratamientoEl pronóstico en pacientes con MN sin tratamiento es generalmente ominoso, con una supervivencia media de 4-6semanas, que aumenta hasta una media de 3-6meses con tratamiento1,3,19,33. Sin embargo, esta supervivencia varía dependiendo del tipo de tumor primario1, siendo de 7-12meses en el cáncer de mama19,34 (con un 11-25% de supervivencia al año del diagnóstico3) y de unos 4meses en el melanoma35 y el cáncer de pulmón36.
Se ha estudiado la influencia de múltiples factores en el pronóstico de MN; el factor más claro es la situación funcional del paciente, y se observa una supervivencia más corta en pacientes con una puntuación menor de 70 en la escala de valoración funcional de Karnofsky (KPS)37,38 (tabla 3).
Escala de Karnofsky (KPS)
| Puntuación | Situación clínico-funcional |
|---|---|
| 100 | Normal, sin quejas ni evidencia de enfermedad |
| 90 | Capaz de llevar a cabo una vida normal pero con signos o síntomas leves |
| 80 | Actividad normal con esfuerzo, algunos signos y síntomas de enfermedad |
| 70 | Capaz de cuidarse pero incapaz de llevar a cabo actividad normal o trabajo activo |
| 60 | Requiere atención ocasional pero es capaz de satisfacer la mayoría de sus necesidades |
| 50 | Necesita ayuda importante y asistencia médica frecuente |
| 40 | Incapaz, necesita ayuda y asistencia especiales |
| 30 | Totalmente incapaz, necesita hospitalización y tratamiento de soporte activo |
| 20 | Muy gravemente enfermo, necesita tratamiento activo |
| 10 | Moribundo irreversible |
| 0 | Muerto |
En el contexto especifico de MN de mama, melanoma y pulmón se han estudiado otros factores pronósticos adicionales. En un estudio retrospectivo realizado en 103 pacientes con MN de cáncer de mama se observó que el estado de los receptores hormonales (estrógenos y progesterona) y la estadificación al diagnóstico eran los factores con mayor influencia en el tiempo transcurrido desde el diagnóstico inicial del tumor hasta el desarrollo de MN. Una estadificación avanzada y la negatividad de receptores hormonales y HER2 (cáncer de mama triple negativo) se asociaron a un tiempo más corto hasta el desarrollo de MN. Una vez diagnosticada la MN, estos factores se relacionaron con la supervivencia, siendo los pacientes con receptores hormonales positivos los que presentaron mejor pronóstico, y los pacientes con cáncer de mama triple negativo los de peor pronóstico32,39. En cuanto a factores pronóstico en pacientes con melanoma y MN, un estudio retrospectivo realizado en 110 pacientes observó que la terapia intratecal mejoraba el pronóstico, pero no se encontró peor pronóstico en pacientes con carga de enfermedad leptomeníngea elevada, en contra de la hipótesis que llevó a realizar el estudio40. Con respecto al cáncer de pulmón en un estudio retrospectivo realizado en 149 pacientes, en el análisis multivariante se observó que factores como una baja puntuación en la escala de calidad de vida del paciente con cáncer del Eastern Cooperative Oncology Group (ECOG), proteínas y células bajas en el LCR, así como los tratamientos con quimioterapia intratecal, con inhibidores tirosina-quinasa frente al receptor de crecimiento epidérmico (EGFR), y la radioterapia mejoraban el pronóstico41. Debido al diseño retrospectivo de estos estudios, no se puede descartar que la mejoría del pronóstico con el tratamiento se deba a un sesgo de selección (es decir, que se hubiesen seleccionado para recibir tratamiento los pacientes con mejor pronóstico).
En general, además de la situación funcional del paciente, son factores conocidos de mal pronóstico: edad mayor de 50años, tiempo desde el diagnóstico del tumor primario hasta el diagnóstico de MN menor de 12meses, múltiples déficits neurológicos establecidos, presencia de encefalopatía, carga de enfermedad leptomeníngea elevada, bloqueos de flujo en el LCR y enfermedad sistémica avanzada con pocas opciones de tratamiento1,3,15,42,43.
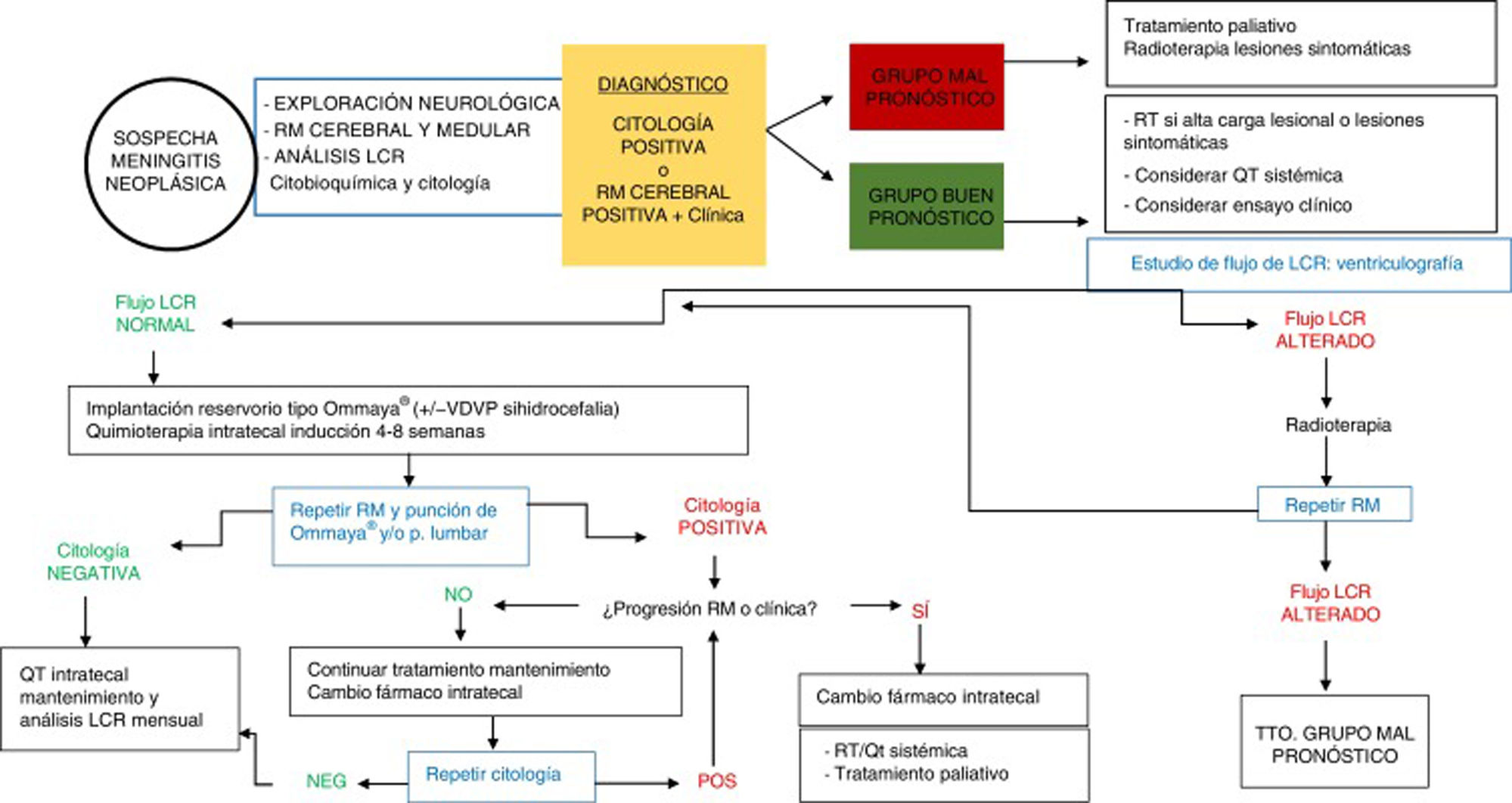
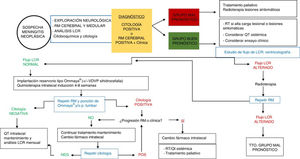
En base a estos factores se pueden establecer dos grupos de pacientes con MN y distintas indicaciones de tratamiento (tabla 4). En el grupo de pacientes candidatos a tratamiento intensivo se incluirán aquellos en los que se prevé mejor pronóstico y respuesta al tratamiento (KPS>60, enfermedad sistémica controlada o con opciones de tratamiento apropiadas, ausencia de déficit neurológicos mayores). En los pacientes con peor pronóstico (KPS≤60, enfermedad sistémica no controlada y con pocas opciones de tratamiento, y/o presencia de déficits neurológicos importantes) es muy improbable que el tratamiento intensivo de MN aporte beneficio, y es más apropiado el tratamiento de soporte o paliativo (fig. 2).
Grupos de tratamiento
| Grupo de buen pronóstico | Grupo de mal pronóstico |
|---|---|
| • KPS mayor de 60• Tumor primario controlado• Ausencia de déficit neurológicos mayores | • KPS igual o menor de 60• Tumor primario no controlado y con pocas opciones de tratamiento• Déficits neurológicos importantes• Encefalopatía• Carga de enfermedad leptomeníngea elevada |
Con las terapias disponibles en la actualidad, el objetivo del tratamiento intensivo no es la curación, sino retrasar y disminuir, en la medida de lo posible, los síntomas neurológicos de la enfermedad y preservar la calidad de vida de los pacientes. La mejor estrategia es el tratamiento individualizado, que en la mayoría de las ocasiones implica la combinación de los diversos tipos de tratamientos disponibles (radioterapia, quimioterapia intratecal, sistémica) a lo largo del curso de la enfermedad, además de tratamientos de soporte apropiados a la situación de cada paciente. Las decisiones de tratamiento se basan típicamente en la carga lesional, en el tipo de tumor, en ela disponibilidad de terapia sistémica con actividad anti MN, en la velocidad de progresión de los síntomas, etc. En el caso de la quimioterapia intratecal, el fármaco utilizado depende de factores como los efectos secundarios, la comodidad del paciente o la experiencia en la administración del fármaco concreto, ya que ninguno ha demostrado superioridad en ensayos clínicos aleatorizados.
TratamientoExisten varias modalidades terapéuticas para el tratamiento de la MN, entre las que se incluyen la quimioterapia intratecal, la radioterapia y la quimioterapia sistémica, además de los tratamientos de soporte o paliativos para los síntomas asociados. Las decisiones de tratamiento deben ser individualizadas a cada paciente, y de manera ideal el plan terapéutico debe ser consensuado por un equipo multidisciplinar (fig. 2).
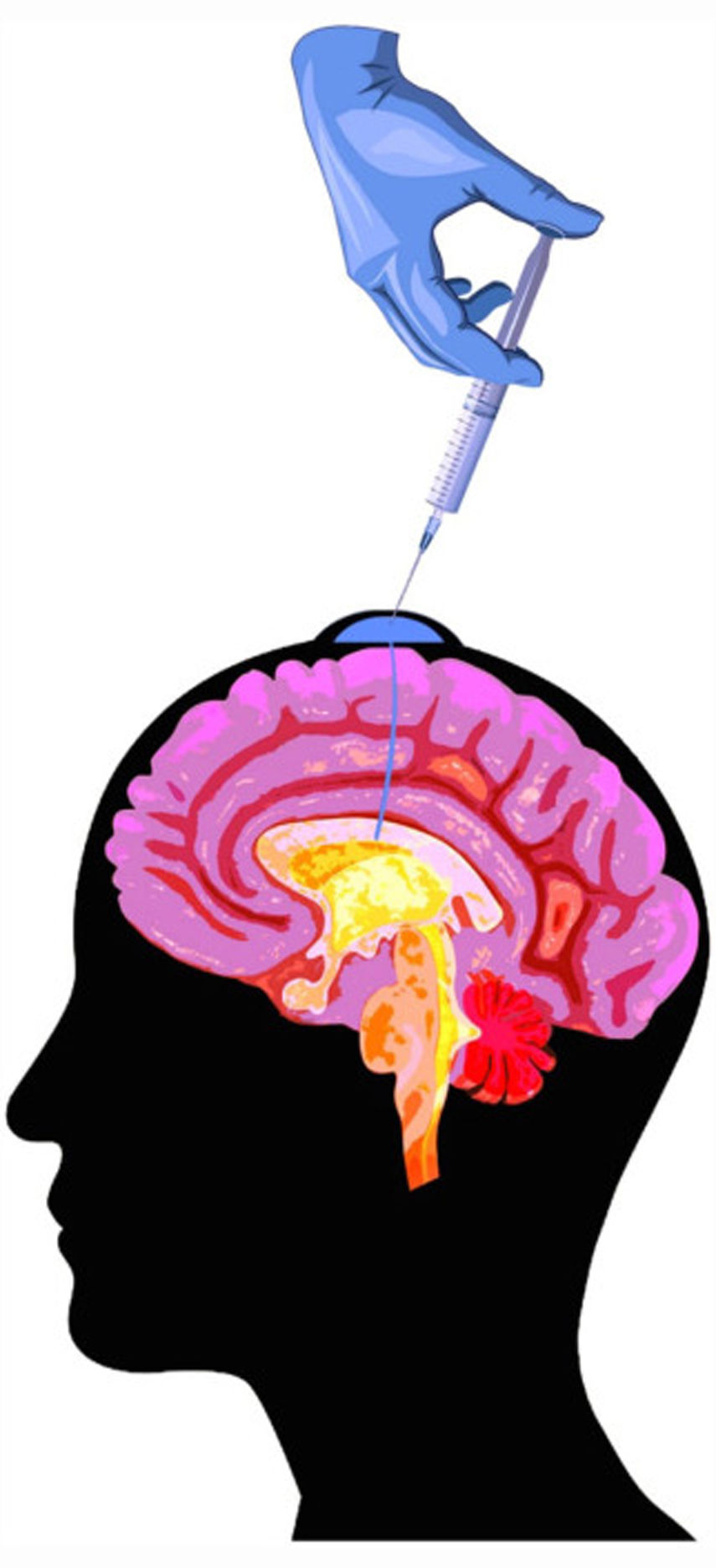
Quimioterapia intratecalModo de administraciónLa quimioterapia intratecal consiste en la administración de fármacos directamente en el espacio subaracnoideo y se puede realizar por dos vías: mediante punciones lumbares repetidas o a través de un catéter intraventricular conectado a un reservorio subcutáneo tipo Ommaya® bajo el cuero cabelludo (fig. 3). Este dispositivo debe ser implantado por el neurocirujano, y tras el procedimiento se recomienda realizar una TC craneal para comprobar que se encuentra en posición correcta antes de iniciar tratamiento, ya que puede estar mal posicionado en el 3-12% de los casos3. La principal ventaja del reservorio tipo Ommaya® sobre la administración vía punción lumbar es la mejor distribución del fármaco en el espacio intratecal, sobre todo al administrar fármacos con tiempo de vida media muy corto1,44, como por ejemplo metotrexato o citarabina, así como la facilidad para administrar tratamiento con mayor comodidad para el paciente. El principal inconveniente que presenta es la necesidad de una intervención quirúrgica y una mayor frecuencia de infecciones1, comparada con la punción lumbar.
Previo al inicio de tratamiento con quimioterapia intratecal se recomienda la realización de un estudio de flujo del LCR, ya que el 30% de pacientes con MN pueden tener obstrucciones de flujo, que ocurren principalmente en las convexidades cerebrales, en la base del cráneo y a nivel espinal45,46. La obstrucción de flujo es un signo de mal pronóstico en estos pacientes, posiblemente debido a distribución subóptima del fármaco, y potencialmente acumulación en la zona de obstrucción causando toxicidad45,47. La técnica de elección para el estudio de flujo de LCR es la ventriculografía con indio-111 o con tecnecio-9948. En el caso de que se demuestre una obstrucción se puede tratar con radioterapia focal, que consigue solucionar la obstrucción en el 30-50% de los casos, mejorando el pronóstico45,47. En el caso de que la obstrucción persista a pesar del tratamiento con radioterapia, la quimioterapia intratecal está contraindicada.
Fármacos disponibles para administración intratecalLos fármacos usados con más frecuencia en la MN son el metotrexato (MTX), la citarabina (Ara-C) y su compuesto de liberación retardada la citarabina liposomal, la tiotepa y el topotecán. Diversos estudios se han realizado comparando la efectividad entre estos fármacos, o combinándolos entre ellos, sin encontrar diferencias significativas en cuanto a tasa de respuesta y supervivencia global49-52. En las neoplasias hematológicas se suelen usar combinaciones de varios fármacos, no así en la MN de órganos sólidos1.
- •
Metotrexato. El MTX es un antagonista del ácido fólico que inhibe la síntesis del ADN mediante la inhibición de la dihidrofolato reductasa. El tiempo de vida media es 4-8h. El protocolo habitual de administración es de 10-15mg dos veces por semana durante 4semanas para la inducción, una vez por semana durante 4semanas para la consolidación, y posteriormente una vez al mes de mantenimiento1,2,53 (tabla 5).
Tabla 5.Protocolos de administración de quimioterapia intratecal
Fármaco Inducción Consolidación Mantenimiento Metotrexato 10-15mg 2 veces por semana durante 4 semanas 10-15mg 1 vez por semana durante 4 semanas 10-15mg 1 vez al mes Citarabina 25-100mg 2 veces por semana durante 4 semanas 25-100mg 1 vez por semana durante 4 semanas 25-100mg 1 vez al mes Citarabina liposomal 50mg 1 vez cada 2 semanas durante 8 semanas 50mg 1 vez cada 4 semanas 50mg 1 vez cada 4 semanas Tiotepa 10mg 2 veces por semana durante 4 semanas 10mg 1 vez por semana durante 4 semanas 10mg 1 vez al mes Topotecán 0,4mg 2 veces por semana durante 6 semanas 0,4mg 1 vez por semana durante 6 semanas 0,4mg 2 veces al mes durante 4 meses y posteriormente 1 vez al mes - •
Citarabina. Ara-C (arabinósido de citosina, citarabina) es un análogo de la pirimidina que se metaboliza en su metabolito activo, ARA-CTP (citarabina-5-trifosfato) que inhibe la ADN polimerasa. Su tiempo de vida media es de 1-3h. El protocolo habitual de administración es de 25-100mg dos veces por semana durante 4semanas para la inducción, una vez por semana durante 4semanas para la consolidación, y posteriormente una vez al mes de mantenimiento2,52 (tabla 5).
- •
La citarabina liposomal es un compuesto de liberación retardada que mantiene niveles citotóxicos en LCR durante 10-14días (tiempo de vida media 100-263h), por lo que su administración puede ser más espaciada en el tiempo. Un ensayo clínico realizado en pacientes con linfomatosis meníngea por Glantz et al.54 comparándola con la formulación convencional de citarabina demostró mayor tasa de respuesta (negativización de la citología del LCR y no progresión neurológica) pero no observó prolongación de supervivencia. En otro ensayo clínico realizado por el mismo autor comparándola con MTX, la tasa de respuesta fue similar, pero en el grupo tratado con citarabina liposomal se observó un tiempo más prolongado hasta el empeoramiento neurológico, aunque la diferencia en supervivencia no fue estadísticamente significativa55. El protocolo habitual de administración es de 50mg una vez cada 2semanas durante 8semanas para la inducción, y posteriormente una vez cada 4semanas para la consolidación y el mantenimiento2,54 (tabla 5).
- •
Tiotepa. Tiotepa es otro de los fármacos disponibles para administración intratecal, aunque su uso no está muy extendido1,2. Es un fármaco alquilante independiente del ciclo celular. Diversos ensayos clínicos avalan su utilidad, siendo similar en eficacia al resto de tratamientos y con escasa toxicidad49,56,57. Su tiempo de vida media es de 6h. El protocolo habitual de administración es 10mg dos veces por semana durante 4semanas para la inducción, 10mg una vez por semana durante 4semanas para la consolidación, y posteriormente una vez al mes de mantenimiento2,56,57(tabla 5).
Además de los fármacos más comúnmente usados, existen otros en los que es posible la administración intratecal y que se han evaluado en ensayos clínicos. Entre ellos se encuentran:
- •
Topotecán, un inhibidor de la topoisomerasa1 aprobado para el uso sistémico en cáncer de ovario y de pulmón. En los ensayos clínicos realizados para comprobar su utilidad y seguridad en la MN, así como en estudios retrospectivos, se observaron tasas de respuesta y supervivencia similares a otros fármacos intratecales y buena tolerabilidad2,58,59. El tiempo de vida media es 2-3h. El protocolo habitual de administración es de 0,4mg dos veces por semana durante 6semanas para la inducción, 0,4mg una vez por semana durante 6semanas para la consolidación, y posteriormente dos veces al mes de mantenimiento seguido de una vez al mes en ausencia de progresión58,59 (tabla 5).
- •
Trastuzumab, un anticuerpo monoclonal contra el receptor tipo2 del factor de crecimiento epidérmico humano (HER2); de usa como terapia sistémica en pacientes con cáncer de mama metastásico y sobreexpresión de HER2 con muy buena respuesta, excepto en las metástasis cerebrales y leptomeníngeas. Se han publicado diversas series de casos con buena respuesta y tolerancia a la administración intratecal en el tratamiento de MN de cáncer de mama HER2 positivo. Actualmente se están llevando a cabo dos ensayos clínicos con el fin determinar la eficacia, la seguridad y la dosis adecuada1,60-62. La preparación intravenosa de trastuzumab no es adecuada para la administración intratecal, ya que los viales de reconstitución contienen alcohol bencílico, que es neurotóxico.
- •
Interleucina 2 (IL-2), una citocina del sistema inmune con una importante función en la regulación de las respuestas de los linfocitosT. En un estudio retrospectivo realizado en 43 paciente con MN de melanoma se observó que el uso intratecal de IL-2 aumentaba la supervivencia. Los efectos secundarios más frecuentes son cefalea, escalofríos, náuseas y fiebre. La administración se realiza cuatro veces por semana durante 4semanas para la inducción, y si hay respuesta, una dosis de mantenimiento cada 1-3meses63.
- •
Meningitis infecciosa3,64,65. Ocurre en el 2-15% de los pacientes, más frecuentemente en los portadores de reservorios tipo Ommaya®. Las manifestaciones clínicas son cefalea, fiebre, náuseas y vómitos, así como alteración del nivel de consciencia y fallos en el funcionamiento del reservorio. Los hallazgos típicos en el LCR incluyen pleocitosis con predominio de polimorfonucleares, aumento de proteínas y disminución de la glucosa. Los microorganismos aislados con más frecuencia son grampositivos, y dentro de ellos, los Staphylococcus coagulasa negativos. El tratamiento requiere antibióticos intravenosos, valorar la administración de antibióticos intratecales y la retirada precoz el catéter. En casos de colonización asintomática la retirada del catéter no siempre es necesaria, y se debe valorar el tratamiento con antibióticos.
- •
Meningitis aséptica66,67. Se manifiesta por cefalea, meningismo y febrícula transitorias, que aparecen a las pocas horas de la infusión y desaparecen en menos de 3días. Es una reacción idiosincrática y no suele recurrir en las siguientes administraciones de tratamiento. Aparece hasta en el 10% de los pacientes tratados con MTX, y también en los pacientes tratados con tiotepa y con Ara-C, siendo más frecuente y con tendencia a recurrir en el caso de la citarabina liposomal. Responde al tratamiento con corticoides y AINE.
- •
Mielopatía aguda66,68,69. Es una complicación devastadora pero rara de la quimioterapia intratecal. Suele asociarse al tratamiento con MTX, pero también hay casos descritos con citarabina o tiotepa. Aparece días o meses después de la administración del tratamiento y se manifiesta como paraparesia, tetraparesia o incluso síndrome del cautiverio. En la RM espinal se observa una lesión hiperintensa en T2 que afecta a los cordones posteriores, pero en algunos casos puede ser normal. No hay un tratamiento establecido, aunque se ha publicado un caso de una paciente que mejoró parcialmente con suplementos a altas dosis de ácido fólico, cianocobalamina, metionina y S-adenosil-metionina iniciados tres días tras el comienzo de la clínica43.El diagnóstico diferencial con mielopatía debida a progresión tumoral es complejo. La determinación de proteína básica de la mielina en el LCR puede ser de utilidad, ya que esta se eleva en el caso de daño medular por mecanismo desmielinizante, pero no en el caso de progresión tumoral69.
- •
Leucoencefalopatía progresiva1,66,67. Es una complicación crónica que puede ocurrir a partir de los 6meses desde la administración de MTX. Se manifiesta típicamente con alteración cognitiva, alteración del comportamiento, incontinencia, crisis epilépticas y alteración de la marcha. Su incidencia es del 2% cuando se administra MTX intratecal, pero aumenta hasta el 48% cuando la administración se realiza después de haber recibido radioterapia cerebral. Por este motivo se recomienda que, en caso de ser necesaria la combinación de ambas terapias, el MTX intratecal se administre 2-3semanas antes que la radiación.
- •
Mielosupresión1,3. No es frecuente tras la administración de quimioterapia intratecal, pero puede ocurrir en algunos casos, por lo que antes de iniciar el tratamiento debe comprobarse que la hemoglobina es >10g/dl, las plaquetas >100.000/μl, y los granulocitos >1.500/μl. En el caso de MTX se recomienda profilaxis con ácido fólico 10-15mg/6h durante 2días.
- •
Aracnoiditis y síndrome del cono medular. Esta complicación es frecuente (17%) tras la administración de citarabina liposomal39. Con medidas preventivas como espaciar la citarabina liposomal intratecal de la quimioterapia sistémica y el uso de corticoides orales o intratecales las complicaciones neurológicas disminuyen, aunque el riesgo no desaparece totalmente70.
La radioterapia (RT) es uno de los tratamientos principales de la MN. Las modalidades de tratamiento son RT cerebral holocraneal, RT focal y RT craneoespinal.
La RT holocraneal se utiliza en pacientes con metástasis cerebrales concomitantes, carga lesional elevada, depósitos leptomeníngeos de gran tamaño (donde los fármacos intratecales no pueden penetrar bien) y en pacientes muy sintomáticos o con síntomas de rápida progresión1,13. La dosis habitual es 30-36Gy1 fraccionados en 3Gy por día, aunque puede variar de 20 a 4013. En estudios realizados en MN de cáncer de mama y de pulmón no se ha obtenido mejoría de la supervivencia con esta terapia71,72, pero su utilidad es paliativa.
La RT focal es especialmente útil en lesiones espinales sintomáticas o de gran tamaño, ya que produce un rápido control sintomático73, o en lesiones que causen alteraciones del flujo de LCR, reestableciendo el flujo en el 30-50% de estos pacientes47.
La RT craneoespinal generalmente no se usa para el tratamiento de MN de tumores sólidos debido a su carácter no curativo, ya a que la toxicidad que produciría en la médula ósea limitaría la posterior administración de tratamiento quimioterápico sistémico si este fuese necesario13.
Quimioterapia sistémicaFármacos citotóxicos sistémicosLa eficacia de la quimioterapia sistémica en MN de tumores sólidos es en general limitada, principalmente debido a que alcanza bajas concentraciones en el LCR y en el parénquima cerebral, y a la falta de eficacia antitumoral en determinadas neoplasias. A pesar de estas limitaciones, un estudio retrospectivo para valorar factores pronóstico en el que se incluyeron 155 pacientes con MN de diferentes tipos de tumores (73 tumores sólidos) mostró que la quimioterapia sistémica sola o en combinación con otros tratamientos, comparada con otras opciones de tratamiento en las que no se incluía, mejora la supervivencia43. Otro estudio retrospectivo realizado en 155 pacientes con MN aportó resultados similares74.
Hay diversos fármacos capaces de atravesar la barrera hematoencefálica (temozolomida, capecitabina, nitrosoureas, metotrexato o topotecán), pero su utilidad en el tratamiento de MN de tumores sólidos es muy limitada. En una serie de casos publicada por Glantz et al.75 se obtuvieron buenos resultados con mayor tiempo de supervivencia en 13 de 16 pacientes tratados con altas dosis de MTX intravenoso, con una supervivencia media de 14meses, aunque la mayoría de los tumores primarios eran gliomas y linfomas. Hay varios casos publicados en los que la temozolomida fue efectiva en el tratamiento de la MN13. Sin embargo, un ensayo clínico en fase2 en MN de tumores sólidos se tuvo que terminar prematuramente por ineficacia76. Se han demostrado casos de respuesta con capecitabina en pacientes con MN de cáncer de mama77.
Fármacos sistémicos contra dianas molecularesEn el cáncer de mama, lapatinib, un inhibidor dual de la tirosina-quinasa HER1 y HER2, administrado por vía oral con capacidad para atravesar la barrera hematoencefálica, ha obtenido buenos resultados en el tratamiento de las metástasis cerebrales, pero no hay estudios prospectivos que determinen su utilidad en MN. Se han publicado casos aislados de respuesta a terapia hormonal, pero actualmente no existe suficiente evidencia para el uso de estas terapias en la MN asociada al cáncer de mama19,78.
En el caso del cáncer de pulmón (no células pequeñas) con mutación en el receptor del factor de crecimiento epidérmico (EGFR), un estudio retrospectivo realizado por Liao et al.79 demostró la eficacia y la seguridad de inhibidores de tirosina-quinasa de EGFR (erlotinib, gefitinib y afatinib) en el tratamiento de MN. El principal problema de estos fármacos es que atraviesan la barrera hematoencefálica pero alcanzan niveles muy bajos en el LCR. Una posible solución es el empleo de pautas alternativas de administración a dosis altas. En un ensayo clínico en fase1 con gefitinib a dosis altas se observó mejoría en la clínica neurológica en el 57% de los pacientes80. Otro estudio retrospectivo probó que erlotinib a dosis altas era seguro y efectivo en aquellos pacientes en los que la posología estándar había fallado. En el caso de mutación del gen ALK, presente en el 5% de los pacientes con cáncer de pulmón, hay varios casos publicados de respuesta a inhibidores de ALK de segunda generación como alectinib y ceritinib78.
Finalmente, se han publicado varios casos de respuesta en pacientes con MN de melanoma1,81 con mutación BRAF V600E tratados con inhibidores de BRAF como vemurafenib o dabrafenib, e inhibidores de MEK como trametinib, solos o en combinación82, pero no se han realizado ensayos clínicos prospectivos. Se han publicado también casos con respuesta a inhibidores de puntos de control inmunitario («inhibidores checkpoint») como ipilimumab83, y actualmente hay varios ensayos clínicos en marcha para el tratamiento de MN de melanoma con nivolumab y pembrolizumab.
Papel de la cirugíaEl papel de la cirugía en la MN es limitado, y su indicación se restringe a la implantación de reservorios tipo Ommaya®, biopsia en algunos casos de tumor primario no conocido y citología no concluyente, y derivación ventriculoperitoneal en el caso de hidrocefalia. En el caso de pacientes con hidrocefalia se puede implantar una válvula de derivación «on-off» junto con un reservorio para permitir la administración de quimioterapia intratecal cuando el dispositivo está en posición «off» y servir como válvula de derivación en el intervalo entre tratamientos cuando el dispositivo está en posición «on». Otra de las opciones quirúrgicas en el caso de hidrocefalia es realizar una ventriculostomía endoscópica.
Valoración de la respuesta al tratamientoLa valoración de respuesta al tratamiento en MN es compleja y debe incluir criterios clínicos, radiológicos y análisis del LCR (fig. 2). Según los resultados de cada uno de estos parámetros, la enfermedad se clasificará en: respuesta al tratamiento, estable y progresiva. En base a estos criterios se toman las decisiones con respecto a la continuación o no de tratamiento. El grupo de trabajo Response Assessment in Neuro-Oncology (RANO) ha publicado recientemente un artículo84 en el que se resume el consenso actual sobre la valoración de la respuesta al tratamiento en la MN.
La valoración neurológica debe incluir la evaluación de los síntomas y la exploración. Respuesta al tratamiento implica una mejoría o ausencia de cambios clínicos significativos. RANO propone en este apartado de exploración 10ítems que se deben valorar con niveles de 0 a3 cada uno, estableciendo progresión como el aumento de 2 o más niveles en un ítem, o el cambio al nivel3 en un ítem.
Con respecto al análisis de LCR, según la proposición de RANO, solo se valora si la citología es positiva o negativa. Este análisis se debe hacer antes del inicio del tratamiento (basal) y durante el tratamiento una vez por semana o dos veces al mes durante la inducción y una vez al mes o una vez cada 2meses durante el periodo de mantenimiento. Se considera respuesta cuando la citología pasa de positiva a negativa. Se considera progresión cuando la citología previamente negativa se hace positiva, o cuando la citología previamente positiva persiste positiva tras la fase de inducción del tratamiento.
La RM cerebral y la espinal son útiles para evaluar la respuesta al tratamiento y se deben realizar antes del inicio del tratamiento y tras la inducción. Se considera progresión cuando hay aumento del tamaño o de la extensión en las lesiones previas en las secuencias con contraste. RANO propone un baremo de puntuación de la RM, pero aún está pendiente de validar.
En definitiva, se considera progresión cuando hay empeoramiento de la clínica neurológica, aumento de las lesiones en la RM o citología persistente positiva o cambio de negativa a positiva (aunque el estudio citológico no se puede considerar un criterio de progresión de manera aislada).
ConclusiónEn pacientes con cáncer de órgano sólido conocido y clínica neurológica multifocal, subaguda y progresiva la sospecha de meningitis neoplásica debe ser alta. Además de las pruebas habituales de RM y citología de LCR que se deben realizar en todos los pacientes, existen otras, como la citometría de flujo, la detección de células tumorales circulantes y la detección de ADN circulante; las dos últimas están en periodo de investigación, pero con estudios que avalan su elevada sensibilidad. El tratamiento de cada paciente debe ser individualizado, y depende de las características del paciente (edad, situación funcional, síntomas neurológicos) y del tumor (tipo de tumor primario, presencia de enfermedad sistémica y posibilidades para su tratamiento, carga lesional de enfermedad leptomeníngea, presencia de bloqueos del LCR). El tratamiento se basa en tres pilares fundamentales: la radioterapia, la quimioterapia intratecal y la quimioterapia sistémica, además de los tratamientos de soporte para el control de síntomas. Los estudios actuales investigan principalmente fármacos dirigidos contra dianas moleculares, y la inmunoterapia está empezando a cobrar protagonismo en ensayos clínicos, especialmente en el melanoma.
Este artículo aporta una revisión actualizada de la práctica habitual vigente y de las posibles direcciones futuras; además, propone un algoritmo de tratamiento que puede servir de guía para el manejo de la MN.
En el futuro el tratamiento —y por tanto el pronóstico— de estos pacientes podría mejorar con la validación de técnicas de diagnóstico precoz de MN y de monitorización de respuesta al tratamiento, y con más ensayos clínicos multicéntricos diseñados específicamente para el estudio de la MN en tipos tumorales específicos o en tumores de distinto origen que comparten las mismas características genético-moleculares, manejo multidisciplinar y guías de consenso nacional e internacional.
FinanciaciónEste trabajo de investigación no ha recibido financiación.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.
Este artículo fue preparado mientras Marta Penas-Prado trabajaba en el MD Anderson Cancer Center de la Universidad de Texas. Las opiniones expresadas en este artículo son de la autora y no reflejan la opinión de los National Institutes of Health, del Department of Health and Human Services o del gobierno de Estados Unidos.