La mielitis longitudinalmente extensa se define como una alteración medular aguda de carácter inflamatorio que afecta a 3 o más segmentos medulares concatenados. De inicio agudo o subagudo, sus causas son muy variables: desde un origen tumoral, hasta uno infeccioso, inflamatorio-desmielinizante, disinmune, vascular o metabólico-carencial1,2. Su incidencia es relativamente baja (1-8 casos por millón de personas/año); no obstante, es responsable de una importante morbilidad neurológica. Presentamos un caso de mielitis longitudinalmente extensa por déficit de cobre, enmascarado inicialmente por déficit de vitamina B12 concomitante, una etiología de baja prevalencia, con casos aislados descritos fundamentalmente en pacientes gastrectomizados3–5.
Nuestra paciente es una mujer de 86 años perteneciente a un nivel socioeconómico medio-alto, sin antecedentes personales de interés, que comienza con un cuadro subagudo de parestesias en miembros inferiores, ataxia de la marcha sensitiva leve y alteración de la sensibilidad vibratoria nivel C7-T1 y de la artrocinética en el miembro inferior izquierdo. Tras estudio analítico y radiológico, se objetiva déficit de cobalamina, siendo diagnosticada de degeneración medular combinada subaguda, por la que se inicia terapia sustitutiva con B12 intramuscular (inicialmente una ampolla diaria durante una semana después una ampolla semanal durante 4 semanas y finalmente una ampolla mensual), con mejoría clínica progresiva posterior.
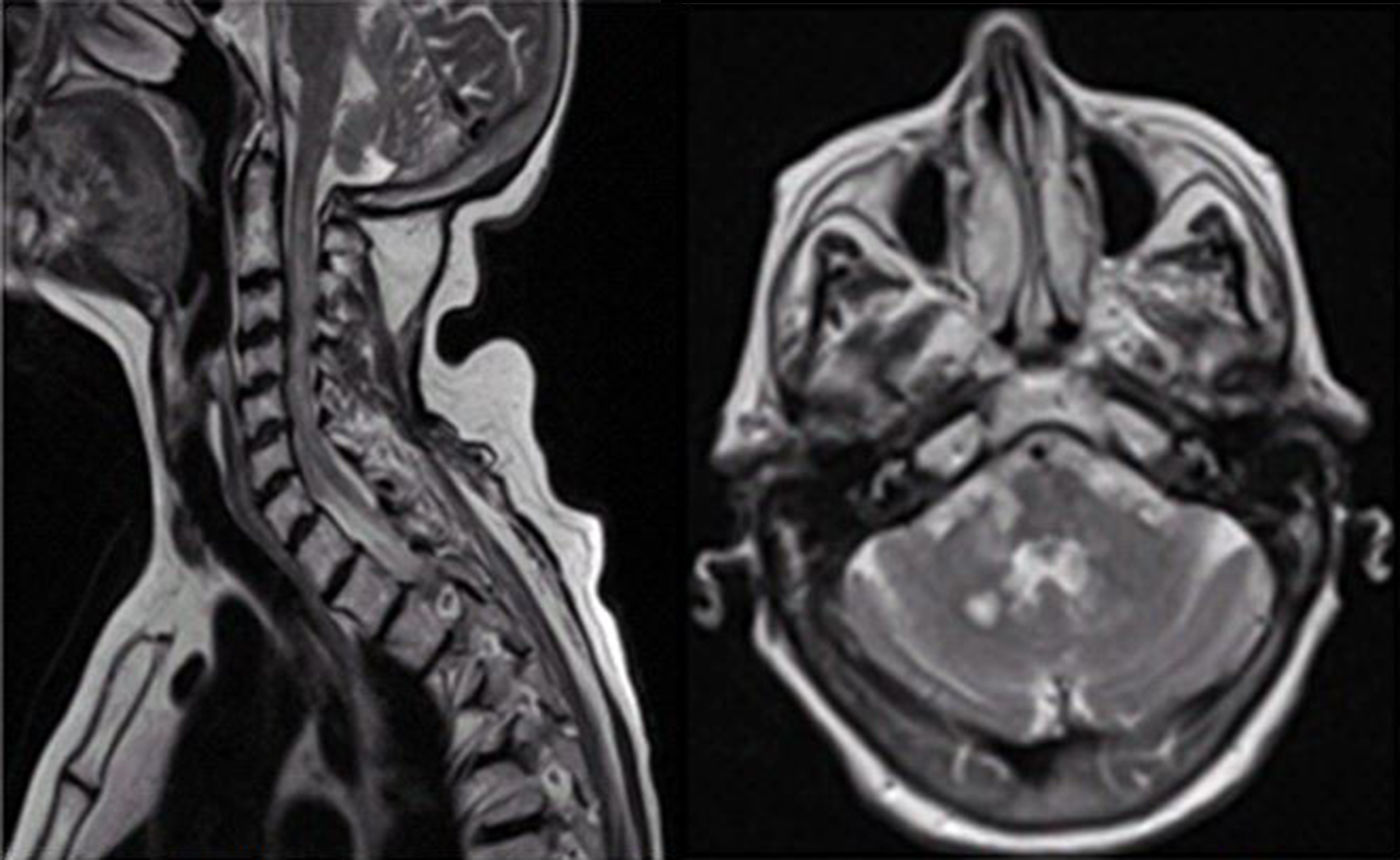
Seis meses después (aun en tratamiento sustitutivo con B12 intramuscular mensual), experimenta un empeoramiento de la clínica inicial, sobreañadiéndose una monoparesia braquial derecha predominantemente proximal que se acompaña de alodinia de la extremidad. En la exploración se constata una hipoalgesia distal en extremidades con una artrocinética abolida globalmente (exceptuando miembro superior izquierdo) y una hiporreflexia generalizada con un reflejo cutáneo plantar extensor derecho. No se constatan alteraciones cognitivas. Analíticamente, presentaba una anemia normocítica normocrómica (hemoglobina: 8,1 g/dl), con niveles de cobalamina normales. Se realiza resonancia magnética (RM) craneal (fig. 1), donde se visualizan varias lesiones redondeadas de distinto tamaño y morfología (unas de aspecto anular con paredes gruesas y otras mal delimitadas) en ambos hemisferios cerebelosos, región bulbar derecha y pedúnculo cerebeloso medio ipsolateral, sin restricción del agua libre en el estudio de difusión y con cierta captación tras administrar contraste paramagnético intravenoso, sin edema vasogénico asociado. También se objetiva afectación de sustancia blanca periauricular y de ambos globos pálidos, sin captación de contraste. En la RM de columna completa destaca una afectación difusa del cordón medular y de cordones posteriores, con realce parcheado tras suministro de contraste predominantemente en los niveles C1 a C5. Se lleva a cabo búsqueda de neoplasia oculta, con tomografía axial computarizada de tórax y marcadores tumorales negativos. Las serologías de virus de la inmunodeficiencia humana, lúes, Lyme y virus de la hepatitis C son negativas, así como el estudio de autoinmunidad con anticuerpos antiperoxidasa, complemento, ANA, ENA, ANCA y anti-NMO (tabla 1). El análisis de líquido cefalorraquídeo (LCR) muestra alteraciones inespecíficas, con una linfocitosis moderada y bandas oligoclonales positivas. Desde el punto de vista metabólico-carencial, los niveles plasmáticos de vitamina B12, ácido fólico, cinc, vitaminas A y E presentan valores normales, estando la homocisteína plasmática ligeramente elevada (13,9 μmol/l), siendo esto último indicativo de déficit de vitamina B12, a pesar de niveles plasmáticos en rango. Se solicitan niveles de cobre (46,9 μg/dl) y ceruloplasmina (15,10mg/dl), con niveles disminuidos en plasma y una determinación de cobre en orina de 24 h rigurosamente normal. Ya que la paciente carecía de antecedentes de cirugía gastrointestinal, no estaba en tratamiento con hierro ni tenía alteraciones de los niveles de cinc; se realiza gastroscopia en busca de posibles causas malabsortivas del déficit, evidenciándose únicamente una leve gastritis crónica antral. Se establece así el diagnóstico de déficit de cobre de etiología indeterminada.
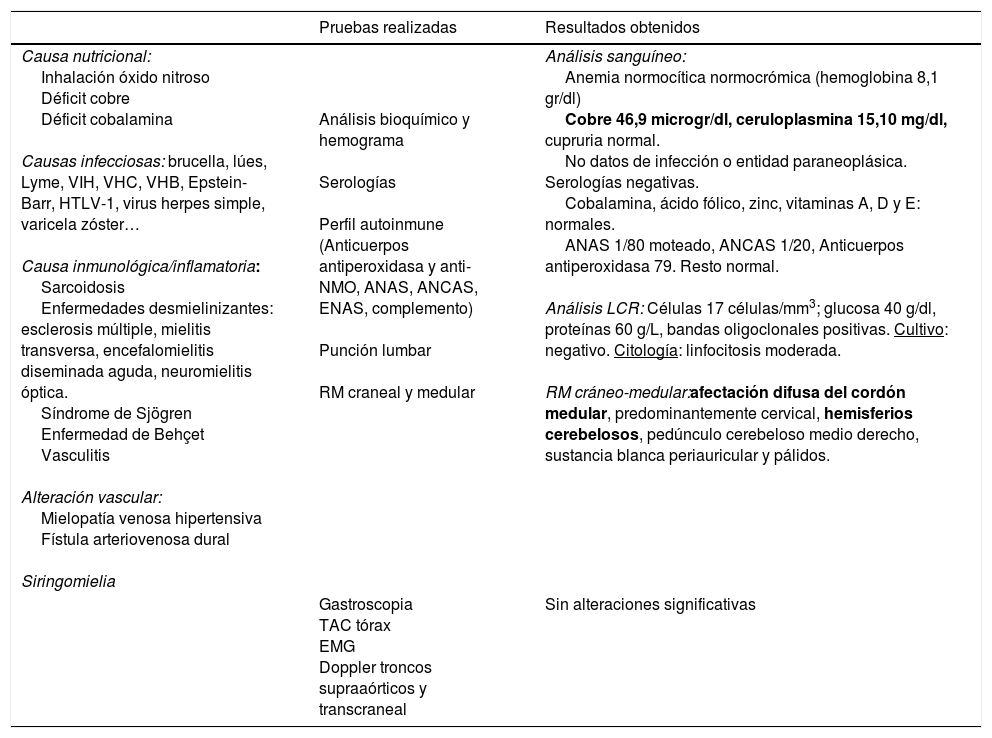
Diagnóstico diferencial de las mielopatías adquiridas no compresivas y proceso diagnóstico llevado a cabo1,2
| Pruebas realizadas | Resultados obtenidos | |
|---|---|---|
| Causa nutricional: Inhalación óxido nitroso Déficit cobre Déficit cobalamina Causas infecciosas: brucella, lúes, Lyme, VIH, VHC, VHB, Epstein-Barr, HTLV-1, virus herpes simple, varicela zóster… Causa inmunológica/inflamatoria: Sarcoidosis Enfermedades desmielinizantes: esclerosis múltiple, mielitis transversa, encefalomielitis diseminada aguda, neuromielitis óptica. Síndrome de Sjögren Enfermedad de Behçet Vasculitis Alteración vascular: Mielopatía venosa hipertensiva Fístula arteriovenosa dural Siringomielia | Análisis bioquímico y hemograma Serologías Perfil autoinmune (Anticuerpos antiperoxidasa y anti-NMO, ANAS, ANCAS, ENAS, complemento) Punción lumbar RM craneal y medular | Análisis sanguíneo: Anemia normocítica normocrómica (hemoglobina 8,1 gr/dl) Cobre 46,9 microgr/dl, ceruloplasmina 15,10 mg/dl, cupruria normal. No datos de infección o entidad paraneoplásica. Serologías negativas. Cobalamina, ácido fólico, zinc, vitaminas A, D y E: normales. ANAS 1/80 moteado, ANCAS 1/20, Anticuerpos antiperoxidasa 79. Resto normal. Análisis LCR: Células 17 células/mm3; glucosa 40 g/dl, proteínas 60 g/L, bandas oligoclonales positivas. Cultivo: negativo. Citología: linfocitosis moderada. RM cráneo-medular:afectación difusa del cordón medular, predominantemente cervical, hemisferios cerebelosos, pedúnculo cerebeloso medio derecho, sustancia blanca periauricular y pálidos. |
| Gastroscopia TAC tórax EMG Doppler troncos supraaórticos y transcraneal | Sin alteraciones significativas |
ANA: anticuerpos antinucleares; ANCA: anticuerpos anticitoplasma de neutrófilo; Anti-NMO: anticuerpos antiacuaporina 4; EMG: electromiograma; ENA: anticuerpos extraíbles del núcleo; HTLV-1: virus linfotrópico humano tipo 1; LCR: líquido cefalorraquídeo; RM: resonancia magnética; TAC: tomografía axial computarizada; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
En negrita, los valores alterados.
Se inicia tratamiento con sulfato de cobre (2mg/24h), complejos de vitaminas B orales e intramusculares y ácido fólico (5mg/24h). Paralelamente, se lleva a cabo infiltración de toxina botulínica a nivel del antebrazo derecho, con mejoría de la espasticidad y alivio secundario del dolor asociado.
En los meses siguientes al inicio de la reposición de cobre, la paciente ha ido experimentando mejoría progresiva de la alteración de la marcha (precisando de apoyo unilateral para distancias largas), persistiendo discretas parestesias y dolor en el miembro superior izquierdo, con cierta paresia en el miembro superior derecho y torpeza manipulativa en mano derecha. A nivel sensitivo, se constata la total recuperación de la artrocinética, con sensibilidad táctil disminuida en el miembro superior derecho (hasta el codo) y sensibilidad vibratoria disminuida en los miembros inferiores y mano derecha. En las analíticas sanguíneas de control se constata la corrección de la anemia y la normalización de los valores de cobre. En cuanto a la neuroimagen, persisten pequeños focos de mielopatía en cordón medular cervical, prácticamente inapreciables, con tenue captación de contraste y atrofia focal así como pequeñas hiperintensidades en T2 inespecíficas a nivel del cerebelo, sin captación de contraste ni edema asociado6.
Para establecer el diagnóstico etiológico de la mielitis transversa, resulta imprescindible el uso combinado de múltiples pruebas complementarias. Aunque la presencia de ciertas alteraciones radiológicas pueden orientarnos hacia una u otra entidad (múltiples pequeñas lesiones medulares son indicativas de lupus eritematoso sistémico o de esclerosis múltiple, mientras que lesiones extensas y a diferentes niveles lo son de una vasculitis), no existen características específicas para cada una de ellas. Del mismo modo, la clínica no permite tampoco la distinción etiológica del cuadro, de ahí la importancia de realizar un estudio completo que incluya bioquímica, hemograma y serologías así como perfil autoinmune (ANA, ANCA, anticuerpos antiperoxidasa, complemento, ENA, anti-NMO) y nutricional (cobre, cobalamina, ácido fólico) a la hora de realizar un buen diagnóstico diferencial. Si además se sospecha de etiología paraneoplásica, se recomienda realizar un cribado tumoral y solicitar un PET-FDG scan4,7–9.
Si bien la fisiopatología del déficit de cobre en la mielopatía aguda está aún por esclarecer, se sabe que es un elemento crucial para el buen funcionamiento del sistema nervioso. Está presente en todo el cerebro, especialmente a nivel de los ganglios basales, el hipocampo y el cerebelo. Son varias las enzimas del sistema nervioso central que dependen de él para su función: la tirosinasa, la monooxigenasa peptidil-glicina alfa-amidante, la cobre/zinc superóxido dismutasa, la ceruloplasmina, la hefaestina, la dopamina-β-hidroxilasa y la citocromo C oxidasa5,10. Su carencia, con una prevalencia de en torno al 23%11, se asocia en un 78% a alteraciones hematológicas (el 68% presenta anemia y el 50% leucopenia), en un 47% a alteraciones de la resonancia magnética (medular y craneal) y en un 48% a alteraciones neurológicas12, siendo la mielopatía con clínica de degeneración combinada subaguda, una de ellas. En la literatura se ha descrito algún caso con hallazgos en LCR similares a los del caso que aquí exponemos (pleocitosis y bandas oligoclonales positivas), si bien lo más frecuente es que el LCR sea normal (en el paraneoplásico puede verse proteinorraquia con leve pleocitosis). El propio proceso inflamatorio causado por la neurodegeneración (con una probable desmielinización secundaria al déficit de cobre) que tiene lugar en esta entidad podría ser el responsable de estas alteraciones. Como causa subyacente, suele encontrarse hasta en un 47% de las veces una cirugía gastrointestinal previa mientras que en un 20% no se encuentra una causa clara13. Otras entidades más prevalentes, como la mielopatía por déficit de cobalamina o la causada por el virus varicela zóster, pueden presentarse con clínica similar, sobreañadiendo una dificultad a la hora de llegar al diagnóstico (tabla 1).
Así pues concluimos que la mielitis longitudinalmente extensa por déficit de cobre es una entidad infrecuente, con una presentación clínica y radiológica indistinguible de otras etiologías más prevalentes, como la degeneración medular combinada por déficit de cobalamina, por lo que si ambas coexisten, y especialmente en pacientes no gastrectomizados en los que no hay sospecha de síndrome malabsortivo, el proceso diagnóstico se retrasa, así como el inicio de la terapia de sustitución con cobre, traduciéndose en posibles secuelas neurológicas irreversibles.